Введение
Рентгенологический синдром затемнения округлой формы на фоне неизмененной легочной ткани встречается при различных патологических состояниях, объединенных понятием «периферическое образование легких». Наиболее часто при этом синдроме необходим дифференциальный диагноз между периферическим раком, доброкачественной опухолью и туберкулемой [1–4]. Доля периферических образований среди всех заболеваний легких составляет 19–25% [5]. Малые (до 2–3 см) периферические образования в легких обнаруживают в 1–2 случаях на 1000 рентгенологических исследований грудной клетки. До 30% из них оказываются злокачественными новообразованиями легких, 2–5% составляют доброкачественные опухоли, а остальная часть приходится на туберкулез, неспецифические и паразитарные заболевания легких [6–8]. Все периферические единичные или множественные образования легких необходимо морфологически верифицировать, поскольку от правильно установленного диагноза зависит выбор тактики лечения. Несмотря на широкие возможности современных лучевых и радионуклидных методов диагностики (мультиспиральная компьютерная томография, магнитно-резонансная томография, позитронно-эмиссионная/компьютерная томография), морфологическая верификация патологии легких с их помощью невозможна [9]. Материал для морфологического исследования получают с помощью фибробронхоскопии с прицельной катетерной аспирационной биопсией, в том числе под контролем эндобронхиального ультразвукового исследования (EBUS) [10, 11], и трансторакальной биопсии. Однако и эти методы далеко не всегда позволяют достоверно установить диагноз. В таких случаях завершающим этапом диагностики становится хирургическое вмешательство со срочным гистологическим исследованием [12–19]. В настоящее время методом выбора при очаговых образованиях служит видеоторакоскопическая атипичная резекция легкого, которую успешно и достаточно широко применяют для лечения туберкулем, доброкачественных опухолей и метастазов в легкие [5, 20–34].
Цель исследования: анализ непосредственных результатов видеоторакоскопических атипичных резекций легкого при очаговых образованиях.
Материал и методы
В исследование включено 94 пациента, которым в 2005–2021 гг. в различных клиниках были выполнены 96 видеоторакоскопических атипичных резекций легких. Среди пациентов были 43 (46%) женщины и 51 (54%) мужчина. Средний возраст пациентов составил 40±12,3 года (от 16 до 78 лет). Операции были выполнены справа 59 пациентам, слева 35 пациентам, в том числе последовательно с двух сторон 2 пациентам. Конверсия в видеоассистированную мини-торакотомию потребовалась 3 пациентам в связи с расширением объема хирургического вмешательства до лобэктомии. Кроме того, у 5 пациентов с туберкулезом легких были выполнены контралатеральные видеоассистированные мини-торакотомии с резекцией легкого, и данные операции в исследование не включены.
Показаниями к хирургическому вмешательству послужили: туберкулез легких (туберкулема, кавернозный, очаговый и диссеминированный туберкулез легких) — 34 случая, метастазы в легкие — 10 случаев, образования в легких неясной этиологии — 52 (в том числе у 7 пациентов множественные и у 1 пациента в сочетании со спонтанным пневмотораксом). Противопоказаниями (относительными) к операции стали: выраженный спаечный процесс в плевральной полости вследствие перенесенных ранее экссудативного плеврита, операций на органах грудной полости, ранений и травм груди; существенное снижение функции внешнего дыхания, определяющее невозможность проведения однолегочной вентиляции; выраженное ожирение.
Для обезболивания использовали: комбинированный ингаляционный интубационный наркоз с раздельной интубацией главных бронхов и этапом однолегочной вентиляции при отключенном из акта дыхания оперируемом легком — 58 случаев; тотальный внутривенный наркоз с раздельной интубацией бронхов — 23 случая; тотальный внутривенный наркоз с интубацией противоположного главного бронха — 10 случаев; тотальный внутривенный наркоз с интубацией трахеи и высокочастотной искусственной вентиляцией легкого — 5 случаев.
Положение пациента для хирургического вмешательства — на боку с отведенной кверху рукой. Оперирующий хирург находился спереди от пациента, а при локализации патологии в передних отделах (III, IV, V, VIII сегменты) — сзади от пациента. Операцию выполняли через 3 торакопорта, расположенных в триангулярной позиции, у 4 пациентов потребовалась установка 4 торакопортов. Расположение торакопортов зависело от локализации патологии. Стандартно первый торакопорт (в 5–7-м межреберье по задней подмышечной линии) использовали для оптики (диаметром 5 или 10 мм), второй торакопорт (в 3–4-м межреберье по средней подмышечной линии) — для введения инструментов. Через третий торакопорт (в 4–6-м межреберье по передней подмышечной линии), расширенный до 2,0–4,0 см, вводили эндостеплер и извлекали удаленный фрагмент легкого. Использовался один троакар для оптики. Торакопорты для введения инструмента и эндостеплера использовали без троакара для большей свободы движения. В ходе освоения методики мы отказались от использования эндоскопических зажимов для поиска локализации патологического очага в пользу окончатого зажима Люэра (легочного или геморроидального) с овальными браншами. За счет непосредственной передачи тактильных ощущений использование 2 зажимов через 2 порта позволило максимально исследовать периферическую (плащевую) поверхность легкого. Этапы видеоторакоскопической атипичной резекции легкого представлены на рисунке 1.
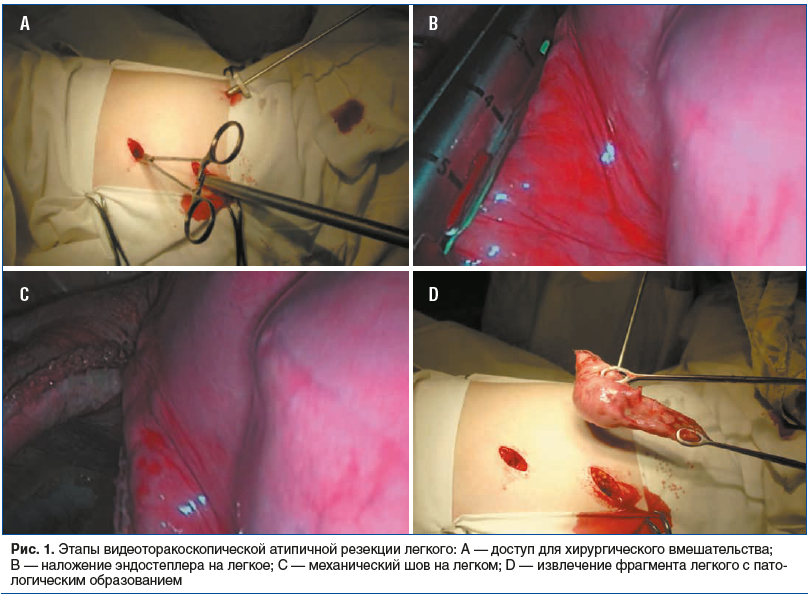
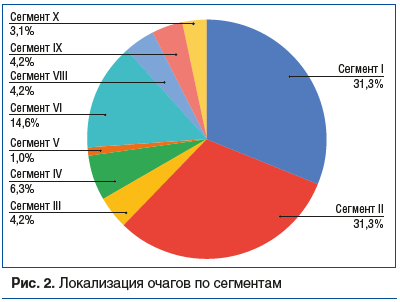
Одиночный очаг обнаружен в 74 случаях, 2 очага — в 11, 3 очага — в 4 и 4 и более — в 7 случаях. Средний максимальный размер очага составил 17,7±7,0 мм (от 4 до 40 мм). Очаги располагались в одном сегменте в 62 случаях, в двух сегментах в 34 случаях. Распределение локализации очагов по сегментам представлено на рисунке 2.
Одиночная резекция легкого выполнена в 80 случаях, комбинированная резекция — в 16 случаях. Для резекции применяли эндоскопические сшивающие аппараты (эндостеплеры) фирм Ethicon Еndo-Surgery и Covidien с кассетами размером 45–60 мм. В 8 случаях использовали 1 кассету, в 31 случае — 2 кассеты, в 22 случаях — 3 кассеты и в 35 случаях — 4 и более кассет.
Результаты и обсуждение
Конверсия в видеоассистированную мини-торакотомию потребовалась в 3 случаях при интраоперационном подтверждении рака легкого и расширении объема операции до лобэктомии. В данном исследовании продолжительность операции и интраоперационную кровопотерю учитывали только на видеоторакоскопическом этапе, без учета этих показателей при расширении объема хирургического вмешательства. Средняя продолжительность операции составила 34,2±13,3 мин (от 15 до 100 мин). Средняя кровопотеря — 8,3±4,2 мл (от 5 до 30 мл). Средняя длительность дренирования плевральной полости — 4,4±2,2 сут (от 1 до 13 сут). Послеоперационные осложнения не наблюдались.
После операций получены следующие гистологические заключения (указано количество наблюдений): туберкулема — 44, гамартомы — 12, метастазы злокачественных новообразований — 11, злокачественные новообразования легких — 9, паразитарные кисты — 3, мезотелиома — 2, лимфангиолейомиоматоз — 2, саркоидоз — 2, висцеральные поражения при ревматоидном артрите — 2, кавернозный туберкулез — 1, очаговый туберкулез — 1, диссеминированный туберкулез — 1, поствоспалительный фиброз — 1, очаговая пневмония — 1, аневризма — 1, доброкачественные образования легких — 1. Сопоставление предварительного диагноза при поступлении пациента и заключительного клинического диагноза представлено в таблице.
Наибольшие сложности при выполнении видеоторакоскопической атипичной резекции легкого связаны с интраоперационной локализацией патологического очага. Несмотря на применение 3D-визуализации и тщательный отбор пациентов на данные операции, патологический очаг зачастую не удается обнаружить, особенно если он расположен в паренхиме легкого на глубине более 2–3 см и его размер не превышает 1 см. В этих случаях приходится переходить к мини-торакотомии для проведения мануальной пальпации легкого. По нашим данным, за период наблюдения (2005–2021 гг.) потребовалось 18 конверсий атипичных резекций легкого в видеоассистированную мини-торакотомию при невозможности локализовать патологический очаг. Данные случаи не включены в исследование. В УНИИФ — филиале ФГБУ «НМИЦ ФПИ» Минздрава России апробирован метод чрескожной локализации очагового образования спиральной проволокой — «якорем» (spiral wire/hookwire) — под контролем компьютерной томографии (КТ). Процедуру проводили непосредственно перед операцией в кабинете КТ, после чего пациента транспортировали в операционную. Однако сложность организации транспортировки, увеличение общей продолжительности вмешательства и высокая стоимость расходных материалов вынудили отказаться от широкого применения метода. Также апробирован метод интраоперационной ультразвуковой локализации очаговых образований в легких внутриполостным датчиком с применением аппарата для эндобронхиального ультразвукового исследования фирмы Hitachi. По нашим данным, метод ультразвуковой локализации не имеет преимущества перед методом инструментальной пальпации, особенно при размерах очага до 1 см и не полностью коллабированном легком. Кроме того, применение данного метода увеличивает продолжительность хирургического вмешательства.
К преимуществам видеоторакоскопического доступа при атипичных резекциях легкого в сравнении со стандартной торакотомией можно отнести: широкие возможности визуализации операционного поля; минимальную травматичность операционного доступа; хороший косметический эффект; раннюю послеоперационную реабилитацию.
Среди недостатков можно отметить: невозможность полноценной мануальной пальпации легкого; необходимость дополнительной подготовки хирурга; потребность в дорогостоящих расходных материалах, в первую очередь эндостеплерах.
Заключение
Видеоторакоскопические атипичные резекции при очаговых образованиях легких обладают минимальной травматичностью, позволяя при этом резецировать любой сегмент легкого, и не уступают в эффективности открытым операциям со стандартной торакотомией. Выполнение атипичных резекций легкого при очаговых образованиях видео-торакоскопическим доступом с применением описанной хирургической техники позволяет в большинстве случаев локализовать патологический очаг и сократить продолжительность вмешательства по сравнению с методами чрес-кожной локализации очагового образования спиральной проволокой и интраоперационной ультразвуковой локализации очаговых образований.
Информация с rmj.ru






