Введение
Хроническая крапивница (ХК) — распространенное заболевание, характеризующееся появлением волдырей, сопровождающихся зудом или ангионевротическим отеком, с продолжительностью более 6 нед. Распространенность ХК в популяции составляет 0,1–1,5%, развивается она преимущественно у лиц трудоспособного возраста [1]. ХК приводит к выраженному снижению качества жизни, оказывая серьезное влияние как на физическое, так и на психологическое состояние [2]. В 80–90% случаев ХК является идиопатической [3].
За последнее время неоднократно пересматривались вопросы патогенеза, классификации, подходы к лечению и профилактике ХК. Выделяют два фенотипа заболевания: спонтанная и индуцированная ХК, возникающая в результате воздействия определенного фактора [4]. Воздействие термических (горячее, холодное), механических (трение, вибрация, давление) или электромагнитных (солнечное излучение) факторов приводит к развитию индуцированной крапивницы (холодовая, аквагенная, тепловая, дермографическая, солнечная, холинергическая, вибрационная, контактная), которая возникает почти сразу после контакта с раздражителем и купируется после прекращения воздействия. Для хронической спонтанной крапивницы (ХСК) характерно спонтанное появление волдырей и/или ангионевротического отека в период 6 нед. и более [5].
Важную роль в патогенезе ХК играют гистамин, а также цитокины, хемокины и другие медиаторы воспаления, которые высвобождаются из тучных клеток при их активации и дегрануляции [4]. Эти медиаторы вызывают вазодилатацию, повышение проницаемости сосудистой стенки с выходом жидкости в окружающие ткани, индуцируют миграцию клеток и активируют чувствительные нервные волокна [6].
В настоящее время можно выделить два эндотипа ХСК, которые различаются по патогенезу и маркерам заболевания, а также по клиническому течению и чувствительности к применяемому лечению: тип I и тип IIb. ХСК типа I связана с появлением антител IgE к аутоантигенам, таким как тирео-глобулин, тиреопероксидаза, двухцепочечная ДНК и интерлейкин 24. Антигистаминные препараты (АГП) и омализумаб (ОМА), используемые при терапии этого эндотипа, обычно эффективны. При ХСК IIb типа выявляются антитела IgG и IgM к IgE и высокоаффинным рецепторам IgE (FcεRI). При данном эндотипе эффективность АГП и ОМА ниже, однако отмечается положительный эффект от иммуносупрессивной терапии [4].
На сегодняшний день выбор терапии при ХСК является очень сложной задачей. Современный алгоритм фармакотерапии предполагает ступенчатое ведение пациентов с ХК [5]. Официально разрешенной с 2014 г. биологической терапией идиопатической ХСК, рекомендованной к применению при неэффективности неседативных АГП, является антиIgE-терапия [5].
Омализумаб — это рекомбинантное гуманизированное моноклональное антитело IgG1, направленное против IgE-специфических эпитопов области связывания FcεRI циркулирующего IgE, которое препятствует связыванию IgE/FcεRI на тучных клетках и базофилах с последующей регуляцией активации клеток [7]. Рекомендуется вводить ОМА для лечения ХСК подкожно в фиксированной дозе 300 мг каждые 4 нед. [8].
Проведено большое количество многоцентровых клинических исследований эффективности ОМА при различных видах крапивницы, в том числе при тяжелых вариантах течения данного заболевания [9–11]. В исследовании II фазы была показана эффективность и безопасность применения ОМА в дозах 300 и 600 мг однократно для купирования симптомов крапивницы, в том числе у пациентов с ХСК, имевших антитела к тиреоидной пероксидазе (АТ к ТПО) и рефрактерных к традиционным методам терапии крапивницы [12].
В 24-недельном клиническом исследовании X-CUISITE изучали эффективность и безопасность терапии ОМА у больных с тяжелой ХК с наличием аутоиммунного тирео-идита, где из 49 пациентов 27 получали терапию ОМА. В группе ОМА при его подкожном введении каждые 2 или 4 нед. в течение 24 нед. получен достоверно лучший эффект по сравнению с плацебо [13].
В исследовании ASTERIA была проведена оценка эффективности и безопасности ОМА у пациентов с тяжелой неконтролируемой крапивницей, ранее получавших терапию блокаторами Н1-гистаминовых рецепторов. Пациенты, включенные в исследование, получали подкожно ОМА в дозе 75, 150, 300 мг каждые 4 нед. К 12-й неделе было выявлено значимое изменение интенсивности зуда, определенное согласно UAS 7 (Urticaria Activity Score 7 — Индекс активности крапивницы 7), в группе пациентов, получающих биологическую терапию (в группе ОМА 300 мг — -9,8±6,0 (р<0,001)), у них также отмечалась регрессия уртикарной сыпи (в 53% — в группе ОМА 300 мг) [14].
В исследование III фазы были включены пациенты с ХСК, у которых сохранялись симптомы заболевания, несмотря на комбинированную терапию Н1-гистаминоблокаторами в четырехкратной дозе в сочетании с Н2-гистаминоблокаторами или антилейкотриеновыми препаратами или в сочетании с двумя этими препаратами. Общая частота и тяжесть побочных эффектов и серьезных нежелательных явлений были схожи между группами ОМА и плацебо. К 12-й неделе терапии росла доля пациентов, у которых зуд и уртикарные элементы отсутствовали полностью (UAS 7=0) по сравнению с группой плацебо (34% против 5%, р<0,001) и данный эффект сохранялся к 24-й неделе лечения [15].
В открытом исследовании оценивалась эффективность применения ОМА в дозе 150 мг ежемесячно у пациентов с тяжелой, трудно поддающейся традиционной терапии крапивницей. Была доказана высокая эффективность данного препарата у пациентов с тяжелой крапивницей, требующей терапии системными глюкокортикостероидами (сГКС), в том числе у пациентов с холодовой крапивницей [16].
В 2020 г. был зарегистрирован первый биоаналог биологического препарата ОМА Генолар®, который рекомендован к применению начиная с 4-й ступени лечения бронхиальной астмы (БА) и ХК. В клиническом исследовании III фазы показана сопоставимая эффективность и безопасность препаратов Генолар® (АО «Генериум», Россия) и Ксолар® («Новартис Фарма АГ», Швейцария) в лечении персистирующей атопической БА среднетяжелого и тяжелого течения, симптомы которой недостаточно контролируются при терапии 4-й ступени (GINA, 2017) [17]. В инструкцию по применению этого препарата было включено такое показание, как лечение хронической идиопатической резистентной к АГП крапивницы у пациентов в возрасте 12 лет и старше[1]. Появление биоаналога препарата ОМА на российском рынке делает выбор лечения для пациентов с тяжелой ХС более доступным.
Цель исследования: провести анализ собственного клинического опыта в достижении ремиссии/контроля у пациентов с тяжелой ХСК на фоне использования терапии ОМА.
Содержание статьи
Материал и методы
Исследование проведено на базе легочно-аллергологического центра ККБУЗ ККБ (Красноярск) в период с января 2022 г. по февраль 2025 г. Протокол исследования одобрен локальным этическим комитетом ККБУЗ ККБ. Использованы данные пациентов в соответствии с подписанным добровольным информированным согласием.
В исследование включено 30 пациентов с подтвержденным диагнозом ХСК тяжелого течения, среди которых 8 (26,7%) мужчин и 22 (73,3%) женщины. Медиана возраста пациентов составила 48 [33; 55] лет. Все пациенты перед инициацией иммунобиологической терапии препаратом ОМА были обследованы в соответствии с федеральными клиническими рекомендациями[2].
Критерии невключения в исследование: острая крапивница, ХК легкой и средней степени тяжести, прием циклоспорина по поводу ХК.
Обязательными были: сбор жалоб и анамнеза, физикальный осмотр, проведение инструментальных и лабораторных методов обследования. Перечень обязательных исследований включал: общий анализ крови с определением СОЭ и уровня С-реактивного белка (СРБ), биохимический анализ крови (общий и прямой билирубин, ревматоидный фактор, трансаминазы), определение уровня общего IgЕ, диагностический поиск с целью исключения паразитарной инвазии. Кроме того, было выполнено инструментальное обследование (УЗИ органов брюшной полости, УЗИ щитовидной железы, фиброгастродуоденоскопия). В случае выявления отклонений в результатах лабораторных или инструментальных методов исследования пациента направляли на консультацию к узкому специалисту.
Оценка степени тяжести крапивницы проводилась при первичном обследовании, а также в ходе динамического наблюдения на всех этапах лечения. Для этого использовали индекс UAS 7, основанный на балльной оценке основных клинических симптомов заболевания (количество высыпаний и интенсивность зуда) самим пациентом каждые 24 ч за 7 последовательных дней. Значения могут варьировать от 0 до 21 балла в неделю для зуда и от 0 до 21 в неделю для количества волдырей. Общее значение UAS 7 за неделю может составлять от 0 до 42 баллов. Тяжелое течение ХК соответствует 28–42 баллам, ХК средней степени тяжести — 16–27 баллам, легкой степени — 7–15 баллам, 0 — отсутствие симптомов.
До включения в исследование пациенты получали терапию АГП нерегулярно. После подтверждения диагноза ХСК всем пациентам была назначена базисная терапия первой линии с использованием АГП второго поколения (АГП 2) в терапевтической дозе в соответствии с федеральными клиническими рекомендациями2. При отсутствии контроля над симптомами в течение 2–4 нед. терапия пересматривалась с увеличением дозы АГП 2 до четырехкратной с оформлением информированного согласия пациента на лечение off-label. При отсутствии эффекта от монотерапии АГП 2 в четырехкратной дозе в период обострения ХСК пациенты получали курсы сГКС.
Сохранение тяжелого течения крапивницы, отсутствие эффекта от монотерапии АГП 2, частые обострения с использованием сГКС являлись показанием к инициации терапии препаратом ОМА (вторая линия терапии ХСК). Препарат использовали согласно инструкции по применению, в дозе 300 мг подкожно 1 раз в 4 нед., курс терапии составлял от 6 мес. до 3 лет. Все пациенты продолжали ведение дневника UAS 7 каждые 24 ч.
Статистическая обработка полученных данных проведена с использованием программного пакета Statistica 10.0. Описательный анализ включал расчет медианы и квартилей (Me [Q1; Q3]).
Результаты исследования
Диагноз ХСК был подтвержден у всех пациентов, в анамнезе паразитарная инвазия определялась у 11 (36,6%) больных, однако после проведения дегельминтизации контроля крапивницы достигнуть не удалось. Все пациенты до начала терапии имели выраженные клинические симптомы ХК, о чем свидетельствовали данные опросника UAS 7, оценка по которому составила 41 [35,25; 42] балл, что соответствует тяжелому течению заболевания. Длительность течения крапивницы от 1 года до 3 лет регистрировалась у 12 (40%) больных, от 3 до 6 лет — у 3 (10%), более 10 лет — у 15 (50%). У 9 (30%) больных заболевание носило смешанный характер: ХСК сочеталась с хронической индуцированной крапивницей (ХИК) в ответ на воздействие специфического триггерного фактора. Наблюдались три физические формы ХИК: симптоматический дермографизм — у 6 (20%) пациентов; холодовая крапивница — у 1 (3,3%) пациента, замедленная крапивница от давления — у 2 (6,7%) пациентов.
Ухудшение течения ХСК после стресса отмечали 13 (43,3%) пациентов. Кроме того, обращает на себя внимание, что в 26,6% случаев больные связывали появление уртикарных элементов и/или ангиоотеков с употреблением некоторых пищевых продуктов, однако соблюдение элиминационной диеты не приводило к исчезновению клинических проявлений. У 10 (33,3%) больных в анамнезе регистрировались уртикарные высыпания с зудом после применения лекарственных препаратов, таких как β-лактамные антибиотики (n=6), нестероидные противовоспалительные средства (n=3), витамины группы В (n=1).
Пациенты с ХСК имели сопутствующую патологию (табл. 1).

По данным УЗИ патология щитовидной железы была выявлена у 9 (30%) пациентов, проведена консультация врача-эндокринолога и выполнены лабораторные анализы для оценки тиреоидного статуса с определением уровня тиреотропного гормона, свободного Т4, АТ к ТПО; все результаты соответствовали референтным значениям.
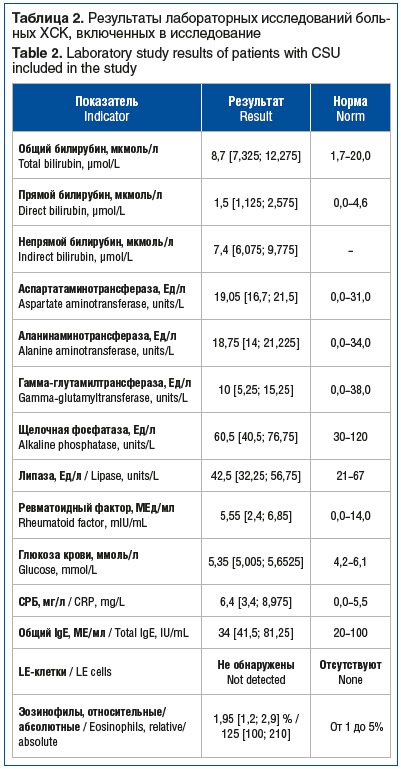
При лабораторном обследовании пациентов значительных отклонений не обнаружено. У 2 пациентов наблюдался повышенный (более 6%) уровень эозинофилов периферической крови, у 16 (53%) — повышенное содержание СРБ. В большинстве случаев уровень общего IgЕ соответствовал нормальным значениям, только у 7 (23%) человек зарегистрировано повышение данного показателя до 275 [211,5; 420] Ме/мл (табл. 2).
Все пациенты исходно получали АГП 2 в стандартной дозировке в течение 2–4 нед. в качестве первой линии терапии крапивницы, однако контроль над симптомами ХСК не достигался. Значение активности по UAS 7 оставалось выше 36 баллов у всех больных. Через 4 нед. всем пациентом доза АГП 2 увеличена до четырехкратной по решению врачебной комиссии с оформлением информированного согласия пациента. Дальнейшее наблюдение показало, что увеличение дозы АГП 2 не позволило получить клинически значимый эффект, активность крапивницы по шкале UAS 7 у всех респондентов оставалась высокой — в диапазоне от 28 до 42 баллов. Увеличение дозы АГП 2 также не позволило сократить потребность пациентов в применении сГКС. Так, до назначения иммунобиологической терапии у 6 (20%) пациентов потребность в терапии сГКС возникала 1 раз в 3 мес., 18 (60%) человек применяли сГКС 1 раз в месяц до 7 дней и 6 (20%) пациентов ежедневно использовали гормоны в дозе от 5 до 20 мг/сут.
Через 24 нед. на фоне терапии препаратом Генолар® полный контроль над ХСК был достигнут у 18 (60%) пациентов. В зависимости от достижения уровня контроля крапивницы пациенты были разделены на 3 группы. В 1-ю группу вошли быстрые и полные ответчики (n=12); 2-я группа характеризовалась отсроченным ответом (n=15); 3-ю группу составили пациенты, которые имели частичный ответ на терапию (n=3).
У 12 (40%) пациентов, составивших 1-ю группу, эффект от назначения ОМА наступил быстро в течение первых 4 нед.: степень активности крапивницы составила от 0 до 9 баллов, а через 8 нед. наблюдения — 0 баллов. В этой группе 2 человека до инициации генно-инженерной биологической терапии (ГИБТ) использовали сГКС, прием которых был отменен уже на 1-й неделе терапии. Через 8 нед. лечения все пациенты использовали АГП 2 в стандартной дозе. Через 12 мес. наблюдения 4 (13,3%) человека достигли контроля заболевания на фоне приема ОМА с отменой всех остальных лекарственных препаратов.
У 15 (50%) больных 2-й группы наблюдался отсроченный ответ на терапию препаратом ОМА. Так, суммарный балл UAS 7 до начала терапии составил 42 [35,5; 42], через 4 нед. после инициации снизился до 28 [21; 28]. После 2-й инъекции (через 8 нед.) активность крапивницы снизилась до 18 [18; 22], а на 16-й неделе показатель UAS 7 соответствовал средней степени тяжести заболевания и составил 16,5 [16,25; 16,75] балла. Через 24 нед. на фоне ГИБТ активность UAS 7 соответствовала легкому течению крапивницы и составила 4 [2,0; 4,0] балла.
В данной группе доза АГП 2 была снижена на 8-й неделе до терапевтической у 11 (73,3%) больных. ГКС прекратили использовать все пациенты данной группы. Через 16 нед. все пациенты использовали АГП 2 в стандартной дозе. Через 24 нед. только 9 (30%) больных продолжают прием АГП 2 в стандартной дозе.
В 3-й группе наблюдаются 3 пациента с частичным ответом на терапию ОМА. Исходно показатель UAS 7 составлял 42 балла. В течение первых 6 мес. лечения у больных наблюдались эпизоды обострения крапивницы, в связи с этим пациенты постоянно самостоятельно использовали АГП 2 в четырехкратной дозе и дополнительно сГКС внутривенно или перорально от 5 до 7 дней. Индекс активности крапивницы оставался высоким в течение 4 мес. наблюдения — 32 [31; 34], что соответствует тяжелому течению заболевания. К 6-му месяцу наблюдения показатель UAS 7 снизился до 22 [22,5; 26,0] баллов, что соответствует средней тяжести ХСК. Терапия ОМА была продолжена, что позволило отказаться от применения сГКС и перевести пациентов на удвоенную дозу АГП 2.
Следует отметить, что все пациенты терапию препаратом ОМА (Генолар®) переносили удовлетворительно, нежелательных побочных эффектов не зарегистрировано.
Обсуждение
Хроническая спонтанная крапивница — это одно из самых распространенных заболеваний кожи, характеризуется рецидивирующим течением и значительным снижением качества жизни. Для практических врачей ключевым является выявление триггерного фактора, после чего назначаются терапевтические мероприятия. Терапия пациентов с ХК характеризуется этапностью, когда переход на следующий этап связан с неэффективностью предыдущего. Большинство пациентов хорошо отвечают на традиционную терапию, однако есть больные, которые нуждаются в альтернативном лечении [18].
На сегодняшний день препаратами первой линии для лечения ХСК являются одобренные дозы АГП 2, и повышение дозы АГП от двукратной до четырехкратной в случае неполного эффекта от указанных в инструкции доз с целью полного или частичного устранения волдырей и кожного зуда1. В клинической практике также используются сГКС коротким курсом (до 10 дней), однако их постоянное применение может привести к возникновению тяжелых осложнений.
Омализумаб, моноклональное антитело к IgE, стал первым препаратом, одобренным для применения у пациентов с ХСК и ХИК, у которых сохраняются симптомы, несмотря на применение АГП [19]. Согласно данным литературы [20], доля пациентов, не отвечающих на стандартную терапию, достигает 40%. В нашем исследовании все пациенты демонстрировали выраженную рефрактерность к стандартной терапии АГП 2, что подтверждалось сохранением высокой активности заболевания (UAS 7 ≥36 баллов) даже при увеличении дозировки АГП 2.
В исследовании О.Ю. Олисовой и соавт. [21] все пациенты получали терапию ОМА в дозе 300 мг подкожно 1 раз в месяц на протяжении 6–12 мес. Уже после первой инъекции ОМА было отмечено снижение тяжести крапивницы, повышение уровня контроля заболевания и улучшение качества жизни у 90% пациентов. В нашей работе контроля над заболеванием также удалось достичь в 90% наблюдений, однако эффект от лечения развивался по-разному.
При анализе данных пациентов, устойчивых к АГП и лейкотриенам, примерно у 40% наблюдается полный ответ на ОМА (т. е. отсутствие крапивницы) при общей частоте ответа примерно 50–70% через 12 нед. Небольшая часть пациентов реагирует чрезвычайно быстро (в течение нескольких дней), в то время как у остальных улучшение наступает постепенно, в течение 2–10 нед. [18]. В нашем исследовании у 40% пациентов отмечена ранняя клиническая ремиссия, у 50% — отсроченный ответ на терапию, при котором значимое снижение активности крапивницы происходило по прошествии 8 нед. лечения. В качестве возможной причины различий в скорости развития клинического эффекта рассматриваются разные патофизиологические механизмы развития ХСК: быстрый и отсроченный ответ на ОМА может быть связан с аутоиммунными реакциями 1-го и 2-го типа соответственно [22].
Применение ОМА позволяет практически полностью избавиться от симптомов ХСК, что значительно улучшает качество жизни пациента и позволяет отменить сГКС, вызывающие развитие осложнений [23]. В нашем исследовании удалось отменить прием сГКС и снизить дозы АГП 2 до терапевтической.
Заключение
Таким образом, ГИБТ препаратом ОМА продемонстрировала высокую эффективность при рефрактерной ХСК. Полного контроля над заболеванием удалось достичь в 90% наблюдений. Важно, что длительное лечение не сопровождалось развитием побочных эффектов и хорошо переносилось пациентами.
Сведения об авторах:
Собко Елена Альбертовна — д.м.н., профессор, профессор кафедры госпитальной терапии и иммуноло-
гии с курсом последипломного образования ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России; 660022, Россия, г. Красноярск, ул. Партизана Железняка, д. 1; заведующий отделением аллергологии КГБУЗ ККБ; 660022, Россия, г. Красноярск, ул. Партизана Железняка, д. 3а; ORCID iD 0000-0002-9377-5213
Демко Ирина Владимировна — д.м.н., профессор, заведующий кафедрой госпитальной терапии и иммунологии с курсом последипломного образования ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России; 660022, Россия, г. Красноярск, ул. Партизана Железняка, д. 1; заведующий легочно-аллергологическим центром КГБУЗ ККБ; 660022, Россия, г. Красноярск, ул. Партизана Железняка, д. 3а; ORCID iD 0000-0001-8982-5292
Крапошина Ангелина Юрьевна — к.м.н., доцент, доцент кафедры госпитальной терапии и иммунологии с курсом последипломного образования ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России; 660022, Россия, г. Красноярск, ул. Партизана Железняка, д. 1; врач-пульмонолог отделения пульмонологии КГБУЗ ККБ; 660022, Россия, г. Красноярск, ул. Партизана Железняка, д. 3а; ORCID iD0000-0001-6896-877X
Черных Виктория Александровна — ассистент кафедры госпитальной терапии и иммунологии с курсом последипломного образования ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России; 660022, Россия, г. Красноярск, ул. Партизана Железняка, д. 1; врач-аллерголог-иммунолог отделения аллергологии КГБУЗ ККБ; 660022, Россия, г. Красноярск, ул. Партизана Железняка, д. 3а; ORCID iD 0009-0003-9191-5475
Контактная информация: Крапошина Ангелина Юрьевна, e-mail: angelina-maria@inbox.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 05.02.2025.
Поступила после рецензирования 28.02.2025.
Принята в печать 25.03.2025.
About the authors:
Elena A. Sobko — Dr. Sc. (Med.), Professor of Department of Hospital Therapy and Immunology with Postgraduate Education course, Prof. V.F. Voino-Yasenetsky Krasnoyarsk State Medical University; 1, Partizan Zheleznyak str., Krasnoyarsk, 660022, Russian Federation; Head of the Department of Allergology, Krasnoyarsk Regional Clinical Hospital; 3A, Partizan Zheleznyak str., Krasnoyarsk, 660022, Russian Federation; ORCID iD 0000-0002-9377-5213
Irina V. Demko — Dr. Sc. (Med.), Professor, Head of the Department of Hospital Therapy and Immunology with Postgraduate Education course, Prof. V.F. Voino-Yasenetsky Krasnoyarsk State Medical University; 1, Partizan Zheleznyak str., Krasnoyarsk, 660022, Russian Federation; Head of the Pulmonary and Allergy Center, Krasnoyarsk Regional Clinical Hospital; 3A, Partizan Zheleznyak str., Krasnoyarsk, 660022, Russian Federation; ORCID iD 0000-0001-8982-5292
Angelina Yu. Kraposhina — C. Sc. (Med.), Associate Professor of the Department of Hospital Therapy and Immunology with Postgraduate Education course, Prof.
V.F. Voino-Yasenetsky Krasnoyarsk State Medical University; 1, Partizan Zheleznyak str., Krasnoyarsk, 660022, Russian Federation; pulmonologist of the Department of Pulmonology, Krasnoyarsk Regional Clinical Hospital; 3A, Partizan Zheleznyak str., Krasnoyarsk, 660022, Russian Federation; ORCID iD 0000-0001-6896-877X
Victoria A. Chernykh — Assistant Professor of the Department of Hospital Therapy and Immunology with Postgraduate Education course, Prof. V.F. Voino-Yasenetsky Krasnoyarsk State Medical University; 1,
Partizan Zheleznyak str., Krasnoyarsk, 660022, Russian Federation; allergologist-immunologist of the Department
of Allergology, Krasnoyarsk Regional Clinical Hospital; 3A, Partizan Zheleznyak str., Krasnoyarsk, 660022, Russian Federation; ORCID iD 0009-0003-9191-5475
Contact information: Angelina Yu. Kraposhina, e-mail: angelina-maria@inbox.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 05.02.2025.
Revised 28.02.2025.
Accepted 25.03.2025.
[1] Листок-вкладыш — информация для пациента. Генолар®, 150 мг, лиофилизат для приготовления раствора для подкожного введения. (Электронный ресурс.) URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=f9549084-3ee4-4079-a38b-a51019ef56f4 (дата обращения: 01.02.2025).
[2] Клинические рекомендации. Крапивница. М., 2023. (Электронный ресурс.) URL: https://diseases.medelement.com/disease/крапивница-кр-рф-2023/17693 (дата обращения: 03.02.2025).
Информация с rmj.ru


