Опыт лапароскопического хирургического лечения параэзофагеальных грыж пищеводного отверстия диафрагмы
М.В. Тимербулатов1, Е. И. Сендерович1, Е. Е. Гришина1*, Е. Н. Санников2
1–Башкирский государственный медицинский университет,
2–Городская клиническая больница № 21, г. Уфа, Республика Башкортостан
e-mail: alyonagrishinа662@mаil.ru; тел. 8 927 313-06-62
(Тимербулатов М. В. – доктор медицинских наук, профессор, заведующий кафедрой факультетской хирургии с курсом колопроктологии;
Сендерович Е. Е. – кандидат медицинских наук, доцент кафедры факультетской хирургии с курсом колопроктологии;
Гришина Е. Е. (*контактное лицо) – аспирант кафедры факультетской хирургии с курсом колопроктологии;
Санников Е. Н. – врач-хирург
Цель. Представить опыт лапароскопического хирургического лечения параэзофагеальных грыж пищеводного отверстия диафрагмы.
Материалы и методы. В период 2012–2014 гг. в клинике факультетской хирургии на базе отделения абдоминальной хирургии ГБУЗ РБ ГКБ № 21 девять пациентов с параэзофагеальными грыжами, содержащими как минимум 50 % желудка, были оперированы лапароскопически. На этапе предоперационного обследования комплекс общепринятых методов включал магнитно-резонансную томографию диафрагмы и манометрию нижнего пищеводного сфинктера.
Результаты. Лапароскопическое хирургическое лечение состояло из полного иссечения грыжевого мешка, крурорафии, протезирующей пластики диафрагмальных ножек при площади грыжевого дефекта в диафрагме более 4 см2 с последующей перитонизацией сетки фрагментом грыжевого мешка, фундопликации. Фундопликация не выполнялась у пациентки с толстокишечной параэзофагеальной грыжей. Среднее время операции составило 110 мин. Интраоперационных, ранних, поздних послеоперационных осложнений не было.
Выводы. Лапароскопическое хирургическое лечение параэзофагеальных грыж является безопасным методом, но некоторые детали и техника оперативного пособия остаются предметом обсуждения. К примеру: всегда ли необходимо выполнять фундопликацию при хирургическом лечении параэзофагеальных грыж, какой метод пластики диафрагмы является оптимальным.
Ключевые слова. Параэзофагеальная грыжа, сетка, фундопликация, лапароскопическая хирургия.
Введение
Несмотря на более чем двадцатилетнюю историю лапароскопических вмешательств в хирургии грыж пищеводного отверстия диафрагмы, многие вопросы остаются актуальными и по сей день [4, 5].
В настоящее время не вызывает сомнения, что оптимальным способом коррекции грыжевого дефекта является сшивание ножек диафрагмы позади пищевода с формированием из предварительно мобилизованного дна желудка манжеты по типу ниссен [5]. Если при скользящих грыжах адекватность закрытия дефекта обусловливается в основном качеством формирования манжеты и швов между ножками диафрагмы, то при параэзофагеальных грыжах реализации этих условий зачастую бывает недостаточно. Этот вид грыж, характеризующийся большим количеством осложнений и высокой летальностью [15], вызывает также значительные трудности при выделении грыжевого мешка, одной из стенок которого, как правило, является проксимальная часть желудка [18]. Важнейшей задачей остается закрытие значительного по размерам грыжевого дефекта, большая часть которого находится кпереди от пищевода. Пластика местными тканями чревата разволокнением ножек диафрагмы и несостоятельностью наложенных швов [11].
Таким образом, хирургическое лечение параэзофагеальных грыж сопровождается значительно большим, по сравнению со скользящими грыжами, количеством рецидивов [6].
Любопытно, что первая в истории грыжа пищеводного отверстия диафрагмы, описанная на секционном материале итальянским анатомом Giovanni Battista Morgagni, была параэзофагеальной [16], что, вероятно, связано с явной клинической и патолого-анатомической картиной данного заболевания.
Материалы и методы исследования
В клинике факультетской хирургии БГМУ на базе 1-го хирургического отделения ГБУЗ РБ ГКБ № 21 в 2012–2014 гг. выполнено 9 лапароскопических операций больным с параэзофагеальными грыжами пищеводного отверстия диафрагмы. Среди пациентов были 6 женщин и 3 мужчины, средний возраст составил 61 год, вес в среднем 67,5 кг. Двое пациентов поступили в отделение абдоминальной хирургии в экстренном порядке с симптомами кишечной непроходимости, у одного из них во время лапароскопии выявлено ущемление содержимого грыжевого мешка. Остальные пациенты оперированы по поводу параэзофагеальной грыжи в плановом порядке.
На этапе предоперационного обследования выполнялся тщательный сбор анамнеза и жалоб. Только у 6 пациентов были жалобы на изжогу, отрыжку кислым в течение нескольких лет до поступления в стационар. У больного с ущемленной параэзофагеальной грыжей и ранее имели место периодические приступы боли в грудной клетке. Жалобы на дисфагию, кашель, осиплость голоса не наблюдались ни у одного больного. Пациенты, попавшие в отделение экстренно, имели схожие симптомы при поступлении: многократную обильную рвоту, умеренные боли в животе. У двух пациентов параэзофагеальная грыжа была выявлена случайно во время планового обследования и не сопровождалась симптомами. Из инструментальных методов обследования перед оперативным лечением всем больным выполнена обзорная рентгенограмма органов брюшной полости и грудной клетки, рентгенконтрастное исследование пищеводно-желудочного перехода, водно-перфузионная манометрия пищевода с измерением давления нижнего пищеводного сфинктера, фиброгастроскопия, магнитно-резонансная томография диафрагмы (рис. 1, 2).
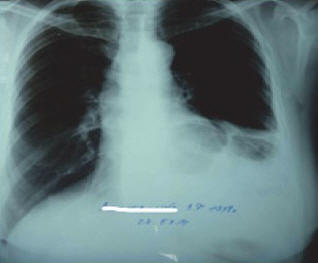
Рис. 1. Обзорная рентгенограмма органов грудной клетки: неоднородное затемнение левого легочного поля с участками просветления с четкими контурами – петля поперечной ободочной кишки в полости заднего средостения
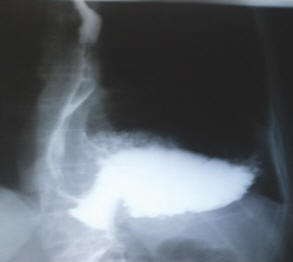
Рис. 2. Рентгенконтрастное исследование пищеводно-желудочного перехода в случае антральной параэзофагеальной грыжи
МРТ диафрагмы проводилась в случаях, когда постановка диагноза вызывала затруднение, а также с целью измерения грыжевого дефекта в диафрагме и выбора метода круропластики (рис. 3).
По данным ФГДС у пациенток с явлениями кишечной непроходимости выявлено увеличение размеров желудка с большим количеством застойного содержимого. Рефлюкс-эзофагит 1–2-й степени по Savary–Miller имел место у 6 пациентов.
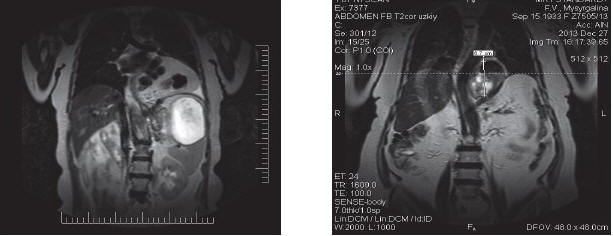
Рис. 3. МРТ диафрагмы, органов верхнего этажа брюшной полости: а – объемное образование в области левого реберно-диафрагмального угла размерами 11,0×11,5×10,9 см с наличием гипоинтенсивных округлых сливных включений – петля поперечной ободочной кишки вместе с большим сальником. На снимке (б) отчетливо визуализируется пролабирование дна желудка выше пищеводного отверстия диафрагмы на 6,7 см, диффузное накопление контраста измененной стенкой желудка размером 8,0×5,8×5,6 см, размеры пищеводного отверстия – 5,1×3,3 см
Всем пациентам перед оперативным лечением проводилось измерение давления нижнего пищеводного сфинктера с помощью водно-перфузионной манометрии на аппарате «Гастроскан-Д» (Россия, Фрязино) (рис. 4). У четырех пациентов, имевших жалобы на изжогу, наблюдалось снижение давления нижнего пищеводного сфинктера ниже нормальных значений (ниже 10 мм рт. ст). У остальных давление нижнего пищеводного сфинктера было в пределах нормы (10– 20 мм рт. ст). У двух пациентов имела место неэффективная моторика пищевода: снижение амплитуды перистальтических волн в нижней трети пищевода ниже 30 мм рт. ст.
Всем больным выполнено оперативное пособие: грыжесечение, задняя или передняя крурорафия, круроэзофагопластика, диафрагмокруропластика. В случаях, когда площадь грыжевого дефекта в диафрагме превышала 4 см2, выполнена протезирующая диафрагмокруропластика с перитонизацией сетчатого импланта. При размерах пищеводного отверстия менее 4 см2 – пластика диафрагмы местными тканями. Фундопликация произведена всем пациентам независимо от исходного состояния моторики пищевода, кроме пациентки с толстокишечной параэзофагеальной грыжей.
Техника операции. С помощью зажима Babcock содержимое грыжевого мешка низведено в брюшную полость (рис. 5). Во всех случаях тракционными движениями книзу грыжевой мешок полностью выделен из полости заднего средостения при помощи гармонического ультразвукового скальпеля и аппарата LigaSure. На этом этапе важно с особой осторожностью производить мобилизацию задней стенки мешка, которая, как правило, представлена задней стенкой дна желудка. Из этих соображений выделение грыжевого мешка стоит начинать с передней полуокружности (рис. 6).
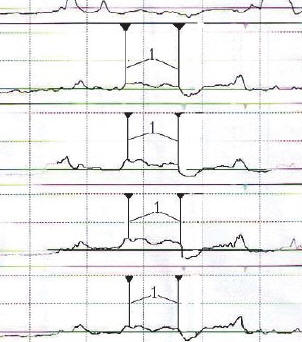
Рис. 4. Плато манометрической кривой (1) соответствует зоне давления покоя нижнего пищеводного сфинктера
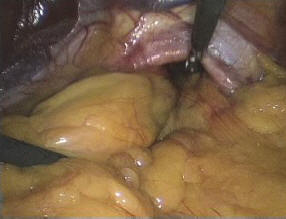
Рис. 5. Лапароскопическая картина толстокишечной параэзофагеальной грыжи пищеводного отверстия диафрагмы
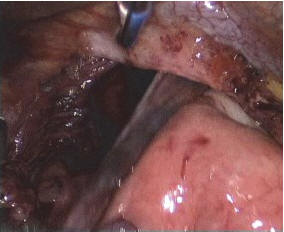
Рис. 6. Этап выделения грыжевого мешка из полости средостения
Во всех случаях пищеводно-желудочный переход располагался в области пищеводного отверстия диафрагмы, длина пищевода была достаточной.
Короткие желудочные сосуды в области проксимальной части дна желудка пересечены с помощью ультразвукового скальпеля. На передней стенке пищевода сформирована симметричная манжета из передней и задней стенок желудка, фиксирована 3 узловыми швами. Длина манжеты не превышала 2 см. Третьим швом манжета фиксирована к правой ножке диафрагмы с целью предотвращения соскальзывания манжеты и миграции ее в грудную клетку в послеоперационном периоде. Пациентке с толстокишечной параэзофагеальной грыжей, принимая во внимание нормальное расположение пищеводно-желудочного перехода, желудка и сохранение острого угла Гиса, решено было не выполнять фундопликацию.
C техническими сложностями вследствие натяжения наложены узловые швы на ножки диафрагмы впереди и позади пищевода. Затем при грыжевом дефекте в диафрагме более 4 см2 (7 пациентов) на разволокнившиеся волокна диафрагмы на некотором расстоянии от пищеводно-желудочного перехода уложен сетчатый имплант прямоугольной формы размером 6×11 см, фиксирован герниостеплером по периметру (рис. 7). В шести случаях использована легкая пористая композитная сетка. У пациентки с ущемленной грыжей операция проходила в условиях экстренной операционной с использованием имевшегося в наличии полипропиленового сетчатого импланта, что не является критичным ввиду последующей перитонизации сетки.
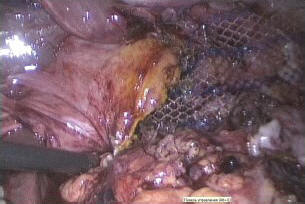
Рис. 7. Сетчатый имплант поверх сшитых диафрагмальных ножек
Поверх сетчатого импланта уложен фрагмент грыжевого мешка, оставленного на передней стенке пищевода при выделении (рис. 8). Грыжевой мешок также фиксирован к диафрагме герниостеплером по периметру (рис. 9).
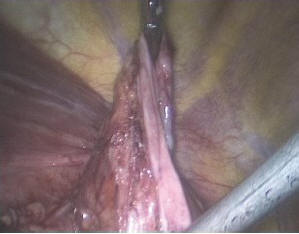
Рис. 8. Фрагмент грыжевого мешка для перитонизации сетчатого импланта
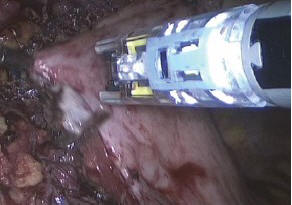
Рис. 9. Фиксация грыжевого мешка к диафрагме поверх сетки
Интраоперационных, ранних и поздних послеоперационных осложнений не было. Среднее время операции составило 110 мин. Среднее время пребывания пациента в стационаре после оперативного лечения – 7 суток. В раннем послеоперационном периоде жалобы на изжогу и дисфагию отсутствовали. На 7-е сутки после операции выполнено контрольное рентгенконтрастное исследование пищеводно-желудочного перехода.
Результаты и их обсуждение
В срок от 3 до 6 месяцев после операции оценено качество жизни пациентов с помощью специализированного опросника GIQLI, который состоит из 36 вопросов и включает в себя разделы, посвященные желудочно-кишечным симптомам, эмоциональному статусу, физическим функциям организма, социальным функциям, стрессовому фактору медицинского вмешательства. В среднем качество жизни составило 118 баллов, что соответствует индексу качества жизни здорового человека [14].
В 1992 г. была выполнена первая лапароскопическая операция по поводу гигантской параэзофагеальной грыжи, но до настоящего времени хирурги не пришли к консенсусу по поводу оптимального метода лапароскопического лечения [8, 18].
Попытки были направлены в первую очередь на низведение желудка в брюшную полость и не подразумевали полного выделения грыжевого мешка, сопровождались большим количеством осложнений, частота конверсий составляла 50 %. По-видимому, это связано с поздним осознанием хирургами, что задняя стенка грыжевого мешка является проксимальной частью желудка [8, 19].
В последние 10 лет значительно возросла оперативная активность в данном направлении [13], летальность составляет менее 0,5 %, при этом пациенты чаще всего преклонного возраста и имеют сопутствующую соматическую патологию [10].
Одной из проблем является пластика грыжевых ворот при гигантских параэзофагеальных грыжах, когда вследствие большой площади грыжевого дефекта в диафрагме натяжение между ножками усугубляется их дистрофией, в этом случае надежная крурорафия едва ли представляется возможной. Швы, накладываемые на разволокненные ножки диафрагмы, прорезываются, что в результате приводит к рецидиву грыжи. По литературным данным рецидив параэзофагеальной грыжи при выполнении крурорафии для ликвидации грыжевых ворот без имплантации сетчатого протеза составляет 42 % [11].
Однако описаны многочисленные угрожающие жизни пациентов осложнения при использовании синтетических сетчатых материалов в области пищеводно-желудочного перехода. Среди них: эрозия висцеральных органов [2], миграция сетки в просвет пищевода [12], миграция сетки в просвет аорты с развитием кровотечения [17], псевдоахалазия пищевода [3] и другие. К тому же, по мнению некоторых зарубежных авторов, процессы рубцевания, усиливающиеся при реакции тканей организма на инородный материал, значительно затрудняют повторное вмешательство в случае рецидива грыжи.
Не разработаны четкие критерии для классификации параэзофагеальных грыж в зависимости от площади поверхности пищеводного отверстия диафрагмы (ПППОД). В. В. Грубник предлагает грыжи с ПППОД<10 см2 называть малыми грыжами и выполнять единственно крурорафию. При ПППОД от 10 до 20 см2 грыжи считать большими и выполнять крурорафию в сочетании с протезирующей пластикой сетчатым имплантом. При ПППОД более 20 см2 грыжи называть гигантскими, производить только аллопластику [1].
В нашем случае при площади грыжевого дефекта в диафрагме более 4 см2 осуществлялась протезирующая диафрагмокруропластика. Перитонизация сетчатого протеза фрагментом грыжевого мешка, оставленного на передней стенке пищевода, позволяет избежать осложнений в послеоперационном периоде, связанных с взаимодействием органов брюшной полости и сетки, а именно: спаечного процесса в брюшной полости, эрозии стенки желудка, эрозии стенки тонкой кишки, миграции сетки в просвет пищевода или желудка.
Принимая во внимание отсутствие симптомов рефлюкса до операции у пациентки с толстокишечной параэзофагеальной грыжей, фиксацию желудка под диафрагмой, сохранение острого угла Гиса, решено не выполнять мобилизацию дна желудка и фундопликацию. Хотя, по мнению некоторых зарубежных авторов, манипуляции в области пищеводно-желудочного перехода могут послужить причиной возникновения симптомов рефлюкса даже при отсутствии таковых до операции [7].
Выводы
Лапароскопическое хирургическое лечение параэзофагеальных диафрагмальных грыж больших размеров является эффективным и безопасным методом лечения, при площади пищеводного отверстия диафрагмы более 4 см2 оптимальным методом является укрепление швов между ножками диафрагмы прямоугольным сетчатым имплантом с перитонизацией последнего фрагментом грыжевого мешка.
Библиографический список
- Грубник В. В., Малиновский А. В. Лапароскопическая пластика грыж пищеводного отверстия диафрагмы: новая классификация, основанная на отдаленных результатах. Эндоскопическая хирургия 2014; 1: 9–15.
- Arpad J. et al. Endoscopic assessment of failed fundoplication: a case for standardization. Surg Endosc 2011; 25: 3761–3766.
- Bonavia L., Bona D., Siano G., Clemente C. Pseudoachalasia occurring after laparoscopic Nissen fundoplication and crural mesh repair. Langenbecks Arch. Surg. 2007; 392: 653–656.
- Cuschieri A., Shimi S., Nathanson L. K. Laparoscopic reduction, crural repair, and fundoplication of large hiatal hernia. Am. J. Surg. 1992; 163: 425–430.
- Dallemagne B., Perretta S. Twenty years of laparoscopic fundoplication for GERD. World J. Surg. 2011; 35: 1428–1435.
- Diaz S., Brunt L. M., Klingensmith M. E., Frisella P. M., Soper N. J. Laparoscopic paraesophageal hernia repair, a challenging operation: medium-term outcome of 116 patients. J. Gastrointest Surg. 2003; 7: 59–66.
- Ellis F. H., Crozier R. E., Shea J. A. Paraesophageal hiatus hernia. Arch. Surg. 1986; 121(4): 416–420
- Edye M., Salky B., Posner A. et al. Sac excision is essential to adequate repair of paraesophageal hernia. Surg. Endosc. 1998; 12: 1259–1263.
- Granderath F. A., Schweiger U. M., Pointner R. Laparoscopic antireflux surgery: Tailoring the hiatal closure to the size of hiatal surface area. Surg. Endosc. 2007; 21: 542–548.
- Grotenhuis B. A., Wijnhoven B. P., Bessell J. R. et al. Laparoscopic antireflux surgery in the elderly. Surg. Endosc. 2008; 22: 1807–1812.
- Hashemi M., Peters J. H.., DeMeester T. R., Huprich J. E., Quek M., Bremner C. G. Laparoscopic repair of large type III hiatal hernia: objective followup reveals high recurrence rate. J. Am. Coll. Surg. 2000; 190: 553–560; discussion 560–551.
- Jansen M., Otto J., Lynen Jansen P. Mesh migration into the esophageal wall after mesh hiatoplasty: comparison of two alloplastic materials. Surg. Endosc. 2007; 21: 2298–2303.
- Jay A. P., Watson D. I. Changing work patterns for benign upper gastrointestinal and biliary disease: 1994–2007. ANZ J. Surg. 2010; 80: 519–525.
- Korolija D., Sauerland S., Wood-Dauphinee S. Evaluation of quality of life after laparoscopic surgery: evidence-based guidelines of the European Association for Endoscopic Surgery. Surg. Endosc. 2004; 18(6): 879–897.
- Landreneau R. J. Surgical management of paraesophageal herniation. In: Nyhus L. M., Baker R. J., Fischer J. E. (Eds.) Mastery of surgery Little, Brown and Conpany, Boston 1997; 694–707.
- Morgagni G. B. The seats and cases of disease. Translated by Benjamin Alexander. Birmingham, AL: Gryphon Editions 1983; IV: 210.
- Nico Zugel, Reinhold A., Lang Martin, Thomas P. Huttl Severe complication of laparoscopic mesh hiatoplasty for paraesophageal hernia. Surg. Endosc. 2009; 3: 2563–2567.
- Watson D. I., Davies N., Devitt P. G. et al. Importance of dissection of the hernial sac in laparoscopic surgery for large hiatal hernias. Arch. Surg. 1999; 134: 1069–1073.
Статья опубликована на сайте http://www.gastroscan.ru
материал MedLinks.ru