Ключевые слова: кластерная головная боль, нейростимуляция, стимуляция затылочного нерва, стимуляция крылонебного узла, стимуляция глубоких структур мозга.
Для цитирования: Исагулян Э.Д., Осипова В.В., Екушева Е.В., Сергеев А.В., Артеменко А.В. Нейромодуляция в лечении кластерной головной боли // РМЖ. 2017. №24. С. 1779-1784
Isagulyan E.D.1, Osipova V.V.2.3, Ekusheva E.V.4, Sergeev A.V. 2, Artemenko А.V.2
1 National Medical Research Center of Neurosurgery named after acad. N.N. Burdenko, Moscow
2 First Moscow State Medical University named after I.M. Sechenov
3 Scientific Neuropsychiatric Center named after Z.P. Solovyov, Moscow
4 Advanced Training Institute of the Federal Medical Biological Agency, Moscow
Cluster headache is one of the most frequent trigeminal vegetative cephalalgia, this type of primary headache is one of the most painful, associated with an increase in the number of suicidal attempts and, in general, negatively affects the quality of life of patients. Despite the large number of existing schemes of pharmacotherapy, cluster headache is refractory to conservative treatment in almost a third of cases, which predetermines the development of surgical methods of treatment, especially methods of neurostimulation. In clinical practice, three methods of neurostimulation are used: occipital nerves stimulation (ONS), sphenopalatine ganglion stimulation (SPGS), deep brain stimulation (DBS). When choosing a method, the principle «from simple to complex» is observed, beginning with the use of stimulation of peripheral structures (ONS and SPGS) and, in case of their inefficiency, DBS. Great attention should be paid to the selection of patients. An important factor in the appointment of neurostimulation is the reduction in the latency period, it is necessary to send the patient with a diagnosed incurable pain syndrome to the neurosurgeon as soon as possible for a consultation on the possible choice of treatment, since the duration of refractory pain is associated with a reduction in the potential effect of the stimulant.
Key words: cluster headache, neurostimulation, occipital nerves stimulation, sphenopalatine ganglion stimulation, deep brain stimulation
For citation: Isagulyan E.D., Osipova V.V., Ekusheva E.V. et al. Neuromodulation in the treatment of cluster headache // RMJ. 2017. № 24. P. 1779–1784.
Кластерная головная боль – тригеминальная вегетативная цефалгия, является наиболее мучительной для пациентов. Кластерная головная боль часто оказывается рефрактерной к консервативному лечению и применяются хирургические методы лечения, прежде всего методы нейростимуляции. В клинической практике используются три метода нейростимуляции: стимуляция затылочных нервов, стимуляция крылонебного ганглия, стимуляция глубоких структур головного мозга.
Кластерная (пучковая) головная боль (КГБ) представляет собой один из самых мучительных и нестерпимых вариантов цефалгии, характерная клиническая картина которого, как правило, позволяет предположить диагноз в первые минуты неврологического приема. Наряду с мигренью и головной болью напряжения КГБ относится к первичным формам головной боли, не связанным с органическим повреждением головного мозга или структур, расположенных в области головы и шеи, и входит, согласно Международной классификации расстройств, сопровождающихся головной болью (МКГБ-3 бета, 2013), в раздел «Тригеминальные вегетативные цефалгии» (ТВЦ) (табл. 1) [1]. КГБ является самой частой среди ТВЦ, однако по сравнению с мигренью и головной болью напряжения ее распространенность в популяции достигает всего лишь 0,1–0,4% при подавляющем большинстве у мужчин [2]. 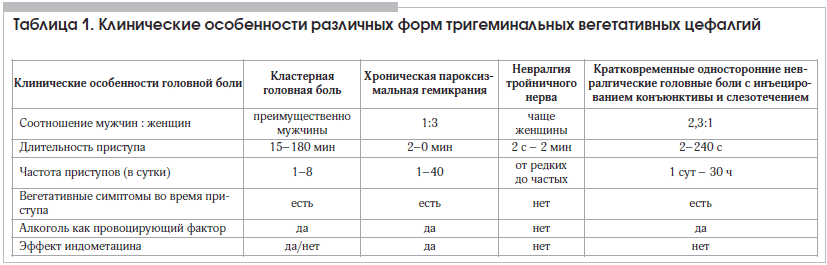
Содержание статьи
Клиника
От других форм первичной головной боли КГБ отличается чрезвычайно интенсивным и нестерпимым характером строго односторонней цефалгии (10 баллов по визуальной аналоговой шкале), сопровождающейся симптомами парасимпатической активации (слезотечение, покраснение конъюнктивы, заложенность носа или ринорея) и дисфункции симпатической нервной системы (миоз, птоз, отечность верхнего века, частичный синдром Горнера) на стороне боли [2, 3]. Не являются редкостью потливость и покраснение противоположной, неболевой стороны лица, реже – гиперестезия, аллодиния и брадикардия [3]. Локализуется боль в области глаза, надбровья, височной или в нескольких из этих областей; возникновение ежедневных кратковременных приступов высокой интенсивности нередко приводит к ошибочному диагнозу невралгии тройничного нерва. Вместе с тем правильно собранный анамнез и тщательный неврологический осмотр задают правильное диагностическое направление (см. табл. 1). В частности, характерной особенностью поведения пациентов во время приступа является двигательное беспокойство и поведенческая ажитация: постоянная смена положения тела, аффективные проявления (плач или агрессия).
Разделяют эпизодическую и хроническую форму КГБ. Эпизодическая КГБ характеризуется чередованием болевых периодов (по меньшей мере 2-х эпизодов, длящихся 7–365 дней без лечения) и ремиссий продолжительностью не менее 1 мес. и наблюдается у большей части больных — до 90% всех случаев заболевания. Другой вариант цефалгии, хроническая КГБ (ХКГБ), наиболее мучительный и дезадаптирующий, поскольку болевой период продолжается без ремиссий или с ремиссиями длительностью менее месяца [1].
Медикаментозное лечение
При исключении вторичного характера КГБ терапия этого заболевания включает два основных направления: 1) купирование по возможности болевого приступа и 2) профилактическое лечение с целью прекращения приступов (табл. 2, 3). Рекомендуется избегать потенциальных провоцирующих приступ факторов во время болевого периода: исключить прием алкоголя и лекарственных средств с вазодилататорными или сосудорасширяющими свойствами, соблюдать режим сна и бодрствования. Поскольку апноэ во сне являются важным фактором риска тяжелого течения КГБ, своевременное выявление и лечение этого синдрома служит залогом успешного ведения данной категории больных.![Таблица 2. Лекарственные средства, обладающие доказанной эффективностью в купировании приступа кластерной головной боли [4–8] Таблица 2. Лекарственные средства, обладающие доказанной эффективностью в купировании приступа кластерной головной боли [4–8]](https://medblog.su/wp-content/uploads/2018/12/1544992205_645_nejromodulyatsiya-v-lechenii-klasternoj-golovnoj-boli-isagulyan-e-d-osipova-v-v-ekusheva-e-v-sergeev-a-v-artemenko-a-v.png)
![Таблица 3. Лекарственные средства, обладающие доказанной эффективностью для профилактического лечения кластерной головной боли [4–7] Таблица 3. Лекарственные средства, обладающие доказанной эффективностью для профилактического лечения кластерной головной боли [4–7]](https://medblog.su/wp-content/uploads/2018/12/1544992205_615_nejromodulyatsiya-v-lechenii-klasternoj-golovnoj-boli-isagulyan-e-d-osipova-v-v-ekusheva-e-v-sergeev-a-v-artemenko-a-v.png)
В купировании приступов КГБ наиболее эффективны ингаляции 100% кислорода и триптаны, в меньшей степени – местные анестетики (лидокаин) (см. табл. 2); анальгетики и опиоиды не применяются при КГБ. Профилактическое лечение должно начинаться как можно раньше при развитии обострения, продолжаться в течение всего болевого периода и завершаться через 2 нед. после достижения полной ремиссии [4–8]. Таблетированные препараты необходимо назначать с учетом эффективности и возможной токсичности, поэтому важно следовать инструкциям по применению рекомендуемых средств (см. табл. 3). Неэффективность одного лекарственного средства не означает, что неэффективны другие; для повышения эффективности возможно применение комбинации препаратов. Для профилактической терапии КГБ рассматриваются моноклональные антитела к CGRP (Calcitonin gene-related peptide – кальцитонин-ген родственный пептид) и его рецепторам, но этот метод находится на стадии клинических исследований [4, 9, 10].
Несмотря на достаточно хорошо разработанные схемы медикаментозного лечения и профилактики, почти в трети случаев у пациентов с ХКГБ со временем возникает резистентность ко всем препаратам с доказанной эффективностью (по данным рандомизированных плацебо-контролируемых исследований), в иных случаях развиваются столь выраженные побочные эффекты, что это не позволяет больным с ХКГБ продолжать начатое лечение [11]. Уже на протяжении многих лет, наряду с медикаментозными, разрабатываются и активно применяются немедикаментозные методы лечения ХКГБ. Если раньше использовались преимущественно блокады и деструкции крылонебного ганглия, то за последние два десятилетия их место заняли методы нейромодуляции.
Нейромодуляция
Нейромодуляция является одним из перспективных и активно развивающихся высокотехнологических направлений современной медицины. Методы нейромодуляции можно условно разделить на неинвазивные и минимально инвазивные. К неинвазивным технологиям относится чрескожная нейростимуляция ветвей тройничного и затылочного нервов, а также транскраниальная магнитная стимуляция. Они хорошо известны, и мы не будем на них останавливаться, поскольку в большинстве случаев они дают временный и нестойкий эффект, сравнимый с эффектом ушедших в прошлое блокад. Не будем забывать, что речь идет о болях крайней (иногда запредельной) интенсивности, из-за которых КГБ называют «суицидальной болью» (риск суицида у пациентов КГБ повышен в 2,5 раза) [4]. При такой боли ни один из методов неинвазивной нейромодуляции не оказывает должного эффекта.
В последние 15–20 лет все активнее развиваются и внедряются методы хирургической или инвазивной нейромодуляции, включающие два основных направления: нейростимуляцию и интратекальное введение лекарственных средств. Последний метод лечения применяется преимущественно при онкологических болях и при резистентных некупируемых диффузных болевых синдромах. Напротив, при головных болях, не связанных с онкологическим процессом, данный метод не используется.
В свою очередь, хирургическая нейростимуляция в зависимости от места приложения электрического импульса подразделяется на нейростимуляцию периферических нервов, их дистальных ветвей и корешков и нейростимуляцию нейрональных структур спинного и головного мозга: стимуляцию глубоких структур мозга – DBS (Deep Brain Stimulation) и стимуляцию двигательной коры – MSC (Motor Cortex Stimulation).
В лечении ХКГБ применяются следующие методы: электростимуляция затылочных нервов, электростимуляция крылонебного ганглия и электростимуляция глубоких структур головного мозга, в частности задненижних отделов гипоталамуса. Все эти методы относятся к минимально инвазивным, поскольку не требуют больших хирургических разрезов, ограничиваются минимальной кровопотерей и, самое главное, несут минимальный потенциальный риск возможных осложнений в отличие от «больших» операций. Даже DBS гипоталамуса является минимально инвазивной операцией, во время которой электрод имплантируется с помощью стереотаксических расчетов через небольшое отверстие в необходимое для воздействия место головного мозга.
Нейрофизиологический механизм нейромодуляции состоит в терапевтическом изменении функциональной активности центральной, периферической или вегетативной нервной системы путем модулирования процессов возбуждения и торможения в нейрональных системах и их элементах посредством электрических или фармакологических воздействий с использованием имплантируемых устройств. Все предполагаемые механизмы действия нейростимуляции можно разделить на общие и местные.
Основным механизмом действия нейростимуляционных техник является их способность блокировать ноцицептивные импульсы за счет активации неноцицептивных путей и таким образом закрывать «ворота боли» [12], что согласуется с теорией воротного контроля боли, опубликованной в свое время Melzackи Wall. Как показано в клинических исследованиях на животных, таким образом происходит влияние на систему тройничного нерва [13], в частности, продемонстрировано снижение концентрации CGRP, что является биомаркером торможения в тригеминальной системе. Основными реализующими противоболевое действие механизмами нейростимуляции считаются:
1) ингибирование патологической активности ядер гипоталамуса и таламуса путем опосредованного воздействия на них через систему тригеминоцервикального комплекса при электростимуляции периферических нервов и верхнего шейного отдела спинного мозга или непосредственное воздействие на указанные ядра при глубокой стимуляции мозга (DBS);
2) активация нисходящих антиноцицептивных влияний.
Вместе с тем эффекты и воздействия, оказываемые нейростимуляцией, гораздо шире, в частности, показано влияние этой технологии на концентрацию биологически активных веществ и нейромедиаторов, а на животных моделях – наличие нейропротективного эффекта после применения методики [13–15].
Стимуляция затылочного нерва (СЗН) (рис. 1). Первым показанием для проведения СЗН или ONS (Occipital Nerve Stimulation) была невралгия затылочного нерва [16]. В настоящее время основными «мишенями» для использования этого высокотехнологичного метода лечения являются хроническая мигрень и ХКГБ, рефрактерные к другим видам адекватной профилактической терапии [16, 17]. Наиболее широко используется метод инвазивной СЗН с имплантацией электрода подкожно в непосредственной близости от места выхода нерва с одной или двух сторон. 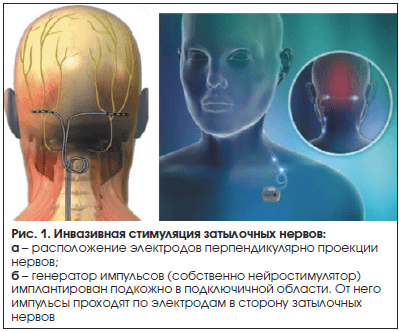
В связи с тяжелой дезадаптацией наибольшее количество разнообразных вариантов функциональной нейромодуляции используются у пациентов с ХКГБ, особенно при ее рефрактерном течении. Эффективность инвазивной СЗН у этой категории больных продемонстрирована во многих работах последних лет. Обобщенные данные наиболее значимых исследований эффективности СЗН при КГБ представлены в таблице 4. Имеются данные об эффективности СЗН и при других разновидностях тригеминальных вегетативных цефалгий: хронической пароксизмальной гемикрании, «гемикрании континуа», синдроме SUNCT (Short-lasting Unilateral Neuralgiform headache attacks with Conjunctival injection and Tearing – кратковременные односторонние невралгические головные боли с инъецированием конъюнктивы и слезотечением) [16, 17]. 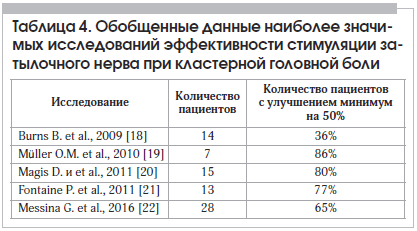
Особое внимание следует уделить исследованию ICON [23], результаты которого были опубликованы в 2016 г. исследовательской группой под руководством Delphine Magis. Было показано, что у 60% пациентов удалось добиться полного избавления от боли, а в целом у 80% больных был получен хороший ответ на стимуляцию. У 6 пациентов не удалось добиться полного обезболивания, при этом частота приступов была сокращена на 70% от исходной.
В работе G. Messina et al. [22] проводилось сравнение двух нейростимуляционных методов: стимуляции затылочных нервов и стимуляции глубоких структур мозга. Уменьшения количества дней головной боли удалось добиться у 15 из 28 пациентов с ONS и у 12 из 17 – с DBS, однако не были выявлены предикторы эффективности используемых методов [22].
Стимуляция крылонебного ганглия – SPGS (Sphenopalatine Ganglion Stimulation) (рис. 2) – является одним из наиболее поздних направлений нейромодуляции в лечении рефрактерных цефалгий. Несмотря на стабильный обезболивающий эффект, наблюдающийся при ONS, в последнее время у больных с КГБ все чаще применяется более перспективный в этом отношении метод, позволяющий добиться хорошего клинического эффекта, – SPGS. Следует отметить, что появление этой методики ни в коей мере не умаляет значимости ONS, но потенциально сделает ее методом второй линии у пациентов с неэффективностью SPGS. Основным показанием для стимуляции крылонебного ганглия является рефрактерная ХКГБ, причем как для купирования приступа, так и для профилактического лечения заболевания. Согласно последним рекомендациям Американского общества по изучению головной боли, методу SPGS присвоен уровень эффективности B [6]. Выделяют два предположительных механизма действия данного метода: 1) прерывание парасимпатических постганглионарных влияний и 2) модуляцию сенсорной информации на уровне ядер тройничного нерва [14].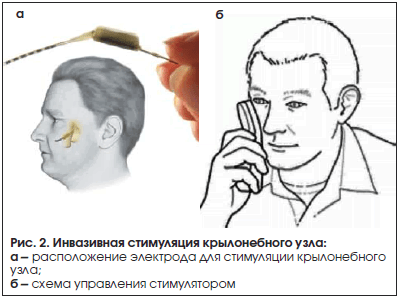
Еще в 2013 г., на заре развития данной технологии, J. Schoenen et al. [24] опубликовали результаты мультицентрового шам-контролируемого исследования, в котором удалось достигнуть обезболивающего эффекта у 68% (n=19) пациентов основной группы в противовес 7% больных из группы шам-стимуляции, причем у 9 человек из группы с хорошим результатом болевых атак не наблюдалось совсем, а у 12 – удалось снизить их частоту.
Большой интерес представляет работа M.C. Barloese et al. [25], в которой проанализированы долгосрочные результаты лечения 33 пациентов методом SPGS. Удлинения межприступных периодов удалось добиться у 30% (n=10) больных; причем у всех больных начало межприступного периода совпало с началом стимуляции, а медиана самого длительного периода составила 149 ± 97 дней. Анализ опросника влияния головной боли на повседневную активность HIT-6 (Headache Impact Test) у пациентов в период приступов показал улучшение по сравнению с исходными результатами, что свидетельствует о меньшем влиянии головной боли на качество жизни у этих больных. У 6 исследуемых удалось добиться снижения количества принимаемых лекарственных препаратов.
В работе T.P. Jürgens et al. [26] показана возможность терапевтического управления болевыми атаками с помощью SPGS: из 4340 эпизодов цефалгии почти в 78% случаев удалось купировать приступ при помощи стимулятора. У 33% больных снизилась частота атак, т. е. в среднем на 83% от исходного уровня.
В 2015 г. J.B. Pietzsch et al. [27] представили результаты исследования экономической обоснованности применения стимуляции крылонебного ганглия у пациентов с рефрактерной КГБ. В частности, экономическая выгода использования SPGS составила почти 42187 евро через 5 лет после начала использования стимулятора, что было связано как с уменьшением затрат на косвенные расходы и оплату больничных листов, так и с уменьшением количества принимаемых лекарственных препаратов [27].
Тем не менее необходимы дальнейшие исследования эффективности обоих методов нейромодуляции (ONS и SPGS) и установление критериев отбора пациентов с ХКГБ для направления на это высокотехнологическое лечение, что позволит добиться ремиссии, стабильного эффекта и снижение выраженной дезадаптации у большего количества больных.
Центральная инвазивная нейромодуляция. Стимуляция глубинных структур мозга, или глубокая стимуляция головного мозга (DBS) (рис. 3), а именно области заднего гипоталамуса, применяется в профилактическом лечении ХКГБ и других ТВЦ с 2001 г. после того, как были получены результаты структурной и функциональной нейровизуализации и исследований гормонального спектра, свидетельствующие о ключевой роли этой области мозга в патофизиологии развития КГБ (в частности, в регуляции суточных и циркадианных ритмов). С учетом возможных осложнений и технической сложности данной операции нейростимуляция гипоталамуса должна осуществляться только в нейрохирургических центрах, специалисты которых имеют достаточный опыт стереотаксических операций. 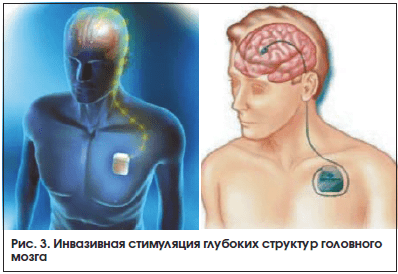
Опубликованы данные о более чем 4-летнем периоде последующего наблюдения пациентов с рефрактерной ХКГБ после DBS, свидетельствующие о хорошей долгосрочной эффективности этой технологии. Вместе с тем у некоторых больных со временем отмечено снижение эффективности метода глубокой стимуляции головного мозга, что является предметом дискуссии: связана ли эта проблема с естественным течением заболевания или представляет собой развитие толерантности к проводимой стимуляции. Глубокая стимуляция гипоталамуса успешно применялась и при других ТВЦ, например у пациентов с синдромом SUNCT и хронической пароксизмальной гемикранией [28, 29].
Отбор пациентов для проведения нейромодуляции: кому и когда? Перед принятием решения о целесообразности применения методов нейромодуляции необходимо, во-первых, удостовериться в том, что имеющаяся головная боль у пациента отвечает диагностическим критериям первичной цефалгии, в частности КГБ, в соответствии с МКГБ–3, бета [1]; во-вторых, что головная боль является хронической (ежедневной или почти ежедневной) и устойчивой к фармакотерапии. Таким образом, основным показанием для проведения инвазивной нейромодуляции у пациентов с первичными цефалгиями является рефрактерность или устойчивость болевого синдрома к повторным курсам профилактической терапии препаратами с доказанной эффективностью по данным рандомизированных плацебо-контролируемых исследований в адекватной терапевтической дозе и с достаточной продолжительностью их приема. Важно заметить, что при подозрении на рефрактерность болевого синдрома сроки консервативного лечения не должны быть слишком продолжительными, поскольку поздно начатая нейромодуляция приводит к существенно худшим результатам, чем начатая своевременно. Кроме того, фармакотерапия нередко сопряжена с различными побочными эффектами, которых лишено физическое воздействие в виде электрического влияния на структуры нервной системы.
Критерии включения в группу лечения методом инвазивной нейромодуляции. Кроме оценки соответствия критериям рефрактерной цефалгии головная боль у пациентов с КГБ должна удовлетворять критериям включения для применения инвазивного метода нейромодуляции (табл. 5) [30]. Поскольку хронические первичные головные боли имеют тенденцию к изменению с течением времени и даже ремиссии, рекомендуется оценить 2-летний анамнез цефалгии по дневникам головной боли, которые ведут пациенты. Дополнительным критерием является наличие значительной психосоциальной дезадаптации пациента в связи с имеющейся головной болью, что позволяет проанализировать опросник влияния головной боли на повседневную активность HIT-6 [31]. Подчеркивается, что отбор пациентов для нейромодуляции и последующее после имплантации устройства наблюдение осуществляются цефалгологами – специалистами по диагностике и лечению головной боли предпочтительно на базе специализированного центра боли или головной боли. Оперативное вмешательство должно проводиться нейрохирургической командой, имеющей опыт инвазивной нейромодуляции.
Нейромодуляция и коморбидные нарушения. При решении вопроса о назначении инвазивной нейромодуляции следует принимать во внимание наличие у пациента с ХКГБ лекарственного абузуса (злоупотребления анальгетическими препаратами, в т. ч. триптанами), являющегося одним из основных факторов хронизации головной боли. Поскольку у больных с хронической цефалгией и лекарственным абузусом отмечается меньшая эффективность СЗН, чем у пациентов, не злоупотребляющих лекарственными препаратами, то перед началом инвазивного лечения больной должен отказаться от приема этих средств; при необходимости возможно проведение дезинтоксикационной терапии [31, 32].
При наличии у пациента психогенного компонента цефалгии, выраженных тревожно-депрессивных нарушений необходимо верифицирование их вторичного характера по отношению к болевому синдрому, т. к. замаскированные депрессии и другие варианты аффективных расстройств могут служить предиктором неблагоприятного прогноза.
Заключение
Методы высокотехнологической нейромодуляции, как неинвазивной, так и инвазивной, многие годы успешно применяющиеся для лечения различных неврологических заболеваний, в последнее время получили широкое распространение и у пациентов с тяжелыми хроническими формами первичных цефалгий. Важно отметить, что инвазивная нейромодуляция должна проводиться при условии неэффективности традиционных методов терапевтического воздействия с доказанной эффективностью (адекватная фармакотерапия, ботулинотерапия, блокады периферических нервов), а также неинвазивной нейромодуляции.
Для успешного применения методов нейромодуляции в лечении рефрактерных ХКГБ, как и других хронических цефалгий, решающее значение имеет междисциплинарный подход с привлечением специалистов, имеющих опыт ведения таких пациентов и имплантации инвазивных устройств для нейромодуляции. Отбор больных (диагностика первичной головной боли и оценка соответствия имеющейся у пациента цефалгии критериям рефрактерной головной боли) и последующее послеоперационное наблюдение должны осуществляться цефалгологом – специалистом по диагностике и лечению головной боли, предпочтительно на базе специализированного центра боли или головной боли. Анализ критериев отбора пациентов для нейромодуляции и выбор индивидуального, наиболее подходящего варианта воздействия является задачей нейрохирурга. Имплантация устройства должна осуществляться квалифицированной бригадой нейрохирургов, владеющих техникой имплантации инвазивных устройств для нейромодуляции. При соблюдении этих условий методы высокотехнологической нейромодуляции открывают перспективы существенного улучшения качества жизни для пациентов с тяжелыми хроническими цефалгиями, устойчивыми к другим видам лечения.
Литература
1. The International Classification of Headache Disorders, 3rd edition (beta version) // Cephalalgia. 2013. Vol. 33(9). P. 629–808.
2. Осипова В.В., Табеева Г.Р. Первичные головные боли. Практическое руководство. М.: ПАГРИ-Принт. 2007. 60 с. [Osipova V.V., Tabeeva G.R. Pervichnye golovnye boli. Prakticheskoe rukovodstvo. M.: PAGRI-Print. 2007. 60 s. (in Russian)].
3. Rozen T.D. Trigeminal autonomic cephalalgias. In: Migraine and other primary headaches. Neurological clinics / Randolph W. EvansEd. 2009. Vol. 27. Elsevier. P. 537–556.
4. Choong C.K., Ford J.H., Nyhuis A.W. et al. Clinical Characteristics and Treatment Patterns Among Patients Diagnosed With Cluster Headache in U.S. Healthcare Claims Data // Headache. 2017. Vol. 57. P. 1359–1374.
5. Francis G.J., Becker W.J., Pringsheim T.M. Acute and preventive pharmacologic treatment of cluster headache // Neurology. 2010. Vol. 75(5). P. 463–473.
6. Robbins M.S., Starling A.J., Pringsheim T.M. et al. Treatment of Cluster Headache: The American Headache Society Evidence-Based Guidelines // Headache. 2016. Vol. 56(7). P. 1093–1106.
7. Sarchielli P., Granella F., Prudenzano M.P. et al. Italian guidelines for primary headaches: 2012 revised version // J. Headache Pain. 2012. Vol. 13(2). Р. 31–70.
8. Tepper S.J., Duplin J., Nye B., Tepper D.E. Prescribing Oxygen for Cluster Headache: A Guide for the Provider // Headache. 2017. Vol. 57(9). P. 1428–1430.
9. Ashina H., Newman L., Ashina S. Calcitonin gene-related peptide antagonism and cluster headache: an emerging new treatment // Neurol. Sci. 2017. doi: 10.1007/s10072-017-3101-8
10. Schuster N.M., Rapoport A.M. Calcitonin Gene-Related Peptide-Targeted Therapies for Migraine and Cluster Headache: A Review // Clin. Neuropharmacol. 2017. Vol. 40(4). P. 169–174.
11. Екушева Е.В. Современные подходы к терапии хронической ежедневной головной боли // Сибирское медицинское обозрение. 2017. Т.1. С.93–98 [Ekusheva E.V. Sovremennye podhody k terapii hronicheskoj ezhednevnoj golovnoj boli // Sibirskoe medicinskoe obozrenie. 2017. T.1. S.93–98 (in Russian)].
12. Dickenson A.H. Gate control theory of pain stands the test of time // Br. J. Anaesth. 2002. Vol. 88. P.755–757.
13. Vincent M.B., Ekman R., Edvinsson L. et al. Reduction of calcitonin gene-related peptide in jugular blood following electrical stimulation of rat greater occipital nerve // Cephalalgia. 1992. Vol. 12. P. 275–279.
14. Khan S., Schoenen J., Ashina M. Sphenopalatine ganglion neuromodulation in migraine: what is the rationale? // Cephalalgia. 2014. Vol. 34(5). P. 382–391.
15. Magis D., Schoenen J. Neurostimulation: which place in the treatment of refractory headaches? // Rev. Med. Liege. 2012. Vol. 67(2). P. 85–90.
16. Brewer A.C., Trentman T.L., Ivancic M.G. et al. Long-term outcome in occipital nerve stimulation patients with medically intractable primary headache disorders // Neuromodulation. 2013. Vol. 16(6). P. 557–564.
17. Hong J., Ball P. A., Fanciullo G.J. Neurostimulation for neck pain and headache // Headache. 2014. Vol. 54(3). P. 430–444.
18. Burns B., Watkins L., Goadsby P.J. Treatment of intractable chronic cluster headache by occipital nerve stimulation in 14 patients // Neurology. 2009. Vol. 72. P. 341–345.
19. Müller O.M., Gaul C., Katsarava Z. et al. Bilateral occipital nerve stimulation for the treatment of chronic cluster headache: case series and initiation of a prospective study // Fortschr. Neurol. Psychiatr. 2010. Vol. 78. P. 709–714.
20. Magis D., Gerardy P.Y., Remacle J.M., Schoenen J. Sustained effectiveness of occipital nerve stimulation in drug-resistant chronic cluster headache // Headache. 2011. Vol. 51. P. 1191–1201.
21. Fontaine D., Christophe S.J., Raoul S. et al. Treatment of refractory chronic cluster headache by chronic occipital nerve stimulation // Cephalalgia. 2011. Vol. 31. P. 1101–1105.
22. Messina G., Franzini A., Proietti A., Leone С.М. (2016). ONS and DBS for the Treatment of Chronic Cluster Headache, From Bench to Bedside – Trauma, Tumors, Spine, Functional Neurosurgery, Dr. Francesco Signorelli (Ed.), InTech, doi: 10.5772/64482. Available from: https://www.intechopen.com/books/from-bench-to-bedside-trauma-tumors-spine-functional-neurosurgery/ons-and-dbs-for-the-treatment-of-chronic-cluster-headache
23. Magis D., Gérard P., Schoenen J. Invasive occipital nerve stimulation for refractory chronic cluster headache: what evolution at long-term? Strengths and weaknesses of the method // J. Headache Pain. 2016. Vol. 17(1). P. 8.
24. Schoenen J., Jensen R.H., Lante ´ri-Minet M. et al. Stimulation of the sphenopalatine ganglion (SPG) for cluster headache treatment. Pathway CH-1: a randomized, sham-controlled study // Cephalalgia. 2013. Vol. 33. P. 816–830.
25. Barloese M.C., Jürgens T.P, May A. et al. Cluster headache attack remission with sphenopalatine ganglion stimulation: experiences in chronic cluster headache patients through 24 months // Headache Pain. 2016. Vol. 17(1). P. 67.
26. Jürgens T.P., Barloese M., May A. et al. Long-term effectiveness of sphenopalatine ganglion stimulation for cluster headache // Cephalalgia. 2017. Vol. 37(5). P. 423–434.
27. Pietzsch J.B., Garner A., Gaul C., May A. Cost-effectiveness of stimulation of the sphenopalatine ganglion (SPG) for the treatment of chronic cluster headache: a model-based analysis based on the Pathway CH-1 study // J. Headache Pain. 2015. Vol. 16. P. 48.
28. Clelland C.D., Zheng Z., Kim W. et al. Common cerebral networks associated with distinct deep brain stimulation targets for cluster headache // Cephalalgia. 2014. Vol. 34(3). P. 224–230.
29. Silberstein S.D., Mechtler L.L., Kudrow D.B. et al. Behalf of the ACT1 Study Group. Non–invasive vagus nerve stimulation for the ACute Treatment of cluster headache: findings from the randomized, double‐blind, sham‐controlled ACT1 Study // Headache. 2016. Vol. 56(8) P. 1317–1332.
30. Mitsikostas D.D., Edvinsson L., Jensen R.H. et al. Refractory chronic cluster headache: a consensus statement on clinical definition from the European Headache Federation // J. Headache Pain. 2014. Vol. 15. P. 79.
31. Miller S., Watkins L., Matharu M. Predictors of response to occipital nerve stimulation in refractory chronic headache // Cephalalgia. 2017. Vol. 1. 333102417728747.
32. Исагулян Э.Д., Томский А.А., Макашова Е.С., Салова Е.М. Критерии подбора пациентов для проведения нейростимуляции в лечении болевых синдромов // Поликлиника. 2017. Т.1. №1. С.39–42 [Isaguljan Je.D., Tomskij A.A., Makashova E.S., Salova E.M. Kriterii podbora pacientov dlja provedenija nejrostimuljacii v lechenii bolevyh sindromov // Poliklinika. 2017. T.1. №1. S.39–42 (in Russian)].
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru





