Оптимизация концентрации аллергенов для использования в тесте активации базофилов
Содержание статьи
Введение
Для выявления сенсибилизации у пациентов с отягощенным аллергологическим анамнезом педиатры, пульмонологи и аллергологи, помимо изучения анамнеза и клинической картины заболевания, используют кожные тесты и определение специфических иммуноглобулинов класса Е (IgE) к различным аллергенам. Ни один метод не обладает абсолютной диагностической точностью. Провокационные пробы с аллергенами могут достаточно надежно выявлять сенсибилизацию, но не используются в широкой медицинской практике из-за высокой частоты быстрых и отсроченных аллергических реакций. Например, проведение ингаляционного теста с антигенами Aspergillus spp. может привести к развитию фатального бронхоспазма [1].
Продолжается поиск новых лабораторных возможностей выявления сенсибилизации к различным аллергенам. Самым современным и перспективным методом в настоящее время является тест активации базофилов, предложенный
в 1990-х гг. Данный тест основан на выявлении in vitro активированных аллергеном базофильных гранулоцитов. В качестве стимулов могут быть использованы пищевые, ингаляционные, инсектные, лекарственные аллергены [2–4]. По данным различных авторов [2, 4, 5], показана высокая чувствительность и специфичность теста активации базофилов in vitro, проводимого методом проточной цитометрии для определения сенсибилизации к различным аллергенам.
Поскольку клиническому применению теста активации базофилов менее 20 лет, а в нашей стране еще меньше, в настоящий момент остается много нерешенных методических вопросов. Например, на результат определения сенсибилизации к определенному аллергену, безусловно, влияют свойства и концентрация используемого в тесте аллергена. Концентрация аллергена должна быть достаточно высокой, чтобы обеспечить хорошую чувствительность, но при этом ее следует протестировать на заведомо толерантных контрольных лицах для того, чтобы избежать риска токсичности вещества и неспецифической активации базофилов [6].
Цель данной работы — изучить влияние концентрации аллергенов на активацию базофилов in vitro у различных категорий пациентов.
Материал и методы
Чтобы оценить влияние различных концентраций пищевых и ингаляционных аллергенов на активацию базофилов in vitro, а также определить оптимальную концентрацию аллергенов, были отобраны пациенты с доказанной различными способами микогенной (Aspergillus fumigatus) и пищевой (пшеничная мука) сенсибилизацией. Группы сравнения состояли из пациентов без такой сенсибилизации.
Для подбора оптимальной концентрации аллергена A. fumigatus в тесте активации базофилов в данное исследование были включены 5 больных аллергическим бронхолегочным аспергиллезом (АБЛА) — 2 (40%) мужчины и 3 (60%) женщины в возрасте от 38 до 78 лет. Группу сравнения составили 9 больных атопической бронхиальной астмой без микогенной сенсибилизации в возрасте от 26 до 68 лет — 2 (22%) мужчины и 7 (78%) женщин.
Все пациенты проходили обследование и лечение в микологической клинике СЗГМУ им. И.И. Мечникова. В аллергологическое обследование входили кожные прик-тесты с шестью грибковыми аллергенами: Alternaria, Aspergillus, Cladosporium, Penicillium, Rhizopus, Candida (Германия).
Лабораторное обследование включало определение уровня специфических IgE к грибковым аллергенам (панель биотинилированных аллергенов, Россия) в сыворотке крови, а также тест активации базофилов in vitro методом проточной цитометрии (Allergenicity kit, США) с аллергеном A. fumigatus («Алкор Био», Россия).
Уровень контроля симптомов и степень тяжести бронхиальной астмы определяли в соответствии с критериями «Глобальной стратегии лечения и профилактики бронхиальной астмы» (GINA, 2018). Для выявления микогенной сенсибилизации использовали критерий, предложенный экспертами Международного общества микологии человека и животных (International Society for human and animal mycology — ISHAM) [7]: положительный кожный прик-тест (≥3 мм) и/или выявление в сыворотке крови уровня специфического IgE к грибковому аллергену, соответствующего классу 1 и выше (≥0,35 МЕ/мл). Диагноз АБЛА устанавливали на основании критериев R. Agarwal et al. (2013) [8].
Для оптимизации концентрации пищевого аллергена (пшеничная мука) в данное исследование были включены 6 больных (3 (50%) мальчика и столько же девочек) атопическим дерматитом с сенсибилизацией к аллергену пшеничной муки, которые находились в состоянии ремиссии. Возраст пациентов был от 1 до 3,5 года. Группу сравнения составили 5 больных (3 (60%) мальчика и 2 (40%) девочки) атопическим дерматитом без сенсибилизации к аллергену пшеничной муки. Возраст пациентов — от 11 мес. до 4 лет.
Пациенты наблюдались в ФГБОУ ВО СПбГПМУ Минздрава России. Аллергологическое обследование включало кожные прик-тесты с пищевыми аллергенами (Чешская Республика).
Лабораторное обследование включало определение уровня специфических IgE к пищевым аллергенам (Immulite, США) в сыворотке крови, а также тест активации базофилов in vitro методом проточной цитометрии (Allerginicity kit, США) с аллергеном пшеничной муки (Россия).
Сенсибилизацию к пшеничной муке выявляли по положительному результату кожного прик-теста (≥3 мм) и/или наличию в сыворотке крови уровня специфического IgE к аллергену пшеничной муки, соответствующего классу 1 и выше (≥0,35 МЕ/мл).
По показаниям пациентам назначали дополнительные клинические и лабораторные методы исследования.
Кровь для определения уровня специфических IgE к пищевым и грибковым аллергенам забирали в вакутейнеры с активатором свертывания, кровь для исследования активации базофилов забирали натощак из кубитальной вены и помещали в вакутейнеры с гепарином.
Тест активации базофилов проводили в течение 1–2 ч от момента забора крови, применяя метод проточной цитометрии с использованием набора Allerginicity kit (Cellular Analysis of Allergy, США). В многоцветном протоколе для анализа проб идентификацию базофилов осуществляли с помощью показателей SSlowCD3-CD294+CD203c+, а активацию базофилов оценивали на основании возрастания экспрессии CD203c после стимуляции in vitro.
Методика теста активации базофилов Allerginicity kit: 50 мкл цельной периферической крови окрашивали тройным коктейлем моноклональных антител CD294-FITC/CD203c-PE/CD3-PC7 в соответствии с инструкцией производителя в присутствии фосфатно-солевого буферного раствора (10 мкл, отрицательный контроль), анти-IgE антител — антител к комплексу IgE с высокоаффинным рецептором для IgE (10 мкл sIgE/FceR1, положительный контроль), а также аллергенов A. fumigatus и пшеничной муки (10 мкл аллергена, тест) в нескольких концентрациях в течение 15 мин при 37 °С на водяной бане в темноте. Далее проводили лизис эритроцитов лизирующим фиксирующим реагентом Allerginicity kit, для отмывки клеток от несвязавшихся антител использовали фосфатно-солевой буферный раствор (Россия). В каждой пробе оценивали 500 базофилов методом проточной цитометрии в мультипараметрическом протоколе с многоэтапным гейтированием.
В тесте оценивали спонтанную активацию базофилов в пробе с буферным раствором — долю клеток с высокой экспрессией CD203c от общего количества базофилов SSlowCD3-CD294+CD203c+. Оценку положительного контроля, обеспечивающего имитацию связывания аллергена с комплексом sIgE/FceR1 на мембране базофилов, использовали для анализа способности базофилов к активации. Оценить специфическую активацию базофилов в тесте с аллергенами возможно в том случае, если при исследовании положительного контроля регистрируется превышение количества активированных базофилов не менее чем на 10% [9]. Порог позитивности в тесте с аллергенами определяют по индексу активации — отношению количества активированных базофилов в пробе с аллергеном к данному параметру в пробе с буферным раствором. На данный момент нет единого мнения, какой индекс активации необходимо использовать. Согласно данным различных авторов, индекс активации рассматривают в качестве позитивного в том случае, если он более 2 [10], более 1,73 [9], более 1,06 [11]. В нашем исследовании тест с грибковым аллергеном считали положительным при индексе активации более 1,1, с аллергеном пшеничной муки — более 1,05.
Результаты и обсуждение
Анализ полученных результатов специфической активации базофилов у пациентов с пищевой и микогенной сенсибилизацией выявил отчетливый дозозависимый эффект активации in vitro на оба исследованных аллергена: с увеличением концентрации аллергенов в пробах повышалось количество активированных базофилов, ярко экспрессирующих CD203c (рис. 1).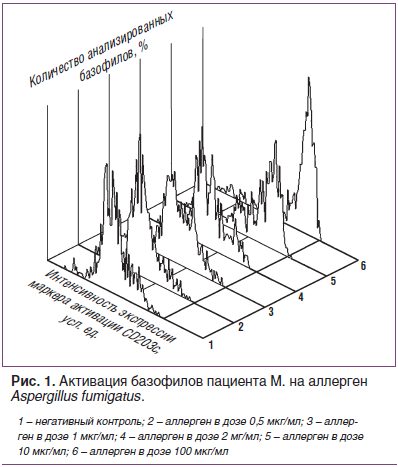
Дозозависимый эффект активации базофилов in vitro различными концентрациями аллергена A. fumigatus и аллергена пшеничной муки оценивался по индексу активации (табл. 1).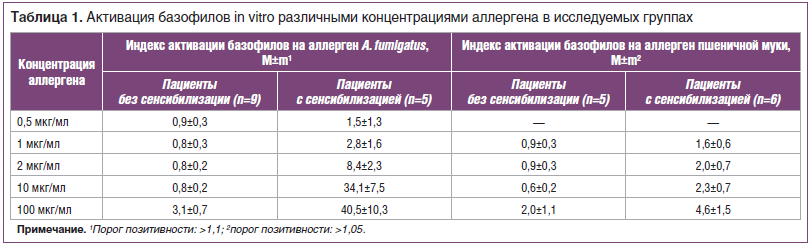
Следует отметить, что самая высокая концентрация аллергенов, используемая нами, составила 100 мкг/мл. Она оказалась излишне высокой и вызвала неспецифическую активацию базофилов у всех пациентов, включая тех, у которых другими методами исследования сенсибилизация не была выявлена. Использование концентрации 100 мкг/мл привело к появлению ложнопозитивных результатов в тесте активации базофилов для обоих аллергенов. При этом степень активации на эти аллергены у несенсибилизированных пациентов была значительно ниже, чем у больных АБЛА к аллергену A. fumigatus (в 13 раз) и у пациентов с атопическим дерматитом к аллергену пшеничной муки (в 2 раза).
Интересно, что даже при использовании очень низких концентраций — 1 мкг/мл для обоих аллергенов и 0,5 мкг/мл для аллергена A. fumigatus — в группах пациентов с сенсибилизацией средний индекс оставался выше порога позитивности. При этом среди 5 пациентов с доказанной микогенной сенсибилизацией у 1 обследованного мы получили ложноотрицательный результат теста активации базофилов при использовании двух низких концентраций. Из 6 пациентов с сенсибилизацией к аллергену пшеницы при использовании концентрации 1 мкг/мл ложноотрицательные результаты получены у 3 человек.
Согласно нашим данным, оптимальная концентрация реактивов данного производителя в тесте активации базофилов составляет от 2 до 10 мкг/мл как для пищевых, так и для ингаляционных аллергенов.
При использовании оптимальной концентрации аллергенов тест активации базофилов выявил сенсибилизацию к A. fumigatus у всех обследованных больных с микогенной сенсибилизацией. Аналогичные данные получены для пациентов с сенсибилизацией к аллергену пшеничной муки. В нашем предыдущем исследовании [12] выявлена достоверная прямая корреляционная зависимость между количеством активированных аллергеном базофилов in vitro и уровнем специфических IgE к A. fumigatus.
Несмотря на то, что оптимальные концентрации схожи для пищевых и ингаляционных аллергенов, степень активации базофилов на аллерген пшеничной муки и аллерген A. fumigatus различается приблизительно в 15 раз при концентрации 10 мкг/мл и в 4 раза при концентрации 2 мкг/мл. Этот эффект обусловлен, вероятно, свойствами ингаляционного аллергена, который вызывает более значительную активацию клеток ввиду того, что непосредственно взаимодействует с организмом в дыхательных путях в отличие от пищевого аллергена, который проходит через пищеварительный тракт, изменяя при этом свои свойства. Вероятно, этими же различиями в степени активации базофилов на действие пищевого и ингаляционного аллергена обусловлено более частое получение ложноотрицательных результатов при использовании низкой концентрации аллергена пшеничной муки. На основании этих данных можно сделать заключение, что подбор оптимальной концентрации для пищевых аллергенов может стать большей проблемой, чем для ингаляционных.
В литературе обсуждается вопрос о том, какие аллергены желательно использовать для выявления сенсибилизации в тесте активации базофилов. A.L. de Weck et al. [13] рекомендуют применять стандартизованные аллергены, адаптированные для клеточных тестов. Некоторые авторы [14] используют аллергены для кожных проб, а также готовят экстракты самостоятельно [15]. Сопоставлять литературные данные об оптимальных концентрациях аллергенов представляется крайне сложной задачей. Во-первых, в тест-системах разных производителей рекомендуется добавлять разное количество аллергена на образец крови: например, в наборе Allergenicity kit (Beckman Coulter) рекомендуется на 100 мкл крови добавлять 20 мкл аллергена, в наборах Basotest (Glycotope Biotechnology) и Flow CAST (Buhlemann Laboratories AG) рекомендуется использовать равное количество крови и аллергена. Подбор оптимальных концентраций при этом, как правило, отдается на усмотрение пользователей. Многие исследователи и производители реагентов рекомендуют использовать несколько концентраций аллергена при тестировании каждого пациента.
В обзоре W.-J. Song, Y.-S. Chang [6] для большинства лекарственных препаратов (бета-лактамы, фторхинолоны), использованных в тесте активации базофилов, указываются концентрации в мг/мл. Для жидких препаратов, например рентгеноконтрастных веществ, рекомендуется разведение лекарственного средства 1:10 [16]. Концентрации ингаляционных аллергенов, например Dermatophagoides pteronyssinus [17], а также аллергена Hymenoptera [18] авторы указывали в нг/мл. Данный порядок указания концентраций рекомендован для использования в тесте активации базофилов компанией Buhlemann Laboratories AG, которая специализируется на выпуске этой продукции. Концентрации экстракта белков пшеницы, рекомбинантного и нативного w-5 глиадина в тесте активации базофилов выражены в мкг/мл [15]. В нашем исследовании рабочие концентрации аллергенов A. fumigatus и пшеничной муки выражались в мкг/мл. Эти концентрации наиболее схожи с теми, которые использовали R. Tokuda et al. для пищевых аллергенов [15]. В данной работе на основании ROC-анализа показана высокая диагностическая значимость теста активации базофилов для разделения чувствительных и толерантных к белкам пшеницы пациентов.
На 9 Европейском консорциуме по применению проточной цитометрии в аллергологии EUROBAT (2016) было высказано мнение о том, что необходимо взвешенно подходить к выбору концентрации аллергенов, используемой в тесте активации базофилов.
Несомненна связь между применяемой концентрацией аллергена в тесте и пороговым значением индекса активации базофилов, который используется для оценки позитивности теста. При высокой концентрации аллергена с целью увеличения специфичности методики для отсечения ложнопозитивных результатов требуется повышение индекса. При этом можно потерять чувствительность, потому что пациенты с невысоким уровнем сенсибилизации, и, соответственно, небольшим индексом активации базофилов, будут неправомерно отнесены в группу с отсутствием активации. Использование низкой концентрации аллергена также может привести к ложнонегативным результатам теста.
По нашему мнению, для разделения сенсибилизированных и толерантных пациентов желательно использовать невысокий индекс активации, чтобы не пропустить больных с низким уровнем сенсибилизации. При этом необходимо вносить в пробу аллерген невысокой, но достаточной для активации базофилов концентрации, проверенной на пациентах с доказанной сенсибилизацией. Использование невысокой концентрации аллергена позволит избежать ложнопозитивных результатов, обусловленных неспецифической активацией базофилов.
Выявление сенсибилизации в тесте активации базофилов при использовании оптимальной дозы аллергена соответствует данным анамнеза, положительным результатам кожных проб и уровню специфических IgE к аллергенам, что подтверждает высокую диагностическую значимость использованного метода.
Выводы
На основании изложенного материала можно сделать следующие выводы.
Степень активации базофилов in vitro на аллергены в тесте активации базофилов носит отчетливый дозозависимый характер.
Оптимальный диапазон концентраций аллергенов
A. fumigatus и пшеничной муки для данного производителя реактива при использовании в тесте активации базофилов составляет от 2 до 10 мкг/мл.
Оптимальную концентрацию требуется подбирать в зависимости от используемых аллергенов.
Активация базофилов на грибковый аллерген in vitro значительно выше, чем на пищевой.
Информация с rmj.ru






