Введение
Хронический гастрит является одним из часто устанавливаемых диагнозов в клинической практике и занимает центральное место среди заболеваний желудка.
К основным изменениям слизистой оболочки желудка (СОЖ), которыми представлена морфологическая картина хронического гастрита, относятся воспаление, атрофия, метаплазия и дисплазия, что и является точками приложения терапии. Несмотря на то, что изменения СОЖ начинаются с развития острого воспаления, которое впоследствии переходит в хроническое, гастрит не всегда проявляет себя выраженной клинической симптоматикой с развитием диспепсических жалоб и может протекать бессимптомно [1].
Helicobacter pylori — наиболее распространенная бактериальная инфекция в мире [2], являющаяся фактором прогрессирования гастрита. H. pylori выявляется у 65–92% взрослого населения (в зависимости от региона) [3]. При этом частота морфологической верификации диагноза «хронический гастрит» гораздо ниже, в том числе у пациентов с H. pylori-позитивным статусом.
Бактерии Н. рylori, персистируя на желудочном эпителии, вызывают хронический хеликобактерный поверхностный гастрит. Длительно существующий поверхностный хеликобактерный гастрит без соответствующего лечения трансформируется в атрофический с необратимой утратой желез желудка и последующим замещением их фиброзной тканью или трансформацией в онкологический процесс [4]. Пациенты с хроническим атрофическим гастритом, особенно при условии его мультифокальности, имеют повышенный риск развития аденокарциномы желудка [3, 5–7].
До недавнего времени атрофию было принято считать необратимым процессом, результатом которого в лучшем случае было отсутствие прогрессирования. С конца 1990-х годов стали появляться сообщения относительно возможности обратного развития процесса атрофии после успешной эрадикационной хеликобактерной терапии. На сегодняшний день эрадикация H. pylori является эффективным методом лечения гастрита, может остановить прогрессирование долгосрочных осложнений, включая рак желудка, и в ряде случаев привести к обратному их развитию [8].
Таким образом, «золотым стандартом» базового лечения хронического H. pylori-ассоциированного гастрита является эрадикационная терапия [3, 6, 9, 10], которая, как было отмечено, позволяет снизить риск развития рака желудка [8].
Одним из примеров может служить длительное исследование, в котором у пациентов оценивали показатели пепсиногена 1 и гастрина 17 в крови, снижение уровня которых свидетельствует об атрофических изменениях в теле и антральном отделе желудка соответственно, что в свою очередь является фактором риска развития рака желудка. Так, за 7 лет наблюдения не было зарегистрировано ни одного случая рака желудка среди 2220 участников с хроническим атрофическим гастритом, из них 2134 — с H. pylori-ассоциированным, прошедших серологический скрининг и лечение [11]. Было показано, что комплексное этиологическое лечение атрофического гастрита достоверно снижает риск и заболеваемость раком желудка у таких больных. Из изложенного выше следует, что такое состояние, как хронический гастрит, особенно с доказанной персистенцией H. pylori, требует обязательного лечения и последующего наблюдения.
Вместе с тем вследствие разнообразия патогенетических механизмов гастрита, кроме эрадикационной терапии, комплекс терапевтических подходов должен предусматривать гастропротекцию, коррекцию метаболизма, восстановление микробиоты, а также стимуляцию регенеративных процессов.
В настоящее время в РФ специалисты руководствуются следующими документами по лечению различных вариантов гастрита:
-
Стандарт медицинской помощи больным хроническим гастритом, дуоденитом, диспепсией1;
-
Клинические рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению инфекции H. pylori у взрослых [3];
-
VI Национальные рекомендации по диагностике и лечению кислотозависимых и ассоциированных с H. pylori заболеваний (VI Московские соглашения) [12];
-
Система поддержки принятия врачебных решений [13].
Основными группами лекарственных средств, применяемых в лечении хронического H. pylori-ассоциированного гастрита, утвержденными стандартами1, являются:
-
антациды;
-
прокинетики;
-
блокаторы H2-гистаминовых рецепторов (ранитидин, фамотидин);
-
ингибиторы протонной помпы (ИПП) (омепразол, рабепразол и др.);
-
антибактериальные средства (амоксициллин, кларитромицин);
-
противопаразитарные средства (метронидазол).
Содержание статьи
Современные представления о лечении хронического гастрита
На данный момент эрадикационная терапия рассматривается в качестве базового лечения с высоким уровнем доказательности и включена практически во все методические и клинические рекомендации [3, 5, 6, 9, 10, 14].
Согласно устоявшимся представлениям целями эрадикационной терапии являются:
-
лечение инфекции, купирование воспаления, нормализация функции желудка;
-
возможное купирование атрофических и метапластических изменений СОЖ;
-
профилактика рака желудка.
В отечественных рекомендациях [15] предложены различные схемы эрадикационной терапии. Оптимальная схема антибиотикотерапии при H. pylori-ассоциированном хроническом гастрите должна обеспечивать уровень эрадикации около 90%, что требует использования многокомпонентных схем лечения.
Стандартная тройная схема продолжительностью 14 дней предусматривает назначение ИПП, кларитромицина и амоксициллина. Стандартную тройную терапию следует назначать, применяя различные меры, повышающие ее эффективность, в первую очередь назначение висмута трикалия дицитрата. При непереносимости препаратов пенициллинового ряда предпочтение отдается комбинации ИПП, висмута трикалия дицитрата, тетрациклина и метронидазола. Вместе с тем применение схем с включением метронидазола не всегда оправдано, так как критический порог резистентности к нему H. pylori (40%) в России преодолен [16]. Также четырехкомпонентная схема с препаратом висмута рассматривается как терапия второй линии при неэффективности стандартной трехкомпонентной схемы [3, 5, 17]. При возникновении необходимости проведения терапии третьей линии при выборе препаратов необходим индивидуальный подход с предварительным определением чувствительности к антибиотикам [3, 5, 18].
К критериям эффективности проведенной эрадикационной терапии относят:
-
купирование клинических симптомов диспепсии через 14 дней;
-
улучшение качества жизни больных через 7 дней;
-
элиминация H. pylori через 30 дней после окончания эрадикационной терапии;
-
регресс у части пациентов гистологических признаков атрофии СОЖ (после успешной эрадикационной терапии);
-
снижение уровня IgG к H. pylori в сыворотке крови пациентов в среднем через 2 мес. лечения (при неэффективности эрадикационной терапии их уровень остается высоким и через 1 год) [19].
Согласно Маастрихтскому консенсусу V пересмотра в отсутствие предраковых изменений успешная эрадикация H. pylori обеспечивает купирование воспаления СОЖ. Активный воспалительный процесс, характеризующийся инфильтрацией полиморфно-ядерными клетками, обычно разрешается в течение 4 нед. [4, 5]. При этом эрадикация H. pylori не только устраняет активную воспалительную реакцию при хроническом активном неатрофическом гастрите, но и предотвращает дальнейшее прогрессирование атрофии и кишечной метаплазии при хроническом атрофическом гастрите [20]. Однако данная положительная динамика может иметь место не у всех пациентов. Существует так называемая «точка невозврата» в виде хронического атрофического гастрита с кишечной метаплазией, когда даже при устранении этиологического фактора сохраняется риск прогрессирования воспалительных изменений СОЖ с нарушением процессов клеточного обновления [21]. Сказанное выше обосновывает необходимость и важность эрадикации Н. pylori до формирования атрофических изменений желудка.
Хроническое воспаление СОЖ у некоторых пациентов не исчезает вместе с элиминацией возбудителя H. pylori, а риск рецидива клинических симптомов в виде диспепсии в течение 1 года после эрадикации H. pylori сохраняется. Так, А.В. Кононов и соавт. [22], проведя гистологический анализ гастробиоптатов через 1 год после успешной эрадикационной терапии, восстановление структуры СОЖ констатировали у 24 (13,2%) пациентов, прошедших курс лечения, частичный регресс воспалительных изменений — у 106 (58,6%) больных, сохранение воспалительных изменений — у 51 (28,2%) пациента.
В случае сохранения воспаления, а также атрофических изменений в СОЖ после антихеликобактерной терапии можно говорить о так называемом постэрадикационном гастрите [23].
К сожалению, уменьшение степени (регресс) атрофии также отмечается не у всех пациентов после антихеликобактерной терапии. Согласно рекомендациям Маастрихтского консенсуса VI пересмотра после успешной эрадикации H. pylori пациенты с высокой стадией (OLGA/OLGIM III–IV) гастрита и/или обширной атрофией, установленной эндоскопически, остаются подверженными риску развития рака желудка [20]. Было показано, что индекс апоптоза мононуклеарных клеток собственной пластинки остается неизменным при отсутствии лечения атрофического гастрита, что свидетельствует о длительном течении воспалительных и апоптотических процессов в желудочном эпителии, которые приводят к прогрессированию атрофии СОЖ [22].
Также важно отметить, что длительная персистенция антител к H. рylori даже после антихеликобактерного лечения рассматривается как один из ключевых механизмов повреждения обкладочных клеток СОЖ [21].
Среди патофизиологических механизмов, обусловливающих сохранение «постэрадикационного гастрита», можно выделить следующие [22, 24–27]:
-
выработка активных форм кислорода (АФК) («оксидативный стресс») нейтрофильными лейкоцитами, инфильтрирующими СОЖ, что приводит к прямому и опосредованному цитокинами повреждению эпителия СОЖ и является фактором риска образования язв и эрозий;
-
необратимые повреждения ДНК как результат длительного воздействия АФК, которые накапливаются и формируют «стартовую площадку» для развития рака желудка;
-
сохраняющаяся определенное время воспалительная инфильтрация СОЖ ассоциирована с возможностью повреждения клеток, в том числе и за счет повышенной активности ферментов перекисного окисления липидов — циклооксигеназы 2 и индуцибельной синтазы окиси азота (iNOS) — белков, участвующих в канцерогенезе в течение 1 года после успешной эрадикации;
-
изменение микробиоты желудка и контаминация другими микроорганизмами (Staphylococcus aureus, Klebsiella pneumoniae, Proteus mirabilis, Enterobacter cloacae, Citrobacter freundii) как дополнительный фактор поддержания воспаления.
Таким образом, назначение только антихеликобактерной терапии не всегда является достаточным для лечения хронического Н. pylori-ассоциированного гастрита. Требуется комплексное терапевтическое воздействие, направленное на коррекцию оксидативных нарушений и снижение выраженности воспалительного процесса, а также ускорение регресса атрофического процесса в желудке. Пациентам с постэрадикационным гастритом показано дополнительное назначение курсов муко-, цитопротективной терапии.
Возможные варианты терапии в постэрадикационном периоде
В настоящее время тактика ведения пациентов с сохраняющимися изменениями в СОЖ после эрадикационной терапии определяется лечащим врачом индивидуально, поскольку каких-либо регламентирующих документов или утвержденных схем в арсенале врача нет.
Нередко встречаются клинические ситуации, когда пациент продолжает принимать длительно ИПП без имеющихся на то показаний. В то же время данная группа препаратов может проявлять и класс-специфические побочные эффекты [28], что требует более бдительного и взвешенного решения в случае назначения ИПП на длительный период времени.
Для повышения эффективности эрадикации H. pylori, а также минимизации побочных эффектов в схемы лечения предлагается включать пробиотические препараты, которые благодаря своему механизму действия реализуют такие эффекты, как повышение гуморального и клеточного иммунитета, снижение окислительного стресса, а также проявляют прямой антагонизм против H. pylori(колонизационная резистентность и синтез бактериоцинов), способствуют стимуляции местной иммунологической защиты (укрепление защитного барьера и уменьшение воспаления СОЖ) [20].
С целью предотвращения развития прогрессирования изменений СОЖ в схему лечения хронического гастрита рекомендуется включать гастропротекторы (препараты, обладающие регенераторным и репаративным действием). Это группа препаратов, обладающих также антагонистическим действием в отношении H. pylori. Оказывают нейтрализующее действие в отношении АФК, ограждают от повреждения ДНК клеток железистого эпителия, способствуют микроциркуляции, слизеобразованию, а также нормализации клеточной СОЖ [17, 29].
Одним из гастропротекторов является препарат висмута. Терапия препаратами висмута трикалия дицитрата потенцирует защитные свойства СОЖ, что актуально для пациентов с хроническим поверхностным и атрофическим гастритом [3, 30, 31]. На фоне применения висмута трикалия дицитрата не развивается первичная и вторичная резистентность к H. pylori. Кроме того, цитопротективный эффект препарата может затормозить прогрессирование гастрита, в том числе и постэрадикационного.
Вместе с тем длительный период приема солей висмута (более 8 нед.) в высоких дозировках может оказать нейротоксический эффект, что было отмечено еще в 1970-х годах, следствием чего явился запрет на лечение висмутом в некоторых странах (Франция, Япония). Однако в настоящее время прием висмута в соответствующих эрадикационной схеме дозировках рассматривается исключительно с положительным эффектом [32].
В настоящее время в клинической практике широко применяется цитопротектор ребамипид, относящийся к клинико-фармакологической группе гастропротекторов. Препарат повышает содержание простагландина Е2, являющегося основным медиатором воспалительного ответа, в СОЖ и в желудочном соке. Защитные свойства ребамипида позволяют рекомендовать его не только для проведения курса эрадикационной терапии инфекции H. pylori, но также для продолжения лечения, особенно при эрозивно-язвенных поражениях желудка и двенадцатиперстной кишки [3, 12 33]. Препарат способствует улучшению кровоснабжения СОЖ, повышает синтез гликопротеинов и бикарбонатов, усиливает пролиферацию эпителиальных клеток желудка [34]. Для реализации значимого регресса морфологических признаков хронического гастрита со снижением инфильтрации нейтрофилами и моноцитами на фоне H. pylori и/или после эрадикации инфекции необходимо лечение ребамипидом в течение 6–12 мес. [35].
Для решения ряда важнейших задач при воспалительно-дистрофических заболеваниях СОЖ и в постэрадикационном периоде возможно применение инновационного лекарственного препарата (не БАД) Регастим Гастро, появившегося на российском фармацевтическом рынке относительно недавно (в конце 2022 г.). Регастим Гастро содержит альфа-глутамил-триптофан, который обладает рядом важных эффектов, а именно2 [36, 37]:
-
оказывает репаративное, противовоспалительное и обволакивающее действие на СОЖ;
-
стимулирует процессы регенерации при наличии очагов атрофии СОЖ;
-
может способствовать нормализации рН желудка, увеличивая количество желез желудочной секреции;
-
снижает уровень гастрина 17 в крови, увеличивает соотношение пепсиноген I / пепсиноген II (что является показателем восстановления кислотообразующей и пепсинобразующей функций);
-
оказывает противовоспалительное действие, снижая выраженность лейкоцитарной инфильтрации СОЖ;
-
способствует более выраженному снижению титра антихеликобактерных антител, уменьшая активность аутоиммунного компонента воспаления СОЖ.
Мощный противовоспалительный и регенераторный эффект альфа-глутамил-триптофана был продемонстрирован в двойном слепом рандомизированном плацебо-контролируемом многоцентровом исследовании [38]. Так, при оценке динамики эндоскопических показателей на фоне применения альфа-глутамил-триптофана было обнаружено статистически значимое снижение выраженности отека в СОЖ более чем на 20% (р<0,01), общей суммы признаков острого воспалительного процесса (толщина складок, гиперемия, отек, выраженность эрозивного процесса) (р<0,01) при сравнении с показателями исходного состояния. Регенераторный эффект альфа-глутамил-триптофана проявлялся в увеличении количества желез на 1 мм2 СОЖ в группе пациентов, принимающих препарат, по сравнению с исходными данными и при межгрупповом сравнении [39]. Был сделан вывод, что альфа-глутамил-триптофан является лекарственным средством, способствующим также уменьшению проявлений постэрадикационного воспаления СОЖ и ее атрофии.
Отечественными экспертами в качестве практической рекомендации для широкой медицинской практики был предложен алгоритм выбора тактики лечения пациентов с подозрением на хронический атрофический гастрит, в том числе H. pylori-ассоциированный [40].
Вместе с тем важным остается вопрос о курсовом применении альфа-глутамил-триптофана: как часто в течение года возможно его назначение? Необходимо обратить внимание на то, что препарат обладает доказанным благоприятным профилем безопасности.
Алгоритм назначения альфа-глутамил-триптофана может включать от 2 до 8 курсов в год, что, вероятно, будет зависеть от стадии атрофического процесса у пациента и причины, которая привела к развитию атрофии (например, аутоиммунный гастрит). Возможный алгоритм назначения альфа-глутамил-триптофана (Регастим Гастро) представлен на рисунке.
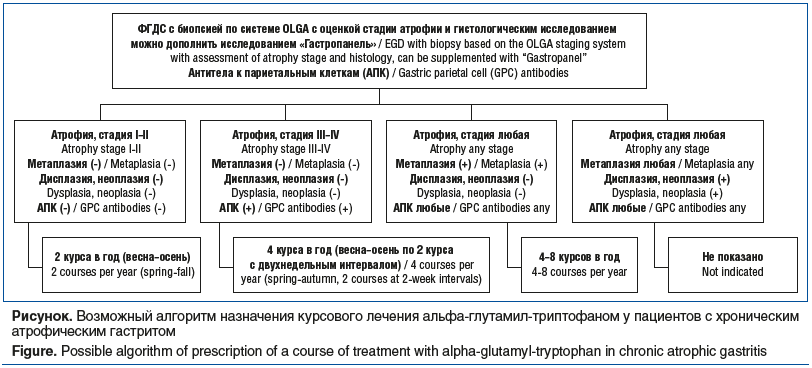
Целесообразность предложенного алгоритма может быть подтверждена в рамках более длительного наблюдения за пациентами, принимающими данный препарат.
Заключение
Таким образом, для лечения хронического гастрита и постэрадикационных изменений в СОЖ необходимо рассматривать комплексный подход, основанный не только на эрадикации инфекции H. pylori, но и на назначении гастропротективных препаратов, обладающих противовоспалительным и регенераторным эффектом.
1Стандарт медицинской помощи больным хроническим гастритом, дуоденитом, диспепсией (утв. приказом Минздрава России № 248 от 22.11.2004). (Электронный ресурс.) URL: https://normativ.kontur.ru/document?moduleId=1&documentId=80697.
2Инструкция по медицинскому применению препарата Регастим Гастро. (Электронный ресурс.) URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=1ae58340-018b-4b9e-8215-0ea2f282045a (дата обращения: 18.05.2024).
СВЕДЕНИЯ ОБ АВТОРАХ:
Пахомова Инна Григорьевна — к.м.н., доцент кафедры факультетской терапии с клиникой ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России; 197341, Россия, г. Санкт-Петербург, ул. Аккуратова, д. 2; ORCID iD 0000-0002-3125-6282.
Скрипачева Яна Юрьевна — к.м.н., ассистент кафедры офтальмологии ФГБОУ ВО ПСПбГМУ им. акад. И.П. Павлова; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, 6–8; ORCID iD 0009-0003-1111-4767.
Контактная информация: Пахомова Инна Григорьевна, e-mail: pakhomova-inna@yandex.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 28.03.2024.
Поступила после рецензирования 22.04.2024.
Принята в печать 20.05.2024.
ABOUT THE AUTHORS:
Inna G. Pakhomova — C. Sc. (Med.), Associate Professor of the Department of Faculty Therapy with the Clinica, V.A. Almazov National Medical Research Center; 2, Akkuratova str., St. Petersburg, 197341, Russian Federation; ORCID iD 0000-0002-3125-6282.
Yana Yu. Skripacheva — C. Sc. (Med.), assistant of the Department of Ophthalmology, Pavlov First Saint-Petersburg State Medical University; 6-8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; ORCID iD 0009-0003-1111-4767.
Contact information: Inna G. Pakhomova, e-mail: pakhomova-inna@yandex.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 28.03.2024.
Revised 22.04.2024.
Accepted 20.05.2024.
Информация с rmj.ru


