Невралгия тройничного нерва, ассоциированная с менингиомами задней черепной ямки: стратегия успешного хирургического лечения
Содержание статьи
Введение
Невралгия тройничного нерва (НТН) — заболевание, проявляющееся острыми приступообразными интенсивными и строго односторонними болями в области лица, описываемыми пациентами как прострелы или удары током. Болевой синдром может возникать спонтанно или провоцироваться прикосновениями к коже лица, открыванием рта, жеванием, поворотами и наклонами головы [1]. Частота встречаемости данного заболевания в популяции составляет от 4 до 15 случаев на 100 000 населения [2–4], и чаще оно наблюдается у лиц трудоспособного возраста — после 45 лет.
Клиническая картина НТН хорошо известна, а ее критерии, определенные Международной ассоциацией по изучению боли, позволяют поставить абсолютно точный диагноз [5]. Также достоверно известно, что в 95% случаев причиной возникновения классической НТН является компрессия артериальным или венозным сосудом препонтинной части корешка тройничного нерва, как правило, в месте его слияния со стволом головного мозга [6]. В связи с этим единственным методом патогенетического лечения НТН является васкулярная декомпрессия тройничного нерва, при которой устраняется непосредственная причина заболевания — сосудистая компрессия V нерва в мостомозжечковом углу (ММУ) [7–11].
Однако в нейрохирургической практике помимо классического варианта НТН болевой синдром наблюдается вследствие опухолей задней черепной ямки (ЗЧЯ). По данным литературы [12–14], тригеминальная невралгия может быть либо единственным симптомом новообразования, либо входит в симптомокомплекс опухолей ММУ (в 5% случаев). Чаще характерный для НТН болевой синдром наблюдается при эпидермоидных кистах, менингиомах ЗЧЯ, вестибулярных шванномах [2, 15–18]. Встречаются единичные упоминания возникновения НТН при параганглиоме, липоме, лимфоме и каверноме [19–24]. Таким образом, можно выделить две основные причины для возникновения НТН:
Сосудистая компрессия тройничного нерва в препонтинной части корешка.
Сдавление препонтинной части корешка тройничного нерва опухолью, достигающей последнего.
До недавнего времени считалось, что единственной причиной возникновения болевого синдрома в области лица при опухолях ЗЧЯ является компрессия корешка тройничного нерва имеющимся новообразованием в полости черепа, и ее удаление приведет к регрессу боли. T.M. Cheng et al. [25] при анализе результатов лечения 5058 пациентов с лицевыми болями в клинике «Мейо» (Mayo clinic в городе Rochester, Minnesota, USA) с 1976 по 1990 г. обнаружили у 2972 из них НТН, ассоциированную в 9,96% случаев (у 296 человек) с опухолями головного мозга, причем наиболее часто наблюдались менингиомы ЗЧЯ.
В работах последнего десятилетия [14, 24, 26], посвященных данной теме, продемонстрированы различные варианты компрессии корешка тройничного нерва при опухолях ЗЧЯ. В частности, при описании эпидермоидных кист ММУ, сопровождающихся НТН или гемифациальным спазмом, H. Kobata et al. [27] представляют следующие анатомо-топографические варианты взаимоотношения опухоли и корешка тройничного нерва:
корешок тройничного нерва включен в строму опухоли без смещения нерва;
компрессия и смещение тройничного нерва опухолью;
смещение тройничного нерва опухолью и компрессия его сосудом снаружи от нерва;
компрессия тройничного нерва непосредственно артерией, смещенной опухолью.
Похожая классификация была предложена отечественными нейрохирургами [24] после проведении исследования с участием 51 пациента с НТН, ассоциированной с опухолью:
тип I — опухоль полностью окружает корешок тройничного нерва;
тип II — опухоль смещает корешок тройничного нерва;
тип III — опухоль располагается внутри корешка тройничного нерва;
тип IV — опухоль и прилежащий к ней сосуд смещают корешок тройничного нерва;
тип V — опухоль смещает корешок тройничного нерва по направлению к сосуду;
тип VI — опухоль не соприкасается с корешком тройничного нерва, который сдавлен сосудом.
Авторами данной классификации были прооперированы все пациенты (51 человек) с НТН и ипсилатеральными опухолями в области ММУ. Объемные образования были представлены менингиомами верхушки пирамиды височной кости (29 человек), эпидермоидными кистами (11), вестибулярными невриномами (9), гемангиомой и каверномой (1). У 49 пациентов в ходе операции были выявлены сдавление и деформация ствола головного мозга на уровне входа корешка ТН. Сосудистая компрессия корешка ТН (чаще верхней мозжечковой артерией) обнаружена у 15 больных. Всем пациентам проводилось удаление опухоли, а при наличии нейроваскулярного конфликта хирургическое вмешательство дополнялось васкулярной декомпрессией корешка тройничного нерва. У 50 пациентов в раннем послеоперационном периоде наблюдался полный регресс болевого синдрома.
В 1 случае удаление эпидермоидной кисты и васкулярная декомпрессия тройничного нерва не привели к существенному снижению частоты и интенсивности боли в области лица, в связи с чем впоследствии пациенту была выполнена радиочастотная ризотомия [24].
Помимо хирургического метода лечения у больных с опухолями ЗЧЯ, ассоциированными с НТН, применяется стереотаксическая лучевая терапия. Она рассматривается у пациентов с опухолями основания черепа в случае фармакорезистентного болевого синдрома при невозможности тотального удаления опухоли, например, при злокачественных опухолях основания черепа или хордомах, при противопоказаниях к хирургическому лечению, связанных с отягощенным соматическим статусом. В анализированных нами исследованиях [28, 29] показана достаточно высокая эффективность в отношении контроля роста опухоли — до 90–100%, однако полный регресс лицевых болей отмечался в меньшем, по сравнению с микрохирургическим удалением опухоли, числе случаев — в 25–76%. Наиболее часто у пациентов с опухолями ЗЧЯ, ассоциированными с НТН, встречались небольшие менингиомы ЗЧЯ (не более 15 мм в диаметре), в частности, менингиомы верхушки пирамиды височной кости и петрокливальной локализации [6, 12–15, 24, 26].
В Центре нейрохирургии им. акад. Н.Н. Бурденко в 2012 г. была разработана следующая классификация компрессии корешка тройничного нерва при опухолях ЗЧЯ:
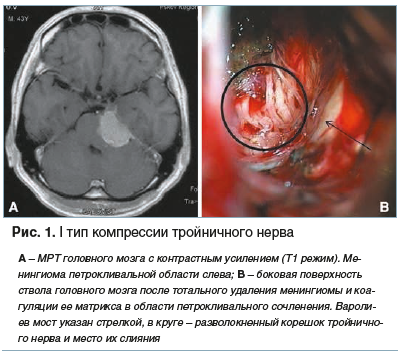
I тип — тройничный нерв компримирован опухолью;
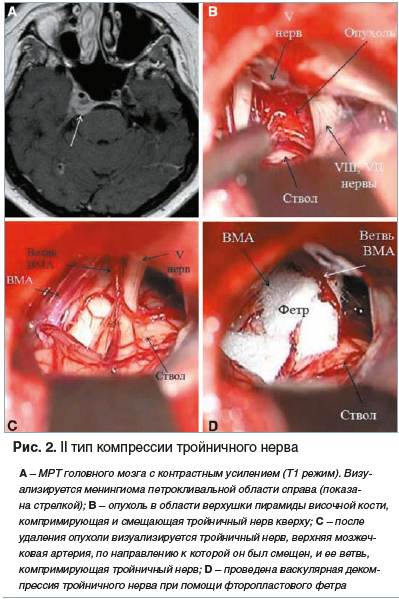
II тип — тройничный нерв смещен опухолью в направлении к какому-либо кровеносному сосуду, что приводит к формированию нейроваскулярного конфликта;
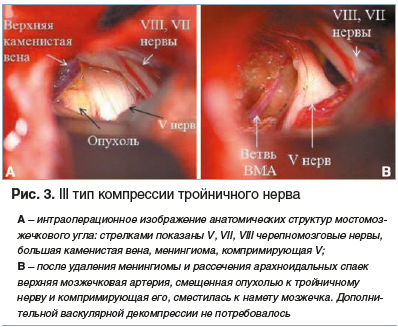
III тип — кровеносный сосуд смещен опухолью и располагается между новообразованием и корешком тройничного нерва, вызывая его сосудистую компрессию.
Представленная классификация лаконична, проста в применении и позволяет в зависимости от типа компрессии корешка тройничного нерва выбрать ту или иную тактику хирургического лечения (рис. 1–3).
Материал и методы
С 2012 по 2017 г. в Центре нейрохирургии им. академика Н.Н. Бурденко было прооперировано 50 больных с менингиомами ЗЧЯ, ассоциированными с НТН (43 женщины и 7 мужчин, в возрасте от 35 лет до 71 года, медиана возраста — 60 лет). В 21 случае опухоль располагалась справа, в 29 — слева. Менингиомы располагались в верхушке пирамиды височной кости у 17 пациентов (34%), петрокливально — у 20 (40%), на задней поверхности пирамиды височной кости — у 13 (26%). В 3 случаях (6%) наблюдались множественные менингиомы: у 1 больного отмечалось справа сочетание менингиомы задней поверхности пирамиды височной кости и парасаггитальной менингиомы, у 1 — сочетание петрокливальной менингиомы и менингиомы задней поверхности пирамиды височной кости и у 1 — менингиома верхушки пирамиды и яремного отверстия. Длительность заболевания от его дебюта до хирургического вмешательства колебалась от 2 мес. до 17 лет (медиана — 33 мес.). Все пациенты для снижения интенсивности имеющегося болевого синдрома принимали препараты карбамазепина в суточной дозе до 2000 мг, т. е. в предельно допустимой дозе этого лекарственного средства в сутки. Хирургическим манипуляциям на периферических ветвях и корешке тройничного нерва с незначительным преходящим эффектом подверглись 4 пациента, а в 2 наблюдениях в качестве первого этапа лечения было выполнено радиологическое лечение.
I тип компрессии по классификации компрессии корешка тройничного нерва при опухолях ЗЧЯ Центра нейрохирургии им. акад. Н.Н. Бурденко (2012 г.) наблюдался у 35 пациентов, II тип — у 11, III тип — у 4. При II и III типах верхняя мозжечковая артерия в 18% случаев (у 9 больных) являлась компримирующим сосудом, передняя нижняя мозжечковая артерия — в 8% (у 4), задняя нижняя мозжечковая артерия — в 2% (у 1 пациента). Васкулярная декомпрессия тройничного нерва проведена в 30% случаев (у 15 пациентов с II и III типами компрессии). У 40 больных опухоль была удалена тотально или почти тотально, у 10 больных — частично. Выраженность болевого синдрома до и после операции оценивалась по визуально-аналоговой шкале (ВАШ) и шкале интенсивности боли Института неврологии Бэрроу (Barrow Neurological Institute Pain Scale, BNI-PS).
Интенсивность боли при использовании ВАШ оценивается с помощью отрезка прямой длиной 10 см, на которой 0 соответствует отсутствию боли, а 10 см — мучительной и невыносимой боли. Пациенту предлагается поставить на ВАШ отметку, отражающую интенсивность испытываемой им боли. Далее проводится измерение расстояния в сантиметрах между началом отрезка и сделанной пациентом отметкой, результаты округляют до целого. В зависимости от полученных данных различают: слабую боль — до 2 см, умеренную — от 2 до 4 см, сильную — от 4 до 6 см, сильнейшую — от 6 до 8 см, сильнейшую и невыносимую — до 10 см [30].
Шкала BNI-PS позволяет комплексно оценить по 5-балльной системе выраженность болевого синдрома и необходимость использования пациентом медикаментозных средств для его купирования (табл. 1) [31].

Результаты
До оперативного вмешательства степень тяжести болевого синдрома по ВАШ оценили как 10 баллов 39 пациентов, как 9 баллов — 5, как 7 баллов — 1, как 6 баллов — 3, как 5 баллов — 2. При оценке боли с помощью шкалы BNI-PS у пациентов в дооперационном периоде были получены следующие данные: у 25 человек (50%) определялось 5 баллов, у 9 (18%) — 4 балла, у 4 (8%) — 3 балла и у 12 (25%) — 2 балла.
В ходе хирургического вмешательства у 34 пациентов опухоль была удалена тотально, у 6 — почти тотально и у 10 — частично. В подавляющем большинстве случаев (92%) у пациентов после хирургического вмешательства отмечался полный регресс интенсивного болевого синдрома. У 4 (8%) пациентов наблюдалось частичное облегчение боли, из них у 2 пациентов интраоперационно определялся I тип компрессии тройничного нерва, еще у 2 — II тип. У всех пациентов с частичным регрессом болевого синдрома проводилось тотальное удаление опухоли.
Катамнестические данные удалось собрать у 28 (56%) пациентов, из них болевые ощущения по ВАШ на момент сбора катамнеза оценили: 1 балл — 21 пациент, 2 балла — 3, 3 балла — 2 пациента, 4 балла — 1, 10 баллов — 1 пациент. В соответствии с классификацией BNI-PS 21 пациент (75%) отметил полный регресс невралгии тройничного нерва после операции (BNI-PS-1). 5 пациентов (18%) указали на наличие редких эпизодов низкой интенсивности, которые не требуют приема лекарственных препаратов (BNI-PS-2). У 1 пациента (3,5%) сохранилась невралгия тройничного нерва, которая хорошо поддается консервативной терапии (BNI-PS-3). У 1 пациента (3,5%) остались невралгические боли в лице, которые не поддаются адекватной терапии лекарственными препаратами (BNIPS-4).
Ниже приведены клинические наблюдения, демонстрирующие успешное хирургическое лечение.
Клиническое наблюдение № 1, тип компрессии тройничного нерва I (рис. 1). Пациент, 43 года, с онемением левой половины лица, снижением слуха слева, симптомами НТН и нистагмом при неврологическом осмотре При магнитно-резонансной томографии (МРТ) головного мозга диагностирована менингиома петрокливальной локализации слева. Во время удаления опухоли каких-либо артериальных или венозных сосудов, компримирующих тройничный нерв, обнаружено не было, в связи с чем васкулярная декомпрессия не проводилась. Отмечается полный регресс интенсивности болевого синдрома сразу же после выхода пациента из наркозного сна.
Клиническое наблюдение № 2, тип компрессии тройничного нерва II (рис. 2). Пациентка Б., 54 года. С 2013 г. беспокоят
боли по типу удара током в правой половине лица. При МРТ
головного мозга диагностирована менингиома петрокливальной локализации справа. В 2013 г. проведено радиохирургическое лечение с помощью аппарата «Гамма-нож», после которого отмечался полный регресс интенсивного болевого синдрома, однако в 2018 г. возник рецидив. В ходе хирургического вмешательства визуализирована опухоль в области верхушки пирамиды височной кости, компримирующая и смещающая тройничный нерв кверху (рис. 2В). После удаления опухоли визуализирован тройничный нерв, ветвь верхней мозжечковой артерии, оказывающая компрессию, а также верхняя мозжечковая артерия, по направлению к которой тройничный нерв был смещен (рис. 2С). Проведенная васкулярная декомпрессия тройничного нерва при помощи фторопластового фетра (рис. 2D) привела к полному регрессу болевого синдрома.
Клиническое наблюдение № 3, тип компрессии тройничного нерва III (рис. 3). Пациентка С., 58 лет, в течение 5 лет отмечает тригеминальный болевой синдром. В 2014 г. при проведении МРТ головного мозга диагностирована менингиома верхушки пирамиды височной кости справа, проведено радиохирургическое лечение с помощью аппарата «Гамма-нож», после которого болевой синдром регрессировал лишь на 6 мес., возобновившись с прежней интенсивностью. Интраоперационно визуализированы V, VII, VIII черепные нервы, верхняя каменистая вена и менингиома, оказывающая компрессию на V нерв и вызывающая его девиацию (рис. 3А). После удаления опухоли визуализирована верхняя мозжечковая артерия, смещенная менингиомой к тройничному нерву и вызывающая его компрессию. После рассечения арахноидальных спаек артерия сместилась к намету мозжечка, дополнительной васкулярной декомпрессии не потребовалось (рис. 3В). Пациентка отмечала полный регресс болевого синдрома после операции.
В раннем послеоперационном периоде наблюдались следующие осложнения:
Ранние неврологические осложнения (на момент выписки): гипостезия — у 13 больных (26%), негрубый парез лицевой мускулатуры — у 18 пациентов (36%) и грубый парез — у 1 (2%) (согласно шкале Хауса — Бракмана 2–3 балла и 4–6 баллов соответственно), снижение слуха отмечено у 6 (12%) пациентов, глухота — у 6 (12%) пациентов, бульбарные расстройства и мозжечковая симптоматика — у 7 (14%) и 4 (8%) пациентов соответственно.
Хирургические осложнения: отек структур ЗЧЯ во время операции — у 1 (2%) пациента и назальная ликворея — у 2 (4%).
Следует отметить, что к 2019 г. доступны полному катамнезу были 29 больных (58%), из которых 21 пациент не отмечал рецидива болевого синдрома на протяжении всего периода после оперативного вмешательства. У 6 из этих 29 пациентов наблюдаются эпизодические слабоинтенсивные боли, не требующие приема лекарственных средств (по BNI-PS-2), у 1 человека возникающий болевой синдром купируется приемом препаратов в терапевтических дозах, а в 1 случае отмечается минимальная положительная динамика, при которой боли не всегда снимаются приемом анальгетиков (по BNI-PS-4). Рецидив болевого синдрома через 32 мес. наблюдался лишь у 1 женщины (2%) с субтотально удаленной петрокливальной менингиомой и I типом компрессии тройничного нерва, определенным в ходе операции. Данные обстоятельства пациентка связывает с проведением лучевого лечения.
При оценке динамики неврологических нарушений в позднем послеоперационном периоде было установлено, что 15 пациентов отмечали гипостезию в зоне иннервации тройничного нерва, среди которых у 10 человек не отмечалось какого-либо сенсорного дефицита в этой области до операции. Из этих 10 больных регресс чувствительных расстройств наблюдался у 4, а у остальных не было изменений. Остальные 5 пациентов имели еще до операции снижение поверхностной чувствительности на ипсилатеральной росту опухоли половине лица, в дальнейшем не наблюдалось положительной динамики в отношении сенсорных расстройств.
Во всех случаях при наличии признаков пареза лицевого нерва на стороне хирургического вмешательства в той или иной степени отмечалось выпадение его функции после проведения операции. Анализ катамнестических данных удалось собрать у 4 пациентов с указанным вариантом осложнения в послеоперационном периоде, причем у 2 больных со временем регистрировалось улучшение функции лицевого нерва (согласно шкале Хауса — Бракмана у 1 пациента — 4 балла и у 1 — 3), а у 2 человек — сохранение неврологической симптоматики (согласно шкале Хауса — Бракмана у 1 пациента — 5 и у 1 — 3 балла). Снижение слуха было зафиксировано в 6 случаях, причем в 5 из них оно присутствовало до операции, у 6 человек необратимая глухота появилась уже после проведения оперативного вмешательства. При анализе катамнестических данных у 3 пациентов с отсутствием положительной динамики после операции отмечалось нарушение координации. Заслуживает внимания 1 больной с наличием бульбарных расстройств, у которого после операции произошел практически полный регресс имеющихся нарушений и восстановилась функция глотания. Напротив, у другой пациентки сохранились проявления бульбарного симптомокомплекса в виде нарушения глотания на стороне оперативного вмешательства.
Обсуждение
Невралгия тройничного нерва при объемных образованиях ЗЧЯ наблюдается достаточно редко [12, 15]. Впервые возникновение интенсивного болевого синдрома при небольших опухолях ММУ, соприкасающихся с корешком тройничного нерва, отметил еще в 1934 г. американский хирург и ученый W.E. Dandy [32]. Позже его соотечественник A.G. Revilla, проанализировав данные 473 пациентов с НТН, прооперированных W.E. Dandy, обратил внимание на то, что опухоли ММУ были обнаружены лишь в 5,1% случаев, тогда как почти у половины больных (46%) определялись невриномы, у 38% — эпидермоидные опухоли и в 16% случаев — менингиомы [33].
Вопросами патогенеза опухоль-ассоциированной НТН активно занимались испанские исследователи [34]. С этой целью они изучали материал биоптата частично резецированной чувствительной порции дислоцированного и растянутого холестеатомой тройничного нерва. Помимо демиелинизации в зоне вхождения корешка тройничного нерва в ствол мозга, в некоторых областях исследуемого нерва было обнаружено тесное прилегание демиелинизированных аксонов, в некоторых участках которых определялся всего один слой миелина. Это приводит, по мнению авторов, к парадоксальному распространению нервного импульса с возбужденного волокна тройничного нерва на интактное. Следует отметить, что результаты данного исследования прямо коррелировали с таковыми при классической НТН, при которой болевой синдром обусловлен имеющимся нейроваскулярным конфликтом [34].
Рассматривая необходимость и возможность хирургического лечения менингиом ЗЧЯ, важно своевременно и правильно диагностировать симптоматические варианты НТН. В частности, у пациента с поражением кавернозного синуса опухолью, радикально удалить которую не представляется возможным, наблюдается клиническая картина невропатии тройничного нерва или атипичной невралгии. В этом случае хирургическое удаление опухоли с большой долей вероятности существенно не повлияет на интенсивность и частоту болевого синдрома. Необходимо четко формулировать показания к хирургическому вмешательству по общим правилам оперативного лечения, определенным для менингиом ЗЧЯ. Если у пациента наблюдается классический тригеминальный болевой синдром, обусловленный имеющейся менингиомой, соприкасающейся с корешком тройничного нерва, то целесообразно проводить хирургическое удаление даже опухолей небольшого размера, выполнив дополнительно васкулярную декомпрессию тройничного нерва с учетом варианта его компрессии.
Заключение
Менингиомы ЗЧЯ, компримирующие корешок тройничного нерва, большая часть которых представлена менингиомами верхушки пирамиды височной кости и петрокливальными менингиомами, могут быть причиной интенсивного и мучительного болевого синдрома. У этой категории пациентов успешно и с отличным результатом может быть использовано хирургическое удаление обнаруженных опухолей, при необходимости дополненное декомпрессией корешка тройничного нерва. Стратегически важно в ходе оперативного вмешательства уделять пристальное внимание состоянию корешка тройничного нерва и ствола головного мозга и, в зависимости от вида компрессии указанных структур, выбирать дальнейшую тактику хирургического лечения. При невозможности проведения нейрохирургического вмешательства и неэффективности консервативной терапии следует рассматривать возможность осуществления деструктивных процедур, в частности различных вариантов лучевого лечения или деструкции экстракраниальной части тройничного нерва.
Информация с rmj.ru



