Введение
Для врачей-аллергологов, так же как и для врачей-педиатров, занимающихся и интересующихся вопросами клинической аллергологии и иммунологии, важно понимать, каков прогноз у ребенка c ранним дебютом аллергического заболевания (АЗ) в младенчестве или в раннем детском возрасте. Будут ли у него формироваться более тяжелые АЗ в дальнейшем как проявление «атопического марша» (АМ)?
Долгое время считалось, что АМ характеризуется ранним и последовательным появлением клинических симптомов атопического дерматита (АтД) и пищевой аллергии (ПА) с последующим присоединением к ним аллергических респираторных проявлений [1]. Сейчас выдвигаются и обсуждаются идеи, что далеко не все дети проходят путь АМ одинаково [2]. Было показано, что взаимосвязи между формирующимися АЗ у детей значительно сложнее, чем первоначально предполагалось в ранних эпидемиологических исследованиях [3].
Наиболее распространенным вариантом развития АМ, согласно данным зарубежных исследователей, проводивших наблюдения за детьми с момента их рождения до совершеннолетия, явилось последовательное формирование АтД, бронхиальной астмы (БА) и аллергического ринита (АР) (ПА в исследовании не рассматривалась) [4]. Были предложены дополнительные траектории, при которых БА и АР возникали раньше АтД как первые проявления АМ у 20,4 и 10,5% детей соответственно.
В работе M. Ödling et al. [5] описано 4 варианта формирования БА у детей (отсутствие астмы, транзиторная астма с ранним началом, подростковая и персистирующая астма). Было замечено, что раннее формирование сопутствующих АЗ у детей соответствовало вариантам 3 или 4, которые характеризовали АМ, но только треть из этих детей страдали АтД в раннем детстве и были чувствительны к пищевым аллергенам. В более раннем проспективном исследовании было установлено, что АтД с поздним началом повышает риск развития БА, но не АР [6], при этом на разнообразие траекторий, по которым формируется БА и АМ, одновременно оказывают влияние наследственные факторы и факторы окружающей среды [7, 8].
Недавно было предложено рассматривать формирование АМ по двум преобладающим траекториям: первая — АтД с дальнейшим развитием респираторной аллергии (БА и/или АР), вторая — АтД с последующим формированием ПА (опосредованная IgE ПА и/или эозинофильный эзофагит) [9]. Действительно, в практике врача-клинициста руководствоваться именно таким подходом было бы просто и понятно, однако в ряде работ определенное место отводится развитию АМ, начинающегося с IgE-опосредованной ПА, как совершенно отдельному пути формирования АМ. Известно, что у детей с IgE-зависимой ПА АМ может прогрессировать даже без проявлений АтД [10]. В таком случае на первый план выходят респираторные симптомы или симптомы пищевой анафилаксии. Скорее всего, ПА является независимым фактором риска развития АР и БА, особенно в случае доказанной истинной аллергии к арахису, молоку и яйцам [10].
В популяционном когортном исследовании было предложено выделение восьми различных траекторий формирования АМ [11]. Изучив 2 независимые популяционные когорты, авторы описали модели, демонстрирующие гетерогенность и наибольшую встречаемость АЗ, распределив их по различиям формирования на типы (классы): 1-й тип — отсутствие АЗ, 2-й тип — «классический» АМ, 3-й тип — АтД и периодическое свистящее дыхание (визинг), 4-й тип — АтД и позднее развитие АР, 5-й тип — периодическое свистящее дыхание и позднее развитие АР, 6-й тип — периодическое свистящее дыхание, 7-й тип — только АтД, 8-й тип — только АР [11]. Исследователи определили, что те или иные формы последовательного формирования АЗ наблюдались у 48,3% детей, однако профили, напоминающие «классический» АМ, встречались только у 7% детей.
На сегодняшний день, спустя десятилетие после опубликования предложенных восьми типов (классов) АМ [11], единого мнения по траекториям его формирования у ученых так и не появилось. По анамнестическим данным пациента не всегда просто понять, какой из аллергенов подействовал на больного первым и какие клинические симптомы болезни имелись раньше, а какие присоединились позднее, проявляясь как респираторная аллергия и АМ. Пониманию и прояснению информации, полученной из анамнеза, может помочь компонентная диагностика [12]. По наличию и уровню сенсибилизации к истинным и перекрестным аллергенам можно предположить, какие из триггерных молекул аллергенов являются мажорными и воздействуют дольше и раньше остальных, а какие, являясь перекрестными, оказываются менее значимыми и, следовательно, слабее влияют на пациента.
Целью данной работы было проанализировать траектории формирования АМ в реальной клинической практике на примере педиатрических пациентов и обсудить роль компонентной диагностики при анализе путей его формирования.
Подробно анализируются 8 типов (классов) АМ [11].
Содержание статьи
Клинические наблюдения
1. Мальчик Р., 9 лет. Наследственный анамнез по атопии отягощен: у старшего брата — проявления АтД, поллиноз, БА; у матери — лекарственная аллергия на антибиотики из группы пенициллинов; у бабушки со стороны матери — поллиноз, лекарственная аллергия на антибиотики из группы пенициллинов.
Особенности быта: мальчик проживает в благоустроенной квартире на 4-м этаже многоэтажного панельного дома, животных нет.
Из анамнеза заболевания: проявления АтД и гастроинтестинальной ПА — с первых месяцев жизни. С 1 года стал появляться навязчивый сухой кашель, в том числе и в ночное время, но главным образом на фоне острых респираторных инфекций. С 2 лет присоединились повторяющиеся эпизоды острого бронхита с бронхообструктивным синдромом. Постоянный сухой кашель стал беспокоить круглогодично, однако при выезде за город самочувствие ребенка улучшалось. С 3,5 года в сезон цветения березы появились симптомы аллергического риноконъюнктивита. Приступы бронхоспазма стали возникать и при респираторных инфекциях, и в период цветения. В 4 года пациенту были установлены диагнозы БА и АР.
По поводу продолжающегося кашля и бронхиальных обструкций, не связанных с острой респираторной инфекцией, было решено провести компонентную аллергодиагностику на мультиплексной панели (рис. 1).
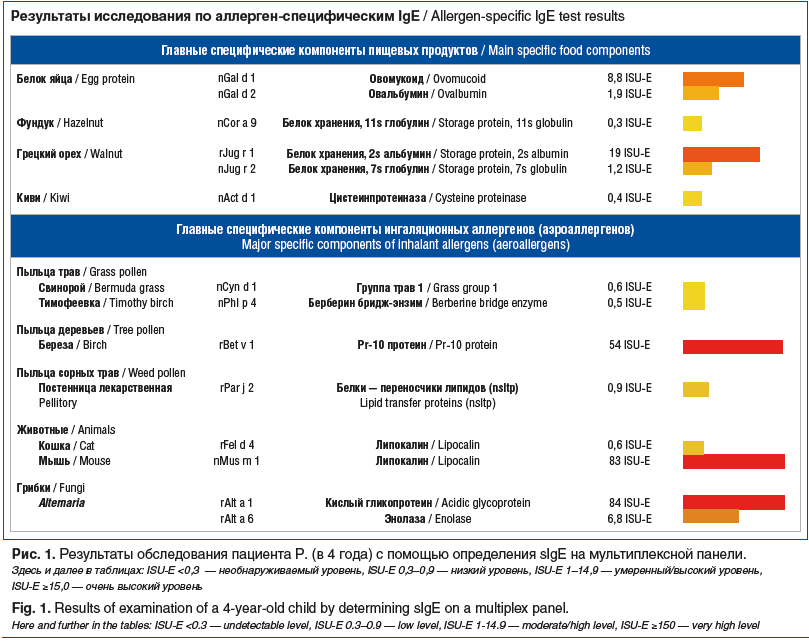
В результате обследования, наряду с пыльцевой сенсибилизацией к березе и сенсибилизацией к пищевым аллергенам (куриное яйцо, орехи, киви), была установлена высокая степень сенсибилизация к липокалину мыши и плесневым грибам (кислому гликопротеину и энолазе альтернарии). Принимая во внимание тот факт, что мальчик проживал в квартире на 4-м этаже, а не на 1-м и не в частном доме, анамнез жизни ребенка был собран более тщательно. Родители мальчика подтвердили присутствие плесени и грызунов в многоквартирном доме, а также проведение дератизации в квартире жилищной коммунальной службой. После смены места жительства самочувствие ребенка значительно улучшилось, кашель и обструкции прекратились.
2. Мальчик Г., 5 лет. Наследственный анамнез по атопии отягощен: у папы — поллиноз; у бабушки со стороны отца — АтД, ПА; у старшей сестры — поллиноз, оральный аллергический синдром.
Особенности быта: пациент проживает в благоустроенной квартире, есть кошка.
Из анамнеза заболевания: до 1 года аллергоанамнез без особенностей. Первые проявления АтД начали беспокоить ребенка на втором году жизни (регресса высыпаний на фоне терапии достигнуто не было). С 2 лет появились первые симптомы АР. Кроме того, периодически отмечались ангиоотеки лица и век.
Было проведено аллергологическое обследование, которое включало определение специфического IgE (sIgE) (ImmunoCAP) к бытовым и эпидермальным аллергенам: клещам домашней пыли Dermatophagoides pteronyssinus — 0,48 kUA/l, Dermatophagoides farinae — 0,50 kUA/l, кошке — <0,1 kUA/l; к пищевым аллергенам: белку коровьего молока — 0,65 kUA/l, белку куриного яйца — 1,32 kUA/l, пшенице — <0,1 kUA/l, креветке — 0,39 kUA/l (референтные значения <0,35 kUA/l). Ни коррекция питания, ни тщательная уборка дома не купировали симптомы АтД и АР, ангиоотеки сохранялись. Поводом для назначения компонентной аллергодиагностики послужил эпизод генерализованной острой крапивницы с ангиоотеком в 2,5 года. В результате определения sIgE на мультиплексной панели была обнаружена единственная и редкая для детей центральной части России сенсибилизация к белкам из группы тропомиозинов очень высокого уровня (рис. 2).
 Поскольку других сенсибилизирующих аллергенов у ребенка установлено не было, семье были даны следующие рекомендации: убрать из рациона питания морепродукты (креветки), обеспечить гипоаллергенный быт (не допускать появления тараканов и других насекомых в жилище, проводить акарицидную обработку), провести обследование ребенка и соответствующее лечение при обнаружении гельминтов. После выполнения всех рекомендаций все АЗ были купированы.
Поскольку других сенсибилизирующих аллергенов у ребенка установлено не было, семье были даны следующие рекомендации: убрать из рациона питания морепродукты (креветки), обеспечить гипоаллергенный быт (не допускать появления тараканов и других насекомых в жилище, проводить акарицидную обработку), провести обследование ребенка и соответствующее лечение при обнаружении гельминтов. После выполнения всех рекомендаций все АЗ были купированы.
3. Девочка Б., 4 года. Наследственный анамнез по атопии отягощен: у мамы — аллергический дерматит, у прабабушки со стороны матери — поллиноз.
Особенности быта: девочка проживает в частном доме, была кошка (порода сфинкс); у бабушек — кошки и собака.
Индивидуальные особенности семьи: в семье ежедневно готовят продукты из рыбы и морепродуктов, поскольку отец не ест мясо, а по роду деятельности он ежедневно контактирует с животными (владелец сети зоомагазинов).
Из анамнеза заболевания: формирование АтД у девочки с первого месяца жизни с резким усилением симптомов до диффузных проявлений и тяжелого течения к 6 мес. жизни. В 7 мес. родители отметили усиление зуда кожи (особенно на ладонях) после пребывания у бабушек. В возрасте 1 года было проведено лабораторное обследование на sIgE (ImmunoСAP). Была выявлена сенсибилизация к перхоти кошки — 51,60 kU/l, яичному белку — 28,60 kU/l, белку коровьего молока — 0,65 kU/l и пшенице — 0,67 kU/l (референтные значения <0,35 kU/l). Первоначально клинические проявления были расценены как АтД + гастроинтестинальная ПА, однако элиминационные диеты (безмолочная, безъяичная, безглютеновая) эффекта не давали. Состояние кожи не улучшалось, даже несмотря на удаление кошки из дома и ограничение контакта с родственниками, где есть животные.
Аллергологическое обследование с применением компонентной диагностики на мультиплексной панели было проведено после эпизода острой аллергической реакции (отечность и зуд губ, выраженное покраснение лица и кожи рук, уртикарные высыпания, возникшие в 1 год 6 мес. после контакта слизистой оболочки рта и кожи рук девочки с арахисом — несколько секунд держала в руке, которой прикоснулась ко рту) (рис. 3).
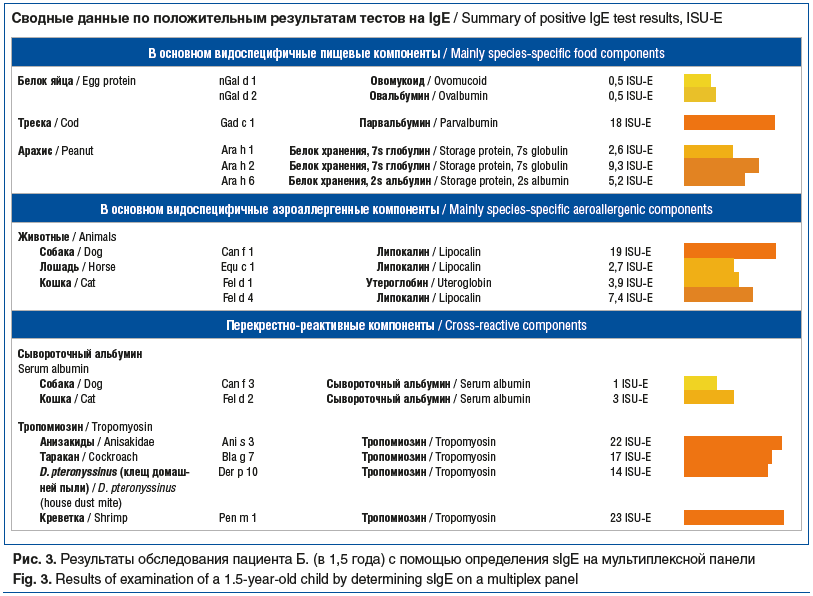
Методом молекулярной аллергодиагностики была подтверждена истинная сенсибилизация к арахису, которая вызвала острую аллергическую реакцию на слизистой оболочке полости рта и коже ребенка. Впервые была установлена высокая чувствительность пациентки к парвальбумину рыб и тропомиозину креветки. Сенсибилизация к этим молекулам была расценена как причинно-значимая, а парвальбумин и тропомиозин — как первично сенсибилизирующие аллергены. Установленные исследованием перекрестно реагирующие компоненты из группы тропомиозинов подтвердили предположение, что контакт с тропомиозином креветки имел место продолжительный период времени. Полное прекращение контакта пациентки с рыбой и креветками (отказ от приготовления рыбы и морепродуктов дома, исключение посуды и предметов, контактирующих с рыбой/креветками, а также случайного употребления внутрь), дообследование пациентки на антитела и яйца гельминтов, дополнительная коррекция питания (исключение куриных яиц), а также выполнение рекомендаций по созданию гипоаллергенного быта (недопущение контакта больной с животными, проведение акарицидной обработки) сначала существенно улучшили самочувствие девочки, а позже привели к стойкой клинической ремиссии заболевания как со стороны кожи, так и со стороны слизистых оболочек.
4. Мальчик З., 8 лет. Наследственный анамнез отягощен по атопии: у мамы — поллиноз и БА, у брата — поллиноз.
Особенности быта: проживает в частном доме, есть постоянный контакт с домашними животными (кошка, собака) и крупным рогатым скотом.
Из анамнеза заболевания: симптомы ринита в виде обильных слизистых выделений из носа отмечались с первых дней жизни ребенка (мальчик получал адаптированную молочную смесь в роддоме). При переводе на грудное вскармливание и исключении молочных продуктов из рациона матери ринорея была купирована. В 3 мес. на фоне приема биопрепарата, содержащего живые бифидумбактерии, появились покашливание и первые проявления АтД. Все попытки ввести прикормы с 4,5 мес. заканчивались неудачей и обострением АтД. В 6 мес. пациент был проконсультирован нутрициологом, который порекомендовал докармливать ребенка бульоном из конского мяса, а также ввести рис и овощи. На грудном вскармливании пациент был до 14 мес., а дальше в рационе до 6 лет были преимущественно мясо-костные бульоны. Известно, что пациента стали беспокоить постоянные симптомы со стороны респираторного тракта (бронхиальные обструкции).
Приступ спастического кашля и бронхоспазм впервые случились у пациента в возрасте 1 года. С 1 года 5 мес. эпизоды острого бронхита с бронхообструктивным синдромом, не связанные с острыми респираторными инфекциями, стали повторяться. Каждую бронхиальную обструкцию купировали в стационаре внутривенным введением глюкокортикостероидных препаратов и раствора аминофиллина. Тяжелые приступы одышки стали отмечаться в весенне-летнее время, сопровождаясь симптомами АР.
В 2 года пациенту впервые было проведено аллергологическое обследование: общий IgE (718 МЕ/мл, референтные значения <60 МЕ/мл) и sIgE методом RIDA. Выявлена сенсибилизация к молоку и α-лактальбумину — >100 IU/ml (6-й класс), казеину — 43,48 IU/ml (4-й класс), β-лактоглобулину — 14,31 IU/ml (3-й класс), сое (бобы) — 5,86 IU/ml (3-й класс), пшенице — 5,35 IU/ml (3-й класс), белку яйца — 0,95 IU/ml (2-й класс), а также лесному ореху — >100 IU/ml (6-й класс) и арахису — >100 IU/ml (6-й класс) (референтные значения <0,35 IU/ml).
Диагноз БА был выставлен больному в 6 лет. Тогда же из-за неконтролируемого течения астмы на фоне адекватной базисной терапии с целью выявления «скрытой» сенсибилизации была проведена молекулярная аллергодиагностика (рис. 4).
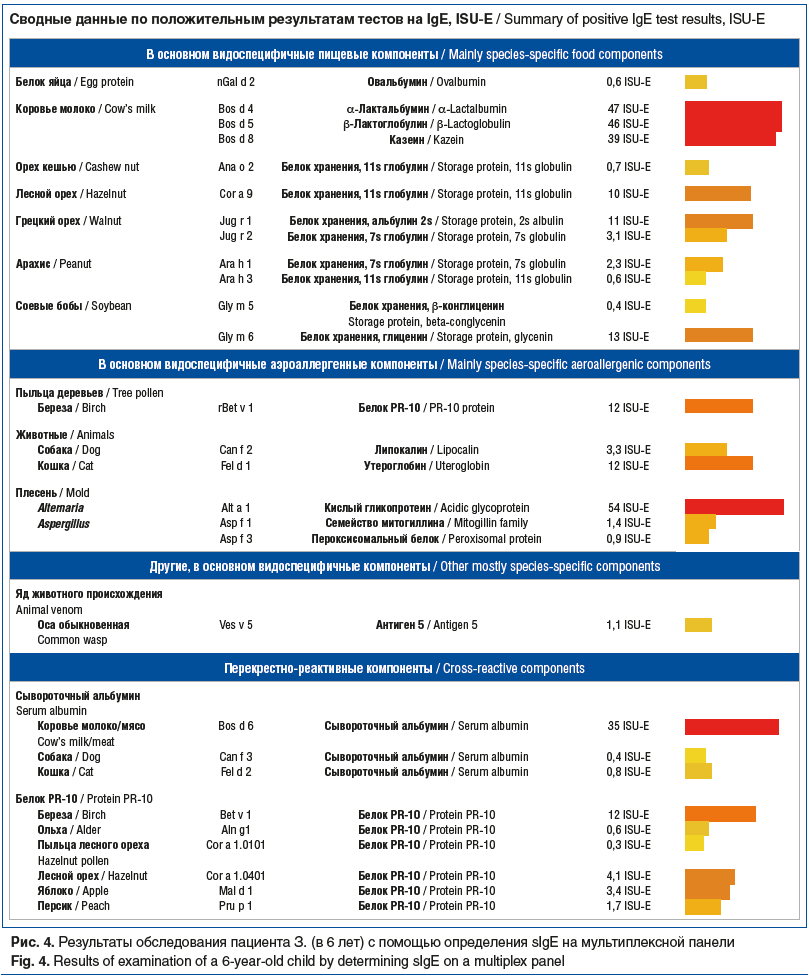
Компонентной диагностикой на мультиплексной панели подтверждена высокая гиперчувствительность пациента к белкам коровьего молока, проявившаяся клинически АР и АтД. Кроме того, у ребенка с БА и АР вместе с предполагаемой по анамнезу сенсибилизацией к респираторным аллергенам (береза и домашние животные) было установлено повышение уровня sIgE к плесневым грибам (альтернария) и найдена гиперчувствительность к группе сывороточных альбуминов (главным образом к бычьему сывороточному альбумину Bos d 6) высокого уровня. Являясь респираторным и пищевым аллергеном, бычий сывороточный альбумин присутствует как минорный аллерген в коровьем молоке, а также обнаруживается в перхоти коровы и является мажорным аллергеном мяса. Постоянное проживание рядом с крупным рогатым скотом и домашними животными, а также прямой и косвенный контакт с коровьим молоком и неограниченное употребление мясо-костных бульонов в течение продолжительного времени предопределило сенсибилизацию ребенка, установленную компонентной диагностикой. Исключение из рациона питания коровьего молока и мясо-костных бульонов существенно улучшило самочувствие пациента, однако полностью устранить контакт ребенка с животными семья не смогла.
Обсуждение
На основании приведенных выше клинических случаев нами была сделана попытка определить типы формирования АМ по восьми траекториям, которые были указаны выше [11].
В клиническом наблюдении 1 после обследования ребенка было установлено, что сенсибилизация к белкам куриного яйца (Gal d 1, Gal d 2) является доминирующей и с раннего детского возраста проявлялась в виде АтД. Поражение кожи способствовало трансдермальной сенсибилизации пациента к аллергенам мыши (Mus m1), которая в дальнейшем стала причиной формирования БА и АР и была выявлена методом компонентной диагностики. Клинические проявления сезонной аллергии были доказаны установленной сенсибилизацией к мажорному аллергену березы (Bet v 1) высокой степени сенсибилизации, а сформировавшаяся чувствительность к мажорной молекуле (Alt a 1) плесневого грибка Alternaria alternatа и присоединение клинических симптомов респираторной аллергии внесли свой вклад в персистирование симптомов БА у пациента. Таким образом, молекулярная диагностика установила скрытые и подтвердила явные молекулы аллергенов, ответственные за формирование клинических симптомов аллергии у данного пациента. По нашему мнению, развитие АМ произошло по 2-му типу формирования — «классическому».
Клиническое наблюдение 2 условно можно отнести к 4-му типу АМ. Но стоит заметить, что симптомы АР у мальчика сформировались довольно рано (к 2 годам), что подтверждает индивидуальный сценарий формирования АЗ. Всему виной оказалась гиперчувствительность к мажорным и минорным аллергенам из группы тропомиозинов (Pen m 1, Der p 10, Bla g 7, Ani s 3), обнаруженная в ходе исследования. Установленная сенсибилизация явилась причиной как респираторных проявлений аллергии (АР и высокий риск формирования БА), так и острых (ангиоотеки) и персистирующих (АтД) симптомов поражения кожи. Удивительно то, что сенсибилизация к одной группе аллергенов стала причиной разных клинических проявлений. Своевременно проведенное обследование предопределило дальнейшую тактику ведения пациента и привело к ремиссии клинических симптомов.
Углубленное компонентное обследование пациентки с диффузным персистирующим течением АтД в клиническом наблюдении 3 показало, что истинными сенсибилизаторами у ребенка являются парвальбумин рыб (Gad c 1) и тропомиозин креветки (Pen m 1). И несмотря на то, что пациентка ни разу не пробовала ни рыбу, ни креветки, установленная сенсибилизация сформировалась трансэпидермально, через поврежденную при АтД кожу или ингаляционным путем при вдыхании виновных аллергенов. Из-за высокой схожести тропомиозинов членистоногих развилась сенсибилизация не только к креветке (Pen m 1), но и к клещам домашней пыли (Der p 10), тараканам (Bla g 7) и анизакидам (Ani s 3). Позже за счет прямого контакта с перхотью, шерстью и слюной животных, а также опосредованно через одежду и кожу отца присоединилась сенсибилизация к кошке (Fel d 1, Fel d 4) и собаке (Can f 1). Выявленные причинно-значимые аллергены стали виновными в тяжелом поражении кожи у ребенка. Они же создают риск формирования у пациентки в будущем респираторной аллергии, т. е. развития сценария АМ.
Высокая гиперчувствительность к белкам хранения арахиса (Ara h 1, Ara h 2, Ara h 6), проявившаяся симптомами острой аллергической реакции, высоковероятно также появилась трансдермально [13]. Сенсибилизация к главным аллергенам куриного яйца (Gal d 1, Gal d 2) подтвердила обнаруженную ранее гиперчувствительность к яйцу в моноплексном исследовании, при этом демонстрируя десенсибилизацию к данному продукту.
Вследствие маленького возраста ребенка точно определить вариант формирования АМ на сегодняшний день не получается и однозначно сказать, к какому классу относится траектория развития АМ у пациентки, пока сложно (возможно, «классический» или 7-й тип). Только по прошествии времени будет ясно, по какому пути сформируются АЗ — будет ли это АМ или только АтД.
Наконец, в клиническом наблюдении 4 развитие аллергических симптомов протекает по ранее не описанному типу. Дебют АМ начался в первые дни жизни ребенка с респираторных проявлений (АР), позже появились симптомы АтД и БА. Вероятно, ведущими на этапе формирования АР, а также ответственными за клинические проявления АтД явились белки коровьего молока: сывороточная (Bos d 4, Bos d 5) и казеиновая (Bos d 8) фракции. Особенности питания пациента с 6 мес. до 6 лет (регулярное употребление мясо-костного бульона и большого количества мяса) предопределили гиперчувствительность к бычьему сывороточному альбумину (Bos d 6), который является мажорным аллергеном мяса крупного рогатого скота и может стать ответственным за клинические проявления респираторной аллергии.
При молекулярном обследовании также была обнаружена сенсибилизация пациента к аллергенам группы белков хранения: орехам (Ana o 2, Cor a 9, Jug r 1, Jug r 2), арахису (Ara h 1, Ara h 3), соевым бобам (Gly m 5, Gly m 6). Большой спектр сенсибилизации ребенка к орехам может быть обусловлен косенсибилизацией. Заметим, что ребенок никогда внутрь не употреблял эти продукты. Что же могло послужить причиной возникновения столь опасной сенсибилизации? Существует несколько предположений, которые в разной степени могут быть связаны с развитием такой гиперчувствительности.
Первая версия заключается в том, что ребенка сенсибилизировала мать. Известно, что мама пациента употребляла эти растительные продукты в больших количествах в период беременности и во время лактации. Позже, после прекращения грудного вскармливания, она часто ела орехи и арахис вне дома. Последнее обстоятельство могло послужить причиной трансдермальной сенсибилизации мальчика при условии, что крупинки продуктов оставались на губах и коже рук матери. В доступной нам литературе нет однозначного мнения в отношении высоты и частоты риска развития сенсибилизации у младенца при употреблении женщиной арахиса и сои во время беременности и грудного вскармливания [14, 15].
Другой причиной появления подобной сенсибилизации может быть генетический фактор, предрасполагающий к развитию сенсибилизации к арахису, в частности у людей с мутацией в гене белка филаггрина [16].
Наконец, использование косметических средств — кремов, шампуней, лосьонов, бальзамов, — которые содержат растительные масла, например ореховое или арахисовое, при нанесении их на кожу ребенка с АтД может инициировать формирование сенсибилизации к этим растительным аллергенам трансдермально [17].
Рецидивирующие бронхиальные обструкции вследствие сенсибилизации к респираторным аллергенам кошки (Fel d 1), собаки (Can f 2), коровы (Bos d 6) и плесневым грибам (Alt a 1, Asp f 1, Asp f 3) могут долго оставаться в жизни мальчика, поскольку он проживает в частном доме с подпольем, а семья держит скот и домашних животных. Повышенная чувствительность к мажорному аллергену березы (Bet v 1) стала причиной клинических проявлений аллергии в весенне-летний сезон и значимо ухудшила состояние пациента в этот период.
Заключение
Таким образом, оказалось сложнее, чем казалось изначально, охарактеризовать каждый клинический случай с точки зрения формирования траектории АМ. Более раннее, «классическое» понимание формирования АМ давало практикующему врачу знание, что у ребенка сначала происходит присоединение новой сенсибилизации, а после прослеживается прогрессирование клинических симптомов болезни. Сейчас, в условиях отсутствия единого мнения в отношении вариабельности и последовательности АЗ при АМ, не просто определиться с вопросом: имеющиеся у пациента заболевания являются отдельными нозологиями или происходит развитие АМ? Описанные в литературе типы АМ не всегда совпадают с реальной клинической картиной конкретного пациента, что указывает на существование не описанных ранее траекторий формирования АМ. Использование молекулярной аллергодиагностики на мультиплексной панели для каждого сложного клинического наблюдения позволяет выявить истинную и перекрестную сенсибилизацию, обдумать причины появления установленной сенсибилизации и осмыслить клинические симптомы и формирование АЗ по индивидуальной траектории пациента при обязательном условии, что сенсибилизация к истинным аллергенам доказана и клинически подтверждена.
СВЕДЕНИЯ ОБ АВТОРАХ:
Лепешкова Татьяна Сергеевна — д.м.н., доцент кафедры поликлинической педиатрии ФГБОУ ВО УГМУ Минздрава России, врач аллерголог-иммунолог; 620028, Россия, г. Екатеринбург, ул. Репина, д. 3; ORCID iD 0000-0002-0716-3529.
Андронова Елена Владимировна — соискатель кафедры поликлинической педиатрии ФГБОУ ВО УГМУ Минздрава России; 620028, Россия, г. Екатеринбург, ул. Репина, д. 3; врач аллерголог-иммунолог ООО «Семейный доктор»; 455017, Россия, г. Магнитогорск, ул. Доменщиков, д. 8А; ORCID iD 0000-0002-9506-6365.
Контактная информация: Андронова Елена Владимировна, e-mail: andronova.elena_@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 19.02.2024.
Поступила после рецензирования 11.03.2024.
Принята в печать 29.03.2024.
ABOUT THE AUTHORS:
Tatyana S. Lepeshkova — Dr. Sc. (Med.), associate professor of the Department of Polyclinic Pediatrics, Ural State Medical University; 3, Repin str., Yekaterinburg, 620028, Russian Federation; ORCID iD 0000-0002-0716-3529.
Elena V. Andronova — applicant of the Department of Polyclinic Pediatrics, Ural State Medical University; 3, Repin str., Yekaterinburg, 620028, Russian Federation; allergist immunologist, LLC «Semeynyy doctor»; 8, Domenshchiki str., Magnitogorsk, 455017, Russian Federation; ORCID iD 0000-0002-9506-6365. Contact information: Elena V. Andronova, e-mail: andronova.elena_@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 19.02.2024.
Revised 11.03.2024.
Accepted 29.03.2024.
Информация с rmj.ru





