Содержание статьи
Введение
В настоящее время поиск оптимальной терапии сахарного диабета 2 типа (СД2) и его осложнений становится все более актуальным, так как численность пациентов неуклонно растет [1]. Несмотря на арсенал антидиабетических препаратов, включающий 11 классов, по данным Федерального регистра сахарного диабета (СД), более 50% пациентов с СД2 в РФ получают препараты сульфонилмочевины (ПСМ). Механизм действия данной группы препаратов основан на активации SUR1, расположенных на β-клетках поджелудочной железы, что сопровождается стимуляцией секреции инсулина путем закрытия АТФ-чувствительных К+-каналов. Группа ПСМ — одна из самых длительно используемых в мире, но работ, посвященных изучению влияния данной группы препаратов на морфологию островков поджелудочной железы, немного, и они, как правило, посвящены оценке числа только β-клеток.
Есть данные, что прием ПСМ способствует развитию β-клеточной недостаточности и через механизм паракринной регуляции приводит к усилению глюкагонового ответа и гиперплазии α-клеток. Результаты проводимых в мире исследований данной группы препаратов весьма противоречивы и зависят от многих факторов, таких как выбор ПСМ, длительность исследования, предмет исследования и условия его проведения.
Согласно некоторым литературным данным производное ПСМ II поколения глибенкламид не нарушает морфологию поджелудочной железы и распределение α- и β-клеток по сравнению со здоровым контролем. Однако в указанных исследованиях длительность терапии, как правило, была ограничена, максимальная длительность составляла 10–12 нед. [2, 3].
С другой стороны, есть исследования, показавшие, что применение ПСМ может вызвать β-клеточную дисфункцию и апоптоз [4]. Например, в работе Г.Л. Снигура было выявлено, что применение препаратов, производных гликлазида и глибенкламида, у крыс с экспериментальным стрептозотоцин-никотинамид-индуцированным диабетом вызывало деструкцию единичных β-клеток отдельных островков в ранние сроки наблюдения (до 10 сут) и очаговые склеротические изменения в поздние сроки (28 сут). По отношению к интактному контролю объемная доля островков Лангерганса оставалась достоверно уменьшенной, а по сравнению с СД2 без лечения — достоверно увеличенной. Индекс пролиферации был сопоставим с группой СД2 без терапии [5].
Между тем разные ПСМ могут оказывать разное влияние на поджелудочную железу. В частности, в одном из исследований на клеточной линии было выявлено, что стимулирующий эффект глибенкламида на апоптоз был значительно более выражен, чем у глимепирида. При этом гликлазид не вызывал значительного увеличения количества апоптотических клеток [6]. Подобные данные были получены и другими исследователями, которые установили, что применение гликлазида в течение 10–12 нед. привело не к усилению апоптоза β-клеток, а к усилению их секреторной функции у взрослых крыс Гото — Какисаки [7].
Таким образом, имеющиеся данные относительно влияния ПСМ на морфологическую структуру островков поджелудочной железы крайне неоднозначны, но отдельные работы указывают на отсутствие усиления апоптоза на фоне приема гликлазида [6]. Возраст включенных в эксперимент животных также может оказывать влияние на морфологию эндокриноцитов. В настоящее время представлены доказательства того, что с возрастом происходит усиление апоптоза β-клеток и гиперплазия α-клеток, что должно быть учтено при планировании эксперимента [8].
В реальной практике пожилые пациенты имеют как наиболее высокий риск развития СД2, так и, вероятно, высокий риск развития β-клеточной недостаточности при использовании ПСМ. В связи с этим изучение динамики клеточного состава эндокринного аппарата поджелудочной железы при введении ПСМ в пожилом возрасте обретает особую актуальность.
Известно, что с возрастом и у людей без СД происходит уменьшение количества β-клеток и гиперплазия α-клеток, что затрудняет клиническую оценку влияния терапии ПСМ на резервную функцию эндокриноцитов в этой группе. Соответственно, целью настоящего исследования стало сравнение влияния длительного введения гликлазида и глибенкламида на морфологический состав поджелудочной железы (количество α- и β-клеток поджелудочной железы и маркеры апоптоза) при экспериментальном СД2 у возрастных крыс (возрастом 12 мес.).
Экспериментальный характер исследования дает возможность оценить эффекты данных препаратов в условиях, трудно реализуемых в клинических исследованиях: длительность беспрерывной терапии, соответствующая 10 и более человеческим годам; тщательная морфологическая и иммуногистохимическая (ИГХ) оценка поджелудочной железы. Включение в эксперимент животных возрастом более 1 года позволило нам в наибольшей степени приблизиться к реальному возрасту развития СД2 в клинике.
Материал и методы
В эксперимент включались белые лабораторные крысы линии Wistar. До 1 года животные содержались без терапии. По достижении животными возраста 12 мес. (в проекции на человеческий возраст — около 40 лет) моделировался стрептозотоцин-никотинамид-индуцированный СД2 по ранее описанной методике [9].
СД2 диагностировался через 1 нед. после проведения моделирования с помощью выполнения глюкозотолерантного теста. Для включения в эксперимент отбирались крысы, уровень глюкозы в крови которых составлял более 9 ммоль/л (по глюкометру One touche ultra, Johnson and Johnson, США) через 2 ч после введения глюкозы, кроме группы контроля. В течение 4 нед. после индукции СД крысы содержались без терапии, после чего получали препараты согласно сформированным группам в течение 24 нед. Группы терапии: 1-я — СД2 без терапии, 2-я — здоровый контроль, 3-я — СД2 + глибенкламид (0,6 мг на кг), 4-я — СД2 + гликлазид (0,75 мг на кг).
После окончания эксперимента были изготовлены препараты поджелудочной железы крыс на базе морфологической лаборатории. Оценивалось микроскопическое строение поджелудочной железы, проводилось ИГХ исследование с помощью поликлональных антител (АТ) к инсулину, глюкагону, Ki-67. АТ к глюкагону использовались в разведении 1:10000, инкубация с первичными АТ к течение 60 мин при комнатной температуре, демаскировка в буфере pH=6 при 98 °C в течение 30 мин (система детекции Thermo (США), ИГХ в стейнере Thermo Autostainer 720). АТ к инсулину использовались в разведении 1:1000, инкубация с первичными АТ 60 мин при комнатной температуре, демаскировка с применением трипсина Thermo (США) при 37 °C в термостате в течение 10 мин (система детекции Abacam (Великобритания), ручная постановка). АТ к Ki-67 использовались в разведении 1:50, инкубация с первичными АТ 60 мин при комнатной температуре, демаскировка в буфере pH=6 при 98 °C в течение 30 мин (система детекции Thermo, ИГХ в стейнере Thermo Autostainer 720). После выполнения ИГХ проводилась окраска ядер гематоксилином в стейнере Leica ST5020 (Leica, Австрия). В дальнейшем выполнялось микроскопическое исследование. Фотографии микропрепаратов изготовлялись с помощью аппаратуры Leica. Морфометрический анализ проводился с использованием микрофотографий, обработка — с использованием программы Photoshop (США).
Статистический анализ проводился с помощью программы IBM SPSS Statistics 23 (США). Результаты представлены в виде M±m, где M — выборочное среднее, m — стандартная ошибка. Значения p<0,05 считались статистически значимыми.
Результаты исследования
Результаты оценки объема эндокриноцитов (α-клеток и β-клеток) в процессе 24-недельного наблюдения у животных различных экспериментальных групп представлены в таблице 1.
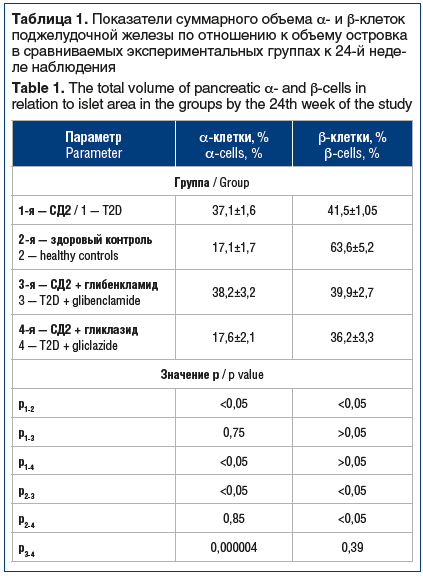
К 24-й нед. эксперимента у животных, получающих глибенкламид, суммарный объем (СО) α-клеток к площади островка поджелудочной железы не изменился по сравнению с группой животных с СД2 без терапии (р=0,75). У животных, получавших гликлазид, было отмечено статистически значимое уменьшение количества α-клеток по сравнению с группой СД2 без терапии (р<0,05), которое стало сопоставимым с таковым в группе интактных животных. СО β-клеток не изменился ни в одной из терапевтических групп. Соответственно, к 24-й нед. эксперимента различие по СО α-клеток к площади островка между группами, получающими препараты глибенкламид и гликлазид, было статистически значимым (p=0,000004), по СО β-клеток — статистически незначимым (p=0,39). При сравнении групп терапии гликлазидом и глибенкламидом с группой интактных животных по объему α-клеток группа гликлазида не имела статистически значимых отличий от группы интактных животных (р=0,85), в отличие от группы глибенкламида (р<0,05). При сравнении групп терапии с группой интактных животных по СО β-клеток в обоих случаях значимых отличий не определялось (р>0,05). Группа животных с СД без терапии статистически значимо отличалась от группы животных с СД, получавших гликлазид, по СО α-клеток (р<0,05), но не отличалась по этому параметру от группы животных, получавших глибенкламид (р=0,75). По СО β-клеток группы животных с СД, как получавшие ПСМ, так и без терапии, не отличались (р>0,05).
Таким образом, при длительности введения ПСМ в течение 24 нед. животным с СД2 типа в возрасте 12 мес. происходит значимое снижение количества β-клеток на терапии как гликлазидом, так и глибенкламидом, сопоставимое с таковым при нелеченном СД2. В то же время при введении глибенкламида количество α-клеток увеличивается, что сопоставимо с увеличением при нелеченном СД2 типа, тогда как введение гликлазида не приводит к значимому увеличению количества α-клеток.
Обсуждение
Полученные данные свидетельствуют о том, что у возрастных животных (возраст 12 мес.) с экспериментальным СД2 происходит изменение соотношения α- и β-клеток, аналогичное таковому у пациентов с СД2: уменьшение процента β-клеток и увеличение процента α-клеток. При этом длительная терапия ПСМ в данной экспериментальной модели не приводит к дополнительным изменениям количества и СО β-клеток: группы, получавшие ПСМ, оставались сопоставимы по объему β-клеток с группой СД2 при терапии 24-й нед. Однако в случае приема гликлазида к 24-й нед. исследования наблюдалась нормализация СО α-клеток, их количество становилось сопоставимо с группой здорового контроля. Как известно, формирование СД2 сопровождается уменьшением СО β-клеток и увеличением СО α-клеток. Об этом свидетельствуют экспериментальные и патологоанатомические исследования. На данный момент уже известно, что терапия ПСМ приводит к быстрому (в течение примерно 5 лет) функциональному истощению β-клеточного аппарата с более частой и ранней необходимостью перехода на инсулинотерапию, чем при терапии другими антидиабетическими препаратами [10]. В экспериментальных исследованиях представлены противоречивые данные: в одних работах указывается на усиление апоптоза на терапии глибенкламидом, в других изменений не выявлено. Изначально мы ожидали получить различия по СО β-клеток между группами терапии гликлазидом и глибенкламидом, т. к. для гликлазида, согласно данным литературы, не описано усиления апоптоза β-клеток, в отличие от глибенкламида [6, 7].
За счет стимуляции ПСМ секреции инсулина β-клетками поджелудочной железы и высвобождения запасов инсулина из внутриклеточных гранул, выброса его кровь происходит постепенное истощение функционального резерва инсулиноцитов [5]. Индукция секреции инсулина происходит за счет блокировки β-клеточных АТФ-чувствительных К+-каналов, что приводит к деполяризации мембраны, открытию Ca2+-каналов, притоку Ca2+ и, следовательно, индукции секреции инсулина. В отличие от гликлазида, который специфично связывается с SUR1 (сайт А), глибенкламид взаимодействует неспецифично с SUR1 (сайты А и В), SUR2 [11].
В некоторых работах высказывалось мнение о том, что усиление притока Ca2+, вызванное глибенкламидом, индуцирует апоптотическую гибель β-клеток [4]. Согласно другим литературным данным гликлазид не может чрезмерно стимулировать и истощать β-клетки по сравнению с глибенкламидом, что связано с особенностью его рецепторов и механизмом действия [12]. Кроме того, гликлазид обладает антиоксидантной активностью [13, 14]. Как было показано в одной из работ японских ученых, оксидативный стресс усиливается при хронической гипергликемии, увеличивая степень поражения β-клеток. Таким образом, антиоксидантная активность гликлазида может защитить β-клетки от окислительного воздействия. Также высказывалось предположение, что гипергликемия стимулирует β-клетки к выработке интерлейкина ИЛ-1b, который в свою очередь индуцирует апоптоз β-клеток аутокринным способом [15]. Есть данные, что гликлазид, в отличие от глибенкламида, подавляет продукцию ИЛ-1b и фактора некроза опухоли α (ФНО-α) in vitro и in vivo у мышей. Вероятно, гликлазид может оказывать протективное действие на клетки поджелудочной железы путем подавления продукции ИЛ-1b и ФНО-α [16]. Складывалось впечатление, что длительность воздействия глибенкламидом имеет значение, но в нашем исследовании с большой длительностью мы тем не менее не получили различий по количеству β-клеток на терапии
двумя ПСМ.
Согласно некоторым литературным данным длительная терапия глибенкламидом in vivo вызывает потерю секреторной способности β-клеток из-за гипервозбудимости, но при этом такая секреторная недостаточность обладает быстрой обратимостью, что является аргументом против апоптоза β-клеток или другой гибели клеток, индуцированной ПСМ. Складывается впечатление, что утрата гликемического контроля и выраженное снижение секреции инсулина, наблюдаемое при длительной терапии ПСМ, является следствием именно нарушения секреции, а не дополнительной гибели клеток под воздействием этих препаратов [3]. Таким образом, вероятно, наблюдаемый нами СО инсулин-позитивных клеток при терапии ПСМ, сопоставимый с группой СД2 без терапии, является отображением подавленной продукции β-клеток на фоне приема ПСМ. На основании данных литературы полагаем, что после отмены ПСМ экспрессия инсулин-положительных клеток в островках поджелудочной железы крыс, получавших ПСМ, будет выше, чем в группе СД2 без терапии. Однако при этом невозможно достоверно оценить влияние глибенкламида и гликлазида на апоптоз β-клеток. Для уточнения этого вопроса требуются дальнейшие исследования.
Кроме того, согласно полученным данным, гликлазид обладает способностью нормализовать глюкагоновый ответ, что может благоприятно влиять на течение СД2. Воздействие ПСМ на α-клетки изучено недостаточно, а сравнительный анализ между отдельными препаратами группы практически не проводился. В условиях сниженной секреции инсулина на терапии ПСМ имеет место усиленная секреция глюкагона в соответствии с паракринной регуляцией [17]. В рамках настоящего исследования оценивался только количественный состав эндокриноцитов, но не их секреторная активность. В то же время, учитывая паракринную регуляцию между α- и β-клетками, можно предположить, что гликлазид, который в меньшей степени истощает секрецию инсулина, не только не вызывает по паракринному механизму гиперсекрецию глюкагона, но и сдерживает гиперплазию α-клеток. В мире проводились исследования, показавшие, что концентрация глюкагона в плазме крови не изменялась или снижалась у лиц без СД с интактной функцией β-клеток, но повышалась у пациентов с недостаточностью β-клеток после приема как смешанной пищи, так и глимепирида, независимо от уровня глюкагона до воздействия [17].
Заключение
Полученные данные свидетельствуют о том, что у возрастных животных (12 мес.) с стрептозотоцин-никотинамид-индуцированным экспериментальным СД2 происходит изменение соотношения клеток панкреатического островка — уменьшается процент β-клеток и увеличивается процент α-клеток, что соответствует изменениям поджелудочной железы у пациентов с СД2.
Длительная терапия ПСМ (24 нед.) в данной экспериментальной модели не приводила к дополнительным изменениям СО β-клеток, который оставался сопоставим с таковым в группе СД2 без терапии. Однако терапия гликлазидом в отличие от терапии глибенкламидом нормализовала при длительном применении (24 нед.) СО α-клеток, который становился сопоставим с таковым в группе здорового контроля.
Полученные данные могут быть экстраполированы в клинические исследования с оценкой функционального и морфологического состояния клеток островков поджелудочной железы в процессе долговременной терапии ПСМ.
Сведения об авторах:
Тучина Таисия Павловна — аспирант, м.н.с. НИЛ диабетологии Института эндокринологии, ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России, 197341, Россия, г. Санкт-Петербург, пр. Пархоменко, д. 15, лит. А; ORCID iD 0000-0003-0994-8650.
Скотникова Ксения Петровна — ординатор, ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России, 197341, Россия, г. Санкт-Петербург, пр. Пархоменко, д. 15, лит. А; ORCID iD 0000-0002-7883-5951.
Вторушина Анна Анатольевна — студентка, ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России, 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; ORCID iD 0000-0002-9577-3676.
Рогоза Ольга Владимировна — биолог патологоанатомической лаборатории лечебно-реабилитационного корпуса 1, ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России, 197341, Россия, г. Санкт-Петербург, пр. Пархоменко, д. 15, лит. А; ORCID iD 0000-0002-5258-5317.
Грозов Роман Викторович — к.м.н., зав. отделением патоморфологии ЛРК-1, ФГБУ «НМИЦ им. В.А. Алмазова» Мин-
здрава России, 197341, Россия, г. Санкт-Петербург, пр. Пархоменко, д. 15, лит. А; ORCID iD 0000-0001-8016-7692.
Бабенко Алина Юрьевна — д.м.н., главный научный сотрудник НИЛ диабетологии Института эндокринологи, ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России, 197341, Россия, г. Санкт-Петербург, пр. Пархоменко, д. 15, лит А; ORCID iD 0000-0002-0559-697X.
Галагудза Михаил Михайлович — д.м.н., профессор, член-корреспондент РАН, директор Института экспериментальной медицины ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России, 197341, Россия, г. Санкт-Петербург, пр. Пархоменко, д. 15, лит. А; ORCID iD 0000-0001-5129-9944.
Контактная информация: Тучина Таисия Павловна, e-mail: tayka_91@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 18.02.2020, поступила после рецензирования 11.03.2020, принята в печать 25.03.2020.
About the authors:
Taisiya P. Tuchina — postgraduate student, junior researcher of the Research Laboratory of Diabetology of the Institute of Endocrinology, V.A. Almazov National Medical Research Center, 15, Parkhomenko pass., St. Petersburg, 197341, Russian Federation; ORCID iD 0000-0003-0994-8650.
Olga V. Rogoza — biologist of the Pathoanatomical Laboratory of the Clinical Rehabilitation Complex, V.A. Almazov National Medical Research Center, 15, Parkhomenko pass.,
St. Petersburg, 197341, Russian Federation; ORCID iD 0000-0002-5258-5317.
Kseniya P. Skotnikova — resident, V.A. Almazov National Medical Research Center, 15, Parkhomenko pass.,
St. Petersburg, 197341, Russian Federation; ORCID iD 0000-0002-7883-5951.
Denis A. Lebedev — postgraduate student, junior researcher of the Research Laboratory of Diabetology of the Institute of Endocrinology, V.A. Almazov National Medical Research Center, 15, Parkhomenko pass., St. Petersburg, 197341, Russian Federation; ORCID iD 0000-0003-1808-1331.
Roman V. Grozov — Cand. of Sci. (Med.), Head of the Department of Pathomorphology of the Clinical Rehabilitation Complex, V.A. Almazov National Medical Research Center, 15, Parkhomenko pass., St. Petersburg, 197341, Russian Federation; ORCID iD 0000-0001-8016-7692.
Alina Yu. Babenko — Doct. of Sci. (Med.), leading researcher of the Research Laboratory of Diabetology of the Institute of Endocrinology, V.A. Almazov National Medical Research Center, 15, Parkhomenko pass., St. Petersburg, 197341, Russian Federation; ORCID iD 0000-0002-0559-697X.
Mikhail M. Galagudza — Doct. of Sci. (Med.)., Professor, Corresponding Member of the RAS, Director of the Institute of Experimental Medicine, leading researcher of Research Laboratory of Microcirculation and Myocardial Metabolism, Head of the Department of Pathology; V.A. Almazov National Medical Research Center, 15, Parkhomenko pass., St. Petersburg, 197341, Russian Federation; ORCID iD 0000-0001-5129-9944.
Contact information: Taisiya P. Tuchina, e-mail: tayka_91@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 18.02.2020, revised 11.03.2020, accepted 25.03.2020.
.
Информация с rmj.ru






