Содержание статьи
Введение
Микроваскулярная стенокардия (МВС) — это заболевание сердечно-сосудистой системы, сопровождающееся типичной для стенокардии болью в грудной клетке и электрокардиографическими изменениями, характерными для ишемии миокарда, без поражения эпикардиальных коронарных артерий, по данным ангиографии [1]. МВС характеризуется затяжными болями в области сердца не только во время физической нагрузки и после нее [2], но и в покое, зачастую сопровождается снижением болевого порога и изменением эмоционального статуса больных. Несмотря на то что прогноз при МВС, как правило, благоприятный, стенокардия значительно ухудшает качество жизни больных и представляет существенную нагрузку для системы здравоохранения. Диагностика МВС в реальной клинической практике зачастую основывается на анамнезе и клинических данных, что ведет к ложноположительным либо ложноотрицательным результатам. При коронарографии можно увидеть только эпикардиальные артерии, а оценить состояние микроциркуляторного русла не представляется возможным [3]. Учитывая широкое распространение МВС среди пациентов с болями в сердце, необходимо глубокое изучение данной патологии, ее диагностики и лечения.
Место МВС в структуре ИБС
Сердечно-сосудистые заболевания (ССЗ) по-прежнему сохраняют лидирующие позиции в структуре смертности по всему миру [4, 5]. Так, по данным Росстата за 2019 г., смертность от ССЗ составила 633 случая на 100 тыс. населения. Годом ранее этот показатель составлял 622,1 случая на 100 тыс. населения. Ежегодная смертность от ишемической болезни сердца (ИБС) среди населения России составляет 27%. При этом только 40–50% больных ИБС знают о своем заболевании и получают комплексное лечение. Более чем у половины госпитализированных больных с диагнозом «острый коронарный синдром» при проведении коронароангиографии обнаруживаются неизмененные коронарные артерии, что указывает на иное происхождение ангинозных болей, не исключая МВС [6]. В настоящее время широко признано, что обструктивное поражение эпикардиальных артерий не является единственной причиной ишемии миокарда [7, 8]. В ретроспективном анализе реестра NCDR Cath только у 37,6% пациентов было диагностировано обструктивное поражение эпикардиальных артерий, в то время как у 69% пациентов была подтверждена преходящая ишемия миокарда при проведении неинвазивных диагностических тестов [9]. Следует отметить, что боли в груди при неизмененных коронарных артериях не всегда являются следствием МВС, поэтому для диагностики требуется применение оптических систем с высокой разрешающей способностью.
Патофизиология коронарной микроваскулярной дисфункции (КМД)
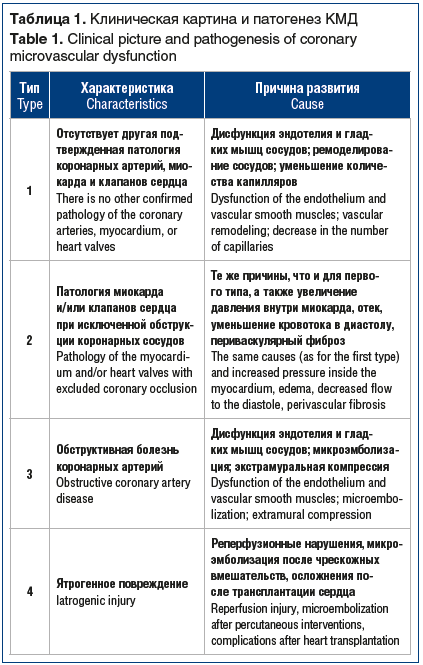
Миокард — это аэробная мышечная ткань, которая нуждается в непрерывном поступлении крови, насыщенной кислородом, для выработки энергии, необходимой для поддержания насосной функции сердца. В базовых условиях работы сердца из артериальной крови можно получить 60–70% необходимого кислорода, поэтому повышенная потребность миокарда в кислороде может быть удовлетворена только путем увеличения коронарного кровотока. Проксимальное коронарное русло состоит из эпикардиальных артерий диаметром от 5 до 0,5 мм и дает начало интрамуральным сосудам. Дистальное коронарное русло представлено преартериолами, артериолами диаметром от 40 до 400 мкм и капиллярами диаметром менее 10 мкм, которые составляют основную систему коронарного кровообращения [10]. В состоянии покоя тонус коронарного микроциркуляторного русла высокий, но диаметр артериол может быстро меняться, реагируя на повышенную потребность миокарда в кислороде и увеличивая коронарный кровоток [11]. Капилляры и венулы являются важным компонентом коронарной микроциркуляции, поэтому структурные и функциональные нарушения на данном уровне (например, падение давления крови в капиллярной сети или микроэмболизация) могут стать причиной развития ишемии миокарда. В зависимости от клинической картины выделяют разные патогенетические механизмы микрососудистой дисфункции (табл. 1) [12].
По мнению A. Faccini et al., воспаление является еще одной потенциально важной причиной развития КМД [13]. Коронарный микрососудистый спазм, первоначально описанный в работе [14], может подобно эпикардиальному спазму вызвать ишемию миокарда при отсутствии повышенных потребностей миокарда в кислороде и инициировать стенокардию покоя. На сегодняшний день нет сомнений в том, что МВС является гетерогенным синдромом, в основе развития которого могут лежать различные патогенетические механизмы. К предполагаемым механизмам КМД относятся измененная регуляция коронарной микроциркуляции вегетативной нервной системой, генерализованные сосудистые нарушения. Так, в одном из крупных исследований P. Ong et al. [15, 16] в ходе тестирования пациентов на ацетилхолин у каждого четвертого наблюдался микрососудистый спазм, характеризующийся ишемическими изменениями на ЭКГ без видимых изменений диаметра эпикардиальных коронарных артерий. A.L. Arrebola-Moreno et al. [17] сообщают, что коронарный микрососудистый спазм, вызванный внутрикоронарным введением ацетилхолина, ведет к нарушениям перфузии и сократимости миокарда. В исследовании V.R. Taqueti et al. [18] была обнаружена непосредственная связь КМД с формированием сердечной недостаточности у пациентов с сохраненной фракцией выброса. Однако в большинстве случаев МВС развивается вследствие изолированной КМД [19] — единственного (или преобладающего) механизма, ответственного за развитие приступа стенокардии или асимптомной ишемии миокарда [20].
Клиническая картина и диагностика МВС
Для МВС характерна триада признаков: 1) типичная стенокардия, обусловленная физической нагрузкой, в сочетании или при отсутствии стенокардии покоя и одышки; 2) наличие признаков ишемии миокарда по данным электрокардиографии (ЭКГ), холтеровского мониторирования (ХМ), стресс-тестов при отсутствии других заболеваний сердечно-сосудистой системы; 3) неизмененные или малоизмененные коронарные артерии (стенозы артерий менее 50%) [21]. Приступы стенокардии могут возникать достаточно часто, до нескольких раз в неделю, но при этом иметь стабильный характер. Боли возникают как при физической нагрузке, эмоциональном стрессе, так и в покое и плохо купируются нитратами. Таким образом, МВС является формой хронической стенокардии и по МКБ-10
относится к коду I20.8 «Другие формы стенокардии».
Выделяют 4 клинических критерия, позволяющих заподозрить МВС [22]:
клиника ишемии миокарда: ангинозные приступы или эквивалентные симптомы (например, одышка) при нагрузке или в покое;
отсутствие обструкции коронарных артерий: сужение просвета артерии на 50% и менее или фракционный резерв кровотока более 0,8, по данным компьютерной томографии или инвазивной коронароангиографии;
объективное подтверждение ишемии миокарда (ишемические изменения на ЭКГ в момент приступа); ангинозная боль, ишемические изменения на ЭКГ и/или при эхокардиографическом исследовании (ЭхоКГ), снижение перфузии миокарда при нагрузочных пробах;
подтверждение микроваскулярных нарушений: резерв коронарного кровотока менее 2,0–2,5 (в зависимости от методики измерения); спазм микрососудов при ацетилхолиновой пробе (ишемические изменения на ЭКГ при отсутствии эпикардиального спазма); увеличение показателей сопротивления микрососудов; замедление коронарного кровотока при сумме баллов по шкале TIMI 25 и более.
При наличии всех 4 критериев диагноз МВС наиболее убедителен. Наличие 1-го и 2-го критериев говорит о возможности МВС, но диагностировать МВС можно, только получив объективные доказательства ишемии миокарда (критерий 3) или нарушения коронарной микрососудистой функции (критерий 4).
Диагностируется ишемия миокарда обычно при проведении нагрузочных тестов (чаще всего используются велоэргометрия (ВЭМ), тредмил-тест и 24-часовое ХМ) путем выявления горизонтальной депрессии сегмента ST более чем на 1 мм от точки J на ЭКГ [23]. Очень важно понимать, что диагноз МВС пациентам с болью в грудной клетке не должен ставиться только методом исключения по результатам коронароангиографии. Необходим комплексный подход с учетом всех неинвазивных и инвазивных методов исследования для верификации ишемии миокарда [24]. Клинические рекомендации предлагают следующий алгоритм подтверждения ишемии миокарда. Диагноз выставляется на основании совокупности жалоб, данных анамнеза (факторов сердечно-сосудистого риска), выявленной скрытой коронарной недостаточности. При подозрении на стенокардию рекомендуется по характеру боли в грудной клетке, возрасту и полу больного рассчитывать предтестовую вероятность ИБС [25]. Однако в ряде крупных исследований последних лет было показано, что такой подход приводит к существенному завышению риска ИБС и сопровождается назначением необоснованных дополнительных диагностических исследований.
Всем пациентам с подозрением на ИБС первым этапом проводится ЭКГ [26]. При неосложненной ИБС специфические признаки ишемии без нагрузки чаще всего отсутствуют. Единственным достаточно специфическим признаком является появление зубца Q после перенесенного инфаркта миокарда. Изолированные изменения зубца T малоспецифичны и чаще всего не учитываются. При проведении ЭКГ с нагрузкой специфическим признаком ишемии миокарда является горизонтальная или косонисходящая депрессия сегмента ST глубиной не менее 0,1 Мв, продолжительностью не менее 0,06–0,08 с от точки J в одном и более ЭКГ-отведениях. Признаками вазоспазма служит транзиторный подъем сегмента ST не менее чем на 0,1 Мв в двух и более отведениях [27]. Однако чувствительность метода снижается у пациентов с рубцовыми изменениями на ЭКГ, при внутрижелудочковых блокадах и гипертрофии левого желудочка (ЛЖ). Хочется отметить, что нагрузочная ЭКГ-проба на велоэргометре или тредмиле неинформативна при полной блокаде левой ножки пучка Гиса, наличии электрокардиостимулятора и синдроме WPW, при которых изменения сегмента ST невозможно интерпретировать. Кроме того, ложноположительные результаты часто обнаруживаются у пациентов с ЭКГ-изменениями в покое вследствие гипертрофии ЛЖ, электролитного дисбаланса, нарушений ритма и проводимости [28].
Всем пациентом с ИБС или подозрением на нее показано проведение ЭхоКГ, которая позволяет оценить систолическую и диастолическую функции ЛЖ, выявить клапанную патологию, исключить гипертрофическую кардиомиопатию, аневризму восходящего отдела аорты, врожденную патологию сердца [22, 26]. Однако при МВС локальные зоны гипокинеза на ЭхоКГ в покое не регистрируются ввиду многочисленности малых зон поражения, но одним из ранних признаков ИБС, а именно микрососудистой дисфункции, может быть нарушенная диастолическая функция ЛЖ [29]. Другими недостатками ЭхоКГ являются низкое качество визуализации базальных сегментов ЛЖ и получение ложноположительных результатов при патологических изменениях в верхушечной области [30]. Наличие у пациента тахикардии/аритмии значительно усложняет интерпретацию результатов ЭхоКГ. Следует отметить, что недостатком всех ультразвуковых методов исследования миокардиального кровотока является зависимость интерпретации от квалификации и опыта специалиста, выполняющего исследование. Чувствительность ЭхоКГ в покое при выявлении ишемии миокарда, по данным разных авторов, составляет 7,5–26,7%. Отсутствие такого признака, как нарушение регионарной и глобальной сократимости у пациентов с МВС, можно объяснить особенностями распространения ишемии, когда она ограничивается отдельными небольшими участками миокарда [31].
Согласно современным европейским и российским рекомендациям ХМ рекомендовано пациентам с болью в грудной клетке и подозрением на аритмию. ХМ в 12 отведениях может быть полезным при подозрении на вазоспастическую стенокардию. Диагностическая ценность данного метода для рутинного обследования больного с подозрением на ишемию миокарда невелика. Депрессия сегмента ST на ЭКГ в покое может быть расценена как признак транзиторной ишемии. Однако депрессия сегмента ST не связана с неблагоприятным прогнозом, не дает дополнительной информации по сравнению с нагрузочными тестами и часто даже не подтверждается как признак преходящей ишемии при проведении визуализирующих нагрузочных тестов. Следует отметить, что депрессия сегмента ST на ЭКГ в покое может быть обусловлена гипертрофией ЛЖ. В связи с этим ХМ не может быть использовано для достоверной диагностики ишемии миокарда, так как результаты исследования не исключают и не подтверждают ИБС, в т. ч. МВС [5, 22].
Нагрузочные тесты очень важны для верификации латентных форм ишемии миокарда путем провокации ишемии фармакологической или физической нагрузкой. Варианты нагрузочных проб разнообразны. В ходе их проведения повышается потребность миокарда в кислороде (тредмил-тест, ВЭМ, добутаминовая проба) или снижается доставка кислорода к миокарду (пробы с дипиридамолом и аденозином) [22, 29].
Тредмил-тест является более физиологичным методом и имеет преимущества перед ВЭМ благодаря возможности дозированно повышать нагрузку с использованием стандартного протокола Bruce до значений больших, чем при ВЭМ. Достоверным признаком ишемии миокарда при выполнении ВЭМ является горизонтальная или косонисходящая депрессия сегмента ST на 1 мм и более [5]. Вероятность диагноза ИБС приближается к 90%, если во время нагрузки депрессия сегмента ST ишемического типа достигает 2 мм и более и сопровождается типичным приступом стенокардии. ВЭМ показана только пациентам, способным выполнить адекватную физическую нагрузку на велотренажере. Следовательно, проведение ВЭМ невозможно, если у пациента имеются заболевания суставов или значимый стеноз артерий нижних конечностей. Из-за относительно низкой чувствительности ВЭМ при ИБС ее отрицательный результат также не исключает этого диагноза. Частота ложноположительных результатов достигает 15% [24, 25]. В многочисленных исследованиях сообщается о меньшей чувствительности ВЭМ и большей частоте ложноположительных результатов у женщин по сравнению с мужчинами. Чувствительность и специфичность тредмил-теста и ВЭМ примерно одинаковы. Ложноотрицательные тесты приводят к недооценке симптомов стенокардии.
По сравнению со стресс-нагрузочными ЭКГ-тестами стресс-ЭхоКГ более предпочтительна. Это один из самых информативных и дешевых методов неинвазивной диагностики ишемии миокарда, доказавший свою высокую диагностическую значимость [32]. Данный метод может быть применен с использованием всех стресс-агентов, обладает высокой чувствительностью (80–85%) и специфичностью (84–86%) в диагностике стенозов, превышающих 50%. Широко изучаются возможности радиоизотопных методов в выявлении МВС, но до сих пор они не стали рутинными ввиду их сложности и дороговизны [21].
Важное место в диагностике МВС занимает позитронно-
эмиссионная томография (ПЭТ) сердца с проведением нагрузочных проб [33]. По мнению большинства специалистов, ПЭТ сердца в покое малоинформативна. Нарушение миокардиального кровотока возможно выявить только в условиях функциональной нагрузки, позволяющей обнаружить снижение кровотока в участках миокарда, обусловленное эндотелиальной дисфункцией или ангиоспазмом микроваскулярного русла [34]. Распределение радиофармпрепарата на фоне стрессорного воздействия позволяет выявить даже небольшие участки ЛЖ, в которых отмечается гипоперфузия миокарда. Существуют различные варианты нагрузочных проб: проба с физической нагрузкой на велоэргометре или тредмиле, фармакологическая проба с вазодилататорами, чреспищеводная кардиостимуляция и холодовая проба. В клинической практике при ПЭТ-перфузионных исследованиях с 13N-аммонием чаще всего применяется фармакологическая проба с аденозином. Согласно данным литературы ПЭТ с использованием фармакологических нагрузочных проб обладает высокой специфичностью (78–100%) и чувствительностью (87–97%) в диагностике ишемии миокарда [33, 34]. Метод ПЭТ подобно однофотонной эмиссионной компьютерной томографии (ОФЭКТ) предоставляет информацию о наличии или отсутствии ишемии миокарда, ее локализации и выраженности, рубцовых изменениях. В то же время ПЭТ, в отличие от ОФЭКТ, характеризуется более высоким качеством изображения, обладает уникальными возможностями по расчету кровотока (в мл/мин/г), что позволяет неинвазивно оценивать резерв кровотока и обеспечивает более низкую лучевую нагрузку. Однако ПЭТ в целом меньше используется из-за малой доступности и высокой стоимости. На сегодняшний день проводятся исследования, совмещающие метод ПЭТ с внутривенной фармакологической нагрузкой. В качестве нагрузки используется доступный на фармакологическом рынке радиофармпрепарат аденозинтрифосфат, он хорошо зарекомендовал себя как вазодилататор, имеет короткий период распада, редко вызывает побочные эффекты. Применение добутамина представляется нецелесообразным при МВС, так как ожидаемые эффекты снижения сократимости миокарда вследствие вызываемой им ишемии крайне редки, как и в случае применения стресс-ЭхоКГ [21, 23].
Постановка диагноза вазоспастической стенокардии осуществляется на основании транзиторных ишемических изменений сегмента ST во время приступа стенокардии (характерны подъемы сегмента ST во время приступа). Для исключения вазоспастической стенокардии возможно проведение при коронароангиографии провокации коронарного спазма [35] введением ацетилхолина хлорида [23]. Проба на ангиоспазм считается положительной, если возникают: а) ангинозный приступ; б) ишемические изменения на ЭКГ; в) выраженная вазоконстрикция эпикардиальных артерий [36]. Если проба с ацетилхолином сопровождается болью и ишемическими изменениями на ЭКГ, но нет спазма эпикардиальных артерий, то можно говорить о вазоконстрикции на уровне микроциркуляторного русла.
Лечение МВС
Лечение МВС включает стандартную терапию ИБС:
β-адреноблокаторы, нитраты, антагонисты кальция, статины, дезагреганты, препараты второй линии (ингибиторы ангиотензинпревращающего фермента (АПФ), никорандил, ивабрадин, ранолазин, триметазидин), немедикаментозные методы лечения (стимуляция спинного мозга, психотерапия) [37].
Традиционные антиангинальные препараты назначают на первых этапах лечения. Короткодействующие нитраты рекомендуют для купирования ангинозных приступов, но они часто не оказывают эффекта. Так, только менее 50% пациентов отмечали улучшение состояния при использовании сублингвального нитроглицерина. И наоборот, сообщается, что никорандил, открывающий калиевые АТФ-каналы и обладающий нитратоподобным действием, оказывает положительный эффект при МВС [38].
У пациентов с доминирующей симптоматикой стенокардии напряжения рациональной представляется терапия β-адреноблокаторами, которые доказанно устраняют симптомы стенокардии. Это препараты первого выбора, особенно у больных с очевидными признаками повышенной адренергической активности (высокой частотой пульса в покое или при физической нагрузке) [39]. Однако пациентам с микрососудистым или эпикардиальным спазмом следует соблюдать осторожность при использовании β-адреноблокаторов (особенно тех, у которых отсутствуют вазодилатирующие свойства), поскольку эти препараты могут усиливать коронарную вазоконстрикцию, маскируя α-адренорецепторы в коронарных сосудах [37].
Другим препаратом, снижающим потребность миокарда в кислороде благодаря его урежающим частоту сердечных сокращений эффектам, является ивабрадин [40]. Антагонисты кальция как препараты первой линии показаны в случае вариабельности порога стенокардии напряжения, особенно при ангиоспастическом генезе ишемии миокарда. Пациентам с клиникой МВС и нарушениями липидного обмена показаны статины, которые, как известно, положительно влияют на эндотелиальную функцию. Ингибиторы АПФ улучшают переносимость физической нагрузки и облегчают симптомы стенокардии [41]. Известно положительное влияние ранолазина на эндотелиальную функцию. В работе E. Rayner-Hartley et al. [42] оценивалось влияние ранолазина на качество жизни пациентов с тяжелой рефрактерной стенокардией, вызванной МВС. Пациенты получали ранолазин в дозе 1000 мг/сут совместно с сулодексидом в течение 4 нед. Применение ранолазина позволило улучшить качество жизни и уменьшить количество обращений за медицинской помощью. С целью коррекции эндотелиальной дисфункции также применяется триметазидин, улучшающий метаболизм кардиомиоцитов при ишемии миокарда. В исследовании С.А. Болдуевой и соавт. [43] показана эффективность применения у больных МВС, помимо стандартной антиангинальной терапии, триметазидина с улучшением клинической картины, качества жизни, перфузии миокарда и функции эндотелия.
К сожалению, традиционная терапия МВС не всегда эффективна, качество жизни из-за болевого синдрома остается низким, пациентов часто госпитализируют. Поэтому всем пациентам с МВС необходима активная коррекция традиционных факторов риска, таких как гипертония, сахарный диабет, курение, ожирение, малоподвижный образ жизни, гиперлипидемия.
Заключение
В заключение хотелось бы еще раз отметить, что диагностика МВС довольно сложна, требует от врача решительности в диагностическом поиске. Только правильно проведенное обследование с взвешенной оценкой полученных данных, кропотливый подбор оптимальной медикаментозной терапии с постоянным контролем состояния позволяют рассчитывать на успех лечения.
Сведения об авторах:
Шматова Евгения Николаевна — аспирант кафедры терапии института последипломного образования, ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России, 660022, Россия, г. Красноярск, ул. Партизана Железняка, д. 1; врач-кардиолог, ФГБУ ФСНКЦ ФМБА России, 660037, Россия, г. Красноярск, ул. Коломенская, д. 26; ORCID iD 0000-0002-3118-0986.
Гринштейн Юрий Исаевич — д.м.н., профессор, заведующий кафедрой терапии института последипломного образования, ФГБОУ ВО КрасГМУ им. проф. В.Ф. Войно-Ясенецкого Минздрава России, 660022, Россия, г. Красноярск, ул. Партизана Железняка, д. 1; ORCID iD 0000-0002-4621-1618.
Контактная информация: Шматова Евгения Николаевна, e-mail: m89535921278.shmatova@yandex.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 08.09.2020, поступила после рецензирования 22.09.2020, принята в печать 06.10.2020.
About the authors:
Evgeniya N. Shmatova — post-graduate student of the Department of Internal Medicine of the Institute of Postgraduate Education, Krasnoyarsk State Medical University named after Prof. V.F. Voino-Yasenetsky: 1, Partisana Zheleznyaka str., Krasnoyarsk, 660022, Russian Federation; cardilogist, Federal Siberian Research Clinical Center under FMBA of Russia: 26, Kolomenskaya str., Krasnoyarsk, 660037, Russian Federation; ORCID iD 0000-0002-3118-0986.
Yuriy I. Grinshtein — Dr. of Sci. (Med.), Professor, Head of the Department of Internal Medicine of the Institute of Postgraduate Education, Krasnoyarsk State Medical University named after Prof. V.F. Voino-Yasenetsky: 1, Partisana Zheleznyaka str., Krasnoyarsk, 660022, Russian Federation; ORCID iD 0000-0002-4621-1618.
Contact information: Evgeniya N. Shmatova, e-mail: m89535921278.shmatova@yandex.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 08.09.2020, revised 22.09.2020, accepted 06.10.2020.
.
Информация с rmj.ru