Ключевые слова: мукозальный иммунитет, микробиота, антибиотики, иммуносупрессия, инфекции, антибиотикорезистентность, иммуномодуляция, заместительная терапия.
Для цитирования: Козлов И.Г. Микробиота, мукозальный иммунитет и антибиотики: тонкости взаимодействия // РМЖ. 2018. №8(I). С. 19-27
I.G. Kozlov
D. Rogachev National Medical Research Center for Pediatric Hematology, Oncology and Immunology, Moscow
There is a multi-level system for protecting the body from foreign infectious and chemical agents, known as «mucosa-associated lymphoid tissue» (MALT), in the barrier tissues (mucosa and skin). It includes humoral factors and cells of congenital and adaptive immunity, as well as non-immune defense mechanisms. One of the important components of protecting barrier tissues is the microbiota, whose commensals, on the one hand, carry out metabolic function and direct anti-pathogenic activity, and, on the other hand, constantly stimulate MALT at different levels and, thus, support the immunity of barrier tissues in the state of «smoldering activation” and readiness for a rapid response to the invasion of foreign organisms or substances. Antibiotics, being one of the most frequently prescribed medications, disrupt the number, composition and activity of symbiotic microorganisms. As a consequence, the immunity of barrier tissues is weakened, which contributes to the colonization of mucous and skin by pathogenic microorganisms and, in particular, their antibiotic-resistant strains. Awareness of this fact requires a change in the tactics of prescribing antibiotics and the introduction of additional medications to maintain MALT activity. Candidate drugs to supplement etiotropic anti-infective therapy are microbial-associated molecular patterns (MAMP) or, that is more real from the pharmacologycal point of view, their minimal biologically active fragments (MBAF).
Key words: mucosal immunity, microbiota, antibiotics, immunosuppression, infections, antibiotic resistance, immunomodulation, replacement therapy.
For citation: Kozlov I.G. Microbiota, mucosal immunity and antibiotics: the fineness of the interaction // RMJ. 2018. № 8(I). P. 19–27.
Обзорная статья посвящена тонкостям взаимодействия микробиоты, мукозального иммунитета и антибиотиков
Содержание статьи
- 1 Введение
- 2 Мукозальный иммунитет и сигнальные рецепторы врожденного иммунитета
- 3 Микробиота: иммунологические механизмы симбиоза
- 4 Состав
- 5 Функции
- 6 Взаимодействие микробиоты и МАЛТ
- 7 Антибиотики и иммуносупрессия
- 8 Варианты преодоления иммуносупрессии, вызванной антибиотиками
- 9 Трансплантация фекальной микробиоты (ТФМ)
- 10 Использование пробиотиков
- 11 МАМР и их минимальные биологически активные фрагменты (МБАФ)
- 12 Заключение
Введение
Иммунология в первые два десятилетия ХХI в. продолжала радовать многочисленными открытиями, целый ряд которых имел практическую направленность и позволил расшифровать патогенез многих заболеваний, понять механизмы действия некоторых часто используемых лекарственных препаратов. В этот промежуток времени наибольший интерес с точки зрения практической медицины представляют результаты трех взаимопересекающихся направлений фундаментальных исследований, а именно изучение мукозального иммунитета (иммунитет барьерных тканей) и открытие сигнальных рецепторов врожденного иммунитета (pattern-recognition receptors — PRR), характеристика нормальной микрофлоры (микробиоты) и описание ее взаимодействия с барьерным иммунитетом, а также последствия применения антибиотиков на систему мукозальный иммунитет/микробиота.
Мукозальный иммунитет и сигнальные рецепторы врожденного иммунитета
На протяжении всего развития иммунологии мукозальный иммунитет (иммунитет слизистых и кожи, иммунитет барьерных тканей) привлекал внимание исследователей и особенно врачей. Это обусловлено тем, что подавляющее большинство иммунных ответов происходит именно в барьерных тканях, которые находятся под непрерывной антигенной нагрузкой вследствие попыток проникновения в организм патогенных микроорганизмов и ксенобиотиков (посторонних или чужеродных веществ с иммуногенными свойствами).
При этом вполне физиологические иммунные реакции, направленные на поддержание гомеостаза организма, почти всегда сопровождаются воспалительным ответом (собственно воспаление является неотъемлемой частью успешной реализации иммунитета) и другой негативной с точки зрения пациента симптоматикой, что приводит его к необходимости искать помощи у врача. Насморк, кашель, боль в горле, диарея и диспепсия, воспаление кожных покровов, с одной стороны, и аллергические реакции, с другой, – возникновение всех этих проблем не обходится без участия мукозального иммунитета, они являются наиболее частыми причинами обращения к врачам различных специальностей. Как ни странно, несмотря на разную локализацию и достаточно разные проявления, в основе патогенеза всех этих состояний (и многих других) лежат одни и те же механизмы активации мукозального иммунитета.
Иммунитет слизистых реализуется через единую структурированную систему, получившую название «мукозоассоциированная лимфоидная ткань» (МАЛТ) (mucosa-associated lymphoid tissue — MALT). Структуризация МАЛТ идет по этажам в зависимости от того, где анатомически размещается та или иная барьерная ткань:
TALT — носоглотка, евстахиева труба, ухо.
NALT — носовая полость, рот и ротоглотка, конъюнктива.
BALT — трахея, бронхи, легкие, грудные железы (у женщин).
GALT — 1) пищевод, желудок, тонкий кишечник;
2) толстый кишечник и проксимальные отделы урогенитального тракта; дистальные отделы урогенитального тракта.
SALT — кожа (дерма).
МАЛТ — это самая большая часть иммунной системы, где на общей площади 400 м2 располагаются около 50% иммунокомпетентных клеток. Здесь представлены клетки как врожденного иммунитета, так и приобретенного. Кроме клеток в МАЛТ сконцентрированы и другие механизмы защиты [1].
В любой части МАЛТ механизмы защиты имеют сходную организацию (хотя есть и различия между этажа-
ми) [2–6]:
Верхний «инертный» барьер представляет собой слой слизи или, в случае кожи, «сухой» слой, состоящий из кератина. Основные защитные факторы, представленные на этом уровне, — это физический барьер, противомикробные пептиды, секреторный IgA, компоненты системы комплемента и микробиота. Очевидно, что инертность этой структуры весьма условна, т. к. здесь постоянно протекают активные реакции киллинга микроорганизмов и множество биохимических процессов метаболической направленности.
Эпителиальный пласт долгое время рассматривался только как физический барьер. Сегодня подобное представление существенно изменилось. Во-первых, было установлено, что эпителиальные клетки экспрессируют отвечающие за взаимодействие с микроорганизмами рецепторы, которые способны запускать активацию этих клеток с последующей продукцией противомикробных пептидов, а также каскадом регуляторных молекул (цитокинов) и экспрессией на эпителиоцитах корецепторов для клеток иммунной системы. Во-вторых, в составе «непроницаемого» эпителиального пласта были обнаружены дендритные клетки (преимущественно ротовая полость, дыхательная система, урогенитальный тракт, кожа) и multifold, или М-клетки (тонкий кишечник, миндалины, аденоиды), осуществляющие контролируемый перенос через барьер внутрь организма чужеродного материала. Этот контролируемый «трафик» необходим для поддержания в «тонусе» барьерного иммунитета и оповещения иммунной системы об изменяющемся окружении (например, о дисбалансе микробиоты или о попадании на слизистые и кожу патогенных микроорганизмов). Иначе говоря, иммунная система барьерных тканей находится все время в состоянии «тлеющей» активации, что позволяет ей быстро и эффективно реагировать на агрессию [7].
Подэпителиальная рыхлая соединительная ткань lamina propria (собственная пластинка), где диффузно, в высокой концентрации располагаются клетки врожденного иммунитета: несколько популяций дендритных клеток, макрофаги, естественные киллеры, гранулоциты, лимфоциты врожденного иммунитета и т. д. [8–10].
Под эпителием в lamina propria находятся так называемые «изолированные лимфоидные фолликулы», которые являются представительством адаптивного иммунитета в барьерных тканях. Эти фолликулы имеют четкую организацию с Т- и В-клеточными зонами и герминативным центром. Т-клеточные зоны содержат практически все субпопуляции αβTCR CD4+ T-хелперов (Th1, Th2 и Th17), продуцирующие ИЛ-10 Т-регуляторные клетки, CD8+ T-эффекторы. В составе В-клеточных зон преобладают В-лимфоциты, секретирующие IgA. Именно в эти фолликулы дендритные клетки и М-клетки доставляют антигенный материал, инициируя адаптивный иммунный ответ. Адаптивная иммунная система барьерных тканей тесно связана с регионарными лимфатическими образованиями: пейеровыми бляшками, аппендиксом, миндалинами и т. д., которые позволяют перевести иммунный ответ с местного уровня на системный [8].
Таким образом, МАЛТ обеспечивает многоуровневую защиту организма от проникновения патогенов и чужеродных веществ: от «пассивной» гуморальной, через активный антиген-неспецифический врожденный иммунитет, к высокоспецифическому адаптивному иммунитету, с возможностью перехода с местного уровня на системный.
Помимо единой структурной организации, описанной выше, существует еще одна особенность, делающая МАЛТ отдельной (и даже почти автономной в некотором смысле) подсистемой в рамках общего иммунитета. Это так называемый «закон хоминга МАЛТ». В соответствии с этим законом активация адаптивного иммунитета в какойлибо части МАЛТ приводит к формированию пула антиген-специфических клеток, часть которого остается в месте начала иммунного ответа, а другая выходит в системный кровоток и расселяется (хоминг) только в другие компартменты МАЛТ. Например, если проникновение патогена произошло в кишечнике (GALT), то через некоторое время секретирующие патоген-специфические IgA В-лимфоциты можно будет обнаружить в бронхолегочных лимфатических фолликулах lamina propria (BALT). За счет этого механизма формируется глобальная защита всех барьерных тканей.
Интерес к открытию и характеристике сигнальных рецепторов врожденного иммунитета (signal pattern-recognizing receptor — sPRR) обусловлен не только Нобелевской премией в области биологии и медицины 2011 г., но и важными прикладными аспектами: от понимания, как в организме осуществляются первые события противоинфекционной защиты, до создания новых лекарств для терапии хронических воспалительных, аутоиммунных и аутовоспалительных заболеваний.
sPRR являются основными рецепторами, осуществляющими связь между клетками врожденного иммунитета и другими клетками организма, включая нелимфоидные клетки и клетки адаптивного иммунитета. Они объединяют воедино все компоненты иммунной системы и координируют ее деятельность. С помощью этих рецепторов врожденный иммунитет распознает высококонсервативные структурные молекулы, имеющиеся у больших таксономических групп микроорганизмов (табл. 1). 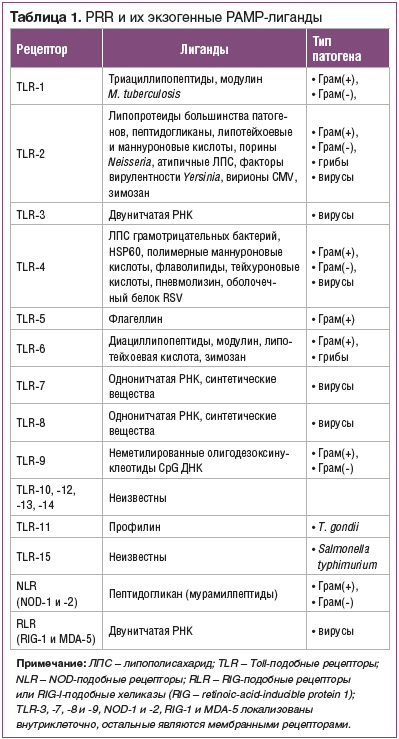
Эти молекулы получили название «патоген-ассоциированных молекулярных образов» (patogen-associated molecular patterns — PAMP). Наиболее известными PAMP являются бактериальный липополисахарид (ЛПС) (Грам(-) — грамотрицательные бактерии), липотейхоевые кислоты (Грам(+) — грамположительные бактерии), пептидогликан (ПГ) (грамотрицательные и грамположительные бактерии), маннаны, бактериальная ДНК, двуспиральная РНК вирусов, глюканы грибов и т. д. [11].
Рецепторы врожденного иммунитета, которые отвечают за распознавание РАМР, были названы «образ-распознающими» (pattern-recognition receptors — PRR) [11]. По функции их можно разделить на две группы: эндоцитозные и сигнальные. Эндоцитозные PRR (маннозные
рецепторы и рецепторы-мусорщики) в иммунологии известны достаточно давно — они обеспечивают процессы фагоцитоза с последующей доставкой патогена к лизосомам (начало адаптивного иммунного ответа).
Среди sPRR наибольшее значение имеют три семейства: Toll-подобные (TLR), NOD-подобные (NLR) и RIG-подобные рецепторы (RLR). Последние два семейства включают по 2 представителя PRR (NOD-1 и -2; RIG-1 и MDA-5), локализованных внутриклеточно и формирующих механизм «оповещения о несанкционированном прорыве» бактериального (NLR) или вирусного (RLR) патогена внутрь клетки или «побега» его из фаголизосомы [12, 13].
Наиболее изученными из sPRR являются Toll-подобные рецепторы (TLR). Данные рецепторы впервые были
описаны у дрозофил, у которых они, с одной стороны, отвечают за эмбриональное развитие, а с другой — обеспечивают антигрибковый иммунитет [14]. Сегодня у млекопитающих и человека охарактеризованы 15 TLR, которые расположены на мембране, в эндосомах или в цитоплазме клеток, осуществляющих первую линию защиты (нейтрофилы, макрофаги, дендритные, эндотелиальные и эпителиальные клетки кожных и слизистых покровов) [15–17].
В отличие от отвечающих за фагоцитоз эндоцитозных PRR, взаимодействие ТLR с соответствующим РАМР не сопровождается поглощением патогена, но приводит к изменению экспрессии большого количества генов и, в частности, генов провоспалительных цитокинов, которая опосредуется через последовательную активацию адапторных белков (например, MyD88), протеинкиназ (например, IRAK-4) и транскрипционных факторов (например, NF-κB) [18–20].
На уровне организма активация синтеза и секреции провоспалительных цитокинов (интерлейкины (ИЛ) -1, -2, -6, -8, -12, фактор некроза опухолей альфа (ФНО-α), интерферон-γ, гранулоцитарно-макрофагальный колониестимулирующий фактор) вызывает развитие воспалительной реакции с подключением всех имеющихся систем защиты от инфекционных агентов. На клеточном уровне эффект реализуется в трех направлениях. Во-первых, происходят активация самих клеток, несущих sPRR, и значительное усиление их защитного потенциала (продукция противомикробных пептидов и комплемента, фагоцитоз, переваривающая активность, продукция активных форм кислорода). Во-вторых, уже имеющиеся антиген-специфические клетки адаптивного иммунитета переходят в активированное состояние и усиливают свои эффекторные функции. В частности, зрелые В-лимфоциты увеличивают продукцию иммуноглобулинов (sIgA) и становятся более чувствительными к антигенной стимуляции, а Т-эффекторы наращивают киллерные функции. И, в‑третьих, происходят активация (прайминг) наивных лимфоцитов и подготовка их к началу адаптивного иммунного ответа [21, 22].
Именно через sPRR барьерный эпителий и мукозальные дендритные клетки распознают на ранних стадиях попытки инвазии микроорганизмов. Через эти же рецепторы клетки врожденного и адаптивного иммунитета подслизистого слоя или собственно дермы реагируют на уже проникшие через барьер патогены. Для реализации эффекта с sPRR не требуется пролиферации клеток и формирования антиген-специфического клона (необходимых при адаптивном иммунном ответе), и эффекторные реакции после распознавания данными рецепторами РАМР наступают немедленно. Этот факт объясняет высокую скорость врожденных иммунных механизмов элиминации патогена [23].
Микробиота: иммунологические механизмы симбиоза
Именно с исследованием микробиоты или совокупности микроорганизмов (нормофлора, комменсалы), обитающих в макроорганизме и находящихся с ним в симбиозе, возникла концепция «суперорганизма» как межвидового единого целого [3].
Состав
Микробиота присутствует у любого многоклеточного организма, и ее состав специфичен для каждого вида организмов. Существуют различия и внутри вида в зависимости от условий жизни и особенностей питания отдельных особей.
У человека микробиота насчитывает более 1000 видов микроорганизмов (бактерий, вирусов, грибов, гельминтов, простейших), хотя в точности этот параметр оценить весьма затруднительно (т. к. многие виды не высеваются, и оценка проведена на основании многопараметрического параллельного секвенирования ДНК) [24–27]. Объем микробиоты оценивается в 1014 клеток, что в 10 раз больше количества клеток в организме человека, а количество генов в микробиоте в 100 раз больше, чем у хозяина [3, 28–31].
Количество и состав микробиоты на различных этажах МАЛТ также существенно отличаются. Наиболее бедная микробиота выявляется в нижних отделах дыхательного тракта и дистальных отделах урогенитального тракта (раньше считалось, что они стерильны, однако последние исследования показывают присутствие нормофлоры и там) [32]. Самая большая микробиота населяет тонкий и толстый кишечник, и она является наиболее исследованной.
В микробиоте кишечника, безусловно, преобладают бактерии, а среди них — анаэробы, относящиеся к родам Firmicutes (95% Clostridia) и Bacteroides. Представители родов Proteobacteria, Actinobacteria, Verrucomicrobia и Fusobacteria представлены в значительно меньшей степени [26, 27, 33, 34]. Бактерии в кишечнике существуют в двух состояниях, образуя мозаичную межвидовую биопленку в верхней части слизистого слоя или находясь в планктонной форме в пристеночной части просвета. Считается, что состав и количество кишечной микрофлоры достаточно стабильны и поддерживаются как за счет межвидового сдерживания, так и за счет воздействий со стороны макроорганизма [30].
Функции
Как уже упоминалось, микробиота и макроорганизм находятся в симбиотических отношениях [26, 35]. Иногда эти отношения носят весьма экзотический характер. Например, микроорганизмы вида Vibrio fischeri образуют колонии и формируют флуоресцентный «фонарь» у глубоководного гавайского кальмара [36].
Стандартный симбиоз микробиоты и макроорганизма основан на взаимной выгоде: хозяин «предоставляет» микроорганизмам место обитания и питание, а микроорганизм защищает хозяина от экспансии другими микроорганизмами (инфекции), обеспечивает его некоторыми нутриентами, а также облегчает переваривание компонентов пищи [3, 30, 37–42]. Среди наиболее значимых полезных свойств микробиоты можно выделить следующие:
метаболизм нерасщепляемых углеводов и обеспечение хозяина энергоносителями (АТФ);
участие в метаболизме жирных и желчных кислот;
синтез витаминов, к которому не способны клетки макроорганизма;
прямая конкуренция с патогенными микроорганизмами и предотвращение колонизации ими кишечного тракта хозяина;
стимуляция мукозального иммунитета хозяина.
Взаимодействие микробиоты и МАЛТ
Исходно считалось, что иммунная система хозяина просто игнорирует присутствие симбиотических микроорганизмов [36, 43]. В пользу этой точки зрения свидетельствует организация первой линии защиты — «пассивного» барьера, покрывающего эпителий [44, 45]. Он состоит из двух слоев, верхнего — более жидкого и текучего и нижнего — более плотного. В норме биопленка из комменсалов располагается в верхнем слое, что должно исключать контакт микроорганизмов с эпителием. Кроме того, эпителий синтезирует противомикробные пептиды, способные диффундировать в слой слизи и создавать градиент концентрации [43, 46, 47]. На определенном уровне слизистого слоя эта концентрация становится достаточной, чтобы напрямую лизировать бактерии, пытающиеся проникнуть через барьер. Дополнительным, и не менее эффективным, защитным от инвазии механизмом является транслокация через эпителий в слизистый слой секреторного IgA (sIgA), в составе которого обнаруживаются антитела против микроорганизмов нормофлоры [30, 48–51]. Очевидно, sIgA также распределяется по градиенту концентрации и, на определенном уровне слизистого слоя «облепляя» бактерии, останавливает их прохождение в нижележащее пространство.
Другая точка зрения предполагает, что в процессе эволюции развились механизмы, обеспечивающие толерантность иммунной системы хозяина к микробиоте. В пользу этой точки зрения говорит и временной фактор появления микробиоты с первых секунд жизни хозяина, когда его иммунная система еще не имеет полного арсенала для того, чтобы отличить свое от чужого, т. е. микробиота воспринимается иммунной системой как нечто свое [36].
На сегодняшний день нет абсолютного понимания всех тонкостей взаимодействия МАЛТ: представление о микробиоте и обе предыдущие концепции частично могут быть справедливыми. Однако многочисленные исследования иммунитета животных-гнотобионтов (лабораторные животные, которых с рождения содержат в стерильных условиях), животных-нокаутов (лабораторные животные, у которых селективно выключен тот или иной ген иммунного ответа) и животных, получавших длительные курсы антибиотиков широкого спектра действия, позволили экспериментально обосновать, как принципиально происходит это взаимодействие.
Наличие в составе sIgA антител к симбиотическим микроорганизмам свидетельствует, что, несмотря на слизистый механический барьер, они сами или их компоненты контактируют с МАЛТ и индуцируют гуморальные адаптивные иммунные ответы [39]. Причем, судя по определяемым постоянно титрам этих антител, данное событие является далеко не редким, а отсутствие нормофлоры приводит к снижению продукции sIgA и размера пейеровых бляшек, где располагаются плазматические клетки, его синтезирующие [52].
Более того, как было убедительно продемонстрировано, компоненты клеточной стенки и внутреннего содержимого комменсалов хорошо распознаются sPRR (TLR и NOD) [6, 53], экспрессируемыми эпителием и клетками врожденного иммунитета, и необходимы для:
активации продукции слизи и противомикробных пептидов эпителиальными клетками, а также уплотнения межклеточных контактов, что делает эпителиальный пласт менее проницаемым [43];
развития изолированных лимфатических фолликулов lamina propria, необходимых для осуществления эффективного адаптивного иммунитета [6];
сдвига Th1/Th2 баланса в сторону Th1 (адаптивный клеточный иммунитет, препятствующий гиперактивации проаллергенного адаптивного гуморального ответа) [30, 47, 54, 55];
формирования местного пула Th17-лимфоцитов, которые отвечают за активность нейтрофилов и их своевременное включение в антибактериальную защиту МАЛТ, а также за переключение классов иммуноглобулинов в В-лимфоцитах [56–58];
синтеза и накопления в макрофагах МАЛТ про-ИЛ-1 и про-ИЛ-18, что существенно ускоряет иммунный ответ при попытке проникновения патогенов (требуется только процессинг этих цитокинов в активную форму) [59].
В связи с тем, что компоненты не только патогенов, но и нормофлоры способны взаимодействовать с сигнальными рецепторами врожденного иммунитета, была предложена ревизия термина «PAMP». Ряд авторов предлагает заменить первую букву «Р» (от «pathogen») на букву «М» (от «microbe»). Таким образом, «PAMP» превращаются в «МAMP» [60].
Учитывая постоянное присутствие микрофлоры и взаимодействие ее или
ее компонентов с sPRR и исходя из «провоспалительной» направленности этих
рецепторов и их сигнальных путей, вполне очевидно было бы ожидать, что микробиота должна индуцировать непрерывный воспалительный ответ в МАЛТ и развитие тяжелых заболеваний. Однако этого не происходит. Напротив, отсутствие нормофлоры вызывает такие заболевания или по крайней мере тесно с ними связано. Почему так происходит, до конца остается неясным, но существуют факты, свидетельствующие о иммуносупрессивном/толерогенном эффекте микробиоты. Например, полисахарид А одного из главных составляющих микробиоты — Bacteroides fragilis способен, соединяясь с TLR-2 на клетках врожденного иммунитета, блокировать их провоспалительную активность [55, 61]. Кроме того, наличие микробиоты приводит к «хронической» активации комменсал-специфических Т-регуляторных клеток (Treg и Tr1) и продукции ими главного антивоспалительного цитокина — ИЛ-10 [26, 54, 61–65]. Но этих механизмов явно недостаточно для объяснения парадоксальных различий в результатах взаимодействия с МАЛТ микробиоты и патогенов [36].
Таким образом, несмотря на оставшиеся вопросы, можно с уверенностью утверждать, что микробиота непрерывно сигнализирует МАЛТ о своем состоянии и поддерживает барьерный иммунитет в состоянии активации без генерации воспалительного ответа. Ослабление микробиота-опосредованной активации
сопряжено с нарушением барьерной функции МАЛТ и развитием хронических воспалительных заболеваний.
Антибиотики и иммуносупрессия
Тема антибиотиков и иммунитета обсуждается в разных аспектах уже больше столетия. Эмпирические попытки воздействия на иммунитет с целью усилить борьбу с инфекциями возникли задолго до «эры антибиотиков» (Э. Дженер, Э. Беринг, В. Колей). Даже первооткрыватель пенициллина А. Флеминг начинал свои опыты по бактерицидности с исследования лизоцима — одного из важнейших гуморальных факторов врожденного иммунитета. Но с появлением антибиотиков, в силу абсолютной понятности их механизма и спектра действия, так же как и безусловной эффективности, иммунотерапия инфекций отошла на второй план и практически не развивалась. В настоящее время ситуация начинает принципиально меняться в связи с наступлением «эры антибиотикорезистентности», и иммуномодулирующая терапия становится одной из реальных альтернатив противоинфекционной химиотерапии [66].
В «эру антибиотиков» сама идеология использования этих лекарственных препаратов предполагала участие иммунной системы в процессах элиминации патогенов. Считалось, что задача антибиотика (особенно бактериостатического) — остановить неконтролируемое размножение бактерий для того, чтобы дать возможность иммунной системе завершить его удаление из организма. В связи с этим на стадии доклинических исследований все современные антибиотики перед их выходом на рынок тестировались по их воздействию на иммунитет. Результаты этих исследований были различными. Часть антибиотиков, например, макролиды, не только не подавляла иммунитет, но и обладала неким позитивным влиянием на иммунокомпетентные клетки. Антибиотики тетрациклинового ряда, напротив, демонстрировали умеренную иммунотоксичность. Но в целом прямого негативного влияния широко используемых в клинике противоинфекционных антибиотиков на иммунную систему выявлено не было [67].
Совсем иная картина возникает, если оценивать непрямое иммуносупрессивное действие антибиотиков (особенно широкого спектра действия) с позиции взаимодействия микробиоты и МАЛТ.
На моделях экспериментальных животных и у человека в клинике многократно подтверждено, что антибиотики приводят к изменению микробиоты. Например, клиндамицин в виде 7-дневного курса почти на 2 года меняет у человека видовой состав комменсалов рода Bacteroides. 5-дневный курс ципрофлоксацина приводит к изменению микробиоты у человека почти на 30%. Для частичного восстановления микробиоты после курса ципрофлоксацина требуется около месяца; некоторые виды комменсалов не восстанавливаются. Амоксициллин в терапевтических дозах уничтожает Lactobacillus. Аналогичные данные по дисбалансу в микробиоте (дисбиоз) продемонстрированы для метронидазола, стрептомицина, неомицина, ванкомицина, тетрациклина, ампициллина, цефоперазона
и их комбинаций [46, 68–74].
Опосредованные антибиотиками изменения микробиоты могут приводить к двум негативным последствиям.
Во-первых, даже неполное (селективное) подавление антибиотиками нормофлоры — лишь отдельной группы микроорганизмов приводит к их замещению патогенами и дисбалансу всей микробиоты. Место комменсалов после курсов антибактериальной химиотерапии занимают грибы, такие как Candida albicans, и бактерии родов Proteus и Staphylococcus, а также Clostridium difficile. Кроме того, при длительных курсах антибактериальной терапии очень высока вероятность заселения освободившегося места антибиотикорезистентными штаммами, у которых в этой ситуации есть безусловное преимущество. Смена состава микробиоты, очевидно, вызывает и существенные нарушения в метаболической функции комменсалов с угнетением продукции полезных нутриентов и производством вредных для организма хозяина веществ (токсинов). Классическим клиническим примером последствий дисбаланса микробиоты после назначения антибиотиков является псевдомембранозный колит, вызываемый заселением кишечника Clostridium difficile [39, 74, 75, 78–82].
Во-вторых, изменение количества и состава микробиоты при антибиотикотерапии изменяет ее взаимодействие с местной иммунной системой, в результате чего одновременно снижается активирующая и толерогенная нагрузка комменсалов на все уровни защиты МАЛТ [26, 36, 58, 68, 83, 84]. При этом разыгрываются два параллельных
сценария:
• На уровне эпителия наблюдаются снижение продукции слизи и истончение «пассивного» барьера. Одновременно уменьшается секреция противомикробных пептидов. В lamina propria происходит дисрегуляция Т-клеточного адаптивного иммунитета, и, в частности, снижается продукция интерферона-γ (Th1) и ИЛ-17 (Th17), падает количество ИЛ-10-секретирующих Тreg. Дисбаланс в Т-хелперных ответах 1 и 17 типа вызывает экспансию Th2-клеток с последующим преобладанием IgE-продуцирующих В-лимфоцитов (проаллергический тип) и снижением продукции защитного sIgA [83]. Все эти изменения ослабляют барьерную функцию и создают благоприятные условия для инвазии любых микроорганизмов и развития системных инфекций, в т. ч. и резистентными к антибиотикам штаммами. Кроме того, создаются предпосылки для стимуляции аллергического воспаления [85].
• Клеточный компонент врожденного иммунитета, напротив, нарастает: увеличивается количество естественных киллеров и макрофагов. Отмена супрессивного влияния Тreg, снижение концентрации полисахарида А B. fragilis, замена МАМР микробиоты на РАМР патогенов срывает толерогенно-активационный баланс МАЛТ и способствует sPRR-индуцированному выбросу провоспалительных цитокинов. Очевидно, таким образом компенсируется недостаточность защитных функций эпителия и адаптивного иммунитета, но при этом в точке дисбаланса микробиоты возникает воспалительный ответ.
Следует также учитывать, что все компартменты МАЛТ тесно взаимосвязаны за счет селективного хоминга, и иммунный дисбаланс в одной части этой подсистемы будет приводить к нарушению работы всех остальных, результатом чего могут стать генерализация иммуновоспалительных процессов и возникновение хронических заболеваний. Как было показано, нарушения микробиоты тесно связаны с развитием таких иммуноопосредованных заболеваний, как воспалительные заболевания кишечника (болезнь Крона и язвенный колит), ревматоидный артрит, аллергия, сахарный диабет 2-го типа, ожирение [24, 47, 68, 78, 83, 85–89].
Подводя итог этой части обзора, следует отметить, что последние данные о взаимодействии микробиоты и МАЛТ, так же и как влияние на это взаимодействие антибиотиков, создают необходимость внести коррективы в стандартную противомикробную химиотерапию с целью устранения дисбаланса в микробиоте и/или (что более важно) поддержания МАЛТ в «рабочем» состоянии.
Варианты преодоления иммуносупрессии, вызванной антибиотиками
Тема непрямой микробиота-опосредованной иммуносупрессии в результате назначения антибиотиков только начинает становиться актуальной для медицинского профессионального сообщества. Но учитывая ее важность для самых разных областей медицины и нарастающую проблему антибиотикорезистентности, в ближайшее время можно ожидать многочисленные попытки решить эту проблему. Некоторый опыт в данной области уже имеется.
Трансплантация фекальной микробиоты (ТФМ)
ТФМ предполагает забор фекальной массы у донора, выделение микроорганизмов и введение их пациенту с нарушенной микробиотой. При этом ректальный путь введения не является оптимальным, т. к. донорская микробиота не попадает в верхние отделы кишечника. В связи с этим разрабатываются специальные лекарственные формы для перорального введения. Сегодня считается, что этот метод в наибольшей степени позволяет восстановить микробиоту ЖКТ [24, 90]. Вместе с тем у него есть ряд существенных недостатков.
Первая проблема — это подбор донора с точки зрения «нормальности» микробиоты. Для того чтобы протестировать фекальную микробиоту, необходимо провести ее полногеномное секвенирование, а как уже упоминалось, количество генов в микробиоте в 100 раз больше, чем в геноме человека. Вторая сложность — это совпадение нормальных микробиот донора и реципиента. С учетом того, что кишечная микробиота достаточно индивидуальна и формируется в том числе в зависимости от образа жизни и условий питания, а также того, что на практике сделать сравнительный анализ не представляется возможным (у реципиента микробиота на момент обращения в клинику уже изменена), подбор донора будет происходить эмпирическим путем (как правило, это ближайшие родственники), что снижает безопасность метода. На безопасность ТФМ также влияет пересадка живых микроорганизмов пациенту с несовершенным слизистым барьером и нарушенным местным иммунитетом (МАЛТ). Это потенциально может привести к инфицированию и осложнению состояния пациента. Ну и, наконец, нужно согласие пациента на подобную процедуру.
Поэтому промышленное масштабирование ТФМ является весьма проблематичным, и процедура сегодня используется (и, очевидно, будет использоваться) как крайняя мера, когда невозможно уничтожить патоген другими способами, например, в случае антибиотикорезистентных штаммов. В настоящее время эффективность ТФМ (80–100%) была продемонстрирована в случае инфицирования Clostridium difficile в качестве меры борьбы с псевдомембранозным колитом [39, 91, 92]. Возможно использование ТФМ при воспалительных заболеваниях кишечника и после трансплантации костного мозга, которой предшествуют длительные курсы антибиотиков.
Использование пробиотиков
История направленного применения пробиотиков для коррекции микробиоты начинается в 1908 г. с простокваши И. И. Мечникова. На современном этапе в этой области наблюдается существенный прогресс.
Выделены, тщательно охарактеризованы (генотипированы) и стандартизованы десятки штаммов пробиотических микроорганизмов: Lactobacillus (plantarum, casei и bulgaricus); Streptococcus thermophilus, Saccharomyces boulardii, Escherichia coli Nissle 1917, Bifidobacterium spp. и т. д. [93–95]. Продемонстрирована их позитивная мета-
болическая, симбиотическая и антипатогенная активность [96]. Проведены исследования по иммуномодулирующей способности некоторых пробиотиков в отношении МАЛТ [47, 97]. Наконец, проведены клинические исследования, доказывающие эффективность отдельных пробиотиков при антибиотик-ассоциированной и инфекционной диарее, инфекции Clostridium difficile, болезни Крона и язвенном колите, синдроме раздраженного кишечника, некротизирующем энтероколите, профилактике сепсиса [47, 94, 98–103].
Однако ни один из пробитиков не может полностью воспроизвести состав нормофлоры, а значит, не способен восстановить нормальный баланс кишечной микробиоты [90]. Кроме того, механизмы позитивного воздействия на организм хозяина у разных пробиотиков различаются, и «оптимальный» пробиотик, совмещающий их все, пока не найден. Другим препятствием для широкого применения пробиотиков в клинике является то, что за исключением постсоветского пространства и отдельных стран Восточной Европы они не зарегистрированы как лекарственные препараты, т. е. назначение их врачами, да еще и при тяжелых инфекциях, не представляется возможным. При этом даже в самых цивилизованных странах продукты питания (основной источник пробиотиков в США и Европе) имеют другие требования к стандартизации, чем лекарственные препараты. В заключение, как и в случае ТФМ, введение живых микроорганизмов в составе пробиотиков пациентам с нарушенным мукозальным барьером является небезопасным. Особенно, когда некоторые производители пробиотических препаратов утверждают, что эти микроорганизмы устойчивы ко всем известным антибиотикам и поэтому могут приниматься одновременно с противоинфекционной химиотерапией.
МАМР и их минимальные биологически активные фрагменты (МБАФ)
С учетом указанных выше недостатков ТФМ и пробиотиков возникает вопрос: нельзя ли заменить формирующие микробиоту живые микроорганизмы на их компоненты, по крайней мере в части поддержания иммунологического баланса в барьерных тканях? Это позволило бы на протяжении курса антимикробной химиотерапии и после него, вплоть до восстановления микробиоты, защитить организм хозяина от инвазии патогенных микроорганизмов.
Прежде чем ответить на этот вопрос, следует дать ответ на другой: что является иммуномодулирующим началом микробиоты? Возможно, это сами симбиотические микроорганизмы. Но тогда они должны постоянно проникать через слизистый барьер и контактировать с эпителием и даже проходить через эпителиальный пласт в lamina propria, чтобы стимулировать клетки врожденного иммунитета. Однако данный процесс совсем небезопасен для макроорганизма, т. к. комменсалы при отсутствии сдерживающих факторов способны вызывать инфицирование хозяина.
Альтернативным ответом на поставленный вопрос является предположение, что стимуляция МАЛТ происходит за счет постоянного разрушения микроорганизмов нормофлоры и высвобождения из них МАМР, которые диффундируют через слизистый слой, контактируют с эпителием и доставляются в lamina propria дендритными клетками и/или М-клетками.
Попробуем рассмотреть такую возможность на примере ПГ как одного из основных источников иммунорегуляторных фрагментов, поддерживающих «тонус» иммунитета в барьерных тканях. Во-первых, ПГ входит как основной компонент в состав и Грам(+), и Грам(-) бактерий, т. е. его суммарная массовая доля в микробиоте должна быть больше, чем других компонентов. Во-вторых, ПГ расщепляется до минорных единиц: мурамилдипептидов (МДП) и производных мезо-диаминопимелиновой кислоты (meso-DAP) лизоцимом, который постоянно присутствует на поверхности слизистых в высокой концентрации (1 мг/мл) [104–106]. Иначе говоря, процесс частичной биодеградации ПГ должен происходить непрерывно где-то на границе между жидким и плотным субслоем слизистого слоя. И, в‑третьих, для компонентов ПГ помимо PRR из семейства Toll (TLR-2) существуют еще 2 специфических цитоплазматических рецептора из семейства NOD: NOD-1 и NOD-2 [13, 107, 108]. При этом NOD-1 экспрессируется преимущественно на эпителиальных клетках и, соединяясь со своим лигандом meso-DAP, запускает двунаправленный сигнал (формирование слизистого слоя и активация иммунитета). NOD-2 преимущественно представлен на клетках врожденного иммунитета (фагоциты, дендритные клетки), и при его взаимодействии со своим лигандом МДП происходит прямая активация регуляторного и эффекторного потенциала этих клеток [109]. Эти факты позволяют предположить, что фрагменты ПГ являются одним из основных (но, безусловно, не единственным) регуляторов, поддерживающих мукозальный иммунитет в сенсибилизированном состоянии и готовности к ответу на проникновение чужеродных агентов. В дополнение в норме фрагменты ПГ и антитела к ним обнаруживаются в системном кровотоке, что свидетельствует об их образовании в слизистом слое и способности проникать через эпителий.
Несколько десятков исследований, проведенных у гнотобионтов или получавших длительные курсы антибиотиков широкого спектра действия экспериментальных животных, подтверждают, что МАМР (ПГ, ЛПС, флагеллин, ДНК комменсалов) или их фрагменты при пероральном или ректальном введении способны имитировать влияние микробиоты на МАЛТ и системный иммунитет [6, 43, 68, 105, 106, 110–113].
Воздействуя через sPRR, МАМР и их фрагменты стимулируют синтез основного компонента слизи — муцина и противомикробных пептидов эпителиальными клетками, способствуют развитию изолированных лимфатических фолликулов в lamina propria, восстанавливают Т-клеточный адаптивный иммунный ответ и синтез антител. На системном уровне фрагменты МАМР проникают в костный мозг и осуществляют прайминг нейтрофилов, а также повышение их бактерицидной активности [106, 111]. Активируя адаптивный иммунный ответ в кишечнике, МАМР
и их фрагменты усиливают защиту против вируса гриппа в легких, тем самым демонстрируя специфический для МАЛТ перенос иммунитета с одного этажа барьерных тканей на другой (хоминг) [112].
На уровне организма мурамилдипептид через свой рецептор NOD-2 защищает кишечник от воспаления [114]. ЛПС и липотейхоевая кислота способны заменить комменсалов в защите экспериментальных животных от химически индуцированного колита [114]. Флагеллин, ЛПС или ДНК комменсалов предотвращают постантибиотиковую колонизацию кишечника Clostridium difficile, Encephalitozoon cuniculi или ванкомицин-резистентными энтерококками [68, 115–117].
Таким образом, ответ на заданный в начале этого раздела вопрос является с высокой вероятностью положительным: МАМР или их фрагменты вполне могут имитировать иммуномодулирующую активность живых комменсалов. Хотя для полного понимания, какие паттерны и в какой дозе будут наиболее эффективны и безопасны, необходимы дополнительные направленные исследования.
Каково же практическое значение этого вывода? Это создание новых лекарственных препаратов для сопровождения антибиотикотерапии и преодоления постантибиотикового дисбиоза на базе МАМР и их фрагментов. При этом МАМР с точки зрения фармтехнологии являются не очень перспективным объектом. Большинство из них — это высокомолекулярные соединения очень сложной структуры. Процесс их выделения и стандартизации является достаточно дорогим. Следует учитывать еще и видовую принадлежность паттерна — многие РАМР, в отличие от МАРМ, пирогенны и токсичны. Кроме того, эти соединения в организме должны быть подвергнуты дополнительному процессингу для того, чтобы иметь возможность пройти через слизистый слой до эпителия и lamina propria.
Альтернативой является создание лекарственных препаратов на базе фрагментов МАМР, сохраняющих способность соединяться с sPRR и обладающих полностью или частично той же биологической активностью. Эти минимальные биологически активные фрагменты (МБАФ) должны не иметь видовой специфичности и обладать достаточно простой структурой, что позволяет получать их путем химического синтеза.
Один из таких МБАФ — глюкозаминилмурамилдипептид (ГМДП) уже представлен на лекарственном рынке постсоветского пространства в виде лекарственного препарата Ликопид.
ГМДП — полусинтетическое производное мурамилдипептида (МДП), представляющего собой МБАФ ПГ. ГМДП является селективным лигандом (агонистом) NOD-2 рецептора, через сигнальные пути которого он активирует клетки врожденного иммунитета [118].
За более чем 20 лет использования в клинике ГМДП многократно исследовался при инфекционных процессах в комбинации с антибиотиками и другими противоинфекционными агентами. В этих исследованиях был продемонстрирован терапевтический выигрыш такой комбинации (снижение тяжести и продолжительности заболевания) на фоне нормализации показателей системного иммунитета. Однако пока не появились приведенные в этом обзоре результаты исследований, ГМДП не рассматривался как модулятор МАЛТ и возможный кандидат, имитирующий иммуномодулирующую активность микробиоты в барьерных тканях.
Заключение
Благодаря расшифровке механизмов барьерного иммунитета (МАЛТ) и открытию сигнальных рецепторов врожденного иммунитета (sPRR) удалось в деталях описать, как на местном уровне осуществляется основная противоинфекционная защита организма. Исследование микробиоты и ее взаимодействия с МАЛТ принципиально изменило представление о работе иммунной системы, особенно в норме, при целостных барьерах и отсутствии агрессии со стороны патогенных микроорганизмов. Оказалось, что иммунитет пограничных тканей должен находиться в состоянии постоянной «тлеющей» активации, и выход из этого состояния (как со знаком «минус», так и со знаком «плюс») сопровождается тяжелыми последствиями для организма. В первом случае — это иммунодефицитные состояния и неспособность остановить инвазию патогенов или прогрессию опухолей. Во втором — развитие местных и системных иммуновоспалительных заболеваний, включая язвенные колиты, диабет и аллергию. Наконец, в совокупности исследования МАЛТ и микробиоты позволили по-новому взглянуть на современную этиотропную антиинфекционную терапию, сформировать представление о непрямом антибиотик-опосредованном иммунодефиците и разработать новую идеологию использования в клинике этих важнейших лекарственных препаратов.
Литература
1. Новое в физиологии мукозального иммунитета. Ред. А. В. Караулов, В. А. Алешкин, С. С. Афанасьев, Ю. В. Несвижский. ПМГМУ им. И. М. Сеченова. М., 2015. 168 c. [Novoye v fiziologii mukozal’nogo immuniteta. Red. A. V. Karaulov, V. A. Aloshkin, S. S. Afanas’yev, Yu.V. Nesvizhskiy. PMGMU im. I. M. Sechenova. M., 2015. 168 s. (in Russian)].
2. McDermott A.J., Huffnagle G. B. The microbiome and regulation of mucosal immunity // Immunology. 2013. Vol. 142. Р. 24–31.
3. Chen G. Y., Nunez G. Gut immunity: a NOD to the commensals // Current Biology. 2008. Vol. 19. P. 171–174.
4. Gordon H. A., Bruckner-Kardoss E., Wostmann B. S. Aging in germ-free mice: life tables and lesions observed at natural death // J. Gerontol. 1966. Vol. 21. P. 380–387.
5. Hamada H., Hiroi T., Nishiyama Y. et al. Identification of multiple isolated lymphoid follicles on the antimesenteric wall of the mouse small intestine // J. Immunol. 2002. Vol. 168. P. 57–64.
6. Bouskra D., Brezillon C., Berard M. et al. Lymphoid tissue genesis induced by commensals through NOD1 regulates intestinal homeostasis // Nature. 2008. Vol. 456. P. 507–510.
7. Garrett W. S., Gordon J. I., Glimcher L. H. Homeostasis and inflammation in the intestine // Cell. 2010. Vol. 140. P. 859–870.
8. Pearson C., Uhlig H. H., Powrie F. Lymphoid microenvironments and innate lymphoid cells in the gut // Trends Immunol. 2012. Vol. 33. P. 289–296.
9. Iwasaki A. Mucosal dendritic cells // Annu. Rev. Immunol. 2007. Vol. 25. P. 381–418.
10. Smith P. D., Ochsenbauer-Jambor C., Smythies L. E. Intestinal macrophages: unique effector cells of the innate immune system // Immunol. Rev. 2005. Vol. 206. P. 149–159.
11. Меdzhitov R., Janeway C. Innate Immunity // N. Engl. J. Med. 2000. Vol. 343 (5). P. 338–344.
12. Yoneyama M., Fujita T. Function of RIG-I-like receptors in antiviral innate immunity // J. Biol. Chem. 2007. Vol. 282 (21). P. 15315–15318.
13. Girardin S. E., Travassos L. H., Herve M. et al. Peptidoglycan molecular requirements allowing detection by Nod1 and Nod2 // J. Biol. Chem. 2003. Vol. 278 (43). P. 41702–41708.
14. Lemaire B., Nicolas E., Michaut L. et al. The dorsoventral regulatory gene cassette spatzle/toll/cactus controls the potent antifungal response in Drosophila adults // Cell. 1996. Vol. 86. P. 973–983.
15. Du X., Poltorak A., Wei Y., Beutler B. Three novel mammalian toll-like receptors: gene structure, expression, and evolution // Eur. Cytokine Netw. 2000. Vol. 11. P. 362–371.
16. Medzhitov R. Toll-like receptors and innate immunity // Nat. Immunol. 2001. Vol. 1 (2). P. 135–145.
17. Mishra B. B., Gundra U. M., Teale J. M. Expression and distribution of Toll-like receptors 11–13 in the brain during murine neurocysticercosis // J. Neuroinflamm. 2008. Vol. 5. P. 53–63.
18. Caamano J., Hunter C. A. NF-kB family of transcription factors: central regulators of innate and adaptive immune functions // Clin. Microbiol. Rev. 2002. Vol. 15 (3). P. 414–429.
19. Yamamoto M., Sato S., Hemmi H. et al. Role of adapter TRIF in the MyD88-independent Toll-like receptor signaling pathway // Science. 2003. Vol. 301. P. 640–643.
20. Kawai T., Akira S. The role of pattern-recognition receptors in innate immunity: update on Toll-like receptors // Nat. Immunol. 2010. Vol. 11. P. 373–384.
21. Akira S., Takeda K. Toll-like receptors in innate immunity // Inter. Immunol. 2005. Vol. 17 (1). P. 1–14.
22. Ковальчук Л. В. Современные проблемы клинической иммунологии в свете новых представлений о врожденном иммунитете // Лекции по педиатрии: иммунология. T. 9. М.: РГМУ, 2010. 320 с. [Koval’chuk L. V. Sovremennyye problemy klinicheskoy immunologii v svete novykh predstavleniy o vrozhdennom immunitete // Lektsii po pediatrii: immunologiya. T. 9. M.: RGMU, 2010. 320 s. (in Russian)].
23. Ахматова Н. К., Киселевский М. В. Врожденный иммунитет: противоопухолевый и противоинфекционный. М.: Практическая медицина, 2008. 256 с. [Akhmatova N.K., Kiselevskiy M. V. Vrozhdennyy immunitet: protivoopukholevyy i protivoinfektsionnyy. M.: Prakticheskaya meditsina, 2008. 256 s. (in Russian)].
24. Ekmekciu I., von Klitzing E., Fiebiger U. et al. Immune responses to broad-spectrum antibiotic treatment and fecal microbiota transplantation in mice // Frontiers Immunol. 2017. Vol. 8. P. 1–19.
25. Sender R., Fuchs S., Milo R. Are we really vastly outnumbered? revisiting the ratio of bacterial to host cells in humans // Cell. 2016. Vol. 164 (3). P. 337–340.
26. Ubeda C., Pamer E. G. Antibiotics, microbiota, and immune defense // Trends Immunol. 2012. Vol. 33 (9). P. 459–466.
27. Eckburg P. B., Bik E. M., Bernstein C. N. et al. Diversity of the human intestinal microbial flora // Science. 2005. Vol. 308. P. 1635–1638.
28. Hooper L. V., Gordon J. I. Commensal host-bacterial relationships in the gut // Science. 2001. Vol. 292. P. 1115–1118.
29. Hsiao W. W., Metz C., Singh D. P., Roth, J. The microbes of the intestine: an introduction to their metabolic and signaling capabilities // Endocrinol. Metab. Clin. North. Am. 2008. Vol. 37. P. 857–871.
30. Macpherson A. J., Hunziker L., McCoy K., Lamarre A. IgA responses in the intestinal mucosa against pathogenic and non-pathogenic microorganisms // Microbes Infect. 2001. Vol. 3. P. 1021–1035.
31. Rajilic-Stojanovic M., de Vos W. M. The first 1000 cultured species of the human gastrointestinal microbiota // FEMS Microbiol. Rev. 2014. Vol. 38. P. 996–1047.
32. Wolff N. S., Hugenholtz F., Wiersinga W. J. The emerging role of the microbiota in the ICU // Crit. Care. 2018. Vol. 22. P. 78–85.
33. Schey R., Danzer C., Mattner J. Perturbations of mucosal homeostasis through interactions of intestinal microbes with myeloid cells // Immunobiol. 2015. Vol. 220 (2). P. 227–235.
34. Suau A., Bonnet R., Sutren M. et al. Direct analysis of genes encoding 16S rRNA from complex communities reveals many novel molecular species within the human gut // Appl. Environ. Microbiol. 1999. Vol. 65. P. 4799–4807.
35. Shanahan F. The host-microbe interface within the gut // Best Pract. Res. Clin. Gastroenterol. 2002. Vol. 16. P. 915–931.
36. Chu H., Mazmanian S. K. Innate immune recognition of the microbiota promotes hostmicrobial symbiosis // Nat. Immunol. 2013. Vol. 14 (7). P. 668–675.
37. LeBlanc J.G., Milani C., de Giori G. S. et al. Bacteria as vitamin suppliers to their host: a gut microbiota perspective // Curr. Opin. Biotechnol. 2013. Vol. 24 (2). P. 160–168.
38. Kamada N., Chen G. Y., Inohara N., Núñez G. Control of pathogens and pathobionts by the gut microbiota // Nat. Immunol. 2013. Vol. 14. P. 685–690.
39. Kamada N., Seo S. U., Chen G. Y., Núñez G. Role of the gut microbiota in immunity and inflammatory disease // Nature Rev. Immunol. 2013. Vol. 13. P. 321–335.
40. Hooper L. V., Midtved T., Gordon J. I. How host-microbial interactions shape the nutrient environment of the mammalian intestine // Annu. Rev. Nutrition. 2002. Vol. 22. P. 283–307.
41. Hooper L. V., Wong M. H., Thelin A. et al. Molecular analysis of commensal host-microbial relationships in the intestine // Science. 2001. Vol. 291. P. 881–884.
42. Backhed F., Ding H., Wang T. et al. The gut microbiota as an environmental factor that regulates fat storage // Proc. Natl. Acad. Sci. USA. 2004. Vol. 101. P. 15718–15723.
43. Hooper L. V. Do symbiotic bacteria subvert host immunity? // Nat. Rev. Microbiol. 2009. Vol. 7. P. 367–374.
44. Johansson M. E., Larsson J. M., Hansson GC. The two mucus layers of colon are organized by the MUC2 mucin, whereas the outer layer is a legislator of host-microbial interactions // Proc. Natl. Acad. Sci. USA. 2011. Vol. 108. Suppl. 1. P. 4659–4665.
45. Johansson M. E., Sjovall H., Hansson G. C. The gastrointestinal mucus system in health and disease // Nat. Rev. Gastroenterol. Hepatol. 2013. Vol. 10 (6). P. 352–361.
46. Cash H. L., Whitham C. V., Behrendt C. L., Hooper L. V. Symbiotic bacteria direct expression of an intestinal bactericidal lectin // Science. 2006. Vol. 313. P. 1126–1130.
47. Wlodarska M., Finlay B. B. Host immune response to antibiotic perturbation of the microbiota // Nature. 2010. Vol. 3 (2). P. 100–103.
48. Peterson D. A., McNulty N.P., Guruge J. L., Gordon J. I. IgA response to symbiotic bacteria as a mediator of gut homeostasis // Cell Host Microbe. 2007. Vol. 2. P. 328–339.
49. Hapfelmeier S, Lawson M. A., Slack E. et al. Reversible microbial colonization of germ-free mice reveals the dynamics of IgA immune responses // Science. 2010. Vol. 328. P. 1705–1709.
50. Fagarasan S., Kawamoto S., Kanagawa O., Suzuki K. Adaptive immune regulation in the gut: T cell-dependent and T cell-independent IgA synthesis // Annu. Rev. Immunol. 2010. Vol. 28. P. 243–273.
51. Macpherson A. J., Geuking M. B., McCoy K. D. Homeland security: IgA immunity at the frontiers of the body // Trends Immunol. 2012. Vol. 33. P. 160–167.
52. Shroff K. E., Meslin K., Cebra J. J. Commensal enteric bacteria engender a self-limiting humoral mucosal immune response while permanently colonizing the gut // Infect. Immun. 1995. Vol. 63. P. 3904–3913.
53. Duan J., Kasper D. L. Regulation of T cells by gut commensal microbiota // Curr. Opin. Rheumat. 2011. Vol. 23. P. 372–376.
54. Macpherson A. J., Gatto D., Sainsbury E. et al. A primitive T cell independent mechanism of intestinal mucosal IgA responses to commensal bacteria // Science. 2000. Vol. 288. P. 2222–2226.
55. Mazmanian S. K., Liu C. H., Tzianabos A. O., Kasper D. L. An immunomodulatory molecule of symbiotic bacteria directs maturation of the host immune system // Cell. 2005. Vol. 122. P. 107–118.
56. Mitsdoerffer M., Lee Y., Jäger A. et al. Proinflammatory T helper type 17 cells are effective B-cell helpers // Proc. Natl. Acad. Sci. USA. 2010. Vol. 107. P. 14292–14297.
57. Atarashi K., Nishimura J., Shima T., et al. ATP drives lamina propria TH17 cell differentiation // Nature. 2008. Vol. 455. P. 808–812.
58. Ivanov I. I., Frutos Rde L., Manel N. et al. Specific microbiota direct the differentiation of IL-17-producing T-helper cells in the mucosa of the small intestine // Cell Host Microbe. 2008. Vol. 4. P. 337–349.
59. Franchi L., Kamada N., Nakamura Y. et al. NLRC4 driven production of IL 1β discriminates between pathogenic and commensal bacteria and promotes host intestinal defense // Nature Immunol. 2012.Vol. 13. P. 449–456.
60. Mackey D., McFall A.J. MAMPs and MIMPs: proposed classifications for inducers of innate immunity // Mol. Microbiol. 2006. Vol. 61. P. 1365–1371.
61. Jeon S. G., Kayama H., Ueda Y. et al. Probiotic Bifidobacterium breve induces IL-10-producing Tr1 cells in the colon // PLoS Pathog. 2012. Vol. 8. e1002714.
62. Lathrop S. K., Bloom S. M., Rao S. M. et al. Peripheral education of the immune system by colonic commensal microbiota // Nature. 2011. Vol. 478. P. 250–254.
63. Mazmanian S. K., Round J. L., Kasper D. L. A microbial symbiosis factor prevents intestinal inflammatory disease // Nature. 2008. Vol. 453. P. 620–625.
64. Ochoa-Reparaz J., Mielcarz D. W., Ditrio L. E. et al. Central nervous system demyelinating disease protection by the human commensal Bacteroides fragilis depends on polysaccharide A expression // J. Immunol. 2010. Vol. 185. P. 4101–4108.
65. Round J. L., Mazmanian S. K. Inducible Foxp3+ regulatory T-cell development by a commensal bacterium of the intestinal microbiota // Proc. Natl. Acad. Sci. USA. 2010. Vol. 107. P. 12204–12209.
66. Козлов И. Г. Ренессанс иммуностимулирующей терапии // Вестник педиатрической фармакологии и нутрициологии. 2008. T. 5 (3). С. 4–13 [Kozlov I. G. Renessans immunostimuliruyushchey terapii // Vestnik pediatricheskoy farmakologii i nutritsiologii. 2008. T. 5 (3).. S. 4–13 (in Russian)].
67. Grayson M. L., Cosgrove S. E., Crowe S. et al. Kucers’ the use of antibiotics: a clinical review of antibacterial, antifungal, antiparasitic and antiviral drugs // M. Lindsay Grayson [edt.]. CRC Press. 2017. ISBN 9781315152110 (e-book).
68. Brandl K., Plitas G., Mihu C. N. et al. Vancomycin-resistant enterococci exploit antibiotic-induced innate immune deficits // Nature. 2008. Vol. 455. P. 804–807.
69. Dethlefsen L., Huse S., Sogin M. L., Relman D. A. The pervasive effects of an antibiotic on the human gut microbiota, as revealed by deep 16S rRNA sequencing // PLoS Biol. 2008. Vol. 6. e280.
70. Jernberg C., Löfmark S., Edlund C., Jansson J. K. Long-term ecological impacts of antibiotic administration on the human intestinal microbiota // ISME J. 2007. Vol. 1. P. 56–66.
71. Buffie C. G., Jarchum I., Equinda M. et al. Profound alterations of intestinal microbiota following a single dose of clindamycin results in sustained susceptibility to Clostridium difficile-induced colitis // Infect. Immun. 2012. Vol. 80 (1). P. 62–73.
72. Tanaka S., Kobayashi T., Songjinda P. et al. Influence of antibiotic exposure in the early postnatal period on the development of intestinal microbiota // FEMS Immunol. Med. Microbiol. 2009. Vol. 56. P. 80–87.
73. Hill D. A., Hoffmann C., Abt M. C. et al. Metagenomic analyses reveal antibiotic-induced temporal and spatial changes in intestinal microbiota with associated alterations in immune cell homeostasis // Mucosal Immunol. 2010. Vol. 3. P. 148–158.
74. Sekirov I., Tam N. M., Jogova M. et al. Antibiotic-induced perturbations of the intestinal microbiota alter host susceptibility to enteric infection // Infect. Immun. 2008. Vol. 76. P. 4726–4736.
75. Bohnhoff M., Drake B. L., Miller C. P. Effect of streptomycin on susceptibility of intestinal tract to experimental Salmonella infection // Proc. Soc. Exp. Biol. Med. 1954. Vol. 86. Р. 132–137.
76. Hentges D. J., Freter R. In vivo and in vitro antagonism of intestinal bacteria against Shigella flexneri I. Correlation between various tests // J. Infect. Dis. 1962. Vol. 110. P. 30–37.
77. Lawley T. D., Clare S., Walker A. W. et al. Antibiotic treatment of Clostridium difficile carrier mice triggers a supershedder state, spore-mediated transmission, and severe disease in immunocompromised hosts // Infect. Immun. 2009. Vol. 77. Р. 3661–3669.
78. Rupnik M., Wilcox M. H., Gerding D. N. Clostridium difficile infection: new developments in epidemiology and pathogenesis // Nature Rev. Microbiol. 2009. Vol. 7. P. 526–536.
79. Clemente J. C., Ursell L. K., Parfrey L. W., Knight R. The impact of the gut microbiota on human health: an integrative view // Cell. 2012. Vol. 148. P. 1258–1270.
80. Potgieter M., Bester J., Kell D. B., Pretorius E. The dormant blood microbiome in chronic, inflammatory diseases // FEMS Microbiol. Rev. 2015. Vol. 39. P. 567–591.
81. Ubeda C., Taur Y., Jenq R. R. et al. Vancomycin-resistant Enterococcus domination of intestinal microbiota is enabled by antibiotic treatment in mice and precedes bloodstream invasion in humans // J. Clin. Invest. 2010. Vol. 120 (12). Р. 4332–4341.
82. Awad M. M., Johanesen P. A., Carter G. P. et al. Clostridium difficile virulence factors: insights into an anaerobic spore-forming pathogen // Gut Microbes. 2014. Vol. 5 (5). P. 579–593.
83. Hill D. A., Siracusa M..C, Abt M. C. et al. Commensal bacteria-derived signals regulate basophil hematopoiesis and allergic inflammation // Nat. Med. 2012. Vol. 18. P. 538–546.
84. Russell S. L., Gold M. J., Hartmann M. et al. Early life antibiotic-driven changes in microbiota enhance susceptibility to allergic asthma // EMBO Rep. 2012. Vol. 13. P. 440–447.
85. Bashir M. E.H., Louie S., Shi H. N., Nagler-Anderson C. Toll-like receptor 4 signaling by intestinal microbes influences susceptibility to food allergy // J. Immunol. 2004. Vol. 172. P. 6978–6987.
86. Spencer S. D., Di Marco F., Hooley J. et al. The orphan receptor CRF2–4 is an essential subunit of the interleukin 10 receptor // J. Exp. Med. 1998. Vol. 187. P. 571–578.
87. Abraham C., Cho J. H. Inflammatory bowel disease // N. Engl. J. Med. 2009. Vol. 361. P. 2066–2078.
88. Wen L., Ley R. E., Volchkov P. Y. et al. Innate immunity and intestinal microbiota in the development of type 1 diabetes // Nature. 2008. Vol. 455. P. 1109–1113.
89. Wu H. J., Ivanov I. I., Darce J. et al. Gut-residing segmented filamentous bacteria drive autoimmune arthritis via T helper 17 cells // Immunity. 2010. Vol. 32. P. 815–827.
90. Yoon M. Y., Yoon S. S. Disruption of the gut ecosystem by antibiotics // Yonsei Med. J. 2018. Vol. 59 (1). P. 4–12.
91. Borody T. J., Khoruts A. Fecal microbiota transplantation and emerging applications // Nature Rev. Gastroenterol. Hepatol. 2011. Vol. 9. P. 88–96.
92. Bakken J. S., Borody T., Brandt L. J. et al. Treating Clostridium difficile infection with fecal microbiota transplantation // Clin. Gastroenterol. Hepatol. 2011. Vol. 9. P. 1044–1049.
93. Hickson M., D’Souza A.L., Muthu N. et al. Use of probiotic Lactobacillus preparation to prevent diarrhoea associated with antibiotics: randomised double blind placebo controlled trial // BMJ. 2007. Vol. 335. P. 80–84.
94. Schultz M. Clinical use of E. coli Nissle 1917 in inflammatory bowel disease // Inflamm. Bowel Dis. 2008. Vol. 14. P. 1012–1018.
95. Gareau M. G., Sherman P. M., Walker W. A. Probiotics and the gut microbiota in intestinal health and disease // Nat. Rev. Gastroenterol. Hepatol. 2010. Vol. 7. P. 503–514.
96. Miller C., Bohnhoff M. Changes in the mouse’s enteric microflora associated with enhanced susceptibility to Salmonella infection following streptomycin treatment // J. Infect. Dis. 1963. Vol. 113. P. 59–66.
97. Mennigen R., Nolte K., Rijcken E. et al. Probiotic mixture VSL # 3 protects the epithelial barrier by maintaining tight junction protein expression and preventing apoptosis in a murine model of colitis // Am. J. Physiol. Gastrointest. Liver Physiol. 2009. Vol. 296. P. 1140–1149.
98. Johnston B. C., Ma S. S., Goldenberg J. Z. et al. Probiotics for the prevention of Clostridium difficile-associated diarrhea: a systematic review and meta-analysis // Ann. Intern. Med. 2012. Vol. 157. P. 878–888.
99. Borchers A. T., Selmi C., Meyers F. J. et al. Probiotics and immunity // J. Gastroenterol. 2009. Vol. 44. Р. 26–46.
100. Wolvers D., Antoine J. M., Myllyluoma E. et al. Guidance for substantiating the evidence for beneficial effects of probiotics: prevention and management of infections by probiotics // J. Nutr. 2010 Vol. 140. P. 698–712.
101. Panigrahi P., Parida S., Nanda N. C. et al. A randomized synbiotic trial to prevent sepsis among infants in rural India // Nature. 2017. Vol. 548. P. 407–412.
102. McFarland L. V. Use of probiotics to correct dysbiosis of normal microbiota following disease or disruptive events: a systematic review // BMJ Open. 2014. Vol. 4. e005047.
103. Hempel S., Newberry S. J., Maher A. R. et al. Probiotics for the prevention and treatment of antibiotic-associated diarrhea: a systematic review and meta-analysis // JAMA. 2012. Vol. 307. P. 1959–1969.
104. Callewaert L., Michiels C. W. Lysozymes in the animal kingdom // J. Biosci. 2010. Vol. 35 (1). P. 127–160.
105. Hasegawa M., Yang K., Hashimoto M. et al. Differential release and distribution of Nod1 and Nod2 immunostimulatory molecules among bacterial species and environments // J. Biol. Chem. 2006. Vol. 281. P. 29054–29063.
106. Clarke T. B., Davis K. M., Lysenko E. S. et al. Recognition of peptidoglycan from the microbiota by Nod1 enhances systemic innate immunity // Nature Med. 2010. Vol. 16. Р. 228–231.
107. Davis K. M., Nakamura S., Weiser J. N. Nod2 sensing of lysozyme-digested peptidoglycan promotes macrophage recruitment and clearance of S. pneumoniae colonization in mice // J. Clin. Invest. 2011. Vol. 121 (9). P. 3666–3676.
108. Nigro G., Fazio L. L., Martino M. C. et al. Muramylpeptide shedding modulates cell sensing of Shigella flexneri // Cell Microbiol. 2008. Vol. 10 (3). P. 682–695.
109. Petnicki-Ocwieja T., Hrncir T., Liu Y. J. et al. Nod2 is required for the regulation of commensal microbiota in the intestine // Proc. Natl. Acad. Sci. USA. 2009. Vol. 106. P. 15813–15818.
110. Kobayashi K. S., Chamaillard M., Ogura Y. et al. Nod2-dependent regulation of innate and adaptive immunity in the intestinal tract // Science. 2005. Vol. 307. P. 731–734.
111. Rakoff-Nahoum S., Paglino J., Eslami-Varzaneh F. et al. Recognition of commensal microflora by toll-like receptors is required for intestinal homeostasis // Cell. 2004. Vol. 118. P. 229–241.
112. Ichinohe T., Pang I. K., Kumamoto Y. et al. Microbiota regulates immune defense against respiratory tract influenza A virus infection // Proc. Natl. Acad. Sci. USA. 2011. Vol. 108. P. 5354–5359.
113. Petersson J., Schreiber O., Hansson G. C. et al. Importance and regulation of the colonic mucus barrier in a mouse model of colitis // Am. J. Physiol. Gastrointest. Liver Physiol. 2010. Vol. 300.. Р. 327–333.
114. Watanabe T., Asano N., Murray P. J. et al. Muramyl dipeptide activation of nucleotide-binding oligomerization domain 2 protects mice from experimental colitis // J. Clin. Invest. 2008. Vol. 118. P. 545–559.
115. Hall J. A., Bouladoux N., Sun C. M. et al. Commensal DNA limits regulatory T cell conversion and is a natural adjuvant of intestinal immune responses // Immunity. 2008. Vol. 29. P. 637–649.
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru

