Содержание статьи
- 1 Введение
- 2 Остеоартрит: медико-социальное бремя
- 3 Терапия остеоартрита в современных клинических рекомендациях
- 4 Роль хондроитина сульфата в терапии остеоартрита: механизм действия, фармакологические эффекты, клиническая эффективность и безопасность у коморбидных пациентов
- 5 Современная доказательная база эффективности парентеральной формы хондроитина сульфата в терапии ОА
- 6 Использование парентеральных форм ХС при наличии абсолютных и относительных противопоказаний к применению НПВП
- 7 Первичный и вторичный остеоартрит крупных суставов: актуальные режимы применения хондроитина сульфата
- 8 Хондроитина сульфат в клинических рекомендациях в РФ
- 9 Выводы
Введение
Экспертная группа представляет первый Консенсус, посвященный месту и роли парентеральной формы хондроитина сульфата (ХС) в терапии остеоартрита (ОА).
Цель первого мультидисциплинарного Консенсуса: всесторонне проанализировать медико-социальные, клинические и фармакотерапевтические аспекты применения парентеральной формы ХС в терапии ОА.
В Консенсусе отмечено увеличение медико-социального бремени ОА во всех странах мира. Клинические разделы Консенсуса посвящены месту парентеральной формы ХС в современных клинических рекомендациях по ведению пациентов с ОА, возможностям применения ХС при ОА различными специалистами, роли ХС в терапии ОА, анализу доказательной базы его эффективности и безопасности, в т. ч. у пациентов с коморбидными состояниями и при вторичных ОА крупных суставов.
В отдельных разделах суммированы материалы, иллюстрирующие преимущества парентерального пути введения ХС, его значимый анальгетический потенциал у пациентов с ОА при наличии абсолютных и относительных противопоказаний к применению нестероидных противовоспалительных препаратов (НПВП), а также результаты фармацевтического анализа 6 парентеральных препаратов ХС, продемонстрировавшие важность стандартизации и фармацевтической экспертизы экстрактов ХС, входящих в состав лекарственных препаратов.
Показано, что парентеральная форма ХС для внутримышечного и внутрисуставного введения (Хондрогард®, ЗАО «ФармФирма «Сотекс», Россия) имеет целый ряд фармацевтических (наименьшее содержание токсических микроэлементов и следовых количеств белка, необходимая молекулярно-весовая характеристика и количество сульфогрупп в экстракте, высокие значения соотношения Na:Cl) и клинических преимуществ, в связи с чем может быть рекомендована для стартового применения при хронической боли в суставах и спине при ОА, в т. ч. у пациентов с сердечно-сосудистой патологией и заболеваниями почек. Отмечено, что эффективность препарата Хондрогард® отдельно подтверждена в собственном метаанализе клинических исследований.
Выявлено, что у пациентов старше 60 лет с болью в суставах и наличием противопоказаний к применению НПВП или старческой астенией для купирования боли и профилактики обострения болевого синдрома целесообразно применение ХС в парентеральной форме.
Рекомендовано включение ХС для внутрисуставного и внутримышечного введения в схему терапии вторичных ОА крупных суставов конечностей (посттравматического, диспластического и др.), в т. ч. на этапах реабилитации.
Среди методологических особенностей создания Консенсуса нам хотелось бы выделить его мультидисциплинарность: в состав экспертной группы, работавшей над созданием Консенсуса, были включены ревматологи, геронтологи, неврологи, клинические фармакологи, травматологи-ортопеды и реабилитологи.
Формат Консенсуса подразумевает компактное изложение. Приводимая библиография включает только ключевые работы последних лет соответствующего методологического качества. В соответствии с критериями доказательной медицины (evidence-based medicine) к анализу и обсуждению подвергались прежде всего рандомизированные клинические исследования (РКИ), обзоры и метаанализы.
По структуре Консенсуса сформировано краткое резюме, ключевые положения Консенсуса суммированы в заключении. Особенность Консенсуса — детальный анализ перспектив применения парентеральной формы ХС по новым показаниям.
Для придания Консенсусу большей компактности эксперты достаточно часто использовали принятые в отечественной и зарубежной научной литературе аббревиатуры. При первом использовании сокращения дается полная расшифровка терминов.
Остеоартрит: медико-социальное бремя
ОА является самой частой патологией в структуре заболеваний костно-мышечной системы, одной из частых причин обращения за медицинской помощью, а среди пациентов старших возрастных групп — ведущей причиной госпитализации. В настоящее время распространенность ОА оценивается от 7,5% в молодом возрасте до 40% в возрасте старше 65 лет [1].
В соответствии с данными большинства эпидемиологических исследований последнего десятилетия, ОА наряду с сердечно-сосудистыми и метаболическими заболеваниями наиболее часто встречается в структуре соматической коморбидности. По данным S. Swain et al. (2020), у лиц с ОА вероятность наличия какой-либо сопутствующей патологии в 1,2 раза выше, чем у лиц из контрольной группы без ОА, и в 2,5 раза выше вероятность наличия ≥3 сопутствующих заболеваний [2]. К сопутствующим заболеваниям с наибольшим увеличением риска относятся инсульт, язвенная болезнь, гипертоническая болезнь и депрессия [2].
Помимо известного влияния ОА на качество жизни в связи с нарушениями функции суставов и болевым синдромом в последние годы обсуждается вопрос существенного повышения риска развития старческой астении у данной категории пациентов, что приводит к формированию зависимости и потребности в посторонней помощи [3], а также к увеличению риска смерти у пациентов с клиническими симптомами ОА (отношение рисков [hazard ratio, HR] 1,37, 95% доверительный интервал [ДИ] 1,22–1,54) [4].
Клинико-эпидемиологические работы последних лет четко обозначили медико-социальное значение проблемы ОА:
хроническая боль в суставах посредством симпатоадреналовых реакций и поддержания активности системного воспаления низкой интенсивности приводит к увеличению тяжести коморбидных заболеваний пациента (ССЗ, сахарного диабета [СД], хронической обструктивной болезни легких, старческой астении);
снижение функциональных возможностей суставов со временем служит причиной иммобилизации больных, что требует ежедневной помощи родственников и/или социальных служб в выполнении жизненно важных функций;
уменьшение ежедневной физической активности вследствие боли в спине и суставах и функциональных нарушений увеличивает декомпенсацию ССЗ (развитие застойных явлений) и не позволяет проводить реабилитационные мероприятия в полном объеме;
снижение постоянной физической активности у пожилых пациентов с ОА приводит также к ускорению развития у них остеопороза, что связано с уменьшением физиологических нагрузок на кости скелета;
отсутствие эффективного интегрального комплекса профилактических мероприятий при ОА у лиц пожилого возраста на поликлиническом, стационарном и санаторном этапах;
отсутствие требований к стандартизации проведения фармакологического анализа, анализа биоэквивалентности и терапевтической эквивалентности препаратов из группы хондропротекторов (ХП), включенных в международные и российские клинические рекомендации по ведению ОА, приводит к различиям в эффективности и безопасности различных ХП и к увеличению прямых и непрямых затрат на ведение пациентов с повышением нагрузки на бюджет здравоохранения;
в популяции ОА является главной и самой частой причиной низкого качества жизни, особенно у пациентов пожилого и старческого возраста, а также причиной потери трудоспособности.
Таким образом, медико-социальное бремя ОА диктует необходимость разработки и внедрения в клиническую практику наиболее эффективных и безопасных методов терапии и профилактики.
Терапия остеоартрита в современных клинических рекомендациях
Современное научно-обоснованное лечение ОА основано на применении немедикаментозных и фармакологических методов, при необходимости рекомендуется хирургическое вмешательство. С точки зрения клинических рекомендаций профильных ассоциаций (OARSI, EULAR, ESCEO, ACR, РАГГ, АРР) базисная терапия ОА включает модификацию факторов риска (снижение веса, повышение физической активности, коррекция кардиометаболических факторов риска и др.), структурированные комплексы лечебных упражнений, использование ортопедических приспособлений (ортезы, средства для ходьбы и пр.) и методы психотерапевтических воздействий, направленные на формирование позитивных копинг-стратегий.
Совет экспертов констатирует, что, несмотря на множество разработанных за последние десятилетия подходов к терапии ОА и болевого синдрома, рутинная клиническая практика в большинстве случаев ограничивается выбором НПВП и пероральных форм симптоматических медленно- действующих препаратов (Symptomatic Slow Acting Drugs for Osteoarthritis [SYSADOA], которые в отечественной научной литературе получили название «симптоматических препаратов замедленного действия» [СПЗД]). Крайне ограниченно используются реабилитационные возможности и немедикаментозные методы лечения ОА, включая когнитивный тренинг, а отсутствие достаточной просветительской работы с пациентами влияет на их приверженность методам физической реабилитации.
Несмотря на наличие множества методов лечения, исходы для пациентов с ОА обычно не являются оптимальными, и пациенты остаются уязвимыми к клиническим последствиям заболевания, связанным с болью и физическим состоянием. Одной из причин неудач клинических испытаний лекарственных средств, предназначенных для модификации структурных изменений при ОА, является то, что сегодня не разработаны принципы стандартизации фармакологического анализа, анализа биоэквивалентности и терапевтической эквивалентности лекарственных средств для лечения ОА, в т. ч. СПЗД, стандартной и персонифицированной терапии с учетом имеющихся данных о фенотипах и молекулярных эндотипах ОА.
Эксперты утверждают, что только комплексная терапия, ориентированная на пациента с учетом индивидуальных особенностей течения ОА, позволит добиться высокой эффективности и безопасности лечения.
Среди обезболивающих интервенций с учетом действующих ограничений рекомендуется использование ацетаминофена, НПВП (местные и системные формы), внутрисуставное введение глюкокортикостероидов (по строгим показаниям и с ограничением кратности введения в один сустав до 2 инъекций на протяжении 6 мес.), применение гиалуроновой кислоты для внутрисуставных инъекций, фармацевтических субстанций ХС и глюкозамина сульфата (ГС) в парентеральных и пероральных лекарственных формах. При наличии клинической необходимости (паттерны нейропатической или дисфункциональной боли) показано назначение специфической терапии (габапентиноиды, селективные ингибиторы обратного захвата серотонина).
Представленные методы и средства терапии ОА имеют надежный уровень доказательности и силу убедительности рекомендаций, что позволяет использовать их у пациентов с первичным и вторичным ОА.
Известно, что в мировой клинической практике ведения пациентов с ОА рутинно используются пероральные формы фармацевтических субстанций ХС и ГС. Данные средства относятся к группе SYSADOA, или СПЗД, поскольку их клинический эффект развивается через 8–12 нед. от начала применения.
В отечественной практике ведения пациентов с ОА часто используется парентеральная форма ХС. Фармакокинетические характеристики парентеральной формы ХС (большой объем распределения, длительный период полувыведения, большая площадь под фармакокинетической кривой «концентрация — время», длительная экскреция с мочой) свидетельствуют о высокой степени биодоступности препарата, что ускоряет время наступления обезболивающего эффекта : наблюдается в среднем через 3–4 нед. применения (25–30 инъекций) [5]. Более того, показано, что введение внутрисуставных инъекций отечественного препарата ХС Хондрогард® с первого дня терапии с последующим переходом на внутримышечный путь введения оказывает достоверно более выраженное анальгетическое действие в сравнении с анальгетическим эффектом, развивающимся после курсового введения внутримышечных инъекций препарата [6].
Роль хондроитина сульфата в терапии остеоартрита: механизм действия, фармакологические эффекты, клиническая эффективность и безопасность у коморбидных пациентов
За последние 20 лет экспериментальные исследования продемонстрировали фармакодинамические эффекты ХС: снижение активности ядерного фактора κВ (NF-κB), в т. ч. путем активации CD44 (интегральный клеточный гликопротеин, играющий важную роль в межклеточных взаимодействиях, клеточной адгезии и миграции); подавление синтеза провоспалительных цитокинов, матриксных металлопротеаз, альгогенов, индуцирование активности ингибитора фактора роста эндотелия сосудов (VEGF) и тромбоспондина-1; подавление синтеза провоспалительных цитокинов в хондроцитах, синовиоцитах, остеоцитах и миоцитах, что уменьшает интенсивность воспаления в тканях сустава; снижение интенсивности ангиогенеза; замедление субхондральной резорбции и уменьшение апоптоза хондроцитов [7, 8]. На фоне приема ХС клинически отмечается уменьшение боли в суставах, улучшение их функции, снижение скорости прогрессирования ОА, уменьшение потребности в НПВП, купирование болевого синдрома, что позволяет отсрочить выполнение операций эндопротезирования крупных суставов конечностей.
Ингибирование ХС воспалительного сигнального пути ядерного фактора NF-κB уменьшает дистрофические изменения не только в хрящевой ткани [7], но и в мышцах [9].
Замедление апоптоза хондроцитов хрящевой ткани способствует сохранению объема хряща [8], а ингибирование NF-kB в мышечной ткани повышает дифференцировку мио-
цитов, способствуя увеличению массы и силы мышц [10]. Влияние сульфатированных полисахаридных молекул на миогенную дифференцировку изучается с конца прошлого века. Однако лишь исследования последних лет позволили установить, что молекулы ХС и ГС ускоряют и улучшают качество регенеративных процессов в тканях мышц
и связок [11]. Результаты вышеперечисленных исследований позволяют предполагать дополнительные позитивные эффекты при назначении ХС пациентам с ОА и саркопенией и диктуют необходимость проведения клинических исследований эффективности и безопасности применения ХС у данного контингента больных.
В исследовании P. Melgar-Lesmes et al. (2016) продемонстрировали, что культуры коронарных эндотелиальных клеток и моноцитов в присутствии ХС секретируют меньше провоспалительных цитокинов (р<0,01), что значимо сокращает атерогенез [12]. Данный результат является существенным положительным эффектом для коморбидных больных с ССЗ и ОА.
Помимо этого, продемонстрировано противоопухолевое действие ХС, которое распространяется на различные типы опухолевых клеток (глиома, рак толстой кишки, легких, молочной железы, яичников, предстательной железы, почек, мочевого пузыря и др.). ХС взаимодействует с рецептором CD44, способствуя снижению хронического воспаления, торможению пролиферации и стимулированию апоптоза опухолевых клеток. Молекулы ХС подавляют экспрессию VEGF и активность ММП, ингибируют активность каскада Wnt/β-катенин. Кроме того, влияя на инкапсуляцию опухолевых образований, молекулы ХС тормозят процесс метастазирования. Имеющиеся данные крупномасштабных клинических исследований указывают на перспективность применения ХС/ГС для долговременной профилактики опухолевых заболеваний [13].
ESCEO рекомендует длительное использование фармацевтических субстанций ХС при ОА коленного сустава [14]. Ранее исследователи провели целый ряд различных плацебо-контролируемых РКИ, наблюдательных программ, метаанализов и подтвердили эффективность ХС в терапии ОА [15–17].
За последние годы лекарственные препараты на основе фармакопейной субстанции ХС получили целый ряд надежных доказательств эффективности в крупных РКИ. Так, в метаанализе 3-х плацебо-контролируемых РКИ пероральной формы ХС (n=1179) продолжительностью 2 года было установлено существенное влияние ХС на снижение скорости сужения минимальной ширины суставной щели в среднем на 0,13 мм (95% ДИ 0,06–0,19; p=0,0002) [16]. В 2015 г. систематический Кохрановский обзор [18] исследований с высоким уровнем доказательности продемонстрировал, что ХС статистически значимо превосходил плацебо по влиянию на боль в суставах при ОА. Авторы исследования The ChONdroitin versus CElecoxib versus Placebo Trial (CONCEPT) показали равную эффективность ХС в суточной дозе 800 мг и целекоксиба в дозе 200 мг/сут через 6 мес. приема препаратов при ОА коленных суставов по уменьшению боли и улучшению функции суставов [19].
По результатам недавно опубликованного метаанализа размер клинического эффекта ХС в отношении боли при ОА коленного сустава составлял -0,63 (95% ДИ -0,91, -0,35) при значительном уровне гетерогенности результата (I2=94%) [20]. Авторы обосновывают гетерогенность результатов включенных РКИ неоднородностью происхождения субстанций ХС, входящих в состав исследуемых препаратов. Так, исследования с эффективности препаратов, содержащих фармакопейную субстанцию, демонстрируют более выраженную клиническую эффективность в отношении параметров боли при ОА. Аналогичный вывод сделали и другие авторы РКИ, проводившие подобные исследования [21]. В другом метаанализе тоже было продемонстрировано более значимое влияние препарата на основе фармакопейной субстанции ХС (ХC: -4,3; контроль: -1,4; р=0,0349) по сравнению с другими ХС-содержащими препаратами на функцию суставов пациентов с ОА, оцененную по функциональному индексу Лекена [22]. Полученные данные исследователи объясняют тем, что фармацевтическая субстанция ХС обладает высокой степенью очистки и проходит необходимые этапы стандартизации и фармацевтического анализа в отличие субстанций различного происхождения, содержащих ХС [23, 24].
Симптоматический эффект ХС оценивается обычно через 6 мес. приема препарата, также есть данные о сохранении более длительного эффекта. Так, Kahan et al. (2009) показали, что различия в уменьшении боли по визуальной аналоговой шкале у лиц с ОА коленных суставов, получавших ХС и плацебо, были статистически значимыми между исходным уровнем и уровнем, измеренными на 39-й неделе исследования (p<0,001) [25]. Кроме этого, хорошо известно, что СПЗД обладают эффектом последействия, который может сохраняться в течение 2–3 мес., иногда и 4 мес. после прекращения приема препарата, поэтому в клинической практике для получения долгосрочного обезболивающего эффекта ХС и повышения комплаентности можно назначать курсовое применение препарата 1–2 раза в год. Но для получения структурно-модифицирующего эффекта длительность приема должна составлять не менее 2 лет, как показано в различных исследованиях, что обеспечивает замедление сужения суставной щели сустава, т. е. влияет на прогрессирование ОА коленного сустава [16].
Авторы нового системного метаанализа вновь продемонстрировали эффективность ХС в терапии боли при ОА. Как в отношении боли, так и в отношении функций суставов терапия ХС на протяжении 6 мес. оказалась наиболее эффективной интервенцией наряду с внутрисуставным введением стероидов, гиалуроновой кислоты и восполнением недостаточности или дефицита
витамина D [26].
Современная доказательная база эффективности парентеральной формы хондроитина сульфата в терапии ОА
В настоящее время представлена большая доказательная база эффективности препарата Хондрогард®. Инъекционная форма ХС имеет целый ряд преимуществ для стартового применения при обострениях хронической боли в суставах и спине при ОА. Это обусловлено более высокой скоростью достижения его максимальной концентрации в крови, прямо пропорционально концентрации ХС в синовиальной жидкости.
Проведенный фармакологический анализ препарата Хондрогард® и фармацевтический анализ его субстанции (CS-Bioactive© «Биоиберика С.А.У.», Испания) позволили сформулировать детальные молекулярные механизмы действия препарата при ОА с указанием соответствующих точек приложения воздействия активной субстанции [27]. Авторы отметили, что высокое качество стандартизации ХС очень важно при использовании лекарственных препаратов, содержащих ХС, у пациентов с различными коморбидными патологиями, например при атеросклерозе, патологии почек [28, 29].
В исследовании клинической эффективности препарата Хондрогард® Г.И. Гулиева (2015) показала, что применение повторных курсов терапии препаратом Хондрогард® в течение 1 года обладает высокой эффективностью в отношении клинических симптомов и рентгенологических признаков ОА [30]. Достоверные клинические различия в долях больных с рентгенологическим прогрессированием ОА в основной группе пациентов, получавших курсы терапии препаратом Хондрогард® по 20 инъекций каждые 6 мес., и в контрольной группе в разные сроки наблюдения (через 6, 12, 18 мес.) свидетельствуют о влиянии данного препарата на прогрессирование ОА, выявлена прямая зависимость эффективности Хондрогарда® от длительности его применения и стадии ОА. Оптимальным является назначение данного препарата на ранних рентгенологических стадиях развития ОА.
Терапия ХС показана не только на ранних, но и на более поздних стадиях развития ОА. Особенно это надо учитывать при эндопротезировании, когда после замены имплантатом пораженного тазобедренного или коленного сустава на одной ноге в первые 3–6 мес. на крупные суставы контралатеральной нижней конечности ложится повышенная функциональная нагрузка.
В исследовании Л.И. Алексеевой и соавт. (2013) продемонстрирован достоверный симптоматический эффект при применении препарата Хондрогард® у пациентов с ОА: уменьшение боли, скованности и улучшение функциональных показателей суставов [31]. Авторы рекомендуют инъекционный курс ХС, содержащегося в препарате Хондрогард®, лицам, страдающим ОА, в качестве первого средства с более быстрым наступлением эффекта, с последующим продолжением терапии пероральной формой ХС.
По результатам проведенного открытого клинического исследования доказана эффективность терапии первичного ОА крупных суставов препаратом Хондрогард® в качестве препарата, модифицирующего симптомы ОА [32]. Хондрогард® оказывает выраженное анальгезирующее действие, позволяет расширять функциональные возможности и улучшать качество жизни пациентов с ОА. Препарат обладает хорошей переносимостью в терапевтических дозах, нежелательные лекарственные реакции незначительны и не потребовали отмены. Данный препарат отличается наибольшим содержанием действующей субстанции (субстанция содержит 99,9% ХС на основе хрящей быка), которая имеет высокую степень очистки (наименьшие уровни содержания белка и токсических элементов), стандартизирована по распределению молекулярных масс ХС (15–17 кДа), сульфатированию ХС (60% хондроитин-4-сульфата и 30% хондроитин-6-сульфата) и показателю рН инъекционных растворов (высокое значение отношения Na:Cl) [33].
В клинических рекомендациях отмечен высокий уровень достоверности и убедительности рекомендаций применения ХС у пациентов с ОА (уровень убедительности рекомендации — А и уровень достоверности доказательств — 1). Важно также отметить, что в настоящее время препарат Хондрогард® — это единственное лекарственное средство из группы инъекционных SYSADOА в РФ, эффективность которого подтверждена собственным метаанализом. В данном метаанализе было показано, что внутримышечное применение препарата ХС с высокой степенью фармацевтической стандартизации (99,9% ХС) в составе комплексной терапии ОА способствует повышению эффективности терапии. При этом не происходит снижения безопасности терапии и не повышается риск появления побочных эффектов [22].
Следует отметить, что в современной отечественной научной литературе представлен целый ряд комплексных методик обезболивания неспецифической скелетно-мышечной патологии с использованием препарата Хондрогард®.
Исследователи показали, что внутрисуставное введение препарата Хондрогард® с последующим внутримышечным обладает достоверно большим анальгетическим эффектом в сравнении только с курсом внутримышечных инъекций данного препарата [6]. Авторы исследования отметили, что изучаемый препарат при любом способе введения (внутримышечный или комбинированный) быстро и эффективно уменьшает болевой синдром и скованность в суставах, улучшает функциональное состояние суставов и при этом остается безопасным лекарственным средством.
Другими авторами было показано, что комплексное использование низкоинтенсивного лазерного излучения и курса терапии препаратом Хондрогард® у пациентов с ОА и кардиоваскулярной патологией уменьшает болевой синдром в суставах, улучшает параметры АД, ЧСС в более короткие сроки, а также позволяет снизить курсовые дозы НПВП и минимизировать их побочные эффекты [34].
А.В. Наумов и соавт. (2018) показали бóльшую эффективность интермиттирующей схемы терапии ХС (Хондрогард® 2,0 № 20 через день) и ГС (Сустагард Артро 3,0 № 20 через день) в сравнении с традиционным лечением НПВП (в режиме «по потребности») при рецидиве хронической боли в суставах и спине у коморбидных больных [35]. Более выраженное снижение степени функциональной недостаточности суставов и улучшение качества жизни пациентов позволяют рекомендовать широкое внедрение в клиническую практику данного метода для терапии рецидивов хронической боли.
Использование парентеральных форм ХС при наличии абсолютных и относительных противопоказаний к применению НПВП
Ряд экспертов предполагает, что у пациентов с наличием абсолютных и относительных противопоказаний к применению НПВП актуальным является использование парентеральных форм препаратов из группы симптоматических медленнодействующих средств для обезболивания при ОА. Аргументы приведены в 2 недавно опубликованных метаанализах эффективности обезболивания при использовании ХС [20, 26]
и подтверждены данными метаанализа клинических исследований эффективности лечения ОА парентеральной формой ХС [22].
Первичный и вторичный остеоартрит крупных суставов: актуальные режимы применения хондроитина сульфата
В зависимости от этиологических факторов выделяют первичный, или идиопатический, и вторичный ОА крупных суставов конечностей, например тазобедренного [36]. При этом, согласно Норвежскому регистру эндопротезирования крупных суставов конечностей, пациенты с первичным ОА тазобедренного сустава составляют абсолютное большинство (72,7%) среди лиц, подвергшихся артропластике тазобедренного сустава [37].
Необходимо отметить, что вторичный ОА, как правило, является механоиндуцированным и обычно обусловлен дисконгруэнтностью суставных поверхностей в результате врожденной дисплазии суставов (диспластический ОА) или последствий травм (посттравматический ОА, ПТОА) [38].
Лечение вторичных форм ОА имеет ряд особенностей и требует участия в лечебном процессе травматологовортопедов, так как устранить механические причины прогрессирования заболевания в таких случаях, как правило, можно лишь посредством хирургических операций.
Известно, что при ПТОА борьба с болевым синдромом и сохранение суставного хряща (предотвращение его деградации) являются важнейшими задачами лечения. При этом, в первую очередь, следует устранять посредством хирургических вмешательств механические причины прогрессирования ПТОА: проводить удаление инородных тел и спаек из полости сустава (дебридмент), шлифовку (шейвирование) поверхности суставного хряща, промывание сустава с удалением вредных продуктов воспаления (лаваж), восстановление конгруэнтности суставных поверхностей посредством остеотомий или моделирующих резекций.
Далее следует восстанавливать и защищать суставной хрящ посредством длительного курсового применения ХП, среди которых наибольшей доказательной базой эффективности обладает ХС. При этом важно использовать официально зарегистрированные фармакологические препараты, а не биологические добавки без доказательной базы клинической эффективности. Известно также, что даже зарегистрированные в РФ лекарственные средства могут различаться по содержанию ХС в десятки раз, о чем свидетельствует недавно проведенное специальное исследование. Авторы сравнительного исследования 6 препаратов ХС, присутствующих на фармацевтическом рынке РФ, убедительно показали, что наибольшим содержанием ХС, а также наименьшими включениями токсичных микроэлементов и нежелательных белков в сравнивавшихся лекарственных средствах отличается экстракт, полученный из трахеи быка, — отечественный препарат ХС Хондрогард® [33].
При вторичных формах ОА, в частности при ПТОА, целесообразно также отдавать предпочтение парентеральным формам ХС, которые можно вводить внутрисуставно и/или внутримышечно ввиду их большей эффективности. Кроме того, парентеральные формы ХС, безусловно, предполагают большую степень приверженности пациентов лечению по сравнению с пероральными его формами, особенно при их использовании пациентами пожилого возраста.
При ПТОА внутрисуставное введение ХП имеет важное значение, так как позволяет достигать наиболее высокой полезной его концентрации именно в полости пораженного сустава. Последующий переход на внутримышечные инъекции обеспечивает защиту суставного хряща не только в пораженном суставе, но и на контралатеральной нижней конечности, что особенно важно в первые 3–6 мес. после оперативного лечения и перераспределения функциональной нагрузки с прооперированной ноги на суставы контралатеральной нижней конечности.
С учетом сказанного отечественный парентеральный препарат ХС Хондрогард® имеет важные преимущества при лечении вторичных ОА крупных суставов конечностей (ПТОА, диспластического ОА) перед другими ХП и их формами, представленными на фармацевтическом рынке РФ.
Хондроитина сульфат в клинических рекомендациях в РФ
Клинические рекомендации «Хроническая боль у пациентов пожилого и старческого возраста», одобренные научно-практическим советом Минздрава России, указывают на возможность использования ХС для лечения боли в суставах у пациентов старше 60 лет с уровнем убедительности рекомендации — А и уровнем достоверности доказательств — 1.
Целесообразность применения ХП при лечении пациентов с ОА отмечена также в проектах отечественных клинических рекомендаций «Коксартроз» и «Гонартроз», которые в настоящее время находятся на этапе экспертизы в Мин-
здраве России. При этом необходимо применять в клинической практике, прежде всего, ХС, обладающий наиболее солидной доказательной базой эффективности при ОА. Подходы к лечению ОА у различных групп пациентов представлены в таблице 1.
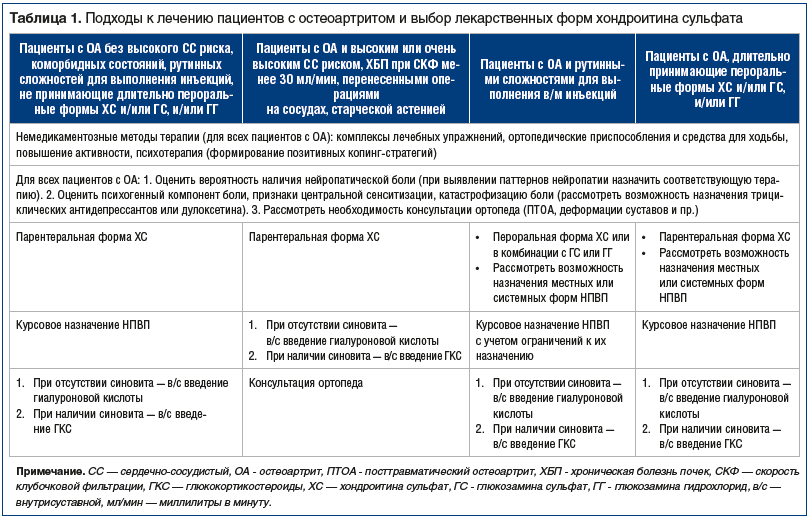
Способ применения: препарат Хондрогард® назначают внутримышечно по 100 мг через день. При хорошей переносимости дозу увеличивают до 200 мг начиная с 4-й инъекции. Курс лечения — 25–30 инъекций. При необходимости через 6 мес. возможно проведение повторного курса лечения. При ОА крупных суставов возможно сочетание внутрисуставного и внутримышечного способов введения. Проводят до 5 внутрисуставных инъекций 200 мг с перерывом 3 дня между введениями и 16 внутримышечных инъекций с перерывом 1 день между введениями (через день). В зависимости от размера сустава в суставную полость можно ввести до 2 мл препарата Хондрогард® [39].
Выводы
Совет экспертов постановил:
Парентеральная форма ХС для внутримышечного введения (препарат Хондрогард®) имеет целый ряд фармацевтических (наименьшее содержание токсических микроэлементов и следовые количества белка, необходимая молекулярно-весовая характеристика и количество сульфогрупп в экстракте, высокие значения соотношения Na:Cl) и клинических преимуществ для стартового применения при обострениях хронической боли в суставах и спине при ОА, в т. ч. у пациентов с сопутствующей патологией (ССЗ, заболевания почек и пр.).
Хондрогард® целесообразно использовать для лечения пациентов с ОА на всех стадиях развития этой патологии, но особенно важно применять его на ранних стадиях развития ОА и в первые 6 мес. после операций эндопротезирования тазобедренного или коленного сустава с целью защиты суставного хряща в условиях повышенной функциональной нагрузки на суставы контралатеральной нижней конечности.
Клиническая эффективность и безопасность применения препарата Хондрогард® , предназначенного для парентерального введения (раствор для внутримышечного введения 100 мг/мл), подтверждены метаанализом (уровень убедительности рекомендации — А, уровень достоверности доказательств — 1).
Парентеральная форма ХС (препарат Хондрогард®) показана к применению у пациентов с ОА, в т. ч. при наличии абсолютных и относительных противопоказаний к назначению НПВП.
У пациентов старше 60 лет с болью в суставах и противопоказаниями к применению НПВП или старческой астенией для купирования боли и профилактики обострения болевого синдрома целесообразно применение ХС в парентеральной форме (препарат Хондрогард®).
С учетом фармацевтической характеристики экстракта применение ХС в парентеральной форме для внутрисуставного и внутримышечного введения (препарат Хондрогард®) рекомендовано для лечения вторичных ОА крупных суставов конечностей
(посттравматический и диспластический ОА) на этапах оказания травматологической и реабилитационной медицинской помощи.
Таким образом, представленные в настоящем мультидисциплинарном Консенсусе экспертов результаты фармацевтических, доклинических и клинических исследований, описанных в релевантной научной литературе, позволяют заключить, что ХС в парентеральной лекарственной форме эффективен и безопасен для симптоматического и патогенетического лечения ОА. Согласованность научных оценок и длительный опыт клинического применения парентеральной формы ХС позволяют считать благоприятным соотношение возможной пользы и потенциального риска при клиническом применении данного лекарственного средства по зарегистрированным показаниям.
Благодарность
Редакция благодарит ЗАО «Фарм-Фирма «Сотекс» за помощь в обеспечении взаимодействия между авторами настоящей публикации.
.
Информация с rmj.ru






