Введение
Синдром поликистозных яичников (СПЯ) — одна из самых распространенных эндокринно-гинекологических патологий среди женщин репродуктивного возраста во всем мире [1–3], по данным некоторых исследований, достигающая в популяции 21% [4]. Для СПЯ характерны гетерогенные проявления, такие как гиперандрогения, нарушение овуляции и поликистозная трансформация яичников, а также метаболические нарушения: инсулинорезистентность (ИР) и ожирение. На сегодняшний день нет единой концепции патогенеза данного заболевания. Согласно проведенным исследованиям в развитии СПЯ и нарушении функции яичников принимают участие многие факторы, основными из которых являются генетическая предрасположенность, эпигенетические изменения, факторы окружающей среды, окислительный стресс, хроническое слабовыраженное воспаление, митохондриальная дисфункция и метаболические нарушения [5]. Такие состояния, как гиперинсулинемия (ГИ) и ИР (выявляющиеся у 65–95% пациенток с СПЯ), позволяют ввести еще одну концепцию, уместно обозначенную как «парадокс яичников» [5]. Действительно, поскольку яичники остаются чувствительными к инсулиновому сигналу, ГИ из-за системной ИР может способствовать повышению секреции андрогенов и приводить к овуляторной дисфункции [6].
На сегодняшний день существует 4 общепризнанных фенотипа СПЯ: тип А — поликистоз яичников (ПЯ), хроническая олигоановуляция (ОА) и гиперандрогения (ГА); тип В — ОА и ГА; тип С — ПЯ и ГА; тип D — ПЯ и ОА [5]. ИР может присутствовать во всех фенотипах, но ее частота варьирует в зависимости от фенотипа СПЯ. Чаще всего, в 80% случаев, ИР встречается при наиболее распространенных классических фенотипах СПЯ (типы А и В), в 65% случаев — при овулирующем фенотипе СПЯ и реже всего (в 38% случаев) ИР выявляется при СПЯ яичникового генеза (табл. 1) [6]. Исходя из вышесказанного, название «синдром поликистозных яичников», строго говоря, уместно только в применении к фенотипу D, в то время как остальные фенотипы должны быть обозначены как различные типы эндокринно-метаболического синдрома (ЭМС).
![Таблица 1. Инновационная классификация СПЯ (по материалам V. Unfer et al. [6]) Table 1. Innovative classification of PCOS (based on V. Unfer et al. [6]) Таблица 1. Инновационная классификация СПЯ (по материалам V. Unfer et al. [6]) Table 1. Innovative classification of PCOS (based on V. Unfer et al. [6])](https://medblog.su/wp-content/uploads/2025/01/Maski-sindroma-polikistoza-yaichnikov-rol-inozitolov-Dub-NV-Kruchinina.png)
Как видно из таблицы 1, СПЯ фенотипа A, B и C могут быть ЭМС с метаболическим клиническим началом. Фенотип D не имеет гиперандрогенных признаков и демонстрирует более низкую частоту метаболических и эндокринных проблем. Поэтому его можно описать как единственный подтип с исключительно яичниковым патогенезом. В зависимости от фенотипов может быть применено то или иное лечение [6, 7]. Таким образом, когда говорят о рисках СПЯ, подразумевают риски для разных фенотипов СПЯ.
По данным F. Chiaffarino et al. [8], частота фенотипа А — самая высокая и составляет 44,8% от всех фенотипов СПЯ, фенотип B встречается в 14,9% случаев, фенотип С — в 16,2% случаев и фенотип D — в 19,5% случаев [7].
Женщины с СПЯ и ИР имеют значительно повышенный риск неблагоприятных исходов беременности [7] и хронических заболеваний, таких как сахарный диабет 2 типа (СД2), сердечно-сосудистые заболевания и метаболический синдром, которые серьезно влияют на физическое и психическое здоровье женщин детородного возраста [7]. Инсулиносентитайзеры могут применяться при фенотипах А, B и С и быть менее эффективными при фенотипе D [6, 7]. К инсулиносентитайзерам относят, прежде всего, метформин, включенный в российские и зарубежные рекомендации по лечению СПЯ1 [9]. Однако применение метформина может быть ограничено побочными эффектами со стороны желудочно-кишечного тракта, а при длительном приеме больших доз возникает дефицит витамина B12 [10].
В настоящее время все большую популярность приобретают натуральные молекулы и биологически активные добавки (БАД), многие пациентки делают выбор в пользу негормональных и натуральных препаратов. На сегодняшний день накопилось огромное количество исследований, доказывающих эффективность инозитолов, α-липоевой кислоты (АЛК), фолиевой кислоты, витамина D в отношении улучшения метаболизма углеводов и жиров [11, 12].
Недавно обнародованный метаанализ исследований 2023 г. продемонстрировал, что инозитолы не уступают в эффективности метформину при минимальном количестве побочных эффектов [13]. Инозитолы включены в международные рекомендации 2023 г. в качестве рекомендованной терапии при СПЯ [9].
Инозитол представляет собой соединение девяти форм сахарных спиртов, из которых мио-инозитол (МИ) и D-хиро-инозитол (ДХИ) являются наиболее распространенными формами, присутствующими в организме человека и играющими важную биологическую роль в опосредовании различных эффектов инсулина. Несколько исследований подтвердили, что он обладает превосходной эффективностью в сенсибилизации инсулина у женщин с СПЯ и способствует овуляции. Учитывая, что введение инозитола безопасно и эффективно для улучшения репродуктивной функции и метаболизма у пациенток с СПЯ, его можно использовать не только для лечения бесплодных и субфертильных женщин на этапе планирования беременности и прегравидарной подготовки, но и в качестве профилактического лечения во время беременности. Правильное применение подходящей пропорции МИ с ДХИ улучшает состояние органов и тканей, в то время как длительная высокодозная монотерапия ДХИ у женщин с СПЯ оказывает отрицательное воздействие. Последние исследования показали, что наилучшее соотношение инозитолов в отношении восстановления метаболических и гормональных параметров, а также менструального цикла и овуляции — это МИ/ДХИ 40:1 [14]. Соотношение МИ и ДХИ варьирует в зависимости от метаболических потребностей ткани и находится под строгим контролем инсулина. В плазме крови соотношение МИ/ДХИ составляет 40:1, тогда как в фолликулярной жидкости — 100:1. У женщин с СПЯ и ИР концентрация ДХИ в чувствительных к инсулину тканях (мышцы, мозг, сердце, жировая ткань) резко снижается, что может быть обусловлено как недостатком общего потребления инозитола, так и нарушением экспрессии/синтеза эпимеразы, конвертирующей МИ в ДХИ. Яичники, наоборот, на избыток инсулина отвечают чрезмерной эпимеризацией МИ в ДХИ и снижением соотношения МИ/ДХИ в фолликулярной жидкости до 0,2:1.
Регуляция метаболизма глюкозы происходит независимо от инозитола, путем воздействия эндогенной АЛК, синтезируемой в митохондриях [14]. АЛК и омега-3 жирные кислоты — вещества, улучшающие чувствительность к липидам и инсулину у женщин благодаря своим противовоспалительным и антиоксидантным свойствам, хотя омега-3 жирные кислоты содержат много калорий [5]. АЛК способна уменьшать ГИ у женщин с ожирением, приводя к снижению массы тела, ИР, улучшению показателей липидного и углеводного обмена [14, 15].
Докозагексаеновая кислота (ДГК) — полиненасыщенная жирная кислота, относящаяся к семейству омега-3, играет незаменимую роль в организме человека, уменьшает уровни холестерина (Хс) и липопротеинов низкой плотности (ЛПНП), улучшает жировой обмен у женщин с СПЯ [5].
Фолиевая кислота играет важную роль в женской репродукции и профилактике СД2. Исследование, проведенное в 2019 г. [15], показало, что использование фолиевой кислоты значительно снижает уровень инсулина и гомоцистеина, который коррелирует с уровнем инсулина натощак и индексом HOMA-IR. Таким образом, назначение фолатов пациенткам с СПЯ способствует снижению риска развития СД2 и других нарушений углеводного обмена [15–17].
Витамин D действует как мощный антиоксидант, и его терапевтический эффект связан с подавлением воспаления и окислительного стресса, а также со снижением секреции инсулина. В настоящее время имеется большое количество исследований, показавших эффективность витамина D в снижении ИР у больных с СПЯ2.
Витамин Е (D-α-токоферол) — природный антиоксидант, обладает антиоксидантной активностью в отношении ДГК. Он может улучшить ИР и уровень сывороточного глобулина, связывающего половые гормоны (ГСПГ) при СПЯ [5].
Добавки с пробиотиками, пребиотиками и синбиотиками у женщин с СПЯ также могут улучшить ИР, защитить кишечный барьер и регулировать иммунную систему, липидный профиль и другие метаболические процессы [5]. Недавние исследования также показали, что диета с высоким содержанием клетчатки, включая цельное зерно и пребиотики в сочетании с ингибитором α-глюкозидазы акарбозой, улучшала репродуктивные эндокринные расстройства, ГИ и ИР у женщин с СПЯ по сравнению с диетой, включающей только высокое содержание клетчатки [5].
Особенности течения СПЯ и метаболического синдрома
Если вовремя не корригировать ИР и не менять образ жизни пациенток с СПЯ в сторону гипокалорийной диеты и физических нагрузок, ИР приводит к развитию метаболического синдрома (МС) у молодых женщин и к его кардиометаболическим осложнениям. Нарушение овуляции может привести к бесплодию у женщин при СПЯ, иногда беременность может наступить при приеме комплексов нутриентов на этапе прегравидарной подготовки или даже без лечения, но СПЯ ассоциируется со множеством факторов, которые повышают риск развития осложнений при беременности, включая гестационный сахарный диабет и МС с гипертонией, что увеличивает вероятность преэклампсии и отслойки плаценты и макросомии плода2. Женщины с СПЯ в большей степени подвержены развитию гипергомоцистеинемии по сравнению со здоровыми, что способствует нарушению овуляции и может приводить к прерыванию беременности [17]. МС также связан с дефектами овуляции, зачатия, осложнениями беременности. На фоне МС увеличиваются потери беременности и уменьшается количество живорожденных детей, что указывает на то, что эти два состояния приводят к дефектам на различных репродуктивных стадиях [18].
Все вышеперечисленное делает особенно важным планирование беременности и прегравидарную подготовку у женщин с СПЯ.
Согласно клиническому протоколу прегравидарной подготовки МАРС 2024 г.2 снижение фертильности при СПЯ обусловлено нарушением овуляторной функции, а 40% беременностей заканчиваются самопроизвольным прерыванием. Недопустимо выполнять индукцию овуляции у пациенток с СПЯ до коррекции ожирения и метаболических нарушений. У пациенток с СПЯ дефицит витамина D — дополнительный фактор риска ИР, поэтому пациенткам назначают витамин D на этапе прегравидарной подготовки. Своевременно корригируя массу тела и устраняя обменные нарушения, можно снизить риск пороков развития, гестационного сахарного диабета, замершей беременности и самопроизвольного аборта, тромбоэмболии, преэклампсии и эклампсии, макросомии, задержки развития плода, родовых травм, асфиксии и гибели плода/ребенка. Метаанализ 30 исследований показал, что более низкие уровни витамина D в сыворотке крови были связаны с метаболическими и гормональными нарушениями у женщин с СПЯ. В частности, у пациенток с СПЯ и дефицитом витамина D чаще наблюдались ИР, более высокий индекс ИР (HOMA-IR) и нарушения липидного обмена по сравнению с пациентками без дефицита витамина D [19–21].
Модификация образа жизни при СПЯ и эффективная дотация диеты в виде микронутриентов стимулируют собственные резервы пациенток и нормализуют метаболический и гормональный статус при СПЯ. Кроме инозитолов, важен вклад витамина D, фолиевой кислоты, марганца, АЛК, омега-3 жирных кислот,, витамина Е, йодида калия в коррекцию метаболических и гормональных нарушений у пациенток с СПЯ.
Поиск препаратов для лечения СПЯ привел к разработке средств, содержащих инозитолы (МИ и ДХИ), АЛК, фолиевую кислоту, витамин D3 и марганец. В России разработана БАД Дифертон, лекарственная форма таблетки, которая представляет собой комбинацию инозитолов (МИ и ДХИ) в суточной дозировке 1,127 г, 75 мг АЛК, 600 мкг фолиевой кислоты, 10 мкг витамина D3 и 5 мг марганца, применяемую у женщин с СПЯ, а также при нарушенной чувствительности к инсулину и МС3. Результаты исследования M. Le Donne et al. [22] показали, что продукт, содержащий 1 г МИ/ДХИ 40:1 и фолиевую кислоту, привел к уменьшению ИМТ, окружности талии и восстановлению менструального цикла и овуляции.
В данной статье публикуются результаты сравнительного наблюдения двух групп женщин с СПЯ, принимавших Дифертон или комплекс нутриентов, содержащий рыбий жир, витамин Е, витамин D, йод, фолиевую кислоту, для подготовки к беременности.
Выбор для наблюдательного исследования поливитаминного комплекса, содержащего ДГК, витамин D3, фолиевую кислоту, витамин Е, йодид калия, также не случаен, так как все указанные компоненты улучшают репродуктивную систему и овуляторную функцию женщин, в том числе с СПЯ. У авторов данной статьи имеется значительный опыт применения данного поливитаминного комплекса у женщин, готовящихся к беременности. Комплекс разработан специально для обеспечения организма женщины в период подготовки к зачатию, беременности и лактации только самыми необходимыми компонентами в физиологически необходимых дозах. Дозы нутриентов комплекса: в 1 капсуле 400 мкг фолиевой кислоты, 5 мкг витамина D3, 150 мкг йода, 200 мг ДГК и 12 мг витамина Е.
При сравнении двух групп авторами оценивался вклад МИ/ДХИ и АЛК в восстановление репродуктивной функции, а также влияние на гормональные и метаболические параметры женщин с СПЯ.
Целью наблюдательного исследования явилась оценка влияния МИ и ДХИ в соотношении 40:1 в сочетании с АЛК (БАД Дифертон) на эндокринно-метаболические параметры, длительность менструального цикла и частоту наступления беременности при применении у женщин с СПЯ в течение 180 дней, в сравнении с базовым комплексом нутриентов (ДГК, витамин D3, фолиевая кислота, витамин Е, йодид калия), при планировании беременности.
Задачи исследования:
-
Оценить влияние комбинации МИ/ДХИ 40:1 и АЛК на ИМТ, массу тела, метаболические факторы: концентрации ЛПНП и ЛПВП, общего Хс, глюкозы, инсулина, индекса HOMA-IR.
-
Оценить гормональный статус пациенток, включенных в исследование: концентрацию лютеинизирующего гормона (ЛГ), фолликулостимулирующего гормона (ФСГ), эстрадиола, прогестерона, общего тестостерона, 17-оксипрогестерона, ГСПГ, пролактина, тиреотропного гормона (ТТГ).
-
Оценить эффективность применения БАД Дифертон в отношении регуляции менструального цикла, восстановления овуляции.
-
Оценить частоту наступления беременности в сравнении с базовым комплексом микронутриентов, принимаемых при планировании беременности у пациенток с СПЯ.
-
Сравнить по группам частоту развития и тяжесть нежелательных явлений (НЯ).
Содержание статьи
Материал и методы
В наблюдательное исследование, проведенное на базе клиники «Доктор Алексеева», включены 50 жительниц Московской области с верифицированным диагнозом СПЯ (фенотип А, В, С). Все пациентки разделены на 2 группы. В соответствии с рандомизацией в течение 180 дней 30 женщин (1-я группа) принимали Дифертон по 1 таблетке 2 р/сут во время еды и 20 женщин (2-я группа, контроль) — по 1 капсуле базового комплекса нутриентов, применяемого при планировании беременности (ДГК, витамин D3, фолиевая кислота, витамин Е, йодид калия). Перед включением в исследование все пациентки подписали добровольное информированное согласие.
Критерии включения: женщины в возрасте от 18 до 35 лет включительно, планировавшие беременность; СПЯ (фенотипы А, В, C) по данным УЗИ и/или клиническим, лабораторным признакам — ГА и наличие олигоменореи; избыток массы тела или ожирение (ИМТ>25 кг/м2 и <40 кг/м2, за исключением морбидного ожирения); отрицательный тест на беременность у пациенток с сохраненным репродуктивным потенциалом; отсутствие приема гормональных препаратов, гормональных контрацептивов в течение 3 мес.; понимание протокола и согласие следовать его требованиям.
Критерии невключения: возраст до 18 лет и старше 35 лет; беременность; прием оральных контрацептивов и гормональных препаратов на протяжении меньше 3 мес. до включения в исследование; СПЯ фенотипа D без ГА и ИР (яичникового генеза); любое оперативное вмешательство на матке и яичниках; мужской фактор бесплодия у партнера; маточные факторы бесплодия (тонкий эндометрий, эндометрит, синехии); пролиферативные заболевания матки и яичников; ИМТ>40 кг/м2; индивидуальная непереносимость компонентов БАД, применявшихся в наблюдении, в анамнезе; наличие сведений об алкоголизме, наркомании или лекарственной зависимости в анамнезе в течение двух лет до включения в исследование; участие в любых клинических исследованиях лекарственных препаратов менее чем за 90 дней до начала исследования; прием БАД, витаминно-минеральных комплексов или препаратов, содержащих инозитол (МИ и/или ДХИ), АЛК, фолиевую кислоту, витамин D3 или марганец, менее чем за 30 дней до скрининга.
На этапе скрининга проводился сбор анамнеза (перенесенные и сопутствующие заболевания, данные о возможных вредных факторах (профессиональных, употребление алкоголя, курение), предшествующей терапии, включая БАД и витаминно-минеральные комплексы), демографические и антропометрические данные (рост, масса тела, ИМТ), физикальный осмотр, УЗИ органов малого таза, анализ крови на содержание гормонов, тест мочи на беременность и оценка критериев включения/невключения.
На последующих визитах через 3 и 6 мес. оценивали показатели липидного профиля (общий Хс, ЛПВП, ЛПНП), уровня глюкозы, инсулина, индекса НОМА, гормональный статус (ЛГ, ФСГ, соотношение ЛГ/ФСГ, эстрадиол, пролактин, ТТГ, общий тестостерон, 17-ОН-прогестерон, ГСПГ) в плазме натощак, а также менструальную функцию, ИМТ, массу тела и окружность талии (ОТ). У всех пациенток оценивали побочные эффекты и НЯ.
Статистическую обработку результатов исследования проводили с использованием методов параметрического анализа. Для накопления, корректировки, систематизации исходной информации и фиксации полученных результатов применяли электронные таблицы Microsoft Office Excel. Статистический анализ проводили с использованием программы Statistica 13.3 (StatSoft. Inc, США). С помощью теста Колмогорова — Смирнова установлено нормальное распределение данных. Количественные показатели были представлены как среднее арифметическое и стандартное отклонение (M±SD). Критерием статистической значимости различий приняты значения: p<0,05, p<0,01.
Результаты исследования
Исходно группы были сопоставимы по изучаемым показателям. Средний возраст пациенток составил 28±2,6 года.
При оценке соматического анамнеза в 4% случаев в обеих группах встречалась патология зрения и в 8% — хронический гастрит в стадии ремиссии. В 28% случаев пациентки обеих групп в анамнезе имели опыт применения оральных контрацептивов (КОК) длительностью до 12 мес. с целью контрацепции. За 6 мес. до включения в исследование прием КОК был исключен. В 1-й группе 10% пациенток и во 2-й группе 5% пациенток в анамнезе имели одни срочные самопроизвольные роды.
При оценке гинекологической патологии у 15% пациенток обеих групп встречался предменструальный синдром, у 3% — хронический цервицит, другая гинекологическая патология отсутствовала. Нарушения менструального цикла в виде олигоменореи были выявлены у пациенток 1-й группы в 80% случаев, у 20% был регулярный цикл, что соответствовало фенотипу С СПЯ. Среди пациенток 2-й группы у 75% наблюдалась олигоменорея, у 25% был регулярный цикл, что также соответствовало овуляторной форме СПЯ.
На основании проведенного дообследования, согласно действующим клиническим рекомендациям1, пациенткам был установлен диагноз СПЯ и инициирована терапия.
На момент включения в исследование и на протяжении наблюдения за пациентками прием антидепрессантов, нейролептиков был исключен.
При оценке пищевого поведения среди пациенток 1-й группы отмечено эмоциональное пищевое поведение в 9% случаев, среди пациенток 2-й группы — у 4% экстернальное пищевое поведение, у остальных нарушений пищевого поведения не выявлено.
При оценке физической активности в 1-й группе имела место физическая активность до 2 раз в неделю у 7% пациенток, во 2-й группе у 4% — от 1 до 2 раз в неделю, что свидетельствовало о снижении физической активности женщин.
Средняя продолжительность сна у пациенток обеих групп составила 6±1,5 ч.
При анализе шкалы FINDRISK, включающей 9 вопросов для оценки степени риска СД2, среди пациенток 1-й группы у 2% получен результат, равный 10 баллам, что соответствует немного повышенному риску развития СД2, у пациенток 2-й группы в 1% случаев — результат 7 баллов, что также соответствует немного повышенному риску. Всем пациенткам даны рекомендации по модификации образа жизни. При избыточной массе тела были показаны нормализация веса, гипокалорийная диета и физические нагрузки согласно действующим рекомендациям.
При оценке по шкале Ферримана — Галвея в обеих группах на этапе скрининга средний балл составил 7±1,3, что говорит о несколько повышенном оволосении пациенток (норма от 0 до 7 баллов).
При УЗИ органов малого таза исходно объем яичников у пациенток обеих групп с фенотипами А и C СПЯ составил более 12,3±1,57 см3 и в структуре яичников более 20 фолликулов до 4–8 мм. У женщин обеих групп с фенотипом В при УЗИ органов малого таза исходно объем яичников составил 8,4±1,36 см3 и в структуре яичников 7–8 фолликулов до 5–6 мм.
По результатам исследования установлено, что в 1-й группе пациенток применение Дифертона способствовало достоверному снижению уровня общего Хс на 15% через 3 мес. и на 16,5% через 6 мес., ЛПНП на 14% через 3 мес. и на 17,5% через 6 мес. и увеличению уровня ЛПВП на 34,5% через 3 мес. и на 31% через 6 мес. Во 2-й группе также отмечены изменения указанных параметров, однако изменения эти не были статистически значимыми (табл. 2). Также у пациенток 1-й группы было отмечено снижение уровня глюкозы натощак на 12% через 3 мес. и на 18% через 6 мес. (p<0,01); через 3 мес. снизился уровень инсулина на 22% и через 6 мес. на 31,4%. Индекс HOMA-IR через 3 мес. снизился на 28,5% и через 6 мес. на 38%, результаты у всех женщин 1-й группы достигли нормальных значений.
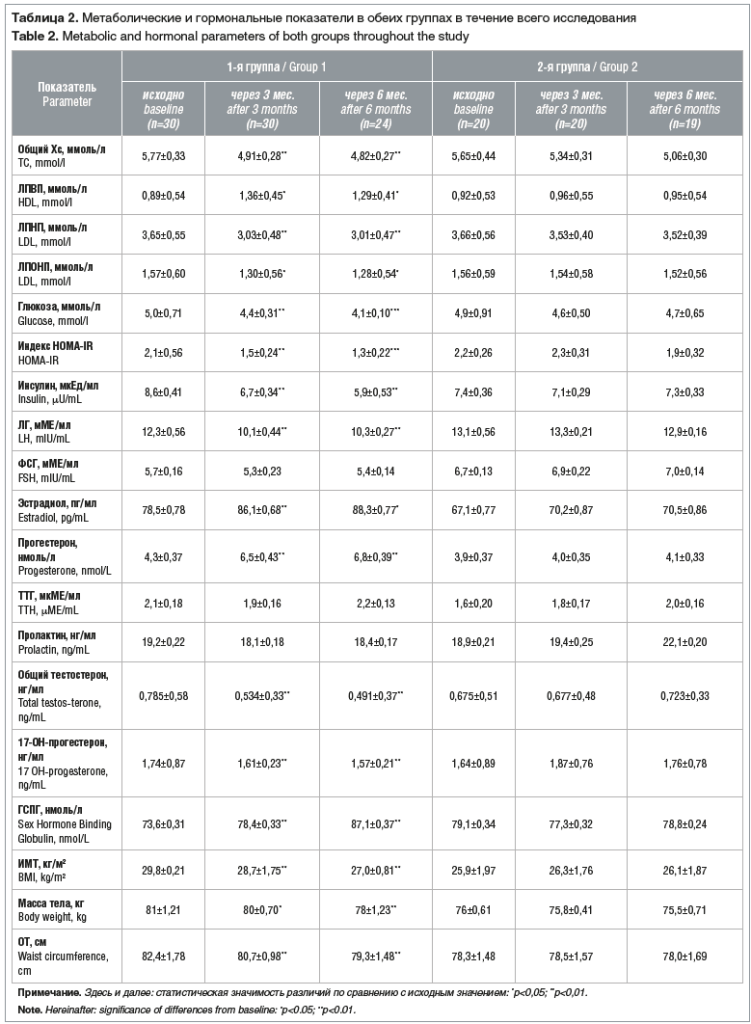
У пациенток 1-й группы достоверно снизился уровень общего тестостерона на 32% через 3 мес. и на 37% через 6 мес., тогда как во 2-й группе статистически значимого уменьшения данных показателей не было выявлено. В 1-й группе уровень 17-ОН-прогестерона также снизился на 7,5% через 3 мес. и на 7,64% через 6 мес; уровень ЛГ снизился на 17,8% через 3 мес. и на 16,2% через 6 мес.
Пациентки 1-й группы похудели в среднем на 3±1,19 кг за 6 мес. (на 1,23% через 3 мес. и на 3,7% через 6 мес.), ОТ в среднем уменьшилась на 3,1±1,5 см, ИМТ через 3 мес. уменьшился на 3,7% и через 6 мес. на 9,39%, тогда как во 2-й группе пациентки практически не похудели и ОТ изменилась незначительно.
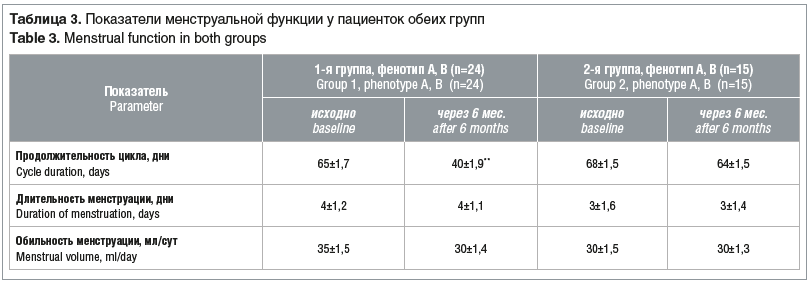
У 6 пациенток 1-й группы с фенотипом С средняя продолжительность менструального цикла составила 25±4 дня. У 5 пациенток 2-й группы с фенотипом С этот показатель составил 24±6 дней. В процессе наблюдения за пациентками через 3 мес. значимых изменений не было выявлено по сравнению с исходными данными. Через 6 мес. в 1-й группе отмечено статистически значимое укорочение менструального цикла почти до нормальных значений (согласно российским рекомендациям4 олигоменорею определяют как менее 9 менструаций в год, что в среднем соответствует продолжительности цикла от 40,5 дня и более), в то время как во 2-й группе аналогичных изменений не отмечено (табл. 3).
У 6 пациенток с фенотипом С между 3 и 6 мес. наблюдения наступила спонтанная беременность в 1-й группе и у 1 пациентки во 2-й группе. Пациентки, которые забеременели, досрочно закончили исследование и не сдавали анализы на метаболические и гормональные показатели через 6 мес. наблюдения.
У пациенток 1-й группы снижение биохимических признаков ГА сопровождалось уменьшением клинических признаков через 6 мес. в виде уменьшения сальности волос, кожи лица и снижения проявлений акне. Степень оволосения по шкале Ферримана — Галвея не изменилась. Согласно действующим клиническим рекомендациям по СПЯ1 пациенткам для коррекции гирсутизма были рекомендованы косметологические процедуры.
Нежелательных явлений в течение всего периода наблюдения у пациенток обеих групп не выявлено.
Обсуждение
Результаты, полученные в нашем наблюдении, соответствуют данным зарубежных и отечественных исследований.
Согласно работе Ю.Э. Доброхотовой и соавт. [23], изучавших женщин с ожирением и МС, принимавших МИ/ДХИ 5:1 дополнительно к КОК для уменьшения ИР и профилактики кардиометаболических осложнений, были получены данные об улучшении углеводного и жирового обмена у женщин с ожирением в группе с МИ/ДХИ. В 1-й группе на фоне лечения через 6 мес. наблюдалось снижение ИМТ на 9,1%, уменьшение ОТ на 4,5%, что коррелирует с нашими данными. Также в данной работе отмечено улучшение показателей липидограммы: снижение Хс на 16,9%, ЛПНП на 17,8% и увеличение ЛПВП на 28,5%, снизилась концентрация глюкозы крови натощак на 16,9%. Изучаемая нами БАД не уступает по влиянию на метаболические показатели препарату МИ/ДХИ 5:1, но в отличие от него МИ/ДХИ 40:1 оказывает выраженное влияние на восстановление менструального цикла и овуляции [24], что было подтверждено в нашем исследовании.
Также интересны данные профессора Г.И. Чернухи и соавт. [25], изучавших прием МИ в наблюдательном исследовании у 140 пациенток в течение 6 мес. Средний ИМТ до начала терапии составил 23,2 кг/м2, что говорит о нормальной массе тела. У 51 пациентки из этого исследования оценивали состав тела с помощью двухэнергетической рентгеновской абсорбциометрии: у 65% пациенток был выявлен избыточный висцеральный жир, несмотря на нормальную массу тела. В процессе лечения через 6 мес. частота скрытого ожирения уменьшилась почти вдвое и составила 39%. Скрытое ожирение диагностировалось по увеличению процентного содержания жировой ткани >30%. Косвенно об уменьшении скрытого ожирения свидетельствовало уменьшение массы тела на 4,8 кг через 6 мес.
Подобно другим исследованиям [25] в нашем исследовании было отмечено уменьшение уровня общего тестостерона и 17-ОH-прогестерона, сопровождавшееся повышением синтеза ГСПГ через 3 мес. на 6,5% и на 18,2% через 6 мес. Это может быть связано с уменьшением количества висцерального жира (о чем косвенно свидетельствует уменьшение ОТ и массы тела) и снижением уровня инсулина, которые оказывают ингибирующее действие на выработку ГСПГ.
В зарубежных и отечественных исследованиях имеется много данных относительно регуляции менструального цикла при СПЯ. В нашем исследовании в течение 6 мес. произошло укорочение менструального цикла у 24 человек, принимавших Дифертон, от 65 до 40±1,9 дня (p<0,01). Мы считаем, что для регуляции цикла данную БАД нужно принимать дольше, до 9–12 мес.
При анализе доступной литературы мы нашли более 10 тыс. зарубежных исследований с инозитолами, в том числе содержащими АЛК. В исследуемой БАД содержится АЛК, усиливающая чувствительность клеток к инсулину через фермент Lasy, что вместе с инозитолами, повышающими активность эпимеразы, обеспечивает двойной механизм усиления чувствительности к инсулину.
В работах изучалось также влияние на метаболические и гормональные параметры, восстановление менструального цикла и овуляции. Эти многочисленные публикации позволили включить инозитолы в международные рекомендации по лечению СПЯ в качестве рекомендованной терапии. В то же время терапия, направленная на лечение бесплодия с использованием инозитолов, пока является экспериментальной. Есть несколько зарубежных [26] и отечественных [25] публикаций на эту тему. В метаанализе J. Pundir et al. [26] говорится об увеличении частоты наступления беременности в 3,3 раза. А в исследовании профессора Г.Е. Чернухи и соавт. [25] беременность наступила у каждой 5-й пациентки из тех, кто был в ней заинтересован. В нашем исследовании все 50 женщин готовились к беременности, и между 3 и 6 мес. наблюдения беременность наступила у 6 пациенток в группе МИ/ДХИ 40:1 и у 1 пациентки при приеме базового нутриентного комплекса. Не менее важно, что курс лечения изученной БАД получается более экономичным по сравнению с импортными инозитолами, что дает возможность увеличить комплаентность и пройти курс лечения полностью. Также Дифертон является единственным продуктом в России, содержащим инозитолы и АЛК, которая особенно важна для пациенток с наследственной предрасположенностью к СД2, когда реализуется двойной механизм повышения чувствительности к инсулину.
У авторов данного исследования не было цели прямого сравнения разных направлений лечения, а только проспективное наблюдение для оценки применения БАД Дифертон у пациенток с СПЯ. Учитывая выявленное положительное влияние данной БАД, будет планироваться проведение дальнейшего исследования на большей выборке с проведением межгруппового сравнения.
Заключение
Синдром поликистозных яичников, многоликий в своих клинических проявлениях и сложный в диагностике, требует пожизненного внимания со стороны акушеров-гинекологов к состоянию репродуктивного здоровья женщин и профилактике кардиометаболических осложнений.
Комплекс МИ/ДХИ в сочетании с АЛК целесообразно использовать у пациенток с ИР с целью повышения их чувствительности к инсулину. Ежедневное потребление МИ и ДХИ в сочетании с АЛК в течение 3–6 мес. оказывает существенное влияние на МС.
Клиническое использование Дифертона у пациенток с СПЯ является новой, интегративной стратегией вне зависимости от репродуктивных планов. Изученное средство, обладая высокой метаболической активностью, способствует улучшению параметров липидного профиля, углеводного обмена, а также снижению массы тела и уменьшению ОТ. У женщин, планирующих беременность, применение Дифертона способствует увеличению частоты наступления беременности. Для подтверждения полученных результатов и дополнительной оценки свойств инозитолов планируется проведение дальнейших, более масштабных исследований.
1Министерство здравоохранения Российской Федерации. Клинические рекомендации. Синдром поликистозных яичников. 2021.
2Прегравидарная подготовка. Клинический протокол Междисциплинарной ассоциации специалистов репродуктивной медицины (МАРС). Версия 3.1. М.: Редакция журнала StatusPraesens, 2024.
3Регистр лекарственных средств России. Дифертон. Инструкция к биологически активной добавке к пище. 2021. (Электронный ресурс.) URL: https: // www.rlsnet.ru/-86033 (дата обращения: 15.04.2024).
4Министерство здравоохранения Российской Федерации. Клинические рекомендации «Аменорея. Олигоменорея», 2021.
СВЕДЕНИЯ ОБ АВТОРАХ:
Дуб Надежда Валентиновна — к.м.н., врач акушер-гинеколог, врач УЗД ООО «Клиника Доктор Алексеева»; 141090, Россия, г. Королев, мкр-н Болшево, ул. Пушкинская, д. 21; ORCID iD 0000-0001-7678-5674.
Кручинина Елена Владимировна — к.м.н., врач акушер-гинеколог ООО «Клиника Доктор Алексеева»; 141090, Россия, г. Королев, мкр-н Болшево, ул. Пушкинская, д. 21; ORCID iD 0000-0002-3628-0863.
Контактная информация: Кручинина Елена Владимировна, е-mail: kruchinina.elena@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 02.06.2024.
Поступила после рецензирования 25.06.2024.
Принята в печать 18.07.2024.
ABOUT THE AUTHORS:
Nadezhda V. Dub — C. Sc. (Med.), obstetrician and gynecologist, LLC «Dr. Alexeeva Clinic»; 21, Pushkinskaya str., Korolev, 141090, Russian Federation; ORCID iD 0000-0001-7678-5674.
Elena V. Kruchinina — C. Sc. (Med.), obstetrician and gynecologist, LLC «Dr. Alexeeva Clinic»; 21, Pushkinskaya str., Korolev, 141090, Russian Federation; ORCID iD 0000-0002-3628-0863.
Contact information: Elena V. Kruchinina, е-mail: kruchinina.elena@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 02.06.2024.
Revised 25.06.2024.
Accepted 18.07.2024.
Информация с rmj.ru