Введение
На сегодняшний день в мире широко распространены заболевания суставно-мышечной системы, что в значительной степени обусловлено трудностями ранней диагностики данной группы заболеваний, ограниченной эффективностью имеющихся в распоряжении клиницистов методов лечения и профилактики данных состояний [1]. Среди разнообразных суставно-мышечных болевых синдромов одной из наиболее распространенных форм является поражение суставов и мягких тканей позвоночника — дорсалгия [2]. Исключительная распространенность данных патологических состояний, значительные материальные затраты на ведение пациентов требуют поиска новых решений для повышения эффективности лечебно-профилактических мероприятий и снижения бремени заболевания.
Результаты исследований последних лет позволили установить тесную связь таких болевых синдромов с остеоартритом (ОА). В частности, показана связь ОА дугоотростчатых суставов, дегенеративного поражения межпозвонковых дисков с наличием болевого синдрома [3, 4]. В основе болевого синдрома у таких больных лежит воспаление, которое в значительной степени соответствует выраженности структурных изменений позвоночного двигательного сегмента [5, 6]. Понимание роли воспалительного процесса низкой интенсивности расширяет возможности для выбора патогенетической терапии таких пациентов.
В этой связи значительный интерес вызывает группа препаратов, обладающих способностью изменять течение заболевания. Такие препараты длительное время рассматривались как хондропротекторы, позволяющие замедлить дегенерацию хрящевой ткани суставов и, вероятно, способствовать ее регенерации.
Исследования последних лет позволили установить целый ряд ранее неизвестных эффектов данной группы препаратов. Так, была установлена их способность воздействовать на процессы воспаления и дегенерации тканей у пациентов с различными суставными заболеваниями, в частности с ОА. Вследствие этого хондропротекторы рассматриваются как симптоматические препараты замедленного действия для лечения ОА (Symptomatic Slow Acting Drugs for Osteoarthritis, SYSADOA). SYSADOA — группа биологических препаратов различного происхождения, оказывающих воздействие на хрящевую ткань, которое, со значительной долей условности, можно разделить на симптом-модифицирующий эффект, обеспечивающий восстановление функций суставов и снижение интенсивности болевого синдрома, а также на структурно-модифицирующий, способный замедлить процессы прогрессирования воспаления и дегенеративно-дистрофического поражения хрящевой и костной тканей [7]. Препараты данной группы обладают способностью угнетать активность ферментов, участвующих в дегенерации суставного хряща, за счет активации синтеза гликозаминогликанов. Благодаря этим эффектам восстанавливается метаболизм гиалина и замедляются процессы разрушения хрящевой ткани. Продемонстрирована эффективность препаратов SYSADOA на различных стадиях дегенеративного поражения суставов.
Широко распространено применение препаратов SYSADOA, содержащих хондроитина сульфат (ХС), глюкозамин, а также их комбинацию. В соответствии с решением Европейской противоревматической лиги (EULAR) [8] с 2003 г. эти препараты рассматриваются как средства замедленного действия для симптоматического лечения пациентов с ОА различных суставов. В ряде стран, в том числе в Российской Федерации, SYSADOA включены в клинические рекомендации по лечению пациентов с многочисленными дегенеративно-дистрофическими заболеваниями суставно-мышечного аппарата [9–11]. Действующим веществом многих препаратов данной группы является ХС. Формы выпуска ХС весьма разнообразны, они предназначены для перорального, парентерального и наружного применения. Имеются данные о том, что более предпочтительным является применение препаратов ХС в форме для приема внутрь (системное действие) и наружно (местное действие) [12].
Также получены данные о том, что ХС способен восстанавливать обмен веществ в костной и хрящевой тканях, ингибировать хемотаксис лейкоцитов и фагоцитов, обладает противовоспалительным действием [13]. Также показана способность ХС предупреждать повреждение клеточных мембран вследствие воздействия свободных радикалов, угнетать образование циклооксигеназы 2-го типа и выработку хондроцитами простагландинов. Таким образом, противовоспалительное действие ХС обусловлено опосредованным воздействием на клеточный компонент воспаления, а также стимуляцией синтеза протеогликанов и гиалуроновой кислоты, подавлением активности протеолитических ферментов [14]. Способностью обеспечивать нормализацию обмена веществ хрящевой и костной тканей также обладает глюкозамин, который синтезируется в хрящевой ткани. Глюкозамин активирует образование аминогликанов, вследствие чего происходит восстановление хрящевой выстилки сустава и нормализация образования внутрисуставной жидкости.
Ключевыми механизмами, объясняющими клинические эффекты препаратов SYSADOA, являются угнетение образования медиаторов воспаления (гиалуронидаза, N-ацетилглюкозаминидаза, миелопероксидаза, эластаза, коллагеназа), замедление процессов дегенерации тканей суставов, стимуляция синтеза основных компонентов межклеточного матрикса (ХС, гиалурон, протеингликан) [15]. Целесообразность широкого применения SYSADOA в клинической практике обусловлена их способностью снижать интенсивность болевого синдрома, уменьшать выраженность клинических проявлений ОА различных суставов, и, что принципиально важно, улучшать функции суставов (устранение или уменьшение скованности, расширение объема активных и пассивных движений без болевых ощущений и пр.).
Не следует рассматривать SYSADOA как полную альтернативу нестероидным противовоспалительным препаратам (НПВП), оптимальный клинический эффект достигается при одновременном применении препаратов обеих групп. Комбинированное лечение позволяет уменьшить дозы НПВП и сроки их назначения, что ассоциировано со снижением риска развития нежелательных эффектов [16]. Риск развития лекарственных взаимодействий при этом отсутствует. Принимая во внимание, что SYSADOA — препараты замедленного действия, развитие клинического эффекта на фоне их применения наблюдается через несколько недель от начала терапии. Именно в этот период целесообразно их совместное применение с НПВП. Назначение SYSADOA подразумевает длительные сроки лечения, целесообразно проведение повторных курсов терапии на протяжении многих лет. Указанные особенности терапевтического процесса следует обсудить с пациентом при начале лечения. Несомненным достоинством SYSADOA является благоприятный профиль безопасности их применения. Хорошая переносимость обусловлена, в первую очередь, их биологическим сродством со структурами суставного хряща. Препараты SYSADOA легко проникают в ткани, не инактивируются при поступлении в желудочно-кишечный тракт.
Результаты метаанализа серии рандомизированных плацебо-контролируемых исследований продемонстрировали клиническую эффективность и хорошую переносимость ХС у пациентов с заболеваниями дегенеративно-дистрофического характера, в том числе было доказано наличие анальгезирующих и противовоспалительных эффектов [17]. Было проведено клиническое исследование, посвященное изучению возможности применения комбинированной терапии: хондропротекторного магнитофореза с наличием «бегущего» импульсного магнитного поля (БИМП) и использования хондроксида (трансдермальная гелевая форма) у пациентов, страдающих ОА коленного сустава. В исследование были включены пациенты с ОА коленного сустава II–III степени, которые были распределены в 3 группы: 1-я группа (n=25) получала локальную терапию — магнитофорез хондроксида с использованием БИМП (20 мТл, частота 6,25 Гц, время воздействия 20 мин, № 12); 2-я группа (n=25) получала плацебо-магнитотерапию хондроксидом; а 3-я группа — БИМП без использования местной терапии хондроксидом. По результатам этого исследования было установлено, что комбинированная терапия в виде местного использования магнитофореза трансдермальной формы хондроксида благоприятно влияет на состояние пациентов с ОА коленного сустава, представляет собой эффективный и безопасный способ лечения [18].
Еще одно клиническое исследование было направлено на изучение эффективности и безопасности использования парентерального введения ХС и глюкозамина сульфата (ГС) при рецидивах хронической боли в суставах и дорсалгии в условиях реальной клинической практики. Пациентам с генерализованным ОА в течение 6 нед. проводилась инъекционная терапия с использованием ХС и ГС. Для исследования было отобрано 70 пациентов, распределенных на 2 группы, сопоставимые между собой по полу, возрасту, коморбидным состояниям, клиническим и физиологическим параметрам. Пациентам 1-й группы назначали комбинированную терапию с интермиттирующей схемой внутримышечного введения ХС (2,0 мл через день, № 20) и ГС (3,0 мл через день, № 20); больные 2-й группы получали стандартное лечение, включая НПВП в режиме «по потребности» для достижения удовлетворительного обезболивания и другие препараты для лечения имеющихся сопутствующих заболеваний. В результате исследования было установлено, что лечение позволило добиться эффективного обезболивания у 91,4% пациентов 1-й группы, тогда как при монотерапии НПВП эффективное обезболивание было достигнуто только у 62,9% больных. Таким образом, по мнению авторов исследования, представляется целесообразным использование интермиттирующей схемы комбинированного лечения у пациентов с хронической скелетно-мышечной болью, обусловленной генерализованным ОА [19].
Таким образом, принимая во внимание высокую клиническую эффективность препаратов SYSADOA у пациентов со скелетно-мышечными болевыми синдромами, разнообразие оказываемых ими эффектов, представляется важным изучение конкретных механизмов действия препаратов данной группы. Несомненный интерес представляет оценка воздействия различных представителей данной группы лекарственных средств на основные механизмы повреждения тканей суставов у таких пациентов.
Цель исследования — провести экспериментальную оценку сопоставимости действия SYSADOA: препаратов биоактивного концентрата из мелких морских рыб и препаратов глюкозамина.
Задачи исследования:
-
сравнение эффективности препарата ЭЛТУФЛОП® БИО и двух препаратов биоактивного концентрата из мелких морских рыб (препарат 1 (Пр1) и препарат 2 (Пр2)) по выраженности воздействия на содержание в крови ключевых медиаторов воспаления и маркеров повреждения тканей: фактора некроза опухоли α (ФНО-α), интерлейкина (ИЛ) 6, матриксных металлопротеиназ (matrix metalloproteinase, ММР) 9, ММР-2, малонового диальдегида (МДА), апоптоз-индуцирующего фактора (АИФ);
-
определение преимуществ препарата Эльбона® в сравнении с глюкозамином (препарат 3 (Пр3)) по ключевым маркерам воспаления (ИЛ-6, ФНО-α, ММР-9, ММР-2, МДА, АИФ).
Содержание статьи
Материал и методы
Экспериментальные животные. Исследование выполнено на 70 половозрелых самцах крыс линии Вистар (масса тела 200–220 г). Животные получены из питомника «Рапполово» (Россия, Ленинградская обл.). Перед началом эксперимента животные в течение 14 сут содержались на карантине. В период проведения эксперимента животные размещались в стандартных макролоновых клетках со свободным доступом к пище и воде; температура окружающего воздуха 22±2 °С, относительная влажность 60±5%, естественная смена суточного цикла (12 ч день / 12 ч ночь). Содержание животных и проводимые с ними манипуляции соответствовали нормам экспериментальной этики (Directive 2010/63 / EU of the European Parliament and of the council on the protection of animals used for scientific purposes, September 22, 2010). В каждой экспериментальной группе было по 10 животных.
Характеристика исследуемых объектов. В качестве анализируемых объектов выступали лекарственные препараты SYSADOA, содержащие экстракт концентрированный из мелкой морской рыбы (ЭЛТУФЛОП БИО®, Пр1 или Пр2) и глюкозамин (Эльбона® или Пр3). Изучавшиеся препараты вводились курсом 14 сут (однократно в сутки) с момента моделирования артрита в дозах, рассчитанных с учетом межвидового коэффициента пересчета доз, которые для экстракта концентрированного из мелкой морской рыбы составили 0,1 мл, для глюкозамина — 93 мг/кг1 [20]. Полученные результаты сравнивали с показателями группы ложнооперированных животных (ЛО) и группы негативного контроля (НК), которые препаратов не получали.
Экспериментальная модель артрита. Модель артрита создавали путем введения коллагена II типа и неполного адъюванта Фрейнда в соотношении 1:1. Индуктор артрита вводили внутрикожно в основание хвоста [20]. Выраженность отека конечностей оценивали на основании полуколичественной шкалы, в соответствии с которой 0 баллов — норма, 1 балл — воспаление и отек одного пальца стопы; 2 балла — воспаление и отек более одного чем пальца с воспалением и отеком всей лапы или легким отеком всей лапы; 3 балла — воспаление и отек всей лапы; 4 балла — сильное воспаление и отек всей лапы или анкилоз суставов [21].
Подготовка биоматериала для анализа. Крыс анестезировали хлоралгидратом (350 мг/кг, внутрибрюшинно), после чего проводили забор крови в пробирки с цитратным наполнением. Кровь центрифугировали 20 мин при 1000 g, в полученной сыворотке оценивали концентрацию ФНО-α и ИЛ-6. Далее проводили диссипацию сустава задней конечности (art. tarsocruralis), полученный материал гомогенизировали в Трис-НСI буфере и центрифугировали при 10 000 g. В полученном супернатанте определяли концентрации ММР-9, ММР-2, МДА и АИФ.
Оценка концентрации МДА. Концентрацию МДА определяли спектрофотометрическим методом в реакции конденсации с 2-тиобарбитуровой кислотой. Образующийся в ходе реакции окрашенный комплекс имеет максимум поглощения при 532 нм, при этом окраска раствора пропорциональна концентрации МДА. Количество МДА рассчитывали по величине молярного коэффициента экстинкции (1,56×105 л/моль-1×см-1), результаты представлены в мкмоль/л [22].
Иммуноферментное (ИФА) исследование. Концентрацию ИЛ-6, ФНО-α, ММР-9, ММР-2 и АИФ определяли методом ИФА с использованием реактивов производства Cloud clone (США) в соответствии с инструкцией производителя. Считывание результатов осуществляли с применением полуавтоматического планшетного ИФА-ридера F50 (Tecan, Австрия). Обработку входящего сигнала проводили в системе Magellan 50.
Статистический анализ. Статистический анализ результатов проведен с использованием программного пакета Statplus 7.0 (AnalystSoft). Данные представлены в виде среднего и стандартной ошибки среднего (M±SEM). Анализ результатов проводили методом однофакторного дисперсионного анализа ANOVA с пост-тестом Ньюмена — Кейлса, отличия принимались статистически значимыми при уровне p<0,05.
Результаты и обсуждение
Результаты применения лекарственных препаратов, содержащих экстракт концентрированный из мелкой морской рыбы
В ходе изучения изменения концентрации цитокинов ИЛ-6 и ФНО-α в сыворотке крови экспериментальных животных было установлено, что в группе НК показатели были выше, чем группе ЛО, в 4,0 раза (p<0,05) и 8,4 раза (p<0,05) соответственно, тогда как применение препаратов ЭЛТУФЛОП® БИО, Пр1 и Пр2 сопровождалось уменьшением содержания ИЛ-6 на 36,9% (p<0,05), 13,6% (p<0,05) и 35,9% (p<0,05) соответственно, а ФНО-α — на 47,9, 26,1 и 37,3% (во всех случаях p<0,05). При этом концентрация в крови ИЛ-6 и ФНО-α у крыс, получавших ЭЛТУФЛОП® БИО, была ниже таковой в группе животных, получавших Пр2, на 27,0% (p<0,05) и 29,5% (p<0,05) соответственно (рис. 1).
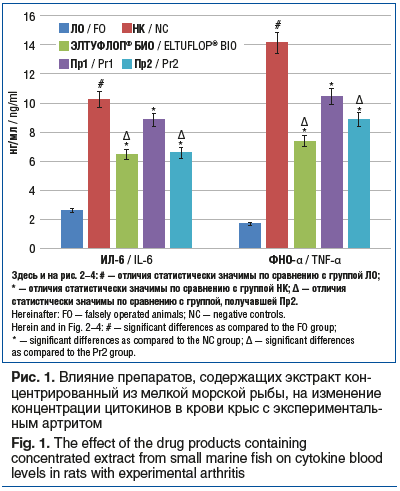
Также было установлено, что в группе НК имело место повышение по сравнению с группой ЛО концентрации ММР-2 и ММР-9 в 3,6 раза (p<0,05) и 3,64 раза (p<0,05) соответственно. Применение препаратов ЭЛТУФЛОП® БИО, Пр1 и Пр2 сопровождалось уменьшением концентрации ММР-2 по сравнению с группой НК на 42,6% (p<0,05), 24,5% (p<0,05) и 34,8% (p<0,05) соответственно, тогда как концентрация ММР-9 снизилась на 21,2% (p<0,05), 11,7% (p<0,05) и 15,5% (p<0,05) соответственно. Важно, что на фоне введения препарата ЭЛТУФЛОП® БИО концентрация ММР-2 и ММР-9 оказалась статистически значимо ниже, чем при применении препарата Пр2, — на 23,9% (p<0,05) и 10,7% (p<0,05) соответственно (рис. 2).
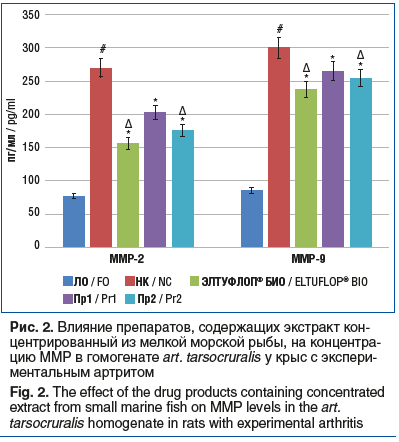
Результаты определения концентрации МДА и АИФ (рис. 3) позволили установить, что в группе НК рассматриваемые показатели были выше, чем в группе ЛО, в 4 раза (p<0,05) и 5,3 раза (p<0,05) соответственно. В группах применения препаратов ЭЛТУФЛОП® БИО, Пр1 и Пр2 концентрация МДА оказалась статистически значимо ниже — на 44,6% (p<0,05), 25,0% (p<0,05) и 41,1% (p<0,05) соответственно, чем в группе НК, при этом концентрация АИФ снизилась на 39,3% (p<0,05), 22,3% (p<0,05) и 31,3% (p<0,05). Необходимо отметить, что в группе крыс, получавших ЭЛТУФЛОП® БИО, концентрация МДА и АИФ была ниже, чем в группе животных, которым вводили Пр2, — на 26,2% (p<0,05) и 21,9% (p<0,05).
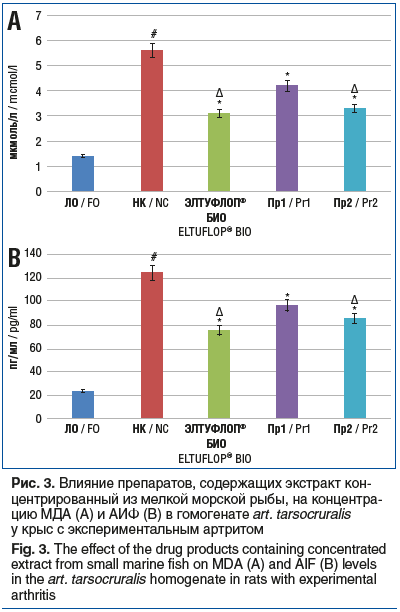
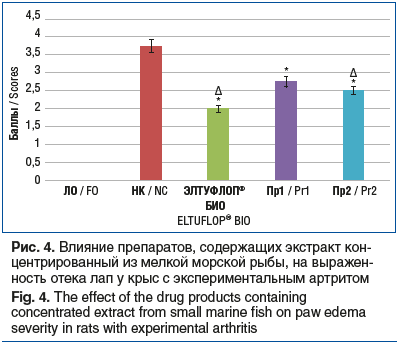
В совокупности выявленные изменения в группе НК привели к формированию выраженного отека лап (3,75±0,67 балла). На фоне применения препаратов ЭЛТУФЛОП® БИО, Пр1 и Пр2 выраженность отека лап (рис. 4) снизилась на 46,7% (p<0,05), 26,7% (p<0,05) и 33,3% (p<0,05) в сравнении с показателем в группе НК. При этом отек лап при использовании препарата ЭЛТУФЛОП® Био был достоверно меньше аналогичного в группах применения Пр2 на 27,3% (p<0,05).
Результаты анализа эффектов лекарственных препаратов, содержащих глюкозамин
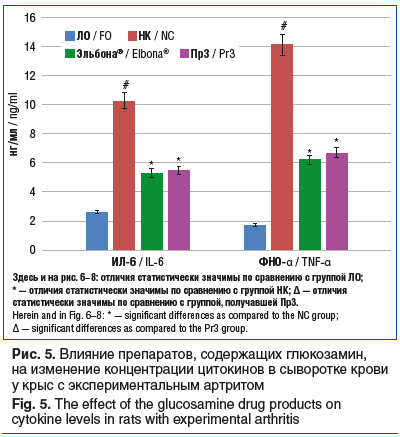
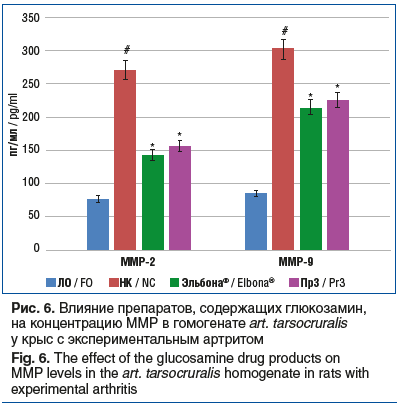
В результате исследования было установлено, что применение препаратов Эльбона® и Пр3 (рис. 5) сопровождалось уменьшением концентрации ИЛ-6 на 48,5% (p<0,05) и 46,6% (p<0,05) при снижении концентрации ФНО-α на 56,3% (p<0,05) и 52,8% (p<0,05). Также выявлено уменьшение концентрации ММР-2 и ММР-9 в группах животных, которым вводили препарат Эльбона®, на 47,2% (p<0,05) и 29,2% (p<0,05), а у животных, получавших Пр3, – на 42,2% (p<0,05) и 25,2% (p<0,05) соответственно (рис. 6).
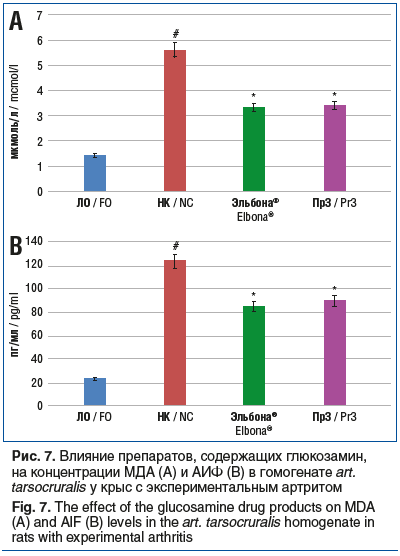
Концентрация МДА в группах животных, которым вводили препараты Эльбона® и Пр3, была ниже соответствующих показателей в группе НК на 41,1% (p<0,05) и 39,3% (p<0,05) соответственно (рис. 7). Также было установлено уменьшение содержания АИФ в данных группах животных на 31,0% (p<0,05) и 27,4% (p<0,05) соответственно (см. рис. 7).
Выраженность отечности конечностей при применении препаратов Эльбона® и Пр3 была статистически значимо ниже, чем в группе НК, — на 46,7% (p<0,05) и 46,7% (p<0,05) соответственно (рис. 8). Следует отметить, что статистически значимых отличий между группами животных, которым вводили препараты Эльбона® и Пр3, при анализе всех исследуемых показателей установлено не было.
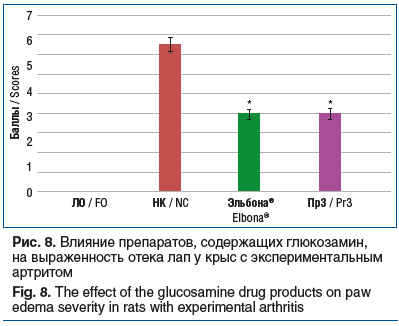
Полученные данные свидетельствуют о выраженной способности препаратов группы SYSADOA изменять течение острого экспериментального артрита. Результаты исследования продемонстрировали, что эффективность применения у животных с экспериментальным артритом препарата ЭЛТУФЛОП® БИО сопоставима с эффективностью препарата Пр1 и превосходит эффективность препарата Пр2 по выраженности угнетения процессов воспаления (снижение концентрации ИЛ-6 и ФНО-α), резорбции хрящевой ткани (снижение содержания ММР-2 и ММР-9), апоптоза (концентрация АИФ), окислительного стресса (содержание МДА). Улучшение со стороны биохимических маркеров сопровождалось уменьшением выраженности отека, обусловленного экспериментальным артритом. Глюкозамин-содержащие препараты Эльбона® и Пр3 у животных с экспериментальным артритом продемонстрировали сопоставимый уровень активности.
Заключение
Имеющиеся результаты позволяют рассматривать препараты ЭЛТУФЛОП® БИО и Эльбона® в качестве долговременной терапии больных с хроническими суставно-мышечными болевыми синдромами, обусловленными ОА различной локализации, в том числе у пациентов с различными формами дорсалгии.
1Estimating the Maximum Safe Starting Dose in Initial Clinical Trials for Therapeutics in Adult Healthy Volunteers. 2005. (Electronic resource.) URL: https://www.fda.gov/regulatory-information/search-fda-guidance-documents/estimating-maximum-safe-sta… (access date: 03.09.2024).
Сведения об авторах:
Кукес Илья Владимирович — к.м.н., директор АНО «Научный центр клинической метаболомики, генетики и фармакологии»; 109147, Россия, г. Москва, ул Нижегородская, д. 1а, кв. 42; ORCID iD 0000-0003-1449-8711
Камчатнов Павел Рудольфович — д.м.н., профессор кафедры неврологии, нейрохирургии и медицинской генетики института нейронаук и нейротехнологий, эксперт-аналитик отдела организационно-методического
руководства НМИЦ неврологии ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117513, Россия, г. Москва, ул. Островитянова, д. 1; врач-невролог, отдел организации внебюджетной деятельности ГБУЗ «ГКБ им. В.М. Буянова ДЗМ»; 115516, Россия, г. Москва, ул. Бакинская, д. 26; ORCID iD 0000-0001-6747-3476
Чугунов Александр Вильмирович — к.м.н., доцент, профессор кафедры неврологии, нейрохирургии и медицинской генетики института нейронаук и нейротехнологий, эксперт-аналитик отдела аналитической работы НМИЦ неврологии ФГАОУ ВО РНИМУ им. Н.И. Пирогова (Пироговский Университет); 117513, Россия, г. Москва, ул. Островитянова, д. 1; ведущий специалист организационно-методического отдела по неврологии Департамента здравоохранения города Москвы ГБУ «НИИОЗММ ДЗМ»»; 115088, Россия, г. Москва, ул. Шарикоподшипниковская, д. 9; ORCID iD 0000-0003-4506-8095
Малашенков Никита Дмитриевич — клинический ординатор ГБУЗ «НИИ СП им. Н.В. Склифосовского ДЗМ»; 129090, Россия, г. Москва, пл. Большая Сухаревская, д. 3; ORCID iD 0000-0001-7334-7820
Казаков Алексей Юрьевич — д.м.н., профессор кафедры неврологии, нейрохирургии и медицинской генетики института нейронаук и нейротехнологий ФГАОУ ВО РНИМУ им. Н.И. Пирогова (Пироговский Университет); 117513, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-2367-545X
Контактная информация: Камчатнов Павел Рудольфович, e-mail: pavkam7@gmail.com
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 05.08.2024.
Поступила после рецензирования 30.08.2024.
Принята в печать 23.09.2024.
About the authors:
Ilya V. Kukes — C. Sc. (Med.), Director, Scientific Center for Clinical Metabolomics, Genetics and Pharmacology; 1a, room 42, Nizhegorodskaya str., Moscow, 109147, Russian Federation; ORCID iD 0000-0003-1449-8711
Pavel R. Kamchatnov — Dr. Sc. (Med.), Professor of the Department of Neurology, Neurosurgery and Medical Genetics, Institute of Neuroscience and Neurotechnology, expert analyst of the Department of Organizational and Methodological Guidance, National Medical Research Neurology Center, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117513, Russian Federation; neurologist, Department of Extra-Budgetary Activity Arrangement, V.M. Buyanov City Clinical Hospital; 26, Bakinskaya str., Moscow, 115516, Russian Federation; ORCID iD 0000-0001-6747-3476
Alexander V. Chugunov — C. Sc. (Med.), Assistant Professor, Professor of the Department of Neurology, Neurosurgery and Medical Genetics, Institute of Neuroscience and Neurotechnology, expert analyst of the Department of Analytical Work, National Medical Research Neurology Center, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117513, Russian Federation; leading specialist of the Organizational and Methodological Department for Neurology, Research Institute of Public Health Organization and Medical Management; 9, Sharikopodshipnikovskaya str., Moscow, 115088, Russian Federation; ORCID iD 0000-0003-4506-8095
Nikita D. Malashenkov — resident of N.V. Sklifosovskiy Research Institute for Emergency Medical Aid; 3, Bolshaya Sukharevskaya sq., Moscow, 129090, Russian Federation; ORCID iD 0000-0001-7334-7820
Alexey Yu. Kazakov — Dr. Sc. (Med.), Professor, Department of Neurology, Neurosurgery and Medical Genetics, Institute of Neuroscience and Neurotechnology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117513, Russian Federation; ORCID iD 0000-0003-2367-545X
Contact information: Pavel R. Kamchatnov, e-mail: pavkam7@gmail.com
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 05.08.2024.
Revised 30.08.2024.
Accepted 23.09.2024.
Информация с rmj.ru





