Содержание статьи
Введение
Аллергический дерматит относится к наиболее распространенным заболеваниям кожи и с точки зрения патогенеза представляет собой реакцию гиперчувствительности замедленного типа (IV тип аллергических реакций), опосредованную сенсибилизированными лимфоцитами. В отличие от простого контактного дерматита, при котором раздражающий фактор у любого человека при воздействии на кожу может вызвать сыпь и при этом не активируется иммунная система, аллергический контактный дерматит возникает только у лиц с повышенной чувствительностью, имеющих специфичные к данному веществу Т-лимфоциты [1].
Аллергический контактный дерматит: этиология и патогенез
Аллергический дерматит могут вызывать различные вещества, которые способны проникать через кожу, при этом описано более 3500 потенциальных контактных аллергенов (табл. 1) [2].
![Таблица 1. Вещества, наиболее часто вызывающие аллергический контактный дерматит [2] Table 1. Agents most commonly provoking allergic contact dermatitis [2] Таблица 1. Вещества, наиболее часто вызывающие аллергический контактный дерматит [2] Table 1. Agents most commonly provoking allergic contact dermatitis [2]](https://medblog.su/wp-content/uploads/2022/05/levotsetirizin-v-kompleksnom-lechenii-bolnyh-allergicheskim-dermatitom-kruglova-l-s-bakulev-a-l.png)
Аллергическая реакция развивается при повторных контактах (в течение 10–14 дней), при этом контакт с потенциальным контактным аллергеном может продолжаться длительное время (до нескольких лет), прежде чем разовьется аллергическая реакция, что обусловлено развитием чувствительности замедленного типа или изменением реактивности организма. В клинической практике, как правило, отмечается повышенная чувствительность к одному определенному потенциальному контактному аллергену, хотя может наблюдаться и поливалентная аллергическая реакция.
Сенсибилизация к потенциальному контактному аллергену происходит при его попадании на кожу с последующим связыванием с тканевыми белками, в состав которых входят лизин и цистеин (ε-аминогруппа лизина или тиоловая SH-группа цистеина), с образованием полноценного антигена — гаптена. В дальнейшем антиген захватывают клетки Лангерганса, и его фрагменты представляются Т-лимфоцитам. Активированные клетки Лангерганса и Т-лимфоциты синтезируют провоспалительные цитокины, участвующие в формировании иммунного ответа и воспалительной реакции. Таким образом, иммунный ответ при аллергическом дерматите условно протекает через афферентную и эфферентную фазы [3]. Так, афферентная фаза характеризуется формированием гаптенов и первичним контактом с кожей с последующей стимуляцией эпидермоцитов, которые экспрессируют молекулы адгезии (ICAM-1),
продуцируют провоспалительные цитокины (ИЛ-1-α, ИЛ-1β, ФНО-α, ИЛ-6) и хемокины (IP-10, MCP-1, RANTES, CCL18). В эпидермальных слоях гаптены связываются с клеточными белками на поверхности клеток Лангерганса, образуя иммунные комплексы «гаптен — пептид» [4, 5]. В дальнейшем данные клетки мигрируют в регионарные лимфатические узлы, где происходит представление комплекса антигена и молекул гистосовместимости MHC II класса наивным Т-лимфоцитам [6, 7], которые и дифференцируются в эффекторные Т-лимфоциты, специфичные для определенного антигена.
Эффекторная фаза характеризуется появлением клинических симптомов, которые формируются после повторного контакта потенциального контактного аллергена с кожей. При этом наблюдается синтез эндогенных гликолипидов, которые презентируются дендритными клетками с высвобождением ИЛ-4 и вовлечением в процесс В-лимфоцитов. Данная фаза характеризуется синтезом специфических иммуноглобулинов класса M, которые активируют систему комплемента с высвобождением из тучных клеток и эндотелиоцитов провоспалительных и хемотаксических факторов. В дальнейшем отмечаются активация антиген-специфических эффекторных Т-лимфоцитов и пролиферация Т-клеток памяти, которые мигрируют в место к онтакта кожи с гаптеном и взаимодействуют с антиген-презентирующими клетками. В свою очередь, данные механизмы регулируются клеточным звеном иммунитета (регуляторные Т- и В-лимфоциты, естественные киллерные Т-клетки) [5].
Сформировавшиеся Т-клетки памяти обеспечивают пожизненный или очень длительный иммунитет и активируются при повторном контакте с потенциальным контактным аллергеном, что способствует быстрой инфильтрации клетками-эффекторами, развитию аллергической реакции замедленного типа и формированию клинических симптомов [8].
Патогенетически обоснованные подходы к лечению аллергического дерматита
Лечение аллергического дерматита включает топическую терапию (глюкокортикостероиды и ингибиторы кальциневрина), системную терапию и методы физиотерапии (например, ПУВА-терапию).
Системная терапия представлена антигистаминными препаратами, например левоцетиризином. Левоцетиризин, R-энантиомер цетиризина, относится ко 2-му поколению антигистаминных средств [9], он обладает высоким сродством и селективной антагонистической активностью в отношении гистаминовых H1-рецепторов и оказывает ингибирующее действие на хемотаксис эозинофилов [10]. В доклинических и клинических исследованиях было показано, что левоцетиризин быстро и надежно связывается с H1-рецепторами [9]. M.S. Benedetti et al. [11] в исследовании с участием здоровых добровольцев изучали фармакокинетику левоцетиризина при однократном пероральном приеме в дозе 5 мг. Авторы установили, что лекарственное средство быстро и полностью всасывалось. Время достижения максимальной концентрации (tmax) в плазме крови составляло 0,75±0,5 ч, максимальная концентрация (Cmax) в плазме крови — 0,27±0,04 мкг/мл, период полувыведения (t1/2) — 7,05±1,54 ч. Средний объем распределения в терминальную фазу при пероральном приеме (Vz/F) составил 0,33±0,02 л/кг, что указывает на то, что распределение левоцетиризина было ограниченным. Связывание с белками плазмы крови составило 96,1% через 1 ч после перорального приема препарата. Левоцетиризин не ингибирует изоферменты CYP1A2, CYP2C9, CYP2C19, CYP2D6, CYP3A4, гликопротеин P [12]. Основными путями метaболизмa левоцетиризина являются окисление (гидроксилирование, о-деалкилирование, n-окисление, n-деалкилирование), глюкуроконъюгирование, конъюгация с таурином или глутатионом, образование меркаптуровых кислот. В исследовании с участием здоровых добровольцев установлено, что с мочой выводилось в среднем 85,4% от принятой дозы левоцетиризина, тогда как с калом — в среднем 12,9% [11].
По данным ряда авторов, левоцетиризин способен дольше оккупировать места связывания H1-рецептора с гистамином, чем другие антигистаминные препараты 2-го поколения (см. рисунок) [12–14].
![Рисунок. Занятость H1-рецепторов антигистаминными препаратами 2-го поколения [13] Figure. Binding of 2nd generation antihistamines and H1 receptors [13] Рисунок. Занятость H1-рецепторов антигистаминными препаратами 2-го поколения [13] Figure. Binding of 2nd generation antihistamines and H1 receptors [13]](https://medblog.su/wp-content/uploads/2022/05/1652602447_438_levotsetirizin-v-kompleksnom-lechenii-bolnyh-allergicheskim-dermatitom-kruglova-l-s-bakulev-a-l.png)
Левоцетиризин в настоящее время выпускается в форме таблеток, покрытых пленочной оболочкой 5 мг или в форме капель для приема внутрь (в 1 мл содержится 5 мг левоцетиризина дигидрохлорида). Показаниями для назначения левоцетиризина являются симптомы круглогодичного и сезонного аллергических ринитов и аллергического конъюнктивита, поллиноз, крапивница и другие аллергические дерматозы, сопровождающися зудом и высыпаниями, что явилось обоснованием его назначения пациентам с аллергическим дерматитом. Представляем собственный опыт ведения данной категории пациентов.
Собственный опыт ведения пациентов с аллергическим дерматитом
Под наблюдением находилось 28 пациентов в возрасте от 18 до 57 лет с диагностированным аллергическим дерматитом (табл. 2). В клинической картине преобладали эритематозные очаги, инфильтрация, везикулы, процесс сопровождался зудом. Все пациенты получали левоцетиризин (Супрастинекс®) 5 мг 1 р/сут внутрь и топические глюкокортикостероиды (метилпреднизолона ацепонат 1 р/сут) на протяжении 10–15 дней. Эффективность лечения оценивалась по 3-балльной визуальной аналоговой шкале (ВАШ) и дерматологическому индексу качества жизни пациентов (ДИКЖ) со шкалой от 0 до 30 баллов. Чем выше ДИКЖ, тем более негативно заболевание сказывается на качестве жизни. Статистическая обработка полученных данных проводилась с использованием статистической программы Statistica 10 и стандартных методов статистической обработки. Различия считались достоверными при р<0,05.
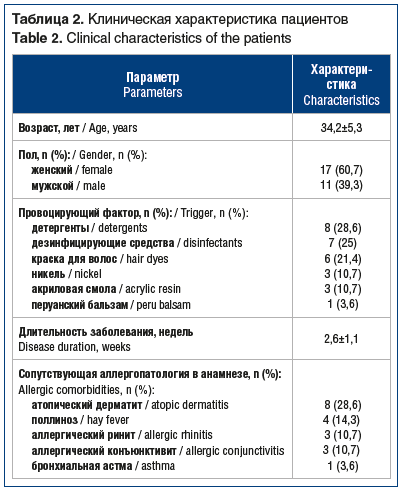
В результа терапии у всех пациентов к концу 2-й недели отмечалось полное купирование симптомов (табл. 3). Следует отметить, что уже через 5 дней лечения показатель эритемы по ВАШ снизился на 57,7%, инфильтрации — на 48,4%, везикул — на 61,5%, при этом общий показатель по ВАШ снизился на 57,1%. Через 10 дней показатель эритемы по ВАШ снизился на 84,6%, инфильтрации — на 79,8%, везикул — на 76,9%, при этом общий показатель по ВАШ снизился на 85,7%. В отношении зуда также отмечалась выраженная положительная динамика по ВАШ: через 5 дней терапии зуд уменьшился на 69,3%, через 10 дней — на 96,2%, к концу лечения зуд отсутствовал у всех пациентов. Качество жизни улучшилось с улучшением клинической картины аллергического дерматита: через 5 дней ДИКЖ снизился на 47,3%, через 10 дней — на 68,9% и к концу лечения — на 82,9%.
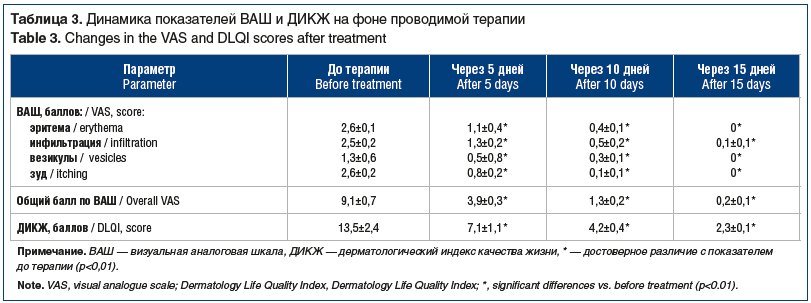
Таким образом, комплексное лечение больных с аллергическим дерматитом, включающее левоцетиризин 5 мг/сут и топические глюкокортикостероиды, в нашем исследовании показало 100% эффект в отношении всех клинических симптомов, включая зуд.
Заключение
Аллергический дерматит относится к распространенным кожным заболеваниям и развивается в ответ на действие триггерных факторов у лиц с повышенной чувствительностью и имеющих специфичные к данному веществу Т-лимфоциты. Стандартом терапии пациентов с аллергическим дерматитом является применение антигистам e8нных препаратов и топических глюкокортикостероидов. Учитывая данные научной литературы и собственный опыт, мы пришли к выводу, что антигистаминные препараты 2-го поколения имеют преимущество перед препаратами 1-го поколения. Левоцетиризин, наряду с высокой селективной антагонистической активностью по отношению к H1-рецепторам, способен дольше, чем другие антигистаминные препараты 2-го поколения, занимать места связывания H1-рецептора с гистамином, что обосновывает его применение в комплексной терапии больных аллергическим дерматитом.
Сведения об авторах:
Круглова Лариса Сергеевна — д.м.н., профессор, заведующая кафедрой дерматовенерологии и косметологии, проректор по учебной работе ФГБУ ДПО «ЦГМА»; 121359, Россия, г. Москва, ул. Маршала Тимошенко, д. 19, стр. 1А; ORCID iD 0000-0002-5044-5265.
Бакулев Андрей Леонидович — д.м.н., профессор кафедры дерматовенерологии и косметологии ФГБУ ДПО «ЦГМА»; 121359, Россия, г. Москва, ул. Маршала Тимошенко, д. 19, стр. 1А; ORCID iD 0000-0002-1450-4942.
Контактная информация: Круглова Лариса Сергеевна, e-mail: kruglovals@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 03.02.2022.
Поступила после рецензирования 01.03.2022.
Принята в печать 28.03.2022.
About the authors:
Larisa S. Kruglova — Dr. Sc. (Med.), Professor, Head of the Department of Dermatovenerology and Cosmetology, Vice Rector for Academic Work, Central State Medical Academy; 19, build. 1A, Marshal Timoshenko str., Moscow, 121359, Russian Federation; ORCID iD 0000-0002-5044-5265.
Andrey L. Bakulev — Dr. Sc. (Med.), professor of the Department of Dermatovenerology and Cosmetology, Central State Medical Academy; 19, build. 1A, Marshal Timoshenko str., Moscow, 121359, Russian Federation; ORCID iD 0000-0002-1450-4942.
Contact information: Larisa S. Kruglova, e-mail: kruglovals@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 03.02.2022.
Revised 01.03.2022.
Accepted 28.03.2022.
.
Информация с rmj.ru