Введение
Рутинная практика врача-ревматолога зачастую сопряжена с решением непростой задачи — купированием болевого синдрома, сопровождающего большое число хронических заболеваний. Распространенность хронической боли разной степени выраженности в популяции достигает 56,7% [1]. Одной из причин является деформирующий остеоартрит (ОА), характеризующийся деградацией хрящевого матрикса и целым спектром патологических изменений всех компонентов и составляющих сустава, что неизменно приводит к возникновению и рецидивированию болевого синдрома.
Боль, по определению Международной ассоциации по изучению боли, представляет собой неприятное сенсорное и эмоциональное переживание, которое связано с уже возникшим или потенциально возможным повреждением ткани [2]. Это не просто физическое ощущение, а комплексная реакция всего организма, затрагивающая психоэмоциональную сферу и когнитивную деятельность. Острый и особенно хронический болевой синдром (ХБС) негативно влияет на когнитивное функционирование, что приводит к поведенческим и аффективным нарушениям и, как следствие, снижению трудоспособности и качества жизни, затруднениям в профессиональной и бытовой сферах деятельности [3]. N. Morone et al. [4] на примере больных с ОА продемонстрировали тесную взаимосвязь между степенью мобильности пациентов и их исполнительными функциями. Кроме того, ХБС, как и когнитивные нарушения (КН), зачастую сопровождаются тревожными и депрессивными расстройствами [1, 5–7], что, безусловно, диктует необходимость выявления всех коморбидных составляющих у этих пациентов. Cистематический анализ 28 исследований в системах PubMed, Embase и Web of Science [8] обнаружил у больных с ХБС эмоциональные нарушения и КН, связанные, согласно данным функциональной нейровизуализации, с патологическими изменениями в схожих церебральных областях.
У пациентов с ХБС с помощью валидизированных опрос-ников, шкал и нейровизуализационных методов обследования продемонстрировано как затруднение при выполнении нейропсихологических тестов, так и структурные изменения в разных отделах головного мозга, в частности уменьшение объема серого вещества, особенно в дорсолатеральных областях префронтальной коры, степень потери которого коррелирует с длительностью болевого синдрома [3, 9–11]. При ХБС происходит нарушение как базовых когнитивных функций (внимания, оперативной и долговременной памяти, скорости обработки информации, когнитивной гибкости и др.), так и более сложных исполнительных функций (планирования, способности рассуждать и принимать решения), требующих одновременного осуществления нескольких когнитивных процессов [3], о чем свидетельствуют многочисленные исследования последних лет [4–6, 12–15].
Установлено, что ряд провоспалительных цитокинов напрямую модулируют активность церебральных нейронов и связи между ними, как и процессы нейрогенеза в гиппокампе [3, 16], что приводит к формированию феномена центральной сенситизации при хронизации болевого синдрома на фоне снижения уровня противовоспалительных цитокинов [17]. Указанные нейрохимические изменения лежат в основе нарушения процессов когнитивной модуляции боли, что объясняет тот факт, что при отвлечении внимания пациента могут существенно уменьшиться его болевые ощущения [3]. С другой стороны, анатомические и функциональные перестройки в нейрональных системах головного мозга могут быть обусловлены не столько самим феноменом боли, сколько изменением когнитивного функционирования как составного элемента ХБС [3].
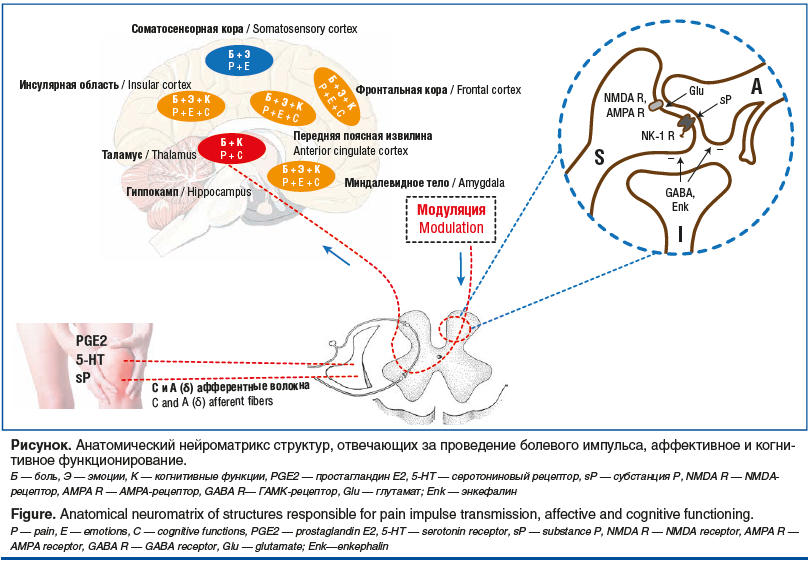
Тесная взаимосвязь и взаимное реципрокное влияние между ХБС и КН обусловлены вовлечением общих анатомических структур, схожими пластическими нарушениями в нейрональных системах головного мозга, истощением общих медиаторных и нейрохимических ресурсов, а также общими нейрохимическими изменениями, что неизменно приводит к дезадаптивной нейропластичности в церебральных системах контроля боли и обеспечения ключевых когнитивных функций (см. рисунок). Лежащие в основе ХБС и КН патологические изменения опосредованы процессами эксайтотоксичности с участием ГАМК-ергических и глутаматергических механизмов, нарушением в опиоид- и дофаминергических системах и другими молекулярными и нейрохимическими процессами [3]. Доказана роль ряда нейротрансмиттеров в формировании боли и КН, в частности, продемонстрирована роль функционального дисбаланса в системах ГАМК и NMDA (N-Methyl-D-Aspartic Acid — N-метил-D-аспаргиновая кислота) [3, 15]. Дисбаланс в системе NMDA-рецепторов рассматривается как один из патологических процессов в основе хронизации болевого синдрома, в том числе развития и поддержания центральной сенситизации и феномена взвинчивания [3]. Немаловажную роль в обеспечении многих когнитивных процессов и антиноцицептивной регуляции играет ацетилхолин, оказывающий влияние на функционирование спинальных и супраспинальных нейрональных систем (области передней поясной извилины, префронтальной коры, миндалевидного тела и инсулярных отделов) [3, 18]. Вместе с тем процессы дезадаптивной нейропластичности, лежащие в основе формирования и поддержания ХБС и когнитивного дефицита, обычно обратимы после успешного и своевременного лечения.
Таким образом, с учетом полиморфной клинической составляющей у пациентов с ОА, имеющих ХБС и широкий спектр КН, подбор персонифицированной терапии должен лежать в плоскости не только этиологического лечения, но и патогенетически направленной терапии этих взаимосвязанных патологических процессов. При подборе терапии важно учитывать, что наличие КН не только усугубляет течение ХБС, но и снижает приверженность лечению. Ведение пациентов с КН требует комплексного подхода: немедикаментозных методов и фармакологической коррекции, причем предпочтение в лекарственной терапии когнитивного дефицита должно отдаваться препаратам с мультимодальным механизмом действия и доказанным профилем безопасности и эффективности, осуществляющим таргетную доставку терапевтического агента к клеткам-мишеням, взаимодействие с рецепторами и наиболее полное проникновение в клетку.
Препаратом, удовлетворяющим всем этим требованиям, является янтарнокислый координационный комплекс с триметилгидразиния пропионатом (Брейнмакс®, ООО «Промомед Рус»). Его компоненты связаны между собой координационными донорно-акцепторными связями, что обеспечивает наиболее выгодные энергетические взаимодействия с белками рецепторов, быстрое проникновение комплекса в клетку и, таким образом, более выраженный терапевтический эффект [19]. Препарат Брейнмакс® способствует активации холинергической нейротрансмиссии (стимуляции никотиновых рецепторов ацетилхолина типа α4β2), что приводит к улучшению процессов адаптивной нейропластичности. Продемонстрировано, что препарат Брейнмакс® восстанавливает баланс глутамат- и ГАМК-ергической систем за счет ингибирования М4 мускариновых рецепторов, что позволяет активировать ГАМК-А-рецепторы типа α2β3γ2 и реализовать ноотропный эффект, а также регулирует функционирование NMDA-рецепторов, снижая глутаматную эксайтотоксичность [20–24].
Представляем собственное клиническое наблюдение пациента с первичным генерализованным ОА, эрозивным ОА, сопровождающимся цереброваскулярной и соматической патологией и ХБС (согласие пациента на публикацию обезличенных данных получено).
Клиническое наблюдение и обсуждение
Пациент К., 58 лет, водитель с большим стажем длительных международных поездок, обратился к ревматологу после перенесенной стрессовой ситуации на работе.
Ведущей жалобой при обращении была постоянная малоинтенсивная боль в паховой, ягодичной, поясничной областях и нижней части спины, возникающая при ходьбе и стихающая в покое, иррадиирующая по задней поверхности левой ноги до колена. В последнее время болевой синдром усилился, достигая 9 мм по визуальной аналоговой шкале (ВАШ).
Пациента также беспокоило постоянное ощущение онемения стоп с двух сторон и снижение концентрации внимания, забывчивость, нарушение сна, колебание артериального давления (АД) от 140/80 до 190/90 мм рт. ст. и нарушение сердечного ритма по типу внеочередных сердечных сокращений.
Из анамнеза известно, что в 2012 г. пациент перенес ишемический инсульт в вертебробазилярном бассейне, в связи с чем наблюдался у невролога по месту жительства и получал сосудистые препараты.
Ревматологический статус: при визуальном осмотре коленных, голеностопных суставов припухлости, отечности нет, температура поверхности кожи над суставами нормальная, определяется незначительная деформация, дефигурация обоих коленных суставов, пальпаторно —– сужение суставных щелей. Уменьшение объема активных и пассивных движений в тазобедренных суставах (ограничение внутренней и наружной ротации и отведения бед-ра). При ходьбе наблюдается прихрамывание на обе ноги с формированием утиной походки, использует трость.
Рентгенография обоих тазобедренных суставов: деформирующий ОА обоих тазобедренных суставов 3-й степени, тендинопатия портняжной, средней и малой ягодичной мышц с двух сторон, дегенеративные изменения ацетабулярной губы с двух сторон, синовит обоих тазобедренных суставов, бурсит большого вертела с двух сторон, остеонекроз головок бедренных костей с двух сторон.
УЗИ тазобедренных суставов: признаки активного воспаления.
Дополнительно пациенту были проведены ультразвуковая остеоденситометрия, определение уровня 25-гидроксикальциферола. Были выявлены признаки остео-пении с низким риском переломов по FRAX.
Консультация невролога: хроническая ишемия головного мозга с мнестическими и астеническими нарушениями.
Консультация терапевта: артериальная гипертензия, церебральный атеросклероз.
Таким образом, у пациента К. выявлены первичный генерализованный ОА, эрозивный ОА, сопровождающийся цереброваскулярной и соматической патологией.
Терапевтическая стратегия при ведении данного пациента включала назначение комбинированной схемы лечения основного заболевания — деформирующего ОА и коррекции имеющихся КН: препаратов из группы SYSADOA, нестероидных противовоспалительных средств, препаратов кальция в дозировке 1000 мг/сут и витамина D 800 МЕ, регулярный прием антигипертензивной терапии и статинов и курсовой прием препарата Брейнмакс® (ООО «Промомед Рус») внутрь по 1 капсуле 2 р/сут в течение 1 мес. Рекомендована повторная консультация через 1 мес. указанной терапии.
На повторном приеме пациент отметил выраженный клинический эффект в виде снижения интенсивности болевого синдрома по ВАШ с 9 до 3 мм, улучшения ночного сна, концентрации внимания, скорости обработки информации, запоминания и общего самочувствия. При проведении контрольного УЗИ тазобедренных суставов: деформирующий ОА обоих тазобедренных суставов с разрешением воспалительной реакции.
Представленное клиническое наблюдение демонстрирует важность персонифицированного подхода к комплексному лечению пациентов с коморбидными состояниями — ХБС и КН. Следует отметить, что выраженный болевой синдром зачастую фокусирует внимание врача лишь на купировании боли, без учета сопутствующих патологических проявлений, в итоге снижая эффективность проводимой терапии. Медикаментозная коррекция КН не только увеличивает приверженность пациентов рекомендованной терапии и способность придерживаться рекомендованной схемы лечения, но и существенно влияет на их качество жизни, повседневную, социальную и профессиональную деятельность.
Функциональные нарушения, отражающие процессы дезадаптивной пластичности и лежащие в основе формирования и поддержания КН и болевого синдрома, обычно обратимы после своевременно начатого и правильно проведенного лечения, что подразумевает использование патогенетически обоснованных лекарственных средств в соответствующих дозах и с адекватной продолжительностью приема [25].
Заключение
На примере клинического наблюдения из рутинной практики врача-ревматолога показано взаимное влияние ХБС и КН. Наличие ХБС требует от врача любой специальности настороженности в отношении выявления у пациента КН и их эффективной терапии, поскольку это определяет успех лечения в долгосрочной перспективе, повышая приверженность пациента терапии и предотвращая ее необоснованное прерывание и, как следствие, рецидивирование патологического процесса и прогрессирование имеющегося заболевания. В представленном клиническом наблюдении пациента с ХБС и КН нами было продемонстрировано не только уменьшение выраженности болевого синдрома, но и улучшение качества жизни, а также устранение КН, что было достигнуто при своевременно начатом патогенетически обоснованном лечении.
СВЕДЕНИЯ ОБ АВТОРАХ:
Екушева Евгения Викторовна — д.м.н., профессор, заведующая кафедрой нервных болезней и нейрореабилитации Академии постдипломного образования ФГБУ ФНКЦ ФМБА России; 125371, Россия, г. Москва, Волоколамское ш., д. 91; старший научный сотрудник лаборатории «Проблемы старения» НИУ «БелГУ»; 308015, Россия, г. Белгород, ул. Победы, д. 85; ORCID iD 0000-0002-3638-6094.
Калинина Наталья Николаевна — к.м.н., ассистент кафедры госпитальной терапии ФГБОУ ВО Тверской ГМУ Минздрава России; 170100, Россия, г. Тверь, ул. Советская, д. 4; ORCID iD 0009-0007-9615-2779.
Пархоменко Екатерина Васильевна — к.м.н., доцент, доцент кафедры неврологии и нейрохирургии с курсом ДПО ФГБОУ ВО АГМУ Минздрава России; 656038, Россия, г. Барнаул, пр-т Ленина, д. 40; ORCID iD 0000-0003-0489-9845.
Хоженко Елена Владимировна — д.м.н., профессор кафедры нервных болезней и нейрореабилитации Академии постдипломного образования ФГБУ ФНКЦ ФМБА России; 125371, Россия, г. Москва, Волоколамское ш., д. 91; ORCID iD 0000-0003-0313-1754.
Контактная информация: Екушева Евгения Викторовна, e-mail: ekushevaev@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 02.02.2024.
Поступила после рецензирования 26.02.2024.
Принята в печать 19.03.2024.
ABOUT THE AUTHORS:
Evgenia V. Ekusheva — Dr. Sc. (Med.), Professor, Head of the Department of Neurological Diseases and Neurorehabilitation, Academy of Postgraduate Education of the Federal Scientific and Clinical Center of the Federal Medical Biological Agency of Russian Federation; 91, Volokolamskoe road, Moscow, 125371, Russian Federation; senior researcher of the Laboratory «Issues of Ageing», Belgorod State University; 85, Pobedy str., Belgorod, 308015, Russian Federation; ORCID iD 0000-0002-3638-6094.
Natalya N. Kalinina — C. Sc. (Med.), assistant of the Department of Hospital Therapy, Tver State Medical University; 4, Sovetskaya str., Tver, 170100, Russian Federation; ORCID iD 0009-0007-9615-2779.
Ekaterina V. Parkhomenko — C. Sc. (Med.), Associate Professor, associate professor of the Department of Neurology and Neurosurgery with the Course of Additional Professional Education, Altai State Medical University; 40, Lenin str., Barnaul, 656038, Russian Federation; ORCID iD 0000-0003-0489-9845.
Elena V. Khozhenko — Dr. Sc. (Med.), professor of the Department of Neurological Diseases and Neurorehabilitation, Academy of Postgraduate Education of the Federal Scientific and Clinical Center of the Federal Medical Biological Agency of Russian Federation; 91, Volokolamskoe road, Moscow, 125371, Russian Federation; ORCID iD 0000-0003-0313-1754.
Contact information: Evgenia V. Ekusheva, e-mail: ekushevaev@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 02.02.2024.
Revised 26.02.2024.
Accepted 19.03.2024.
Информация с rmj.ru





