Клинический случай метастазов рака тела матки в кожу лобковой области
Содержание статьи
Введение
Злокачественные заболевания органов репродуктивной системы занимают 39% в структуре заболеваемости женского населения. Опухоли половых органов составляют 18% от всех злокачественных заболеваний у женщин. Среди злокачественных заболеваний органов репродуктивной системы рак тела матки (РТМ) стоит на 2-м месте, пропуская вперед рак молочной железы (20,9%) и новообразования кожи (14,6%, с меланомой — 16,5%) [1].
За последние десятилетия отмечается неуклонный рост заболеваемости РТМ, только за период с 1970 по 1995 г. данный показатель возрос на 55%. Следует отметить, что существуют различия по распространенности РТМ: у женщин западных стран данный показатель выше по сравнению с восточными. Прирост заболеваемости РТМ, по данным на 2017 г., составил 39,6% по сравнению с 2016 г., ежегодный темп прироста — более 3%. В 2017 г. выявлен 26 081 новый случай заболевания РТМ [2, 3].
На основании данных литературы до недавнего времени рак эндометрия расценивался как заболевание старческого возраста, однако данные современной статистики противоречат этой теории, поскольку около 40% всех случаев РТМ встречаются у женщин репродуктивного и пременопаузального возраста. В последние годы прирост заболеваемости отмечается среди женщин различных возрастных групп. Так, в возрастной группе до 29 лет за 10 лет прирост составил 49,53%, в возрастной группе 30–39 лет — 16,4%, в группе 40–49 лет — 21,9% и в группе 50–59 лет — 22,21%. Рост заболеваемости среди пациенток молодого возраста является особенно тревожным фактом, т. к. может негативно сказываться на уровне естественного прироста населения [1, 4].
Увеличение заболеваемости РТМ обусловлено отчасти общим старением населения, однако немаловажными факторами являются рост частоты нарушений в гипоталамо-гипофизарной системе с развитием ановуляторных циклов и, вследствие возникающей на этом фоне гиперэстрогении, формирование гормонозависимых гинекологических заболеваний. Как известно, риск развития рака эндометрия многократно возрастает в случае сочетания гинекологической патологии с метаболическим синдромом, для которого характерно развитие нарушений в разных отделах эндокринной системы. Такие патологические состояния, как инсулинорезистентность, повышенная активность гормона лептина в жировой клетчатке, способствуют трансформации доброкачественных пролиферативных процессов в эндометрии и формированию предраковых изменений, а впоследствии по совокупности механизмов приводят к развитию злокачественной опухоли [3].
РТМ отличается разнообразием морфологической структуры, разной чувствительностью к проводимому лечению, а также агрессивным течением и неблагоприятным прогнозом. Хорошо известно 2 теории развития рака эндометрия, разделяющих данное заболевание на 2 типа исходя из особенностей патогенеза. К I типу относится гормонозависимый рак, формирующийся в условиях эстрогениндуцированного митогенеза, чаще представленный высокодифференцированной эндометриоидной аденокарциномой. Данный тип опухоли характеризуется относительно доброкачественным и менее агрессивным течением, обладает высокой чувствительностью к гормональной терапии за счет наличия большого количества рецепторов прогестерона и эстрадиола. Второй тип не связан с гормональной активностью в эндометрии и развивается при отсутствии гиперэстрогенемии. Злокачественная опухоль, принадлежащая ко II типу, отличается агрессивным течением, характеризуется наличием низкодифференцированных и неэндометриоидных типов клеток, склонных к активному метастазированию и быстрому локорегионарному распространению [3, 5].
Тактика ведения пациенток с диагнозом РТМ после морфологической верификации процесса строится на гистологической структуре опухоли, клинической стадии онкопроцесса, а также с учетом возраста пациентки и сопутствующей соматической патологии. Немаловажным является определение в клетках опухоли экспрессии рецепторов к стероидным гормонам, что играет большую роль в лечении первично распространенных стадий онкопроцесса, при наличии отдаленных метастазов и рецидивов опухолевого процесса после ранее перенесенного лечения. Течение РТМ отличается высокой гетерогенностью. Отдаленные метастазы РТМ чаще поражают печень, кости и легкие, однако существуют упоминания и о нетипичных локализациях метастатических очагов. Решение вопроса о проведении противоопухолевого лечения при рецидивах РТМ всегда является сложной клинической задачей.
Клиническое наблюдение
Больная Д., 71 год, находится под наблюдением врача-онкогинеколога в онкологическом диспансере г. Москвы. В анамнезе в 2014 г. в возрасте 65 лет пациентка перенесла комбинированное лечение по поводу РТМ. Диагноз установлен на основании гистологического исследования материала после раздельного диагностического выскабливания. На основании дополнительного предоперационного обследования — УЗИ органов малого таза выявлены признаки патологии эндометрия, признаки распространенного опухолевого процесса отсутствовали. Больной первым этапом было выполнено хирургическое лечение в объеме экстирпации матки с придатками и оментэктомии. Выполнение оментэктомии было обусловлено наличием опухоли в структуре левого яичника, что оказалось интраоперационной находкой. После гистологического исследования удаленного материала было установлено наличие умеренно дифференцированной эндометриоидной аденокарциномы с инвазией в миометрий на 2 мм и распространением на цервикальный канал и ткань левого яичника. На основании морфологического заключения выставлен диагноз: РТМ T3аN0M0G2. Среди сопутствующих диагнозов у пациентки диагностирована гипертоническая болезнь III стадии, риск сердечно-сосудистых осложнений 4, инсулинзависимый сахарный диабет 2 типа тяжелого течения, ожирение II степени.
Учитывая стадию опухолевого процесса, в составе комбинированного специального противоопухолевого лечения, пациентке была проведена сочетанная лучевая терапия в суммарной дозе 40 Гр. Проведение химиотерапии было нецелесообразно в связи с тяжелой соматической патологией. В период с 2014 г., после окончания лечения, до 2017 г. пациентка находилась на диспансерном наблюдении с периодическим обследованием 1 раз в 3 мес.: признаков рецидива заболевания не выявлено. При очередном посещении онкогинеколога в июне 2017 г. у пациентки выявлены множественные плоские багрово-розовые очаги с тенденцией к слиянию на коже лобка и промежности с участками изъязвлений (рис. 1).
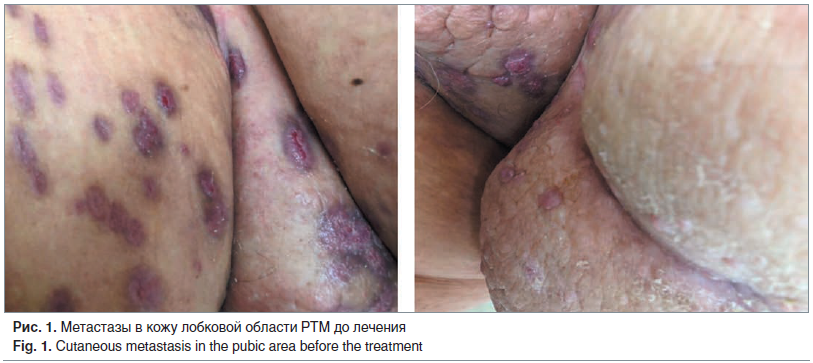
Выполнена биопсия патологических новообразований кожи. По результатам гистологического и иммуногистохимического исследований установлена морфологическая структура, соответствующая умеренно дифференцированной аденокарциноме. При дополнительном исследовании выявлено наличие экспрессии рецепторов к эстрогенам в клетках опухоли. Учитывая верифицированный рецидив РТМ с метастазами в кожу, наличие рецепторов к эстрогенам, а также противопоказания к химиотерапии в связи с тяжелой соматической патологией, пациентке рекомендовано проведение гормонотерапии с применением ингибитора ароматазы — анастрозола 1 мг/сут непрерывно согласно действующим рекомендациям [3, 6].
Оценка результата гормонотерапии проведена через 8 мес. от начала лечения. При осмотре выявлено значительное клиническое улучшение в виде уменьшения количества метастатических очагов на коже и частичной эпителизации на месте ранее изъязвленных очагов (рис. 2). За период наблюдения отмечается положительная динамика: постепенное исчезновение имевшегося ранее метастатического поражения, новые очаги за время терапии не выявлены.
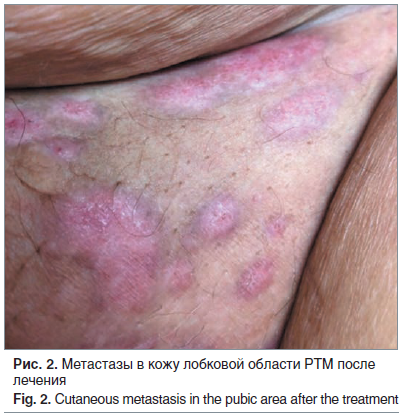
На момент написания статьи у пациентки установлена ремиссия, продолжительность жизни от момента верификации рецидива РТМ составила 6 мес. За период наблюдения не выявлено существенных негативных побочных явлений проводимой терапии. В течение первых 2 мес. пациентка отмечала приливы умеренной интенсивности, которые самостоятельно купировались через 8 нед.
Обсуждение
При распространенном РТМ резко возрастает риск как лимфогенного (с вовлечением регионарных лимфоузлов), так и гематогенного (с поражением печени, костей и легких) метастазирования. В настоящее время все чаще встречаются случаи атипичного метастазирования РТМ, например с развитием очагов в головном мозге. Метастазы РТМ в кожу являются крайне редкой локализацией и встречаются менее чем в 1% случаев [7, 8].
Метастатическое поражение кожи наиболее часто связано с прогрессированием рака молочной железы, яичников, легких и толстой кишки. С 1966 по 2014 г. в литературе описано около 30 случаев метастазирования рака эндометрия в кожу, таким образом, каждый клинический случай столь редкой патологии достоин отражения в литературе [9–11].
При подозрении на наличие метастазов опухоли в кожу у пациенток с первичным диагнозом РТМ обязательным условием постановки диагноза является морфологическая верификация процесса методом биопсии. Именно биопсия дает возможность дифференцировать истинное метастатическое поражение кожи от паранеопластического дерматоза, представляющего собой совокупность доброкачественных заболеваний и симптомов поражения кожи, возникающих под влиянием злокачественных опухолей различной локализации. Паранеопластический дерматоз является частным случаем паранеопластического синдрома и развивается в результате воздействия секретируемых опухолью биологически активных белков или полипептидов, факторов роста, интерлейкинов, цитокинов, простагландинов, эмбриональных (раково-эмбрионального антигена или α-фетопротеина) и других протеинов (иммуноглобулинов), а также энзимов. Кроме того, большую роль играет образование аутоиммунных и иммунных комплексов в условиях иммуносупрессии, а также блокирование действия нормальных гормонов биологически неактивными гормонами, продуцируемыми опухолью. Паранеопластический дерматоз может быть следствием генерализации опухолевого процесса и проявляет крайнюю резистентность к проводимому лечению [12].
Морфологически верифицированные метастазы РТМ в кожу характеризуются неблагоприятным прогнозом.
Наиболее часто среди всех случаев метастазирования РТМ в кожу наблюдается поражение в области первичной опухоли или ранее проведенного лечения (кожа наружных половых органов, промежности), однако в литературе встречаются указания на отдаленные метастазы в область волосистой части головы, стоп. Клинически кожные метастазы могут принимать любую форму, включая узелки, папулы, язвы, бляшки [13].
Количество метастазов варьирует от единичных очагов до множественных поражений сливного характера, как в описанном нами клиническом случае. Продолжительность жизни после выявления метастазов в кожу в большинстве случаев не превышает 4–12 мес. ввиду генерализации опухолевого процесса [10].
Стандартным подходом в лечении рецидивов РТМ являются химиотерапия, лучевое лечение или гормонотерапия при наличии рецепторов к стероидным гормонам, однако в каждом клиническом случае виды лечения определяются строго индивидуально. Гормонотерапия является одним из альтернативных методов лечения рецидивов РТМ [7]. Применение ингибиторов ароматазы у пациенток с первично распространенным РТМ и рецидивами данного заболевания показало статистически значимую эффективность, обусловленную супрессией рецепторов к эстрогенам и антипролиферативной активностью, при минимальных побочных эффектах. Ранее проведенные исследования также показали, что ингибиторы ароматазы эффективны вне зависимости от уровня активности ароматазы в клетках опухоли [6, 14].
Заключение
Таким образом, описанное в данной статье клиническое наблюдение подтверждает эффективность ингибиторов ароматазы в терапии рецидивов эндометриоидного РТМ с метастазами в кожу при противопоказаниях к другим видам специального противоопухолевого лечения. При наличии рецепторов к стероидным гормонам возможно проведение гормонотерапии с выраженным клиническим эффектом. По данным клинических наблюдений, этот вид лечения обладает достаточной эффективностью наряду с хорошей переносимостью и минимальным количеством побочных эффектов, что особенно важно в случаях соматической отягощенности у пациенток. Описание данной клинической ситуации несет научную ценность, поскольку метастатическое поражение кожи в результате рецидива РТМ встречается крайне редко.
Сведения об авторах:
1Венедиктова Марина Георгиевна — д.м.н., профессор, ORCID iD 0000-0001-7783-4917;
2Тер-Ованесов Михаил Дмитриевич — д.м.н., профессор, ORCID iD 0000-0001-7335-895X;
1Морозовa Ксения Владимировна — к.м.н., ассистент кафедры, ORCID iD 0000-0002-3732-0070.
1ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России. 117997, Россия, г. Москва, ул. Островитянова, д. 1.
2ФГАОУ ВО РУДН. 117198, Россия, г. Москва, ул. Миклухо-Маклая, д. 6.
Контактная информация: Морозовa Ксения Владимировна, e-mail: morozovadk@mail.ru. Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах. Конфликт интересов отсутствует. Статья поступила 27.12.2018.
About the authors:
1Marina G. Venediktova — MD, PhD, Professor, ORCID iD 0000-0001-7783-4917;
2Mikhail D. Ter-Ovanesov — MD, PhD, Professor, ORCID iD 0000-0001-7335-895X;
1Kseniya V. Morozova — MD, PhD, assistant, ORCID iD 0000-0002-3732-0070.
1Pirogov Russian National Research Medical University. 1, Ostrovityanov str., Moscow, 117437, Russian Federation.
2Peoples’ Friendship University of Russia. 6, Miklukho-Maklaya str., Moscow, 117198, Russian Federation.
Contact information: Kseniya V. Morozova, e-mail: morozovadk@mail.ru. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. There is no conflict of interests. Received 27.12.2018.
Информация с rmj.ru






