Содержание статьи
Клиническая эффективность масляной кислоты и инулина в
купировании болевого синдрома у пациентов с синдромом раздраженной кишки
М. Д. Ардатская*, доктор медицинских наук, профессор
Т. Б. Топчий*, кандидат медицинских наук
Ю. Н. Лощинина**, кандидат медицинских наук
М. А. Калашникова***
* ФГБУ ДПО ЦГМА УД Президента РФ, Москва
** ФБУЗ Лечебно-реабилитационный центр Минэкономразвития России, Москва
*** ФГБУ «Объединенная больница с поликлиникой» УД Президента РФ, Москва
Синдром раздраженной кишки (СРК) представляет собой функциональное
расстройство кишечника, при котором боль или дискомфорт в животе связаны с актом
дефекации или изменениями его частоты [1].
Абдоминальная боль является обязательным элементом клинической картины СРК. У
80% пациентов боль в животе является причиной обращения к врачу [2], у 70% —
ведущей причиной, приводящей к снижению качества жизни [3].
Согласно Римским критериям III для купирования боли при СРК применяются
различные группы спазмолитиков. На основании метаанализа 22 рандомизированных
плацебо-контролируемых исследований (n = 1778), посвященных изучению
эффективности двенадцати спазмолитических препаратов для лечения абдоминальной
боли у больных СРК (циметропия бромид, гиосцина бутилбромид, тримебутина малеат,
мебеверина гидрохлорид, альверина цитрат, отилония бромид, дицикловерина
гидрохлорид, пирензипин, прифиния бромид, пропинокс и росиверин), было показано,
что эффективность данной группы препаратов составляет 53–61% (эффективность
плацебо 31–41%, p < 0,05) [4]. Лечение больных СРК до сих пор остается трудной
задачей, нередко бывает сложно добиться полного и стойкого купирования боли.
Назначение длительной терапии, эффективность которой в ходе лечения снижается,
требует смены лекарственных препаратов. Это диктует необходимость поиска новых
терапевтических подходов, с учетом открывающихся патофизиологических механизмов
формирования болезни, позволяющих повысить эффективность лечения больных СРК.
В настоящее время в качестве первичного патофизиологического механизма,
который обуславливает возникновение и интенсивность абдоминальной боли и
моторных нарушений кишечника при СРК, рассматривается висцеральная
гиперчувствительность (ВГЧ). ВГЧ — это повышенная чувствительность к
периферическим стимулам (механическим, термическим, химическим и др.),
проявляющаяся возникновением болевых ощущений, моторных и секреторных нарушений
в ответ на допороговые стимулы. По данным исследований, выраженность ВГЧ
достоверно коррелирует с симптомами СРК [5]. Поэтому важным аспектом лечения
абдоминальной боли при СРК является не только купирование спазма, но и снижение
ВГЧ.
Одним из терапевтических подходов, позволяющих контролировать ВГЧ при СРК,
является применение масляной кислоты. В настоящий момент накоплено значительное
количество как экспериментальных [6], так и клинических данных [7–11],
демонстрирующих эффективность масляной кислоты в уменьшении интенсивности и
частоты абдоминальной боли у пациентов с СРК. Масляная кислота запатентована в
странах Европейского Союза как средство для снижения ВГЧ [12].
В РФ зарегистрирован препарат масляной кислоты — Закофальк, содержащий
масляную кислоту в виде бутирата кальция 250 мг и инулин (250 мг) с таргетной
доставкой непосредственно в толстую кишку.
Целью нашего исследования была оценка клинической эффективности Закофалька в
купировании абдоминальной боли в составе комплексной терапии пациентов с СРК.
В задачи исследования входила оценка влияния Закофалька в составе комплексной
терапии СРК на течение болевого синдрома (степень купирования и изменение
интенсивности), а также на другие симптомы — метеоризм, частоту и консистенцию
стула.
Материалы и методы исследования
В интервенционное проспективное сравнительное исследование были включены 110
пациентов, обращавшихся за амбулаторной помощью к гастроэнтерологу в четыре
медицинских центра г. Москвы: ГБУЗ «ГКБ № 51 ДЗМ» (клиническая база ФГБУ ДПО «ЦГМА»
УД Президента РФ), Филиал № 2 ФБУЗ «Лечебно-реабилитационный центр
Минэкономразвития России», ФГБУ «Объединенная больница с поликлиникой» УД
Президента РФ, ООО Клиника «Эхинацея».
Диагноз СРК устанавливался на основании исключения органической патологии
желудочно-кишечного тракта (ЖКТ) по результатам проведенного современного
клинического и лабораторно-инструментального обследования и соответствия
клинической картины Римским критериям III (2006).
В исследование не включались пациенты с тяжелой соматической патологией
(сердечно-сосудистая патология, дыхательная недостаточность и др.),
онкологическими заболеваниями любых органов и систем. Из итогового анализа
исключали пациентов, которые в период исследования принимали нерекомендованные и
неразрешенные препараты (психотропные препараты, анальгетики, антибиотики,
комбинации спазмолитиков, прокинетики, пробиотики, месалазин), не посещали врача
в рекомендованные сроки и самовольно отменяли прием или изменяли режим и дозу
препаратов.
В исследовании принимали участие пациенты с различными подтипами СРК: СРК с
запором, СРК с диареей, СРК смешанный, которые были разделены на две группы
исходя из проводимого лечения.
Первая группа — 55 больных получали «стандартную» терапию СРК, которая
включала препараты, направленные на купирование симптомов, согласно Римскому
консенсусу III и российским рекомендациям по диагностике и лечению СРК и
доступные на фармрынке РФ [1, 13].
Вторая группа — 55 больных также получали «стандартную» терапию в комбинации
с препаратом Закофальк по 1 таблетке 3 раза в день.
Стандартная терапия включала:
- СРК с запором — спазмолитик + Мукофальк в индивидуально подобранной дозе
3–6 пакетов в день. - СРК с диареей — спазмолитик + лоперамид в стандартной дозе в режиме «по
требованию». - СРК смешанный — спазмолитик + Мукофальк в индивидуально подобранной дозе
1–3 пакета при преобладании диареи, 4–6 пакетов при преобладании запора.
Длительность терапии составила 4 недели в обеих группах.
Дизайн исследования включал 2 визита (рис. 1).
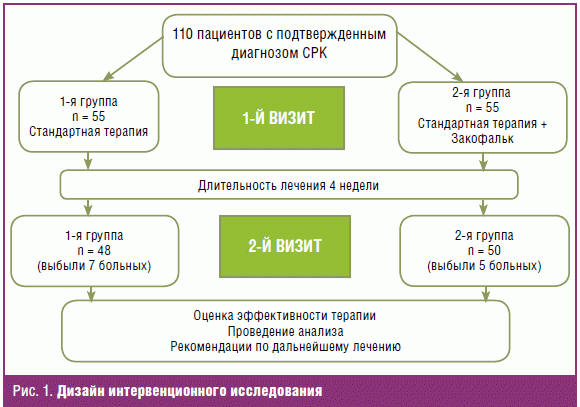
Критериями оценки эффективности проводимой терапии служила динамика
клинических симптомов (полное купирование симптома, улучшение, отсутствие
эффекта) на основании индивидуального дневника пациента:
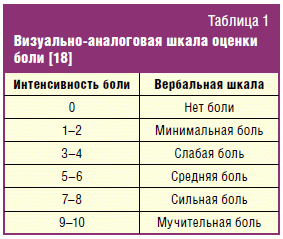
- боль в животе — степень выраженности и интенсивность по
визуально-аналоговой шкале (ВАШ), от 1 до 10, где 0 — отсутствие боли, 10 —
максимальная боль (табл. 1); - метеоризм — степень выраженности;
- стул — частота в день и консистенция по Бристольской шкале.
Также мы оценивали субъективную удовлетворенность терапией пациентов по
3?балльной шкале (1 — не удовлетворен, 2 — частично удовлетворен, 3 — полностью
удовлетворен).
Пациентов также просили отмечать все нежелательные явления во время
проводимой терапии.
Через 4 недели ко второму визиту из первой группы выбыли 7 пациентов (4 не
явились, 3 самостоятельно изменили схему терапии, применяя не предусмотренные
дизайном препараты), из второй группы выбыли 5 пациентов (4 не явились, 1
пациент не заполнял в динамике индивидуальный дневник).
Таким образом, в итоге нами проанализированы результаты лечения 98 пациентов
с СРК. Возраст пациентов от 19 до 50 лет, средний возраст 34,53 ± 15,5 лет.
Женщин — 66 (67%), мужчин — 34 (33%). Группы были сопоставимы по полу, возрасту
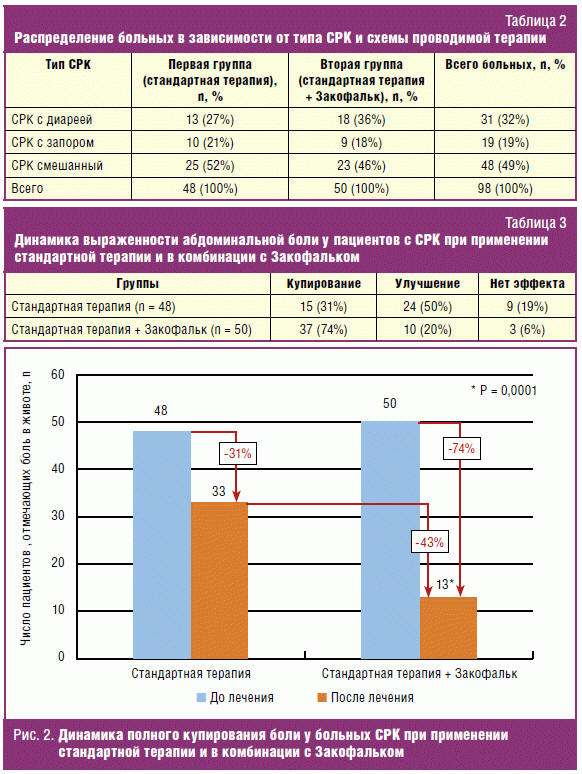
и типу СРК. Распределение пациентов по подтипам СРК и группам в зависимости от
проводимой терапии представлено в табл. 2.
Статистическая обработка полученных в ходе исследования результатов
проводилась с помощью программы Statistica for Windows 6.0 (StatSoft Inc.). Для
оценки динамики болевого синдрома в обеих группах использовали стандартный тест
χ2 с поправкой Pearson. Для сравнения интенсивности абдоминальной боли у
пациентов основной группы и группы сравнения применяли U-тест Манна–Уитни.
Результаты исследования
До лечения абдоминальная боль отмечалась у всех пациентов с СРК в обеих
группах. В результате лечения положительный эффект в отношении боли отмечен в
обеих группах, у 39 пациентов (81%), получавших стандартную терапию, и у 47
(94%) пациентов, получавших дополнительно Закофальк (табл. 3).
При этом полное купирование боли (0 баллов по шкале ВАШ) получено у
достоверно значительно большего количества больных в группе, получавшей
стандартную терапию в комбинации с Закофальком (37 пациентов, 74%), по сравнению
с больными только на стандартной терапии (15 пациентов, 31%) (р = 0,0001).
Таким образом, в отношении полного купирования боли у пациентов с СРК
Закофальк демонстрирует дополнительный эффект к спазмолитикам у 43% пациентов
(рис. 2).
Нами были проанализированы сроки наступления эффекта полного купирования
абдоминальной боли в обеих группах. Как видно из рис. 3, практически у всех
пациентов с СРК с полным исчезновением абдоминальной боли эффект отмечался к
21?му дню терапии. Однако в группе с Закофальком полное купирование боли
наступало раньше, уже к 14?му дню терапии у достоверно большего числа больных
(56%), по сравнению с группой получавших только стандартную терапию (19%) (р =
0,0003).
Интенсивность абдоминальной боли по ВАШ до лечения составила в группе
стандартной терапии 7,1 ± 1,4 балла и 7,4 ± 0,8 балла (сильная боль) в группе
получавших комбинацию с Закофальком. Сравнительный анализ показал, что
интенсивность боли была достоверно выше (p < 0,05) у пациентов со смешанным
типом СРК, чем у пациентов с преобладанием запора или диареи. Эти данные
соотносятся с результатами других исследований, в которых изучалась
интенсивность боли у пациентов с разными типами СРК [19, 25]. Как видно из
данных, представленных на рис. 4, на фоне приема Закофалька отмечалось
достоверно более выраженное снижение интенсивности болевого синдрома у
пациентов, получавших комбинацию стандартной терапии с Закофальком, — 1,94 балла
по шкале ВАШ (минимальная боль) по сравнению с только стандартной терапией
спазмолитиками — 4,8 по ВАШ (слабая боль) (р < 0,05).
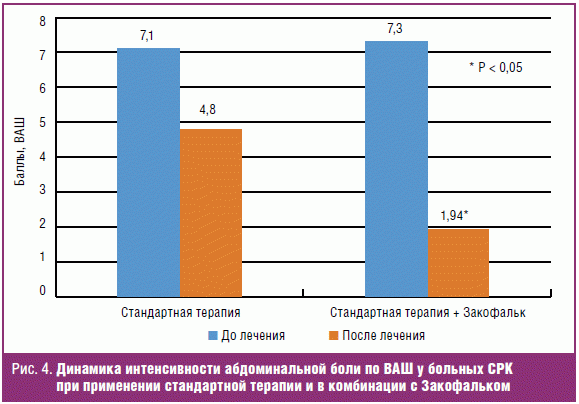
Таким образом, включение Закофалька в комбинацию со спазмолитиками позволяет
значительно снизить интенсивность болевого синдрома у больных СРК.
Метеоризм до лечения отмечался у 39 (81%) пациентов в группе стандартной
терапии и у 34 (68%) больных в группе получавших стандартную терапию в
комбинации с Закофальком. После лечения отмечена положительная динамика у всех
пациентов с СРК, выражавшаяся в купировании или уменьшении метеоризма. Метеоризм
сохранялся у 10 (26%) больных первой группы и 7 (18%) больных второй группы, но
выраженность его уменьшилась. Данные статистически недостоверны (р = 0,94).
Нами проанализирована эффективность проводимой терапии в отношении
нормализации стула у пациентов с разными типами СРК.
У пациентов с СРК с преобладанием запора в обеих группах было достигнуто
клиническое улучшение. Нормализация частоты и консистенции (3–4 тип по
Бристольской шкале стула) была отмечена у 90% больных в первой группе и у 89%
больных второй группы, данные статистически недостоверны (р = 0,71).
У всех пациентов с СРК с преобладанием диареи также отмечалось клиническое
улучшение. Частота стула нормализовалась в группе пациентов, получавших
комбинированную терапию с Закофальком, и составила 1 раз в сутки, в группе без
Закофалька — 3 раза в сутки (p < 0,05). Консистенция стула у всех пациентов в
группе с Закофальком также нормализовалась, преобладал 3–4 тип стула по
Бристольской шкале кала, тогда как в группе на стандартной терапии сохранялся
5?й тип. Важно отметить, что у пациентов с преобладанием диареи, получавших
комбинацию стандартной терапии с Закофальком, не потребовался прием лоперамида,
нормализация как частоты, так и консистенции стула отмечалась уже к концу первой
недели у 96% пациентов.
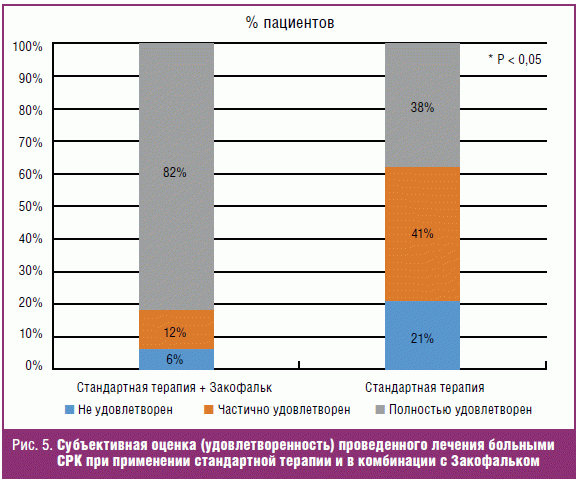
Более выраженный положительный эффект в отношении симптомов СРК у больных,
получавших Закофальк, нашел свое отражение и в субъективной оценке пациентами
проведенной терапии (рис. 5). Подавляющее большинство (82%) больных в группе
получавших комбинацию стандартной терапии с Закофальком отметили в анкетах
«полную удовлетворенность» от проведенной терапии, по сравнению с группой без
Закофалька (38%) (p < 0,05). После 4?недельного курса лечения практически все
пациенты, ответившие на терапию Закофальком, изъявили желание продолжить его
прием, в связи с чем им была продолжена терапия Закофальком в монотерапии в
поддерживающей дозе 2 таблетки в сутки.
В течение проводимого лечения каких-либо осложнений, побочных эффектов у
пациентов, получавших Закофальк, отмечено не было.
Таким образом, результаты нашего исследования демонстрируют, что комбинация
Закофалька со стандартной спазмолитической терапией позволяет значительно
повысить эффективность терапии болевого синдрома у пациентов с СРК, а также
эффективно контролировать диарею.
Обсуждение результатов исследования
В нашем исследовании при назначении базовой терапии у пациентов с СРК мы
отталкивались от перечня лекарственных препаратов согласно Римским критериям III
(табл. 4) и российским рекомендациям по диагностике и лечению СРК и доступных на
фармрынке РФ.

В качестве спазмолитика рекомендовался прием одного из следующих препаратов в
регламентированных инструкцией дозах (пинаверий 200 мг/сут, гиосцин 60 мг/сут,
альверин 120 мг/сут, тримебутин 600 мг/сут). Согласно данным Кохрановского
обзора, различные спазмолитики с пролонгированным действием более эффективны,
чем плацебо, в лечении СРК, наиболее эффективными из которых признаны пинаверий
и тримебутин [14]. В отдельных метаанализах доказаны преимущества альверина и
пинаверия в комбинации с симетиконом [15], а также гиосцина [4]. Как уже
указывалось выше, общая эффективность данной группы препаратов составляет 53–61%
[4]. Таким образом, как и в работе Маева и соавт. [11], мы рассматривали все
четыре доступных в РФ спазмолитика эффективными для купирования боли.
Эффективность Мукофалька (псиллиума) при СРК подтверждена результатами
нескольких метаанализов [4, 16, 17], что позволяет рекомендовать его в качестве
препарата первой линии у пациентов с СРК с запорами. Включение Мукофалька в
схему терапии связано также с уникальным механизмом действия, позволяющим
применять его как при запоре в высоких дозах, так и при диарее в низких, что
особенно важно у пациентов со смешанным типом СРК, позволяющим корректировать
режим приема в процессе лечения. Кроме того, псиллиум демонстрирует лучшую
переносимость в отношении метеоризма, по сравнению с нерастворимыми пищевыми
волокнами (отруби) и лактулозой, что также является важным моментом в лечении
СРК.
Препараты базовой терапии направлены на купирование того или иного ведущего
симптома — боль, запор, диарея. Включение в состав базовой терапии препаратов,
влияющих на патофизиологические механизмы СРК (ВГЧ, воспаление, нарушение
микрофлоры и др.), позволяет значительно повысить эффективность терапии, что и
было продемонстрировано в нашем исследовании.
За счет каких механизмов реализуется такой эффект Закофалька в отношении
абдоминальной боли при СРК? Масляная кислота, входящая в состав Закофалька,
является одной из основных короткоцепочечных жирных кислот, продуцируемых
нормальной сахаролитической микробиотой толстой кишки. Ключевая роль масляной
кислоты (бутирата) как основного источника энергии и метаболического регулятора
для здоровых клеток толстого кишечника (колоноцитов), а также как регулятора
клеточных функций и пролиферации хорошо известна [20]. В последние годы
накоплены значительные данные и о влиянии масляной кислоты на ВГЧ. В двойном
слепом плацебо-контролируемом перекрестном исследовании S. A. Vanhoutvin с соавт.
[6] был показан эффект ректального введения масляной кислоты на ВГЧ у здоровых
добровольцев. Результаты исследования показали, что введение масляной кислоты
повышало пороги болевой чувствительности и снижало дискомфорт. При этом отмечен
дозозависимый эффект бутирата: чем выше доза, тем больше снижалась ВГЧ.
На сегодняшний день выяснены три возможных молекулярных механизма,
объясняющих влияние масляной кислоты на снижение висцеральной
гиперчувствительности и, соответственно, уменьшение болевых ощущений [21].
Во?первых, путем прямой модуляции активности 5?гидрокситриптамина (серотонина) —
важного нейротрансмиттера, выделение которого стимулирует бутират, что может
приводить к повышению адаптации рецепторного аппарата кишки к растяжению.
Во?вторых, бутират инактивирует активность TRPV1?рецепторов в слизистой оболочке
толстой кишки путем повышения концентрации внутриклеточного Са++.
TRPV1?рецепторы являются компонентом эндогенной ванилоидной системы организма и
одним из важнейших интеграторов болевых и воспалительных стимулов. Масляная
кислота, выступая в данном случае своеобразным антагонистом данного вида
рецепторов, может уменьшить чувствительность сенсорных нейронов кишки и тем
самым предотвратить развитие болевых ощущений. В?третьих, показано, что масляная
кислота может снизить ВГЧ через ингибирование гистондезацетилазы (HDAC), что
приводит к апоптозу микроглии и предотвращает повреждение рецепторного аппарата
кишки.
В настоящее время накоплено достаточное количество данных, которые показывают
взаимосвязь между субклиническим воспалением в слизистой оболочке толстой кишки
и повреждением энтеральной нервной системы у больных с постинфекционным СРК и
СРК, которое приводит к изменению ВГЧ и формированию болевых ощущений. С этой
точки зрения применение Закофалька также оправдано, поскольку доказано прямое
противовоспалительное действие масляной кислоты. Под действием бутирата
происходит снижение секреции провоспалительных цитокинов, таких как ФНО-α, оксид
азота, γ-интерферона, интерлейкинов (ИЛ-2, ИЛ-12, ИЛ-8), снижается кишечная
экспрессия TLR-4, избыточная продукция которого приводит к воспалению кишечника.
Бутират также стимулирует высвобождение противовоспалительного цитокина ИЛ-10
[22]. Несомненным преимуществом Закофалька является его инновационная
лекарственная форма, позволяющая высвобождать действующее вещество на протяжении
всей толстой кишки. Это позволяет реализовывать терапевтическое действие
Закофалька в дистальных отделах толстой кишки, где как раз и выявляются признаки
минимального воспаления у пациентов c СРК [23].
Масляная кислота является основным регулятором водно-электролитного обмена в
толстой кишке. Установлено, что бутират поступает в колоноцит в обмен на
гидрокарбонатные ионы. Часть всосавшегося бутирата поступает опять в просвет
кишки в обмен на ионы хлора. Кроме того, всасывание бутирата тесно связано с
всасыванием натрия: блокирование всасывания бутирата блокирует всасывание натрия
и наоборот. Это взаимодействие имеет особое значение, т. к. поступление натрия в
колоноцит определяет всасывание воды. Несомненно, учитывая роль масляной кислоты
в регуляции водно-электролитного баланса в толстой кишке, применение Закофалька
позволяет добиться положительных результатов при использовании у пациентов с СРК
с преобладанием диареи, что и было продемонстрировано в нашем исследовании.
Роль кишечной микробиоты в патогенезе СРК подтверждена во многих
исследованиях. У больных СРК практически всегда имеет место дисбиоз толстой
кишки. С этой точки зрения интерес представляет недавнее исследование,
посвященное изучению состава микробиоты толстой кишки у пациентов с различными
типами СРК и здоровых лиц [24]. У 116 больных СРК и 66 здоровых лиц были
исследованы фекальные образцы методом определения последовательностей 16S рРНК
бактерий толстой кишки. В результате было выявлено значительное достоверное
снижение количества бутират-продуцирующих бактерий у пациентов с СРК с диареей и
СРК смешанного типа, что соотносилось с большей выраженностью клинических
симптомов у этих больных — абдоминальной боли и диареи. С учетом этих данных
Закофальк позволяет восполнить дефицит бутирата у пациентов с СРК. Активность
масляной кислоты в препарате Закофальк потенцируется присутствием инулина,
поскольку последний обладает способностью стимулировать рост бактерий,
продуцирующих бутират, что вносит значительный вклад в эндогенную продукцию
масляной кислоты.
Таким образом, Закофальк позволяет воздействовать на важные
патофизиологические механизмы СРК — ВГЧ, субклиническое воспаление, нарушение
микробиоты, водно-электролитный дисбаланс в толстой кишке, что значительно
повышает эффективность базовой терапии у пациентов с СРК. Наш опыт это наглядно
демонстрирует. Несомненный научный интерес представляют отдаленные результаты
лечения и эффективность Закофалька в качестве поддерживающей терапии, что
является целью наших дальнейших исследований.
Выводы
Результаты нашего исследования показывают несомненные преимущества комбинации
стандартной спазмолитической терапии с Закофальком в купировании болевого
синдрома у пациентов с СРК по сравнению с только стандартной терапией.
На основании полученных данных можно сделать следующие выводы:
1. Применение Закофалька у пациентов с различными типами СРК в составе
стандартной терапии, по сравнению с только стандартной терапией обеспечивает:
- достоверно большую частоту (в 2,4 раза) полного купирования абдоминальной
боли; - достоверно более раннее, уже на второй неделе, полное купирование боли у
56% пациентов (по сравнению с 19% только на стандартной терапии); - достоверно более выраженное снижение интенсивности абдоминальной боли
(минимальная боль по ВАШ); - нормализацию стула (частоты и консистенции) у пациентов с СРК с диареей.
2. Закофальк хорошо переносится пациентами с СРК, нежелательных явлений не
отмечено.
3. Полученные данные в отношении купирования болевого синдрома позволяют
рекомендовать Закофальк в сочетании со спазмолитиками уже на старте терапии СРК,
в первую очередь у пациентов с выраженным болевым синдромом (смешанный тип СРК).
Литература
- Клинические рекомендации по диагностике и лечению взрослых больных
синдромом раздраженного кишечника. 2013. -
Ручкина И. Н. Синдром раздраженного кишечника. Дис. канд. мед.
наук. М., 1996. -
Mangel A., Northcutt A. Review article: the safety and efficacy
of alosetron, a 5?HT3 receptor antagonist, in female irritable bowel syndrome
patients // Aliment. Pharmacol. Ther. 1999; 13 (Suppl. 2): 77–82. -
Ford A. C., Talley N. J., Spiegel B. M. et al. Effect of fibre,
antispasmodics, and peppermint oil in the treatment of irritable bowel
syndrome: systematic review and metaanalysis // BMJ. 2008, Nov 13; 337. -
Макарчук П. А., Халиф И. Л., Михайлова Т. Л., Головенко О. В.
Динамика показателей висцеральной чувствительности у больных с синдромом
раздраженного кишечника при лечении спазмолитиками // Российский журнал
гастроэнтерологии, гепатологии, колопроктологии. 2008. Т. 18. № 1. С. 45–51. -
Vanhoutvin S. A., Troost F. J., Kilkens T. O. et al. The effects
of butyrate enemas on visceral perception in healthy volunteers //
Neurogastroenterol. Motil. 2009; 21 (9): 952–976. -
Banasiewicz T. et al. Microencapsulated sodium butyrate reduces
the frequency of abdominal pain in patients with irritable bowel syndrome //
Colorectal Dis. 2013, Feb. -
Tarnowski W. et al. Outcome of treatment with butyric acid in
irritable bowel syndrome — preliminary report // Gastroenterol Prakt. 2011; 1. -
Scarpellini E. Efficacia del butirrato nel trattamento della
variante diarroica della syndrome del colon irirtabile // Digestive and Liver
Disease. 2007. -
Немцов В. И. Синдром раздраженной кишки (СРК): новые
представления об этиопатогенезе и лечении // Лечащий Врач. 2015. № 6. С. 60. -
Маев И. В., Оганесян Т. С., Кучерявый Ю. А., Черемушкин С. В., Баркова
Т. В., Кривобородова Н. А., Черемушкина Н. В. Комбинированная терапия при
синдроме раздраженного кишечника: контроль моторики кишечника, кишечного
транзита и висцеральной гиперчувствительности // Клинические перспективы
гастроэнтерологии, гепатологии. 2015, № 5. - http://patentscope.wipo.int/search/en/result.jsf.
-
Шептулин А. А. Римские критерии III синдрома раздраженного
кишечника: что мы ожидали и что мы увидели? // Российский журнал
гастроэнтерологии, гепатологии, колопроктологии. 2007. № 2. С. 63–68. -
Ruepert T., Quartero А., de Wit N. et аl. Bulking agents,
antispasmodics and antidepressants for the treatment of irritаblе bowel
syndrome // Cochrane Database Syst Rev. 2011. № 8. CD 003460. -
Martínez-Vázquez M. A., Vázquez-Elizondo G., González-González J. A.,
Gutiérrez-Udave R., Maldonado-Garza H. J., Bosques-Padilla F. J. Effect
of antispasmodic agents, alone or in combination, in the treatment of
Irritable Bowel Syndrome: systematic review and meta-analysis // Rev.
Gastroenterol. Mex. 2012. Vol. 77, № 2. P. 82–90. -
Bijkerk C. J., Muris J. W., Knottnerus J. A., Hoes A. W., de Wit N. J.
Systematic review: the role of different types of fibre in the treatment of
irritable bowel syndrome // Aliment. Pharmacol. Ther. 2004. Vol. 19, № 3. P.
245–251. -
Bijkerk C. J., de Wit N. J., Muris J. W., Whorwell P. J., Knottnerus
J. A., Hoes A. W. Soluble or insoluble fibre in irritable bowel syndrome
in primary care? Randomised placebo controlled trial // Br. Med. J. 2009. Vol.
339. B3154. -
Wewers M. E., Lowe N. K. A critical review of visual analogue
scales in the measurement of clinical phenomena // Res. Nurs. Health. 1990. -
Ивашкин В. Т., Шептулин А. А., Соловьева А. Д., Полуэктова Е. А.,
Белхушет С., Марданова О. А. Новые возможности патогенетического лечения
синдрома раздраженного кишечника // Российский журнал гастроэнтерологии,
гепатологии, колопроктологии. 2007. № 6. С. 37–40. -
Wong J. M., de Souza R., Kendall C. W., Emam A., Jenkins D. J.
Colonic health: fermentation and short chain fatty acids // J Clin
Gastroenterol. 2006; 40: 235–243. - Pradeep Kannampalli, Reza Shaker, Jyoti N. Sengupta. Colonic Butyrate-
algesic or analgesic? // Neurogastroenterol Motil. 2011; 23 (11): 975–979. -
Hamer Н., Jonkers D., Venema K. et al. Review article: the role
of butyrate on colonic function // Aliment. Pharmacol. Ther. 2008. Vol. 27. P.
104–119. -
Корниенко Е. А., Типикина М. Ю. Результаты исследования
эффективности пробиотиков и коррекции моторики кишечника у детей // Фарматека.
2014, № 2, с. 33–37. -
Pozuelo M. et al. Reduction of butyrate- and methane-producing
microorganisms in patients with Irritable Bowel Syndrome // Sci. Rep. 2015, 5,
12693; doi: 10.1038/srep12693. -
Dorofeyev A. E., Kiriyan E. A., Vasilenko I. V., Rassokhina O. A.,
Elin A. F. Clinical, endoscopical and morphological efficacy of
mesalazine in patients with irritable bowel syndrome // Clinical and
Experimental Gastroenterology. 2011: 4; 141–153.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru






