Содержание статьи
- 1 Кальций и витамин D3 — базисная фармакотерапия соматической полиморбидности
- 1.0.1 Патогенетическое понимание роли кальция и витамина D в генезе соматической полиморбидности
- 1.0.2 Группы лиц, требующих обязательного обследования уровня кальция и витамина D
- 1.0.3 Кальций снижает риск развития сердечно-сосудистых осложнений
- 1.0.4 Безопасность применения комбинированных препаратов кальция и витамина D3
- 1.0.5 Выбор методов коррекции и доз кальция и витамина D в базисной стратегии ведения пациентов с полиморбидностью
Кальций и витамин D3 — базисная фармакотерапия соматической полиморбидности
А. В. Наумов, доктор медицинских наук, профессор
А. Л. Вёрткин, доктор медицинских наук, профессор
ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
Хорошо известно, что недостаточное поступление в организм витамина D и кальция в любом возрасте оказывает отрицательное влияние на костную ткань, поскольку приводит к развитию рахита у детей младшего возраста, замедляет набор костной массы при формировании скелета у подростков, а также служит причиной ускоренной потери костной массы у взрослых лиц обоих полов, что сопровождается развитием остеопороза.
Важно заметить, что в эпидемиологических и клинических интервенционных исследованиях, а также в моделях заболеваний человека на животных были получены доказательства того, что низкий уровень витамина D и недостаточное потребление кальция с пищей повышают вероятность развития множества других заболеваний, включая различные типы злокачественных опухолей, хронические инфекции, воспалительные и аутоиммунные заболевания, метаболические нарушения, а также артериальную гипертензию и сердечно-сосудистые заболевания.
Данные обстоятельства требуют пересмотра и понимания роли кальция и витамина D в терапии больных с соматической полиморбидностью. В качестве доказательства взаимосвязи дефицита кальция и витамина D с соматической полиморбидностью прежде всего стоит привести известные факты в соответствии с уровнем доказательности, что было сделано в работе М. Peterlik и соавт. [1] (табл.).
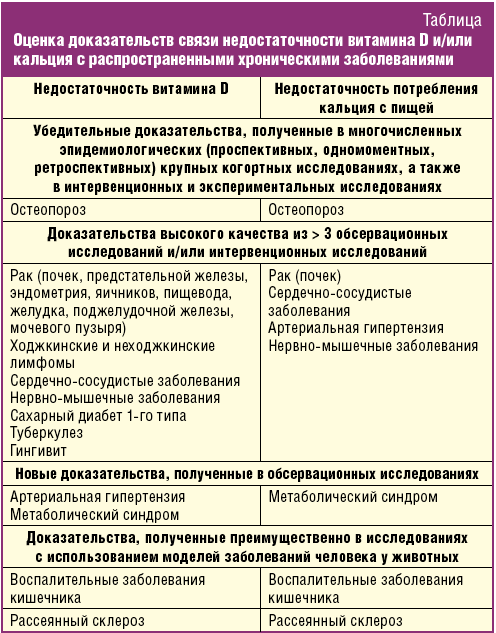
Патогенетическое понимание роли кальция и витамина D в генезе соматической полиморбидности
Многие типы клеток экспрессируют кальций-чувствительные рецепторы (CaR), которые способны реагировать на изменения концентрации кальция продолжительностью несколько минут; вследствие этого ионы кальция служат «первичным посредником» для различных клеточных реакций [2].
Усиление сигналов от внеклеточного кальция, в свою очередь, посредством связи рецепторов с активирующими либо тормозящими G-белками передается через различные внутриклеточные сигнальные пути. Экспрессия функционирующих CaR обеспечивает специфичные для разных клеток реакции на физиологические изменения концентрации кальция в крови.
Рецепторы CaR не только регулируют секрецию паратиреоидного гормона в паращитовидных железах, но также играют ключевую роль в формировании нормальной хрящевой и костной ткани, а также ограничивают рост нормальных и опухолевых клеток.
С другой стороны, низкое потребление кальция с пищей сопровождается развитием гиперпаратиреоза вследствие снижения активности CaR; этот механизм может приводить к развитию не только остеопороза и различных злокачественных опухолей, но и других хронических заболеваний.
У человека витамин D поступает из двух источников: он может синтезироваться в форме витамина D3 (холекальциферол) в эпидермисе под воздействием солнечного ультрафиолетового излучения, а также усваиваться из продуктов питания и пищевых добавок, которые в некоторых странах могут содержать витамин D2 (эргокальциферол). Обе эти формы витамина D поступают в печень, где превращаются в 25-гидроксивитамин D, или 25(OH)D (возможно лабораторно исследовать концентрацию у больного). Термин 25(OH)D используется для обозначения суммы 25(OH)D3 и 25(OH)D2. Таким образом, плазменная концентрация данного метаболита отражает суммарное количество синтезированного в организме и поступившего с пищей витамина D, являясь надежным индикатором уровня витамина D у конкретного человека.
Превращение 25(OH)D3 в наиболее активный метаболит, 1,25-дигидроксивитамин D3(1,25(OH)2D3), катализируется ферментом 25(OH)D-1-альфа-гидроксилазой, который кодируется геном CYP27B1 и содержится преимущественно в почках, но также и во многих других органах и тканях [3], включая нормальные и опухолевые клетки эпителия кожи, желудочно-кишечного тракта, мужских и женских половых органов, а также остеобласты и остеокласты, клетки сосудистой, центральной нервной и иммунной систем.
Наиболее активный метаболит витамина D(1,25(OH)2D3) связывается с высокоаффинным ядерным рецептором к витамину D (VDR), который регулирует экспрессию генов.
Интенсивность внутриклеточного синтеза этого метаболита в клетках зависит преимущественно от уровня 25(OH)D3 в окружающих тканях и не связана с концентрацией 1,25(OH)2D3 в системном кровотоке [4].
Следовательно, при низкой сывороточной концентрации 25(OH)D активность 25(OH)D-1-альфа-гидроксилазы может быть недостаточной для поддержания тканевого уровня 1,25(OH)2D3, достаточного для эффективной регуляции аутокринных и паракринных функций, а также для роста и функционирования клеток. Это объясняет наличие отрицательной связи с сывороточной концентрацией 25(OH)D у множества хронических заболеваний [5]. Было также продемонстрировано, что низкая сывороточная концентрация 25(OH)D является важным прогностическим фактором смертности от всех причин [6].
В понимании того, как уровень витамина D и кальция влияет на патогенез хронических заболеваний, важную роль играет тот факт, что большинство типов клеток синтезируют 25(OH)D-1-альфа-гидроксилазу и клеточные CaR.
Следовательно, при недостаточности витамина D и кальция нарушаются специфичные для отдельных клеток сигнальные пути, опосредованные 1,25(OH)2D3/VDR и CaR, которые необходимы для нормального функционирования клеток.
В частности, данный механизм был продемонстрирован для остеопороза и многих злокачественных опухолей, таких как колоректальный рак и рак молочной железы.
Низкая сывороточная концентрация 25(OH)D и недостаточное потребление кальция были описаны в качестве факторов риска таких заболеваний, как артериальная гипертензия, ожирение, метаболический синдром и сахарный диабет 2-го типа.
Кроме того, была установлена корреляция недостаточности витамина D и кальция с развитием сердечно-сосудистых симптомов, таких как стенокардия, коронарная недостаточность, инфаркт миокарда, транзиторная ишемическая атака и инсульт, а также с повышением смертности от хронических сердечно-сосудистых заболеваний [7–17].
По данным многих исследований, дефицит витамина D и его метаболитов играет ключевую роль в патогенезе широкого спектра клинически важных внескелетных дисфункций или заболеваний, особенно это относится к мышечной, сердечно-сосудистой, аутоиммунной патологии и некоторым злокачественным новообразованиям.
Интересно то, что при метаанализе 18 рандомизированных клинических исследований, включающих 57 311 пациентов, было сделано заключение, что дополнительный прием витамина D снижает общую смертность (отношение рисков (ОР) 0,93; 95% доверительный интервал (ДИ) 0,77–0,96, по сравнению с контрольной группой). Это может быть вызвано влиянием витамина D на костно-мышечную систему или на различные внескелетные нарушения [18].
Группы лиц, требующих обязательного обследования уровня кальция и витамина D
В соответствии с рекомендациями M. Peterlik и соавт. (2009 г.) [1], особое диагностическое внимание дефициту кальция и витамина D следует уделить следующим категориям пациентов [19]:
- дети, подростки, молодого и пожилого возраста;
- больные с соматической полиморбидностью;
- иммобилизация более 2 недель или снижение физической активности;
- определенные этнические группы.
Кальций снижает риск развития сердечно-сосудистых осложнений
Наблюдательные исследования свидетельствуют о наличии обратной связи между приемом кальция и развитием сосудистых заболеваний.
В исследовании Iowa Women’s Health Study, проведенном с участием 34 486 женщин в постменопаузе (55–69 лет), R. M. Bostick и соавт. обнаружили, что прием кальция, соответствующий верхнему квартилю (> 1425 мг/день), по сравнению с нижним квартилем (< 696 мг кальция/день), на 33% снижает смертность от ишемической болезни сердца (ОР 0,67, 95% ДИ 0,47–0,94). По результатам анализа снижение риска зависит от общего уровня потребления кальция и может быть достигнуто диетой, приемом пищевых добавок или обоими методами [20].
Таким же образом E. G. Knox обнаружил выраженную отрицательную связь между потреблением кальция с пищей и уровнем смертности от ишемической болезни сердца [21].
Исследование Nurses’ Health Study проводилось в течение 14 лет на группе из 85 764 женщин в возрасте от 39 до 59 лет. Было выявлено, что у женщин, принимавших общую дозу кальция, соответствующую верхнему квинтилю (медиана 1145 мг/день) риск инсульта был ниже (ОР 0,69, 95% ДИ 0,50–0,95), по сравнению с нижним квинтилем (медиана 395 мг/день) [22].
Чтобы объяснить наблюдаемое защитное действие на сосуды, можно предположить, что кальций оказывает благоприятный эффект на большое количество сосудистых факторов риска. К ним, в частности, можно отнести снижение следующих параметров у пациента [23]:
- артериального давления;
- сывороточной концентрации липидов;
- массы тела, хотя в некоторых случаях данные являются неоднозначными.
В некоторых испытаниях наблюдалась обратная связь между содержанием кальция и уровнем артериального давления. В контролируемых рандомизированных исследованиях при проведении метаанализа выявлено, что артериальное давление снижается как при приеме кальция с пищей, так и при его употреблении в виде добавок.
В соответствии с этими выводами настоящее исследование показало, что у женщин старше 45 лет, принимающих с пищей как минимум 679 мг кальция/день, значительно снижается риск артериальной гипертензии. У женщин с уровнем потребления кальция с пищей, соответствующим верхнему квинтилю (1000–2560 мг кальция/день), риск снижается на 13% (ОР 0,87, 95% ДИ 0,81–0,93) [24].
Еще один потенциальный кардиопротективный механизм может выражаться в снижении сывороточной концентрации липидов. Это наблюдается благодаря происходящему в кишечнике связыванию кальция с жирными и желчными кислотами, в результате чего осуществляется мальабсорбция жиров. Кроме того, существует прямое влияние кальция на адипоциты в виде усиления липолиза [25].
В контролируемом рандомизированном исследовании у мужчин при диете, богатой кальцием, значительно снизился уровень общего холестерина, липопротеинов низкой плотности (ЛПНП) и аполипопротеина В [26].
Подобным образом в рандомизированном плацебо-контролируемом исследовании у женщин в постменопаузе при приеме пищевой добавки, содержащей 1000 мг кальция, в течение 12 месяцев отмечено повышение уровня липопротеинов высокой плотности (ЛПВП) и их отношения к уровню ЛПНП [27].
Что касается снижения массы тела, различные крупные эпидемиологические исследования свидетельствуют о том, что прием кальция с пищей и употребление кальцийсодержащих добавок может снижать вес пациента [28], этот эффект опосредован тем же механизмом, что и влияние на липидный профиль [29].
Безопасность применения комбинированных препаратов кальция и витамина D3
Последнее время ряд исследователей обсуждают некоторое увеличение кардиоваскулярного риска при приеме препаратов кальция. Однако следует обратить особое внимание на тот факт, что увеличение кардиоваскулярного риска установлено лишь в отношении монотерапии кальцием.
Метаанализ 15 двойных слепых плацебо-контролируемых исследований был опубликован в 2010 г. в Британском медицинском журнале (M. J. Bolland и соавт.) и включал данные о более чем 12 000 испытуемых. Наблюдалось повышение риска инфаркта миокарда около 30% у лиц, принимавших кальцийсодержащие добавки (≥ 500 мг/день), по сравнению с получавшими плацебо [30].
Тем не менее, не наблюдалось достоверного повышения частоты встречаемости конечных точек, связанных с сосудистой патологией. К ним относятся инсульт (ОР 1,20, 95% ДИ 0,96–1,50), смерть (ОР 1,09, 95% ДИ 0,96–1,23) и составные конечные точки, включающие инфаркт миокарда, инсульт и внезапную смерть (ОР 1,18, 95% ДИ 1,00–1,39).
Хотя данные метаанализа должны быть интерпретированы как значимое свидетельство того, что прием кальцийсодержащих добавок (без витамина D) может потенциально повышать риск инфаркта миокарда, необходимо принимать в расчет некоторые ограничения и даже противоречия.
Во-первых, статистическая значимость различий была только пограничной (ОР 1,31, 95% ДИ 1,02–1,67; p = 0,035), с доверительной вероятностью 95% нижний лимит приближается к 1, поэтому оценка данных результатов должна проводиться с осторожностью. Кроме того, исследования, включенные в анализ, были направлены на оценку влияния кальция на плотность костной ткани и риск переломов. Ни в одном из представленных исследований кардиоваскулярные осложнения не фигурировали в качестве первичной или вторичной конечной точки. В результате они не были учтены стандартизированным способом, что могло привести к завышению или занижению сведений.
В-третьих, хотя данные метаанализа отражают явное повышение риска инфаркта миокарда, эта зависимость не характерна для риска инсульта, смерти или составной конечной точки, включающей инфаркт миокарда, инсульт и внезапную смерть. Можно добавить, что из исследований были исключены данные о приеме кальция в комбинации с витамином D, что является рекомендуемой стратегией для предупреждения переломов у большинства пожилых людей. В этой связи надо отметить, что в большом количестве крупномасштабных исследований по приему кальция в сочетании с витамином D не было выявлено повышения кардиоваскулярного риска [31].
Возможно, хотя и не установлено точно, что коррекция дефицита витамина D может препятствовать развитию потенциально вредных сосудистых эффектов кальцийсодержащих добавок [18, 32].
Наконец, за исключением относительно малочисленной группы испытуемых [30], отдельные исследования кальцийсодержащих добавок не выявили достоверного повышения кардиоваскулярного риска.
Фактически, данные настоящего рандомизированного плацебо-контролируемого исследования, проведенного J. R. Lewis и соавт., без учета метаанализа, не указывают на высокий риск смерти или первичной госпитализации, связанной с атеросклерозом сосудов, у пациентов, принимающих кальцийсодержащие добавки [33]. Более того, поданализ даже свидетельствует о наличии их кардиопротективного эффекта у пациентов с предшествующими сердечно-сосудистыми заболеваниями.
Выбор методов коррекции и доз кальция и витамина D в базисной стратегии ведения пациентов с полиморбидностью
В международном исследовании потребления витамина D [34] было ясно показано, что во многих странах содержание витамина D в рационе питания является слишком низким, чтобы поддерживать уровень 25(OH)D среди всего населения в диапазоне 40–100 нмоль/л, что считается достаточным для оптимального состояния здоровья [35].
K. D. Cashman и соавт. [36] рассчитали, что лицам в возрасте 20–40 лет для поддержания баланса витамина D в зимнее время необходимо ежедневно принимать витамин D в дозе от 300 до 1600 МЕ, в зависимости от продолжительности пребывания на солнце предыдущим летом.
M. L. Nelson и соавт. [37] сообщили, что прием витамина D3 в суточной дозе 800 МЕ позволял обеспечить устойчивую «оптимальную» концентрацию 25(OH)D в сыворотке крови (≥ 75 нмоль/л) у 80% женщин в пременопаузе.
Прием аналогичной суточной дозы витамина D3 позволял поддерживать сывороточную концентрацию 25(OH)D на уровне 50 нмоль/л у 97,5% пожилых людей в условиях недостаточного пребывания на солнце [38].
Имеются надежные документальные подтверждения благоприятного влияния витамина D в дозе 800 МЕ на различные показатели здоровья. Прием витамина D3 в дозе 700–800 МЕ/сут обеспечивает нормальный уровень ремоделирования костной ткани у здоровых мужчин в зимнее время [39], а также снижает риск колоректального рака и рака молочной железы на 50% [40, 41].
Потребление кальция в среднем 1000–1200 мг/сут основано не только на соображениях физиологии, но и на результатах исследований влияния на состояние здоровья.
Так, например, суточная доза кальция 1200 мг обеспечивает эффективную профилактику потери костной массы и переломов вследствие остеопороза у людей в возрасте 50 лет и старше [42], а также приводит к снижению на 40–50% риска колоректального рака у мужчин и рака молочной железы у женщин в пременопаузальном периоде [43, 44].
В целях профилактики либо улучшения течения многих хронических заболеваний необходима одновременная коррекция недостаточности потребляемых с пищей витамина D и кальция, что объясняется двумя причинами.
Во-первых, потребление с пищей витамина D и кальция тесно взаимосвязано [45], вследствие чего недостаточность витамина D во многих случаях ассоциируется с низким потреблением кальция.
Во-вторых, поскольку витамин D и кальций оказывают совместное влияние на пролиферацию, дифференцировку и функционирование клеток, можно предположить, что для достижения положительного эффекта от увеличения потребления кальция потребуется наличие адекватного количества витамина D и наоборот.
На основании метаанализа 10 рандомизированных контролируемых исследований влияния перорального приема витамина D с кальцием или без него на риск перелома шейки бедра у пожилых людей по сравнению с плацебо или отсутствием лечения, S. Boonen и соавт. [46] сделали вывод о том, что, по всей видимости, прием витамина D приводит к снижению риска перелома шейки бедра только при дополнительном приеме кальция.
J. M. Lappe и соавт. [47] представили результаты рандомизированного плацебо-контролируемого исследования, согласно которым у женщин в постменопаузе комбинированный прием кальция и витамина D3, то есть 1400–1500 мг кальция вместе с 1100 МЕ витамина D3, снижает кумулятивный риск злокачественных опухолей молочной железы, легких, толстой кишки, матки и системы гемопоэза до 0,232 спустя 4 года терапии.
E. Cho и соавт. [48] на основании анализа объединенных первичных данных из 10 когортных исследований, включавших результаты наблюдения у более чем 500 тыс. людей на протяжении 6–16 лет, сделали вывод о том, что наибольшее снижение риска колоректального рака достигается при одновременном приеме высоких доз витамина D и кальция.
Дополнительный прием комбинации витамина D и кальция является безопасной и малозатратной стратегией профилактики остеопороза, колоректального рака и рака молочной железы, а также, вполне вероятно, множества других компонентов соматической полиморбидности.
Следует подчеркнуть, что суточное потребление 800 МЕ витамина D и 1000–1200 мг кальция находится гораздо ниже принятых в настоящее время предельно допустимых доз, которые составляют 2000 МЕ (= 50 мкг) витамина D3 и 3000 мг кальция [49].
Относительно недорогим способом профилактики остеопоротических переломов является комбинированный прием 1200 мг/сут кальция и 800 МЕ/сут витамина D3. Однако выраженный эффект от приема такой комбинации наблюдается только в группах пациентов, соблюдающих режим приема как минимум на 80% [42].
Недостаточное соблюдение режима приема, которое наблюдается при длительном приеме любого лекарственного препарата, ограничивает эффективность комбинации витамина D и кальция в отношении коррекции соответствующих видов недостаточности среди населения в целом. Вследствие этого комбинированный прием витамина D и кальция должен рекомендоваться только с целью профилактики заболеваний в группах высокого риска, т. е. среди лиц, у которых не удается достичь адекватного поступления витамина D и кальция другими способами; это может быть связано со специфическими условиями жизни (иммобилизация, инвалидность, пожилой возраст, хронические заболевания), традиционными или личными пищевыми предпочтениями, образом жизни (недостаток физической активности, постоянное пребывание в помещении) и др.
Литература
- Peterlik M., Cross H. S. Vitamin D and calcium insufficiency-related chronic diseases: molecular and cellular pathophysiology // Eur. J. Clin. Nutr. 2009.
- Tfelt-Hansen J., Brown E. M. The calcium-sensing receptor in normal physiology and pathophysiology: a review // Crit. Rev. Clin. Lab. Sci. 2005, 42, 35–70.
- Zehnder D., Bland R., Williams M. C., McNinch R. W., Howie A. J., Stewart P. M., Hewison M. Extrarenal expression of 25-hydroxyvitamin D3–1 alpha-hydroxylase // J. Clin. Endocrinol. Metab. 2001, 86, 888–894.
- Anderson P. H., O’Loughlin P. D., May B. K., Morris H. A. Modulation of CYP27 B1 and CYP24 mRNA expression in bone is independent of circulating 1,25(OH)2D3 levels // Bone. 2005, 36, 654–662.
- Cross, H. S., Kallay E. Regulation of the colonic vitamin D system for prevention of tumor progression: an update // Future Oncol. 2009, 5, 493–507.
- Dobnig H., Pilz S., Scharnagl H., Renner W., Seelhorst U., Wellnitz B., Kinkeldei J., Boehm B. O., Weihrauch G., Maerz W. Independent association of low serum 25-hydroxyvitamin D and 1,25-dihydroxyvitamin D levels with all-cause and cardiovascular mortality // Arch. Intern. Med. 2008, 168, 1340–1349.
- McCarron D. A., Reusser M. E. Finding consensus in the dietary calcium-blood pressure debate // J. Am. Coll. Nutr. 1999, 18, 398 S-405 S.
- Hintzpeter B., Mensink G. B., Thierfelder W., Muller M. J., Scheidt-Nave C. Vitamin D status and health correlates among German adults // Eur. J. Clin. Nutr. 2008, 62, 1079–1089. Int. J. Environ. Res. Public Health 2009, 62601.
- Judd S. E., Nanes M. S., Ziegler T. R. Wilson P. W., Tangpricha V. Optimal vitamin D status attenuates the age-associated increase in systolic blood pressure in white Americans: results from the third National Health and Nutrition Examination Survey // Am. J. Clin. Nutr. 2008, 87, 136–141.
- Davies K. M., Heaney R. P., Recker R. R., Lappe J. M., Barger-Lux M. J., Rafferty K., Hinders S. Calcium intake and body weight // J. Clin. Endocrinol. Metab. 2000, 85, 4635–4638.
- Arunabh S., Pollack S., Yeh J., Aloia J. F. Body fat content and 25-hydroxyvitamin D levels in healthy women // J. Clin. Endocrinol. Metab. 2003, 88, 157–161.
- Alemzadeh R., Kichler J., Babar G., Calhoun M. Hypovitaminosis D in obese children and adolescents: relationship with adiposity, insulin sensitivity, ethnicity, and season // Metabolism. 2008, 57, 183–191.
- Pittas A. G., Lau J., Hu F. B., Dawson-Hughes B. The role of vitamin D and calcium in type 2 diabetes. A systematic review and meta-analysis // J. Clin. Endocrinol. Metab. 2007, 92, 2017–2029.
- Reis J. P., von Muhlen D., Kritz-Silverstein D., Wingard D. L., Barrett-Connor E. Vitamin D, parathyroid hormone levels, and the prevalence of metabolic syndrome in community-dwelling older adults // Diabetes Care. 2007, 30, 1549–1555.
- Wang T. J., Pencina M. J., Booth S. L., Jacques P. F., Ingelsson E., Lanier K., Benjamin E. J., D’Agostino R. B., Wolf M., Vasan R. S. Vitamin D deficiency and risk of cardiovascular disease // Circulation. 2008, 117, 503–511.
- Bostick R. M., Kushi L. H., Wu Y., Meyer K. A., Sellers T. A., Folsom A. R. Relation of calcium, vitamin D, and dairy food intake to ischemic heart disease mortality among postmenopausal women // Am. J. Epidemiol. 1999, 149, 151–161.
- Hagstrom E., Hellman P., Larsson T. E., Ingelsson E., Berglund L., Sundstrom, J., Melhus H., Held C., Lind L., Michaelsson K., Arnlov J. Plasma parathyroid hormone and the risk of cardiovascular mortality in the community. Circulation. 2009, 119, 2765–2771.
- Autier P., Gandini S. Vitamin D supplementation and total mortality: a meta-analysis of randomized controlled trials // Arch Intern Med. 2007, 167: 1730–1737.
- Peterlik. M., Boonen S., Cross H. S., Lamberg-Allardt C. Vitamin D and Calcium Insufficiency-Related Chronic Diseases: an Emerging World-Wide Public Health Problem // Int. J. Environ. Res. Public Health. 2009, 6, 2585–2607.
- Bostick R. M., Kushi L. H., Wu Y., Meyer K. A., Sellers T. A., Folsom A. R. Relation of calcium, vitamin D, and dairy food intake to ischemic heart disease mortality among postmenopausal women // Am J Epidemiol. 1999, 149: 151–161.
- Knox E. G. Ischaemic-heart-disease mortality and dietary intake of calcium // Lancet. 1973, 1:1465–1467.
- Iso H., Stampfer M. J., Manson J. E., Rexrode K., Hennekens C. H., Colditz G. A., Speizer F. E., Willett W. C. Prospective study of calcium, potassium, and magnesium intake and risk of stroke in women // Stroke. 1999, 30: 1772–1779.
- Chung M., Balk E. M., Brendel M. et al. Vitamin D and calcium: a systematic review of health outcomes // Evid Rep Technol Assess (Full Rep). 2009, 1–420.
- Wang L., Manson J. E., Buring J. E., Lee I. M., Sesso H. D. Dietary intake of dairy products, calcium, and vitamin D and the risk of hypertension in middle-aged and older women // Hypertension. 2008, 51: 1073–1079.
- Zemel M. B., Shi H., Greer B., Dirienzo D., Zemel P. C. Regulation of adiposity by dietary calcium // FASEB J. 2000, 14: 1132–1138.
- Denke M. A., Fox M. M., Schulte M. C. Short-term dietary calcium fortification increases fecal saturated fat content and reduces serum lipids in men // J Nutr. 1993. 123:1047–1053.
- Reid I. R., Mason B., Horne A., Ames R., Clearwater J., Bava U., Orr-Walker B., Wu F., Evans M. C., Gamble G. D. Effects of calcium supplementation on serum lipid concentrations in normal older women: a randomized controlled trial // Am J Med. 2002, 112: 343–347.
- Heaney R. P. Normalizing calcium intake: projected population effects for body weight // J Nutr. 2003, 133: 268 S–270 S.
- Parikh S. J., Yanovski J. A. Calcium intake and adiposity // Am J Clin Nutr. 2003, 77: 281–287.
- Bolland M. J., Avenell A., Baron J. A., Grey A., MacLennan G. S., Gamble G. D., Reid I. R. Effect of calcium supplements on risk of myocardial infarction and cardiovascular events: metaanalysis // BMJ. 2010, 341: c3691.
- Hsia J., Heiss G., Ren H. et al. Calcium/vitamin D supplementation and cardiovascular events // Circulation. 2007, 115: 846–854.
- Wang T. J., Pencina M. J., Booth S. L., Jacques P. F., Ingelsson E., Lanier K., Benjamin E. J., D’Agostino R. B., Wolf M., Vasan R. S. Vitamin D deficiency and risk of cardiovascular disease // Circulation. 2008, 117: 503–511.
- Lewis J. R., Calver J., Zhu K., Flicker L., Prince R. L. Calcium supplementation and the risks of atherosclerotic vascular disease in older women: results of a 5-year RCTand a 4. 5-year follow-up // J Bone Miner Res. 2011, 26: 35–41.
- Calvo M. S., Whiting S. J., Barton C. N. Vitamin D intake: a global perspective of current status // J. Nutr. 2005, 135, 310–316.
- Yetley E. A., Brule D., Cheney M. C., Davis C. D., Esslinger K. A., Fischer, P. W., Friedl K. E., Greene-Finestone L. S., Guenther P. M., Klurfeld D. M., L’Abbe M. R., McMurry K. Y., Starke-Reed P. E., Trumbo P. R. Dietary reference intakes for vitamin D: justification for a review of the 1997 values // Am. J. Clin. Nutr. 2009, 89, 719–727.
- Cashman K. D., Hill T. R., Lucey A. J., Taylor N., Seamans K. M., Muldowney S., Fitzgerald A. P., Flynn A., Barnes M. S., Horigan G., Bonham M. P., Duffy E. M., Strain J. J., Wallace J. M., Kiely M. Estimation of the dietary requirement for vitamin D in healthy adults // Am. J. Clin. Nutr. 2008, 88, 1535–1542.
- Nelson M. L., Blum J. M., Hollis B. W., Rosen C., Sullivan S. S. Supplements of 20 microg/d cholecalciferol optimized serum 25-hydroxyvitamin D concentrations in 80% of premenopausal women in winter // J. Nutr. 2009, 139, 540–546.
- Cashman K. D., Wallace J. M., Horigan G., Hill T. R., Barnes M. S., Lucey, A. J., Bonham M. P., Taylor N., Duffy E. M., Seamans K., Muldowney S., Fitzgerald A. P., Flynn A., Strain J. J., Kiely M. Estimation of the dietary requirement for vitamin D in free-living adults > 64 y of age // Am. J. Clin. Nutr. 2009, 89, 1366–1374.
- Viljakainen H. T., Vaisanen M., Kemi V., Rikkonen T., Kroger H., Laitinen E., Rita H., Lamberg-Allardt C. Wintertime vitamin D supplementation inhibits seasonal variation of calcitropic hormones and maintains bone turnover in healthy men // J. Bone Miner. Res. 2009, 24, 346–352.
- Gorham E. D., Garland C. F., Garland F. C., Grant W. B., Mohr S. B., Lipkin, M., Newmark H. L., Giovannucci E., Wei M., Holick M. F. Vitamin D and prevention of colorectal cancer // J. Steroid Biochem. Mol. Biol. 2005, 97, 179–194.,
- Garland C. F., Gorham E. D., Mohr S. B., Grant W. B., Giovannucci E. L., Lipkin M., Newmark H., Holick M. F., Garland F. C. Vitamin D and prevention of breast cancer: Pooled analysis // J. Steroid Biochem. Mol. Biol. 2007, 103, 708–711.
- Tang B. M., Eslick G. D., Nowson C., Smith C., Bensoussan A. Use of calcium or calcium in combination with vitamin D supplementation to prevent fractures and bone loss in people aged 50 years and older: a meta-analysis // Lancet. 2007, 370, 657–666.
- Shin M. H., Holmes M. D., Hankinson S. E., Wu K., Colditz G. A., Willett W. C. Intake of dairy products, calcium, and vitamin D and risk of breast cancer // J. Natl. Cancer Inst. 2002, 94, 1301–1311.
- Slattery M. L., Sorenson A. W., Ford M. H. Dietary calcium intake as a mitigating factor in colon cancer // Am. J. Epidemiol. 1988, 128, 504–514.
- Berube S., Diorio C., Verhoek-Oftedahl W., Brisson J. Vitamin D, calcium, and mammographic breast densities // Cancer Epidemiol. Biomarkers Prev. 2004, 13, 1466–1472.
- Boonen S., Lips P., Bouillon R., Bischoff-Ferrari H. A., Vanderschueren D., Haentjens P. Need for additional calcium to reduce the risk of hip fracture with vitamin D supplementation: evidence from a comparative metaanalysis of randomized controlled trials // J. Clin. Endocrinol. Metab. 2007, 92, 1415–1423.
- Lappe J. M., Travers-Gustafson D., Davies K. M., Recker R. R., Heaney R. P. Vitamin D and calcium supplementation reduces cancer risk: results of a randomized trial // Am. J. Clin. Nutr. 2007, 85, 1586–1591.
- Cho E., Smith-Warner S. A., Spiegelman D., Beeson W. L., van den Brandt P. A., Colditz G. A., Folsom A. R., Fraser G. E., Freudenheim J. L., Giovannucci E., Goldbohm R. A., Graham S., Miller A. B., Pietinen P., Potter J. D., Rohan T. E., Terry P., Toniolo P., Virtanen M. J., Willett W. C., Wolk A., Wu K., Yaun S. S., Zeleniuch-Jacquotte A., Hunter D. J. Dairy foods, calcium, and colorectal cancer: a pooled analysis of 10 cohort studies // J. Natl. Cancer Inst. 2004, 96, 1015–1022.
- Human vitamin and mineral requirements. Report of a Joint FAO/WHO Expert Consultation. Food and Agriculture Organization, Rome, Italy, 2002.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru







