Введение
Локальные офтальмологические методы лечения ретинобластомы (РБ), а также методы лучевой терапии и локальной химиотерапии, несмотря на высокую эффективность, сопряжены с риском развития внутриглазных осложнений различной степени выраженности. Наиболее частыми внутриглазными осложнениями локального лечения РБ являются непролиферативная ретинопатия и/или нейропатия, а также кровоизлияния в стекловидное тело различной степени выраженности [1–3]. Данные осложнения при нарастании их тяжести могут приводить к отслойке сетчатки, вплоть до тотальной, и к субтотальному/тотальному гемофтальму, что не только резко ухудшает зрительные функции, но и делает невозможным контроль за состоянием опухоли и глазного дна в динамике. Согласно отечественным клиническим рекомендациям гемофтальм и вовсе служит показанием к энуклеации глаза у пациентов с РБ, так как может быть обусловлен не только осложнениями лечения, но и прогрессией опухоли1 [4]. Катаракта в настоящее время встречается несколько реже ввиду отказа от использования дистанционной лучевой терапии (ДЛТ) для лечения интраокулярной РБ.
Наличие клинически значимого помутнения оптических сред может существенно затруднять осмотр глазного дна, не позволяя адекватно оценивать состояние опухоли в динамике, а также нарушает процесс формирования зрительных функций у детей раннего возраста, что особенно нежелательно в случае единственного глаза у ребенка [4]. Все вышесказанное обусловливает необходимость купирования осложнений в наиболее ранние сроки. Вместе с тем любые интраокулярные вмешательства при РБ сопряжены с высоким риском экстраокулярного распространения опухоли, что требует тщательной оценки ее состояния в динамике и уверенности в стабильности ремиссии [5], что не всегда возможно оценить при непрозрачных оптических средах. В целом количество опубликованных исследований по вопросу интраокулярного хирургического вмешательства (ИОХВ) при РБ в зарубежной литературе небольшое [6–12], а в отечественной литературе и вовсе имеются лишь единичные работы [13, 14].
Цель исследования: оценить отдаленные клинико-функциональные результаты, а также локальную и системную безопасность ИОХВ у детей, перенесших лечение по поводу РБ.
Содержание статьи
Материал и методы
За период с 2012 по 2023 г. в ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России ИОХВ при РБ выполнено у 34 детей (35 глаз). Средний возраст пациентов на момент лечения составил 68 (28–180) мес.
Бинокулярная форма РБ наблюдалась у 25 (74%) пациентов, монокулярная — у 9 (26%). В 15 (44%) случаях ИОХВ проводилось на единственном глазу. Стадирование заболевания согласно международной классификации РБ и классификации TNM было следующим: группа А (T1a) — 1 (2,9%) глаз, группа В (T1b) — 3 (8,5%), группа C (T2a) — 6 (17%), группа D (T2b) — 23 (66%), группа Е (T2c) — 2 (5,8%).
На первом этапе лечения все пациенты получали химиотерапию (ХТ): в объеме системной и локальной ХТ (n=22, 65%), только системной ХТ (n=7, 20%) или локальной ХТ (n=5, 15%). У 18 (53%) пациентов использовались локальные офтальмологические методы: лазерная транспупиллярная термотерапия (n=12), криодеструкция (n=8), брахитерапия (БТ) (n=13), как отдельно, так и в сочетании.
При невозможности проведения либо неэффективности ХТ или локальных методов лечения как альтернатива энуклеации у 8 пациентов проведена стереотаксическая радиохирургия (СРХ), у 11 — ДЛТ.
Интраокулярное хирургическое вмешательство проводилось в сроки 20 (6–140) мес. после окончания органосохраняющего лечения.
На момент проведения ИОХВ во всех случаях признаки прогрессии опухоли не наблюдались, что подтверждалось при помощи ультразвукового исследования в режиме В-сканирования и ультразвуковой биомикроскопии с оценкой состояния очагов в динамике и магнитно-резонансной томографии глазниц с контрастированием.
Максимально корригируемая острота зрения (МКОЗ) до операции варьировалась в диапазоне от светоощущения до 0,2 (Ме 0,01).
Хирургическое вмешательство по поводу катаракты было выполнено у 33 пациентов (34 глаза). У 28 пациентов (29 глаз) наблюдалась заднекапсулярная катаракта, у 3 — полная, в 2 случаях была выполнена факоаспирация прозрачного хрусталика в ходе витреоретинального вмешательства. Во всех случаях наличие катаракты затрудняло оценку состояния опухоли в динамике.
Хирургическое вмешательство во всех случаях выполнялось в условиях общей анестезии. В большинстве случаев (n=31) удаление мутного хрусталика осуществляли методом факоаспирации по стандартной методике. Трем пациентам удаление хрусталика выполняли по технологии ленсвитрэктомии. Расчет ИОЛ и технология хирургического лечения подробно описаны в опубликованном ранее исследовании [14]. Длина передне-задней оси (ПЗО) на момент ИОХВ составила 20,2 (19,90–24,30) мм. Оптическая сила имплантируемых ИОЛ составила 27 (21–38) D.
Витреоретинальное хирургическое вмешательство выполнено у 12 пациентов (12 глаз). Показаниями к его выполнению были субтотальный/тотальный гемофтальм, не поддающийся купированию на фоне консервативного лечения (n=10), а также субтотальная отслойка сетчатки (n=2). У 11 пациентов проведение витреоретинального вмешательства одномоментно или отсроченно сопровождалось хирургическим удалением хрусталика. В 1 случае через 15 мес. после хирургического вмешательства была проведена селективная интраартериальная ХТ (СИАХТ) с сохранением глаза.
С целью профилактики рецидива и экстраокулярной диссеминации опухоли витреоретинальное вмешательство по поводу гемофтальма у всех пациентов выполнялось с одномоментной и постоянной ирригацией мелфалана по описанной ранее технологии [13]. При выявлении тракционной отслойки сетчатки не стремились к полному прилеганию сетчатки, а ограничивались выполнением швартэктомии в области крупных шварт с целью ослабления натяжения сетчатки. Тампонада витреальной полости выполнялась с использованием силиконового масла либо газо-воздушной смеси.
После извлечения портов накладывали узловые эписклеральные швы с последующим двукратным промораживанием мест вкола в течение 60 с. Материал, полученный при витрэктомии, обязательно подвергали гистологическому исследованию на наличие живых опухолевых клеток.
После ИОХВ всем детям проводился осмотр глазного дна в условиях медикаментозного сна на ретинальной педиатрической широкоугольной камере RetCam 3 через 7 дней после вмешательства, далее — регулярно с интервалами в 2–3 мес.
Статистическая обработка данных проводилась с использованием компьютерных программ MedCalc19.5.3. и Microsoft Office Excel 2019 и включала методы описательной статистики, анализ выживаемости методом Каплана — Мейера и ROC-анализ, которые использовались для определения предикторов неудачи ИОХВ. Для сравнения количественных признаков в зависимых выборках с учетом отсутствия нормального распределения использовался непараметрический критерий Уилкоксона. Количественные показатели представлены в виде медианы, минимального и максимального значения — Me (min–max), качественные — в виде абсолютных и относительных (%) значений.
Результаты исследования
Медиана срока наблюдения после ИОХВ составила 57 (61–20) мес. В раннем послеоперационном периоде после ИОХВ удалось восстановить прозрачность оптических сред во всех случаях, осложнений не наблюдалось ни у одного пациента.
В отдаленном периоде у 12 (34%) пациентов возникла вторичная катаракта в сроки 32 (6–104) мес. после хирургического вмешательства: у 8 из них была выполнена YAG-лазерная дисцизия вторичной катаракты, у 7 — микроинвазивная капсулэктомия. У 1 пациента спустя 6,5 года после хирургического вмешательства развилось помутнение оптической части ИОЛ из гидрофильного акрила, в связи с чем была проведена замена ИОЛ с имплантацией в капсульный мешок линзы из гидрофобного акрила.
После хирургического лечения катаракты без витреоретинального вмешательства осложнений не наблюдалось ни в одном случае, в то время как после сочетанного ИОХВ в отдаленном периоде в 5 случаях развилась субатрофия глазного яблока, из них в 3 случаях была выполнена энуклеация ввиду сочетания субатрофии с длительно существующей тотальной отслойкой сетчатки и рецидивирующей гифемы. МКОЗ после ИОХВ составила 0,1 (0,005–0,5), отмечалось ее статистически значимое улучшение по сравнению с дооперационным значением (p=0,0001).
В целом в результате проведения ИОХВ после органосохраняющего лечения РБ удалось сохранить 92% глаз (n=32). В 1 случае через 15 мес. после хирургического вмешательства у пациента была выявлена прогрессия основного опухолевого очага, в связи с чем пациенту было выполнено 3 курса СИАХТ с сохранением глаза. Экстраокулярного распространения и отдаленных метастазов не выявлено ни у одного пациента. Один пациент умер из-за развития вторичной радиоиндуцированной опухоли после ДЛТ — эстезионейробластомы, при этом на единственном глазу, на котором проводилось хирургическое вмешательство, на момент последнего осмотра отмечалась клинически полная регрессия опухоли и прозрачные оптические среды. Трех- и пятилетний уровень сохранности глаз составил 94 и 90% соответственно. Трех- и пятилетняя безрецидивная выживаемость составила 97%.
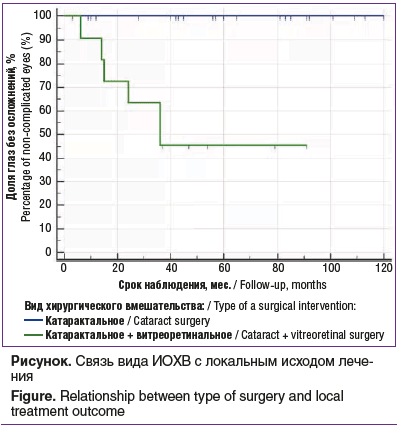
Были проанализированы различные факторы как возможные предикторы неудачи ИОХВ. За неудачу мы принимали прогрессию опухоли, энуклеацию глаза и развитие субатрофии со вторичными изменениями. Было продемонстрировано, что вид предшествующей ХТ (p=0,3), количество применяемых локальных методов (p=0,75), проведение БТ до ИОХВ (p=0,39), стадия опухоли (p=0,44), длина ПЗО на момент хирургического вмешательства (p=0,8), количество курсов СИАХТ до ИОХВ (p=0,97), ДЛТ и СРХ перед локальным лечением (p=0,3), а также срок от момента завершения лечения до ИОХВ (p=0,13) статистически значимо не оказывали влияния на исход ИОХВ. При оценке влияния пола была отмечена тенденция к статистической значимости влияния данного фактора с более частой неудачей лечения у пациентов женского пола. Статистически значимыми предикторами неудачи ИОХВ были возраст на момент ее проведения более 30 мес. (p=0,0012) и проведение сочетанного катарактального и витреоретинального вмешательства (p=0,0002) (см. рисунок).
Обсуждение
Среди осложнений локального лечения РБ катаракта, гемофтальм и отслойка сетчатки относятся к внутриглазным осложнениям, которые могут потребовать хирургического лечения [7, 15, 16]. Основной причиной развития катаракты у детей, пролеченных по поводу РБ, является лучевая терапия (ДЛТ и БТ). Частота формирования катаракты после проведения ДЛТ составляет от 75 до 100%, после БТ — до 31% [17, 18]. Кроме того, мелфалан — химиопрепарат, применяемый при СИАХТ и ИВХТ, также обладает катарактогенным эффектом и приводит к развитию катаракты в 5–9% случаев [19, 20].
Вопрос безопасности ИОХВ и лечения катаракты, в частности, весьма актуален, так как в зарубежной литературе имеется крайне мало публикаций, посвященных данной проблеме, а в отечественной литературе и вовсе представлено единичное исследование, опубликованное нами ранее [5–10, 14, 21].
Хирургическое вмешательство по поводу катаракты позволяет добиться прозрачности оптических сред и восстановить контроль за состоянием опухоли во всех случаях с отсутствием осложнений интраоперационно и в раннем послеоперационном периоде (как по собственным результатам, так и по данным других авторов) [8, 9, 14, 21].
По данным ряда авторов, частота рецидивов после лечения катаракты составляет от 3 до 7% при сроке наблюдения от 17 до 90 мес. [5, 9, 21]. В опубликованном ранее исследовании нам удалось добиться прозрачности оптических сред без случаев рецидива, с сохранением глаз в 100% случаев у 21 пациента (22 глаза) при среднем сроке наблюдения 29 мес. [14]. На сегодняшний день наш опыт хирургического лечения катаракты представлен 33 пациентами (34 глаза), у всех удалось добиться прозрачности оптических сред с сохранением глаз в 94% случаев, без признаков диссеминации и рецидива опухоли у всех пациентов в отдаленные сроки наблюдения (57 (6–120) мес.). У пациентов, у которых была проведена энуклеация, проводилось сочетанное катарактальное и витреоретинальное вмешательство, а глаза были энуклеированы из-за субатрофии глаза. Важным аспектом хирургического лечения катаракты у детей с РБ, с нашей точки зрения, является сохранение целостности задней капсулы хрусталика, так как она служит естественным барьером для потенциального проникновения опухолевых масс в передний отдел глазного яблока [7].
Закономерным образом после хирургического лечения катаракты без проведения заднего капсулорексиса мы наблюдали развитие вторичной катаракты в 34% случаев в сроки от 32 (6–104) мес., в связи с чем пациентам выполнялась дисцизия задней капсулы. С нашей точки зрения, предпочтение следует отдавать YAG-лазерному рассечению задней капсулы ввиду меньшей инвазивности данной технологии, однако при выраженном фиброзе капсульного мешка возможно выполнение хирургической дисцизии задней капсулы и передней витрэктомии. По собственным наблюдениям, выполнение дисцизии задней капсулы во всех случаях не сопровождалось развитием осложнений и рецидивом опухоли. В одном случае после выполнения лазерной, а впоследствии хирургической дисцизии задней капсулы у ребенка развилось помутнение оптической части ИОЛ из гидрофильного акрила по типу «глистенинга». У данного пациента успешно была выполнена замена ИОЛ с имплантацией в капсульный мешок линзы из гидрофобного акрила. Подобный опыт удаления ИОЛ с ее последующей успешной заменой у пациента с РБ впервые представляется в научной литературе.
Витреоретинальное хирургическое вмешательство при РБ представляется особенно проблемным и дискутабельным, так как в рамках ИОХВ витреоретинальное вмешательство наиболее часто сопряжено с риском диссеминации РБ [22]. По мнению некоторых авторов, витреоретинальное вмешательство опасно тем, что движение ирригационной жидкости в ходе витрэктомии при наличии активной опухоли может способствовать заносу опухолевых клеток в трудно визуализируемые отделы глаза — такие, как отростки цилиарного тела и задняя поверхность радужки [23]. Опубликованные ранее работы свидетельствуют о том, что в результате вторичной энуклеации после витреоретинальной хирургии требуется профилактическое лечение в связи с чрезвычайно плохим жизненным прогнозом при метастатической РБ [24].
Вместе с этим, наряду с существующими рисками диссеминации опухоли в случае ИОХВ при РБ, в зарубежной литературе представлены исследования с положительными результатами витрэктомии у пациентов с леченной РБ. Первый успешный случай хирургического лечения гемофтальма с одномоментной ирригацией мелфалана у ребенка с единственным глазом и РБ описан нами в 2015 г. [25]. Впоследствии J. Zhao et al. [11] опубликовали исследование о выполнении витрэктомии с ирригацией мелфалана при лечении единственного глаза с РБ у 21 ребенка в качестве альтернативы энуклеации. Авторам удалось сохранить 86% глаз со средними сроками наблюдения 39 мес., однако в 14% случаев обнаружен рецидив опухоли, была выполнена энуклеация глазного яблока. В отечественной литературе имеется одно подробное исследование, опубликованное нами ранее, в котором витрэктомия с одновременной ирригацией мелфалана при гемофтальме была выполнена у 5 пациентов с РБ. При этом все пролеченные глаза удалось сохранить, ни в одном случае не было выявлено признаков рецидива или диссеминации опухоли (средний срок наблюдения 34 мес.) [13].
Вопросу хирургии отслойки сетчатки после лечения РБ уделено еще меньше внимания в научной литературе. C.L. Shields et al. [26] описывают хирургическое лечение отслойки сетчатки у 10 пациентов после СИАХТ, возникшей в сроки от 1 до 12 мес. Лечение отслойки сетчатки выполняли методом витрэктомии на 3 глазах, эписклерального пломбирования — у 1 пациента, лазерной коагуляции — также у 1 пациента, остальные 5 пациентов были оставлены под наблюдением (с полным прилеганием у 2 пациентов и частичным — также у 2 пациентов). Энуклеация была выполнена у 4 из 10 пациентов из-за рецидива опухоли, у 1 ребенка — из-за неоваскулярной глаукомы.
P. Rating et al. [12] представили свой опыт ИОХВ у 40 пациентов (42 глаза), пролеченных по поводу РБ. Из них у 17 пациентов выполнено витреоретинальное хирургическое вмешательство: у 11 детей — по поводу гемофтальма, у 6 — по поводу отслойки сетчатки. В результате лечения у 3 пациентов развилась субатрофия глаза, у 2 — рецидив опухоли, в связи с чем глаза были энуклеированы. Один пациент умер от развития второй опухоли. Метастазов и экстраокулярного распространения опухоли не было выявлено ни у одного пациента со средним сроком наблюдения 114 мес.
На сегодняшний день наш опыт проведения витреоретинального хирургического вмешательства у детей, перенесших лечение по поводу РБ, представлен 12 пациентами (12 глазами). Показаниями к его выполнению были тотальный гемофтальм, не поддающийся купированию медикаментозным лечением (83%, 10 глаз), и отслойка сетчатки с наличием тракционного компонента (17%, 2 глаза). Витреоретинальное вмешательство проводилось в сроки 14 (6–71) мес. Всем пациентам с гемофтальмом в данном исследовании в качестве первой линии проводили инфузионную терапию по ранее описанной методике без положительной динамики с нарастанием интенсивности кровоизлияния, в связи с чем в качестве спасательной терапии как альтернатива энуклеации было принято решение о проведении витрэктомии с одномоментной ирригацией мелфалана [27].
В результате витреоретинального хирургического вмешательства нам удалось сохранить 75% глаз, 3 (25%) глаза были удалены из-за развития субатрофии со вторичными изменениями (рецидивирующая гифема и кровоизлияния в витреальную полость у 2 пациентов и субтотальная фиброзно-измененная отслойка сетчатки у 1 пациента). У 2 пациентов отмечено уменьшение длины глаза с формированием субатрофии, однако эти глаза были сохранены, а пациенты находятся под динамическим наблюдением без отрицательной динамики в настоящий момент. Считаем важным отметить, что все эти глаза были исходно предлечены с применением многократной СИАХТ, БТ и/или СРХ, которые обладают собственной токсичностью в отношении сосудов и тканей глаза и могут приводить к вышеуказанным изменениям, а геморрагические осложнения могут повторно развиваться и после ИОХВ.
Более частое развитие осложнений после сочетанного вмешательства в сравнении с только катарактальным вмешательством объясняется тем, что сочетанное вмешательство проводилось в более тяжелых ситуациях — как единственная возможность спасти глаз. Более высокий процент осложнений у пациентов более старшего возраста (старше 30 мес.) требует дальнейших исследований с целью более точной интерпретации данного фактора.
Максимально корригированная острота зрения после ИОХВ, по нашим данным, составила 0,1 (0,005–0,5), а хирургическое вмешательство позволило статистически значимо повысить МКОЗ после интраокулярной хирургии (p=0,0001). Безусловно, функциональный результат у таких детей зависит не столько от технологии выполнения хирургического вмешательства, сколько от исходной стадии опухолевого процесса, его локализации и объема проведенного системного и/или локального лечения.
Трех- и пятилетняя безрецидивная выживаемость пациентов в данном исследовании после ИОХВ составила 97%, что соответствует уровню выживаемости у пациентов с РБ после локального лечения в целом [1].
Заключение
Таким образом, ИОХВ показало себя эффективным и безопасным способом восстановления прозрачности оптических сред и контроля за состоянием глазного дна и опухоли у детей с внутриглазными осложнениями органосохраняющего лечения РБ. Сочетанное витреоретинальное и катарактальное вмешательство сопряжено с большим риском развития осложнений по сравнению с катарактальным, так как проводится у более тяжелого контингента пациентов. Несмотря на это, современный уровень развития как органосохраняющего лечения, так и методик интраокулярной хирургии позволил добиться уровня безрецидивной выживаемости, сопоставимого с уровнем выживаемости у пациентов с РБ после локального лечения в целом. Функциональные результаты после ИОХВ, безусловно, зависят не только от технологии хирургического лечения, но и от исходной стадии, локализации опухоли, вида и объема проведенного системного и/или локального лечения.
Сведения об авторах:
Яровой Андрей Александрович — д.м.н., заведующий отделом офтальмоонкологии и радиотерапии ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 127486, Россия, г. Москва, Бескудниковский б-р, д. 59а; ORCID iD 0000-0003-2219-7054
Володин Денис Павлович — к.м.н., врач-офтальмолог, младший научный сотрудник отдела офтальмоонкологии и радиотерапии ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 127486, Россия, г. Москва, Бескудниковский б-р, д. 59а; ORCID iD 0000-0002-3660-7803
Алексеев Антон Сергеевич — врач-ординатор ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 127486, Россия, г. Москва, Бескудниковский б-р, д. 59а; ORCID iD 0009-0003-7714-4088
Яровая Вера Андреевна — к.м.н., врач-офтальмолог отдела офтальмоонкологии и радиотерапии ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 127486, Россия, г. Москва, Бескудниковский б-р, д. 59а; ORCID iD 0000-0001-8937-7450
Осокин Иван Геннадьевич — к.м.н., заведующий отделением микрохирургии и функциональной реабилитации глаза у детей ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 127486, Россия, г. Москва, Бескудниковский б-р, д. 59а.
Горшков Илья Михайлович — к.м.н., заведующий отделением витреоретинальной хирургии ФГАУ «НМИЦ «МНТК «Микрохирургия глаза» им. акад. С.Н. Федорова» Минздрава России; 127486, Россия, г. Москва, Бескудниковский б-р, д. 59а; ORCID iD 0000-0002-9370-5549
Контактная информация: Володин Денис Павлович, e-mail: volodin.den2016@yandex.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 04.12.2024.
Поступила после рецензирования 27.12.2024.
Принята в печать 21.01.2025.
About the authors:
Andrey A. Yarovoy — Dr. Sc. (Med.), Head of the Department of Ophthalmo-oncology and Radiotherapy, S. Fyodorov Eye Microsurgery Federal State Institution; 59a, Beskudnikovskii blvd., Moscow, 127486, Russian Federation; ORCID iD 0000-0003-2219-7054
Denis P. Volodin — C. Sc. (Med.), Ophthalmologist, Junior Scientific Officer, S. Fyodorov Eye Microsurgery Federal State Institution; 59a, Beskudnikovskii blvd., Moscow, 127486, Russian Federation; ORCID iD 0000-0002-3660-7803
Anton S. Alekseev — Resident Doctor, S. Fyodorov Eye Microsurgery Federal State Institution; 59a, Beskudnikovskii blvd., Moscow, 127486, Russian Federation; ORCID iD 0009-0003-7714-4088
Vera A. Yarovaya — C. Sc. (Med.), Ophthalmologist, Department of Ophthalmo-oncolology and Radiotherapy, S. Fyodorov Eye Microsurgery Federal State Institution; 59a, Beskudnikovskii blvd., Moscow, 127486, Russian Federation; ORCID iD 0000-0001-8937-7450
Ivan G. Osokin — C. Sc. (Med.), Head of the Department of Eye Microsurgery and Functional Rehabilitation, S. Fyodorov Eye
Microsurgery Federal State Institution; 59a, Beskudnikovskii blvd., Moscow, 127486, Russian Federation.
Il’ya M. Gorshkov — C. Sc. (Med.), Head of the Department of Vitreoretinal Surgery, S. Fyodorov Eye Microsurgery Federal State Institution; 59a, Beskudnikovskii blvd., Moscow, 127486, Russian Federation; ORCID iD 0000-0002-9370-5549
Contact information: Denis P. Volodin, e-mail: volodin.den2016@yandex.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 04.12.2024.
Revised 27.12.2024.
Accepted 21.01.2025.
1Интраокулярная ретинобластома. Клинические рекомендации Министерства здравоохранения Российской Федерации. 2020. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/preview-cr/71_1 (дата обращения: 04.02.2024).
Информация с rmj.ru





