Содержание статьи
Введение
Несмотря на значительные достижения медицины и увеличение продолжительности жизни людей, сердечно-сосудистые заболевания (ССЗ) остаются ведущей причиной летальности во всем мире [1]. Согласно статистическим данным Всемирной организации здравоохранения ССЗ каждый год уносят порядка 17 млн людских жизней [2]. Согласно данным Службы государственной статистики Российской Федерации в 30% случаев ССЗ являются причиной смерти мужчин и женщин трудоспособного возраста [3].
В настоящее время идентифицировано большое количество новых биологических маркеров, которые могли бы служить лабораторным инструментом диагностики и прогнозирования течения ССЗ, но только мозговой натрийуретический пептид (BNP), его предшественники (proBNP, NT-proBNP) и сердечные тропонины (cTnI и cTnT) нашли применение в реальной клинической практике [4–7].
В данной статье представлены результаты обзора литературы, касающегося перспективного биологического маркера интерлейкина 15 (ИЛ-15) в аспекте ССЗ.
Биологические аспекты ИЛ-15
Интерлейкин 15 был идентифицирован в 1994 г. двумя независимыми научно-исследовательскими лабораториями [8, 9]. J. Burton et al. [8] описали новый цитокин (ЦК) интерлейкин ИЛ-T, вырабатываемый лимфомной Т-клеточной линией HuT-102. Ученые обнаружили, что супернатант (supernatant — плавающий на поверхности), полученный от данной клеточной культуры, при переносе его в ИЛ-2-зависимую культуру мышиной клеточной линии CTLL-2 усиливал пролиферацию Т-клеток и активацию больших зернистых (гранулярных) лимфоцитов, при этом антисыворотка к ИЛ-2 не уменьшала обнаруженного эффекта. Также для проявления активности ИЛ-T требовалась экспрессия β-цепи рецептора (R) ИЛ-2 (ИЛ-2R). ИЛ-T был охарактеризован как Т-клеточный ростовой фактор.
Несколькими месяцами позже J. Giri et al. [9] доложили об открытии ЦК с биологической активностью, схожей с ИЛ-2, который также функционировал посредством ИЛ-2R.
K. Grabstein et al. [10] в результате эксперимента на клетках эпителия почки выявили, что супернатант поддерживал пролиферацию ИЛ-2-зависимой линии клеток CTLL. Из супернатанта был получен белок, охарактеризована его аминокислотная последовательность и идентифицирована структурная аналогия с ИЛ-2. Было показано, что антитела к β-цепи ИЛ-2R (ИЛ-2Rβ) подавляют биологическую активность нового ростового фактора, который был назван ИЛ-15 [11].
Интерлейкин 15 экспрессируется моноцитами, макрофагами и другими клетками, участвующими во врожденных и адаптивных иммунных реакциях [12–14]. ИЛ-15 представляет собой гликопротеин, молекулярная масса которого составляет порядка 15 килодальтон (кДа). Он кодируется геном размером в 34 кб (килобаза (кб)) = 1000 пар нуклеотидов), который расположен на длинном плече 4-й хромосомы (4q31) [12–14]. Ген, кодирующий ИЛ-15, состоит из 9 экзонов и 8 интронов, 4 из которых (экзоны с 5 по 8) кодируют белковую часть данного ЦК [12–14].
Описаны две изоформы ИЛ-15 [12–14]. Первая изоформа — ИЛ-15SSP, для нее характерна более короткая цепь, содержащая 21 аминокислоту. Вторая изоформа обозначается как ИЛ-15LSP, обладает более длинной цепью, состоящей из 41 аминокислоты. ИЛ-15SSP обнаружена преимущественно в вилочковой железе и яичниках. Экспериментальные исследования [12–14] с использованием различных изоформ и зеленого флуоресцентного белка продемонстрировали, что ИЛ-15SSP определяется преимущественно в цитоплазме и ядре клетки и принимает участие в транскрипционной регуляции белков. ИЛ-15LSP экспрессируется преимущественно в комплексе Гольджи, ранних эндосомах и эндоплазматическом ретикулуме, где регулирует трансляцию белков и функционирует в качестве секреторного сигнального пептида.
Интерлейкин 2 и ИЛ-15 связываются с общим гетеродимерным рецептором, состоящим из β-субъединицы ИЛ-2/15Rβ (CD122) и γ-субъединицы (γc или CD132). Специфическую активность обоих ЦК обусловливают соответствующие цепи α-рецепторов — ИЛ-2Rα (CD25) и ИЛ-15Rα (CD215). ИЛ-15Rα связывает ИЛ-15 с высоким сродством, тогда как изолированный ИЛ-2Rα является низкоаффинным рецептором для ИЛ-2 [15].
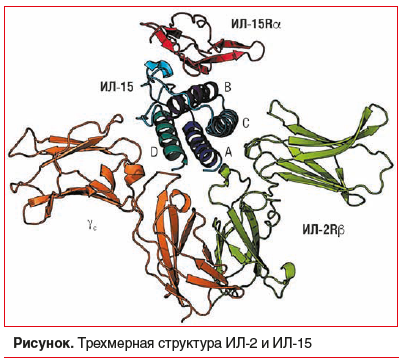
Интерлейкин 15 и ИЛ-2 похожи по трехмерной структуре (см. рисунок) [16]. ИЛ-15Rα содержит 173 аминокислоты экстрацеллюлярного компонента, 21 аминокислоту трансмембранного компонента и 37 аминокислот цитоплазматического компонента [13, 14]. Кроме того, интрон-экзонная организация гена ИЛ-15Rα аналогична организации ИЛ-2Rα [13, 14]. Несмотря на это сходство, ИЛ-15Rα имеет небольшую гомологию последовательности с ИЛ-2Rα [17]. ИЛ-15Rα широко экспрессируется у людей и мышей независимо от цепи ИЛ-2R/ИЛ-15Rβ-γ. ИЛ-15, связанный с ИЛ-15Rα, также может циркулировать через эндосомальные везикулы в течение многих дней (эндосомальная рециркуляция), что приводит к стойкости связанного с мембраной ИЛ-15 [13, 14]. Повышение регуляции ИЛ-15 и ИЛ-15Rα обнаруживается во время воспалительных реакций [18, 19].
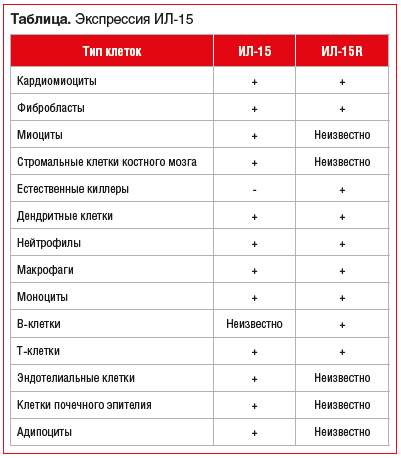
Экспрессия ИЛ-15 и ИЛ-15Rα была обнаружена во многих типах клеток (см. таблицу) [13, 14, 20–25].
T. Dinh et al. [26] показали, что комплекс ИЛ-2, который включает ИЛ-2 и моноклональное антитело (mAb), усиливает активность регуляторных Т-лимфоцитов, уменьшает прогрессирование атеросклероза у мышей с дефицитом аполипопротеина E (АпоЕ), уменьшает размер зоны инфаркта миокарда (ИМ) и улучшает функции левого желудочка (ЛЖ). K. Webster et al. [27] обнаружили, что ИЛ-2 уменьшает апоптоз кардиомиоцитов у мышей с ИМ. Z. Zeng et al. [28] продемонстрировали, что комплекс ИЛ-2 оказывает защитное действие, напрямую ингибируя инфильтрацию воспалительных макрофагов и способствуя поляризации противовоспалительных макрофагов M2, что, в свою очередь, уменьшает апоптоз кардиомиоцитов и ослабляет локальные воспалительные реакции.
Целью исследования M. Bouchentouf et al. [29] была проверка гипотезы о том, что введение рекомбинантного человеческого ИЛ-2 (rhИЛ-2) улучшает ангиогенез и сохраняет функцию сердца после ИМ. Однократная внутривенная инъекция rhИЛ-2 через 2 дня после ИМ увеличивала на 27,7% фракционное укорочение ЛЖ у иммунокомпетентных (C57Bl6) мышей, но не влияла на сердечную функцию у иммунодефицитных (NOD-SCID ИЛ-2Rγnull) мышей. Иммуногистохимический анализ поперечных срезов сердец C57Bl6 показал, что отложение коллагена уменьшилось на 23,1%, а плотность капилляров увеличилась в области рубца и в пограничной зоне ИМ соответственно на 22,4% и 33,6% после инъекции rhИЛ-2. Кроме того, rhИЛ-2 увеличил в 1,6 раза индекс пролиферации эндотелиальных клеток in vivo и в 1,8 раза количество естественных киллеров, инфильтрирующих инфарктные сердца. RhИЛ-2 не влиял на количество сердечных клеток CD4 и CD8. In vitro активированные rhИЛ-2 NK-клетки усиливали пролиферацию эндотелиальных клеток сердца на 17,2%.
Поскольку две субъединицы рецепторов ИЛ-15 и рецепторов ИЛ-2 схожи, биологическая активность ИЛ-15 может частично совпадать с активностью ИЛ-2 [13].
Роль ИЛ-15 при миокардите и окислительном стрессе
Как известно, ЦК играют важную роль в возникновении и течении вирусного миокардита (ВМ).
B. Bigalke et al. [30] изучали влияние ИЛ-15 на течение экспериментального миокардита у мышей, инфицированных вирусом Коксаки B3 (CVB3). Проводили анализ сердец CVB3-инфицированных мышей (n=14), ложно инфицированных мышей (n=14) и CVB3-инфицированных мышей линии Balb/c (инбредных), получавших ИЛ-15 (n=6) или слитый белок ИЛ-15 (n=6). Анализировали гемодинамическую функцию, клеточные инфильтраты и содержание коллагена в миокарде. Индукция ВМ была связана со значительной потерей массы тела и массы сердца, снижением функции ЛЖ, увеличением содержания коллагена и клеточных инфильтратов в миокарде. Лечение инфицированных животных ИЛ-15 приводило к нормализации массы тела и массы сердца, а также к значительному улучшению систолической и диастолической функций ЛЖ. Отмечено значительное снижение содержания коллагена, а также уменьшение клеточной инфильтрации лимфоцитов и макрофагов в миокарде. Ингибирование внутреннего ИЛ-15 приводило к обострению заболевания. Таким образом, лечение ИЛ-15 оказывает положительное влияние на CVB3-индуцированный миокардит у мышей и, по-видимому, является многообещающим подходом к изменению клинического течения, гемодинамики и морфологической картины ВМ.
Y. Yeghizarians et al. [31] показали, что ИЛ-15 и его рецепторы присутствуют в кардиомиоцитах. Введение ИЛ-15 увеличивало выживаемость кардиомиоцитов в условиях окислительного стресса посредством фосфорилирования сигнального белка и активатора транскрипции (signal transducer and activator of transcription 3, STAT3). Также ИЛ-15 защищал кардиомиоциты от окислительного стресса посредством PI3K / ERK1 (сигнальный путь, центральными компонентами которого являются ферменты фосфоинозитид-3-киназа (PI3K)) / неклеточная киназа 1, регулируемая сигналом (extracellular signal-regulated kinase (ERK)).
P. Carai et al. [32] идентифицировали 5 ИЛ (3, 4, 9, 13 и 15) в качестве кардиопротективных факторов при CVB3-индуцированном миокардите у мышей.
ИЛ-15 при атеросклерозе и связанных с ним заболеваниях
Как известно, в качестве главного этиологического фактора развития многих ССЗ выступает атеросклероз [33–35]. Атеросклеротический процесс, проявляющийся острыми сосудистыми катастрофами, такими как ИМ и инфаркт головного мозга, или хроническими ишемическими состояниями, такими как ишемическая болезнь сердца (ИБС) и цереброваскулярная болезнь, является по сути системным воспалительным процессом [36].
D. Wuttge et al. [37] обнаружили, что ИЛ-15 активируется при атеросклеротических поражениях как у человека, так и у животных и может способствовать рекрутированию и активации Т-клеток во время атерогенеза.
Как известно, CD4+CD28null (CD28null) Т-клетки представляют собой специализированную подгруппу Т-лимфоцитов, продуцирующих воспалительные ЦК и цитотоксические молекулы. J. Bullenkamp et al. [38] исследовали роль ЦК в экспансии CD28null Т-клеток при остром коронарном синдроме (ОКС). Отсортированные CD4+ Т-клетки высокой чистоты от пациентов с ОКС обрабатывали ЦК (фактором некроза опухоли α (TNF-α), ИЛ-1β, 6, 7 и 15). ИЛ-7 и -15 индуцировали экспансию CD28null Т-клеток у пациентов с ОКС, в то время как TNF-α, ИЛ-1β и -6 не обладали данным эффектом. Механизмы, лежащие в основе экспансии CD28null T-клеток под действием ИЛ-7/ИЛ-15, заключались в преимущественной активации и пролиферации CD28null T-клеток. Кроме того, ИЛ-7/ИЛ-15 заметно увеличивали цитотоксическую функцию CD28null T-клеток и продукцию интерферона γ (IFNγ). Дальнейший анализ выявил различия в исходной экспрессии компонентных цепей рецепторов ИЛ-7/ИЛ-15 (CD127 и CD122), повышенном исходном уровне фосфорилирования STAT5 в CD28null T-клетках у пациентов с ОКС по сравнению с контрольной субпопуляцией CD28+ T-клеток. Было продемонстрировано, что размножение CD28null Т-клеток значительно ингибируется тофацитинибом (селективный иммунодепрессант; представляет собой мощный селективный ингибитор семейства янус-киназ, обладающий высокой избирательностью в отношении прочих киназ генома человека). Таким образом, представленные данные показали, что ИЛ-7 и ИЛ-15 стимулируют размножение CD28null Т-клеток у пациентов с ОКС. Это говорит в пользу того, что блокада ИЛ-7/ИЛ-15 может предотвратить размножение этих клеток и улучшить результаты лечения данной категории пациентов.
Ученые под руководством G. Tarantino [39] обследовали 80 пациентов с ожирением и неалкогольной жировой болезнью печени. Также авторы исследовали взаимосвязь между толщиной комплекса интима-медиа сонных артерий (ТКИМ СА) и концентрациями ИЛ-15 в сыворотке крови. Уровни ИЛ-15 у пациентов с ожирением были повышены по сравнению с таковыми у 44 молодых здоровых людей (2,77 (1,21–4,8) пг/мл против 1,55 (1–2,4) пг/мл (р=0,002)). В однофакторном анализе уровни ИЛ-15 были связаны с индексом массы тела (ИМТ) и уровнями моноцитарного хемотаксического белка 1 (MCP-1), фактором роста фибробластов (FGF) и гранулоцитарно-макрофагальным колониестимулирующим фактором. Согласно данным многомерного анализа только возраст и ИЛ-15 оставались предикторами ТКИМ (β=0,60, p=0,0001 и β=0,25, p=0,024 соответственно). Не было обнаружено связи ИЛ-15 с различными антропометрическими параметрами, а также с распределением жира в организме и тяжестью стеатогепатита, в том числе после поправки на возраст.
Целью исследования Es. van Thomas et al. [40] явилась оценка роли ИЛ-15 в развитии атеросклероза. Авторы изучали влияние ИЛ-15 на ассоциированные с атеросклерозом клетки in vitro и in vivo путем его нейтрализации с использованием ДНК-вакцины (вакцина на основе нуклеиновых кислот). При кормлении мышей с дефицитом рецептора липопротеинов низкой плотности (LDLr (-/-)) продуктами, типичными для «западной диеты», в селезенке отмечен более высокий уровень ИЛ-15 и клеток, его экспрессирующих. Добавление ИЛ-15 к макрофагам индуцировало экспрессию TNF-α и MCP-1. После вакцинации мышей против ИЛ-15 наблюдалось уменьшение размера атеросклеротических бляшек на 75%. Относительное количество макрофагов в бляшке оказалось в 2 раза выше у вакцинированных мышей, чем у контрольных мышей. Вакцинация приводила к повышенной цитотоксичности в отношении сверхэкспрессирующих ИЛ-15 клеток-мишеней, что способствовало снижению числа экспрессирующих ИЛ-15 клеток и макрофагов в крови и селезенке, а также снижению отношения CD4/CD8.
E. Fisman et al. [41] продемонстрировали, что вакцинация против ИЛ-15 уменьшила размер участков атеросклероза у LDLr-/- мышей.
S. Bulfone-Paus [42] доказали, что ИЛ-15 способствуют выживанию естественных Т-киллеров, которые участвуют во врожденных и адаптивных иммунных реакциях и способствуют прогрессированию атеросклероза.
C. Gokkusu et al. [43] исследовали 5 однонуклеотидных полиморфизмов (SNP) в гене ИЛ-15 и уровни ИЛ-15 у 102 пациентов с ОКС, 102 пациентов со стабильной ИБС и 162 здоровых добровольцев. Идентифицировано пять SNP в гене ИЛ-15: G367A, C267T, A14035T, C13687A и A10504G. Уровни ИЛ-15 в сыворотке крови были значительно выше у пациентов как с ОКС, так и со стабильным течением ИБС по сравнению с лицами из контрольной группы. Было показано, что генетические варианты гена ИЛ-15 и концентрации ИЛ-15 были ассоциированы с ИБС. Авторы сделали заключение, что генетическая изменчивость гена ИЛ-15 и уровень ИЛ-15 влияют на риск ИБС.
Группа исследователей под руководством K. Ameri [44] показала, что введение ИЛ-15 может улучшать функцию сердца у мышей после ИМ за счет снижения гибели кардиомиоцитов, уменьшения размера рубца и улучшения васкуляризации. Это свидетельствует в пользу того, что ИЛ-15 играет положительную роль при ИМ.
E. Dozio et al. [45] определяли ИЛ-15 и ИЛ-15Rα у пациентов с ИБС и различными типами ожирения. Белки ИЛ-15 и ИЛ-15Rα количественно определяли с помощью твердофазного иммуноферментного анализа. Экспрессию генов ИЛ-15 и ИЛ-15Rα в эпикардиальной жировой ткани (ЭЖТ) оценивали с помощью цветных микрочипов. Толщину ЭЖТ измеряли с помощью эхокардиографии (ЭхоКГ). Уровни ИЛ-15 и ИЛ-15Rα в крови были выше у пациентов с ИБС, чем у пациентов без ИБС. Уровень ИЛ-15 был выше у пациентов с ИБС и абдоминальным ожирением (АО). Повышенный уровень ИЛ-15Rα наблюдался у пациентов с ИБС как с АО, так и без АО. Согласно полученным результатам ЭЖТ явилась источником ИЛ-15 и ИЛ-15Rα, кроме того, их экспрессия была выше у пациентов с ИБС и увеличенной толщиной ЭЖТ.
Согласно данным M. Kaibe et al. [46] при проведении одномерного статистического анализа выявлено, что уровни ИЛ-15, высокочувствительного С-реактивного белка (hs-CRP), азота мочевины, общего холестерина, триглицеридов и холестерина липопротеинов высокой плотности, а также ИМТ связаны с ИБС. При многомерном логистическом регрессионном анализе только уровни ИЛ-15 и hs-CRP были связаны с ИБС.
В исследовании [47] установлено, что риск атеросклеротических ССЗ увеличивается примерно в 2 раза у лиц с вирусом иммунодефицита человека (ВИЧ-инфекцией). Так, S. Panigrahi et al. [48] исследовали роль Т-клеток CD8 при атеросклерозе в модели ВИЧ-инфекции на приматах и у не инфицированных ВИЧ пожилых людей. Также исследователи стремились идентифицировать факторы, способствующие активации, функционированию и рекрутированию Т-клеток CX3CR1+ CD8. Была определена повышенная экспрессия CX3CL1 и ИЛ-15 и повышенное количество Т-клеток CD8 в аортах макак. Также авторы продемонстрировали аналогичные изменения в атеросклеротических сосудах ВИЧ-неинфицированных людей. Было обнаружено, что рекомбинантный TNF увеличивает продукцию и высвобождение CX3CL1 и биоактивного ИЛ-15 из эндотелиальных клеток аорты. ИЛ-15, в свою очередь, способствует поверхностной экспрессии CX3CR1 и синтезу TNF CD8 T-клетками, а обработанные ИЛ-15 CD8 T-клетки проявляют усиленную CX3CL1-зависимую хемоаттракцию к эндотелиальным клеткам in vitro.
Таким образом, роль ИЛ-15 при гиперлипидемии и атеросклерозе является до конца не ясной и нуждается в дальнейшем изучении.
Роль ИЛ-15 в гликометаболизме
Интерлейкин 15 является не только провоспалительным ЦК, но и миокином. Миокин представляет собой разновидность ЦК, секретируемого скелетными мышцами. Помимо ИЛ-15, существует множество миокинов, таких как ИЛ-6, иризин и декорин [49]. Сократительная активность скелетных мышц увеличивает продукцию миокинов, которые впоследствии стимулируют транспорт глюкозы [50].
Так, H. Yang et al. [51] показали, что диета с высоким содержанием жиров вызывает снижение регуляции ИЛ-15 в мышцах и ИЛ-15R в жировой ткани. Физические упражнения могут уменьшить ожирение и данную негативную регуляцию. Согласно данным M. Yargic et al. [52] уровень ИЛ-15 в сыворотке повышался после интенсивных физических упражнений.
Установлено [53], что ИЛ-15 оказывает анаболическое действие на скелетные мышцы, снижая скорость протеолиза на клеточном уровне. Более того, он увеличивает поглощение глюкозы скелетными мышцами и на клеточном уровне. Таким образом, в будущем ИЛ-15 может стать антидиабетогенным препаратом.
Независимо друг от друга T. Fujimoto et al. [54], L. Nadeau et al. [55] обнаружили, что сверхэкспрессия ИЛ-15 в скелетных мышцах мышей может улучшать метаболизм глюкозы через путь АМФ-активируемой протеинкиназы. В то время как J. Krolopp et al. [56] продемонстрировали, что именно путь Янус-киназа 3/STAT3 регулирует метаболизм глюкозы. А L. Quinn et al. [57] обнаружили, что сверхэкспрессия ИЛ-15 уменьшает инсулинорезистентность.
Y. Duan et al. [58] описали положительные эффекты ИЛ-15: увеличение потери жировой массы и общей массы тела, улучшение метаболизма липидов и глюкозы, уменьшение выраженности воспаления в белой жировой ткани и уменьшение митохондриальной дисфункции при метаболическом синдроме. Вследствие этого ИЛ-15 дает большие надежды в аспекте профилактики, лечения ожирения и сахарного диабета 2 типа.
ИЛ-15 и фибрилляция предсердий
Воспаление играет значимую роль в инициации, поддержании и прогрессировании фибрилляции предсердий (ФП). В доступной нам литературе найдено лишь одно исследование, посвященное изучению роли ИЛ-15 при ФП. A. Borowiec et al. [59] провели проспективную оценку параметров воспаления у больных с различными формами ФП. В исследование было включено 158 пациентов с пароксизмальной/персистирующей ФП (из них 87 (55,1%) мужчин, средний возраст 65,8±9,6 года) без структурной патологии сердца. Параметры воспаления: лейкоциты, скорость оседания эритроцитов (СОЭ), hs-CRP, ИЛ-6, ИЛ-15 и TNF-α измеряли исходно и через 1 год наблюдения. Несмотря на частые эпизоды ФП, средние значения лейкоцитов, СОЭ и hs-CRP исходно и после наблюдения были в пределах нормы. Существенных различий показателей лейкоцитов, СОЭ и hs-CRP в отношении типов ФП не было. У пациентов, у которых развилась постоянная форма ФП (n=14), исходные концентрации hs-CRP были выше. Тем не менее после 1 года наблюдения эти различия не были достоверными. Среди всех изученных цитокинов только ИЛ-15 достоверно коррелировал с количеством эпизодов ФП. Авторы резюмировали, что потенциальная роль ИЛ-15 в качестве маркера ФП заслуживает дальнейшего изучения.
Заключение
В современном мире остается актуальным поиск и изучение новых биологических маркеров, способных помогать ранней диагностике ССЗ, служить лабораторным инструментом оценки эффективности проводимой терапии, являться прогностическим критерием возможных клинических исходов и значимым показателем стратификации риска. Появляется все больше данных, подчеркивающих ценность ИЛ-15 в качестве нового биомаркера диагностики и оценки прогноза у кардиологических пациентов. Роль ИЛ-15 при ССЗ весьма интересна вследствие его кардиопротективных эффектов. Однако не все проведенные к настоящему моменту исследования дают однозначную оценку эффективности ИЛ-15 как биологического маркера ССЗ. Окончательное подтверждение диагностической, предиктивной и, возможно, терапевтической роли данного маркера будет получено в результате будущих крупномасштабных проспективных исследований.
Информация с rmj.ru