Иммуно-секреторные параллели при хроническом гастрите
Л.М. Мосина
ФГБОУ ВПО «Мордовский государственный университет им. Н.П. Огарёва», медицинский институт, г. Саранск
М.А. Стенина
ГБОУ ВПО «Российский государственный национальный исследовательский медицинский университет им. Н.И. Пирогова», медико-биологический факультет, г. Москва
Л.В. Матвеева
ФГБОУ ВПО «Мордовский государственный университет им. Н.П. Огарёва», медицинский институт, г. Саранск
Цель исследования — определить у больных хроническим гастритом сывороточные концентрации и взаимосвязи пепсиногена-1, -II, гастрина-17, секреторного иммуноглобулина А, иммуноглобулина Е, суммарных антител к CagA Helicobacter pylori. У обследованных 118 больных хроническим гастритом в фазе обострения иммуноферментным методом выявлены изменения количества и корреляционные зависимости показателей секреции желудка и местного иммунитета, взаимосвязанные с атрофией слизистой оболочки желудка.
Ключевые слова: хронический гастрит, пепсиноген, гастрин, секреторный иммуноглобулин А, иммуноглобулин Е, Helicobacter pylori.
The purpose of the study — to identify patients with chronic gastritis and serum concentrations of the relationship pepsinogefi-L-ll, G-17, secretory immunoglobulin A, immunoglobulin E, total antibodies to CagA Helicobacter pylori. We studied 118 patients with chronic gastritis in acute phase EtJSA revealed changes in the number of indicators and correlations of gastric secretion and local immunity related to the atrophy of the gastric mucosa.
Key words: chronic gastritis, pepsinogen, gastrin, secretory immunoglobulin A, immunoglobulin E, Helicobacter pylori.
Введение
В последние годы наметилась неустойчивая тенденция к росту числа больных с заболеваниями желудочно-кишечного тракта. По данным ФГУ «ЦНИИОИЗ Минздравсоцразвития РФ» [1] в 2009 г. количество лиц с впервые в жизни установленным диагнозом заболевания органов пищеварения по сравнению с 2005 г. увеличилось в Приволжском федеральном округе на 2,9%, в Республике Мордовия — на 4,9%, составив 3624,9 и 3652,2 на 100 000 населения соответственно, при снижении общероссийского показателя на 2,6% (3454,1 на 100 000 населения). В структуре заболеваемости органов гастродуоденальной зоны 80-90% приходится на долю хронического гастрита [2]. По данным ряда авторов [3] хроническим гастритом страдает около 60% населения в возрасте до 50 лет, 95% — в возрасте от 50 до 70 лет. Значимость данного заболевания определяется также способностью становиться фоном для ульцеро- и канцерогенеза желудка.
Актуальным диагностическим направлением в гастроэнтерологии стало использование серологических маркеров воспаления и атрофии слизистой оболочки желудка (СОЖ): пепсиногенов, гастрина, антител к антигенам Helicobacter pylori (H. pylori) [4-11].
Пепсиногены — функционально неактивные, неоднородные проферменты пепсина, образующегося из них под действием соляной кислоты желудочного сока и расщепляющего белки. Пепсиноген-І (PG-I) синтезируется главными клетками желез дна и тела желудка, пепсиноген-И (PG-II) — муцинообразующими клетками всех отделов желудка и железами проксимальной части двенадцатиперстной кишки. В норме количество PG-I в 3 и более раз превышает уровень PG-II, являющегося маркером воспаления СОЖ любой этиологии [6].
Гастрин — второй вид протеолитических ферментов желудочного сока, не однороден по количеству аминокислотных остатков в молекуле, продуцируется G-клетками антрального отдела желудка, регулирует секрецию соляной кислоты и регенерацию СОЖ [12]. Доминирующей тканевой формой является гастрин-17 (G-17). В здоровом желудке пищевая белковая стимуляция или недостаток соляной кислоты приводят к увеличению уровня G-17, а высокая кислотность желудочного сока ингибирует его секрецию [12]. Показано [5, 7, 11, 12], что величина снижения концентрации G-17 и ответ на стимуляцию зависят от степени атрофии: чем больше выражена атрофия, тем меньше увеличение его уровня.
Среди факторов патогенности Н. pylori особое внимание заслуживает Сад антиген, способный изменять морфологию эпителиоцитов. Ранее [13] выявлена большая частота атрофических изменений СОЖ (снижение плотности желез, количества главных и обкладочных клеток, увеличение стромального компонента) у пациентов с высоковирулентными CagA-штаммами Н. pylori в сравнении с пациентами без Саg антигена.
Известно, что слизистые оболочки ассоциированы с развитой сетью лимфоидных образований, образующих мукозальную иммунную систему [3, 14,15]. Ведущим гуморальным фактором является секреторный иммуноглобулин А (slgA), продуцируемый плазматическими клетками собственной пластинки СОЖ, оказывающий вируснейтрализующее действие, ингибирующий адгезию микроорганизмов, предотвращающий абсорбцию токсинов и антигенов [14,16,17]. При хроническом гастрите были установлены [2] статистически значимые прямые взаимосвязи между уровнем рН желудочного содержимого и сывороточной концентрацией IgA. Определена умеренной силы отрицательная корреляция количества slgA в слизистой оболочке антрального отдела с длительностью язвенной болезни желудка и частотой ее рецидивов [18].
В защите СОЖ играет роль и иммуноглобулин Е (IgE), вырабатываемый плазмацитами собственной пластинки слизистой, способный активировать киллерные клетки и усиливать их цитотоксичность, участвуя в противоинфекционном и противоопухолевом иммунитете [15, 19]. Инфицирование Н. pylori может приводить к гипериммуноглобулинемии Е и, как следствие, к повышенной секреции гистамина и других медиаторов воспаления, усилению продукции соляной кислоты, лейкотриенов [2].
Таким образом, анализ научных литературных данных указывает на формирование хронического гастрита вследcтвие нарушений желудочной секреции, микробиоценоза, токапьного и системного иммунитета.
Цель работы — определить у больных хроническим астритом сывороточные концентрации и взаимосвязи іепсиногена-І, -II, гастрина-17, секреторного иммуноглобулиyа А, иммуноглобулина Е, суммарных антител к CagA H. pylori.
Материал и методы
Проведено комплексное клинико-лабораторное и инструментальное (эзофагогастродуоденоскопия с биопсией, 2-часовая рН-метрия) обследование 118 больных (55,9% мужчин, 44,1% женщин) хроническим гастритом в фазе обострения, проходивших лечение в лечебно-ірофилактических учреждениях г. Саранска. Средний возраст обследуемых составил 43,9±7,5 года, длительность заболевания — 13,2±5,1 года. Больные в зависимости от стадии атрофии, определенной гистологически, и нарушения желудочной секреции [3] были разделены на соответствующие группы. Неатрофический гастрит с сохраненной секрецией (рН 1,6-2) был выявлен у 42 пациентов — 1-я группа, очагово-атрофический (I-II ст.) гастрит с умеренной секреторной недостаточностью (рН 2,1-3,4) — у 40 — 2-я группа, распространенный атрофический (III-IV ст.) гастрит с выраженным нарушением секреции (рН 3,8-5) — у 36 — 3-я группа.
В контрольную группу вошли 30 практически здоровых добровольцев (16 мужчин, 14 женщин, средний возраст составил 36,2±10,3 года), подобранных по принципу случайной выборки, не имеющих на момент обследования клинико-анамнестических и инструментальных признаков гастро- и иммунопатологии.
Кровь на обследование забиралась при получении информированного согласия в утренние часы натощак из локтевой вены в объеме 5 мл в пробирку без консервантов. Время коагуляции в пробирке не превышало 30 минут при температуре 20-25°С. Сыворотка выделялась центрифугированием в течение 10 минут, помещалась в стерильные пробирки и замораживалась до процедуры анализа.
Методом твердофазного иммуноферментного анализа в сыворотке крови обследуемых определяли уровни PG-I, PG-II, slgA, IgE, суммарных антител (CAT) к CagA H. pylori с применением наборов реагентов ЗАО «Вектор-Бест» (Новосибирск, Россия) и G-17 ООО «БИОХИТ» (Хельсинки, Финляндия). Фирмами-производителями рекомендовано считать нормальной концентрацию PG-I в сыворотке крови в пределах — 40-130 мкг/л, PG-II — 4-22 мкг/л, тощакового G-17 — 2-5 пмоль/л, slgA — 1,69-5,47 мг/л, IgE — 0-100 ME/ мл. При интерпретации уровня CAT к CagA H. pylori учитывали отрицательный, сомнительный (титр <1:5), слабоположительный (титр 1:5), положительный (1:10-1:20), сильноположительный (1:40-1:80) результаты. Статистическую обработку результатов проводили на компьютере с использованием программ Microsoft Excell 7.0 с вычислением значений средней арифметической (М), средней ошибки средней арифметической (т). О значимости различий в группах судили по критерию Стьюдента (т) и степени вероятности (р). Статистически значимыми считали различия при p=s0,05. Для оценки взаимосвязи величин определяли коэффициент ранговой корреляции Спирмена (г). Сила взаимосвязи оценивалась при г=0,1—0,29 как слабая; при г=0,3-0,69 - умеренная; при г=0,7-1 - сильная.
Результаты и их обсуждение
У обследованных больных хроническим гастритом наблюдались изменения исследуемых показателей секреции желудка (таблица 1) и местного иммунитета (таблица 2).
Таблица 1. Уровень пепсиногенов и гастрина-17 в сыворотке крови обследованных (М±m)
| Показатели | Контрольная группа | Больные хроническим гастритом | ||
| 1-я группа | 2-я группа | 3-я группа | ||
| пепсиноген-1, мкг/л | 74,3±6,1 | 63,1±5,2 | 52,4±4,7, рк<0,01 | 28,5±4,5,
Рк’ Pi’ р2<0,001 |
| пепсиноген-П, мкг/л | 12,7±1,бЗ | 14,4±2,32 | 9,52±2,16 | 7,61±1,85, Рк- Pi<0-05 |
| гастрин-17, пмоль/л | 4,61±0,9 | 3,31±0,57 | 2,53±0,41, рк<0,05 | 1,84±0,32, рк<0,01,
р1<0,05 |
Примечание: статистически значимые различия при сравнении с контрольной группой — рк, с 1-й группой — pv со 2-й группой — рг.
Таблица 2. Уровень иммуноглобулинов в сыворотке крови обследованных (М±m)
| Показатели | Контрольная группа | Больные хроническим гастритом | ||
| 1-я группа | 2-я группа | 3-я группа | ||
| slgA, мг/л | 2,2±0,56 | 4,32±0,8,
рк<0,05 |
4,59±1,03, рк<0,05 | 4,87±0,91, рк<0,01 |
| IgE, МЕ/мл | 18,6±2,3 | 43,1±5,2, рк<0,001 | 53,3±7,1, рк<0,001 | 58,7±6,34, рк<0,001, р1<0,05 |
Примечание: статистически значимые различия при сравнении с контрольной группой — рк с 1-й группой — рг.
Уровень PG-I при хроническом неатрофическом гастрите имел тенденцию к снижению, при очаговом и распространенном атрофических гастритах уменьшался относительно аналогичного показателя контрольной группы на 29,5% (р<0,01) и 61,6% (р<0,001) соответственно, что обусловлено прогрессирующим уменьшением количества главных клеток желез СОЖ. Количество PG-I в 3-й группе достоверно снижалось относительно значений 1-й и 2-й групп на 54,8% и 45,6% соответственно.
Определение уровня PG-II в сыворотке крови обследуемых пациентов выявило тенденцию к увеличению показателя относительно контрольной группы при неатрофическом гастрите, что обусловлено активным воспалительным процессом в СОЖ, к снижению — при очагово-атрофическом гастрите, достоверное уменьшение на 40,1% при распространенном атрофическом гастрите, что связано с поражением антрального отдела желудка. Количество PG-II в 3-й группе уменьшалось относительно значений 1-й и 2-й групп на 47,2% (р<0,05) и 20,1% соответственно (рис. 1).
Данные изменения согласуются с научными данными [4-7,10-12] о целесообразности использования PG-I и PG-II в качестве серологических маркеров воспаления и атрофии СОЖ.
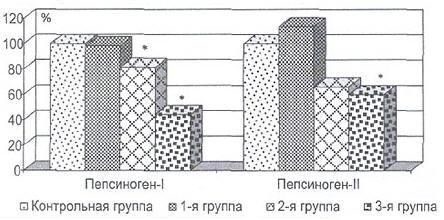
Рис. 1. Изменения количества пепсиногенов при хроническом гастрите (в %).
Примечания: значения лиц контрольной группы приняты за 100%;
* — статистически значимые изменения при сравнении с контрольной группой.
Диагностически ценным является определение соотношения количества PG-I и PG-II [6], в контрольной группе оно было больше, чем 3:1, чаще 4:1. Линейное уменьшение соотношения PG-I/PG-II наблюдалось при увеличении выраженности атрофии желудка: менее 2,1 — у 36,1% обследованных лиц 3-й группы.
Тощаковый G-17 в сыворотке крови больных хроническим гастритом определялся в меньших концентрациях, чем у лиц контрольной группы, что может быть объяснено повышенной кислотностью желудочного содержимого в 1-й группе, прогрессирующей атрофией слизистой оболочки антрального отдела желудка и гибелью G-клеток во 2-й и 3-й группах. В среднем значения данного показателя в 1-й группе уменьшались относительно контрольных цифр на 28,2%, во 2-й группе — на 45,1% (р<0,05), в 3-й группе - на 60% (р<0,01) и относительно данных 1-й группы - на 44,4% (р<0,05).
При сравнении обследованных по наличию и титру CAT к CagA H. pylori наибольшее количество серопозитивных лиц определилось в 3-й группе (рис. 2). Следует отметить, что сочетание низких значений маркеров секреции СОЖ (PG-К40 мкг/л, PG-IK4 мкг/л, G-T7<2 пмоль/л) наблюдалось у 22,2% обследованных 3-й группы, серологически подтверждало наличие у больных распространенной тяжелой атрофии слизистой оболочки, что потребовало отнесения данных пациентов к группе повышенного онкологического риска. Из них у 2 больных определился титр CAT к CagA Helicobacter pylori - 1:5, у 2 - 1:20, у 4 -1:40, что стало показанием для назначения эрадикационной терапии [17].
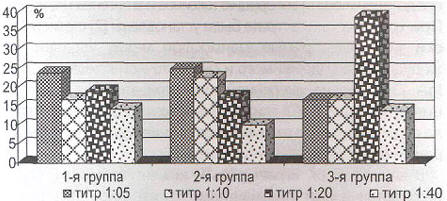
Рис. 2. Количество лиц, серопозитивных по CAT к CagA H. pylori (в %).

Рис. 3. Изменение уровня иммуноглобулинов при хроническом гастрите (в %).
Примечания: значения лиц контрольной группы приняты за 100%;
* — статистически достоверные изменения при сравнении с контрольной группой.
Изменения секреторного IgA и IgE также определялись характером и тяжестью поражения СОЖ. Сывороточная концентрация slgA >5,47 мг/л, свидетельствующая о раздражении слизистых оболочек и напряженности местного гуморального иммунитета, определилась у 26,2% пациентов 1-й группы, у 27,5% лиц 2-й группы и 33,3% обследованных 3-й группы. У 13,9% обследованных 3-й группы отмечалось сочетающееся с дефицитом пепсиногенообразования снижение концентрации slgA (до 1,5-1,1 мг/л), что указывало на недостаточность местного гуморального иммунитета вследствие уменьшения количества плазматических клеток-продуцентов slgA в атрофированной СОЖ, могло способствовать активации условно-патогенных инфекционных агентов с развитием очагов инфекции, аутосенсибилизации и метаплазии.
Сывороточная концентрация IgE у больных хроническим гастритом превышала средние значения контрольной группы, хотя у 86,4% пациентов определялась в пределах нормальных колебаний и нарастала пропорционально увеличению стадии атрофии СОЖ (рис. 3). Уровень IgE в среднем по 3-й группе на 36,2% (р<0,05) был выше аналогичного показателя 1-й группы больных. При этом клинических признаков и анамнестических данных о наличии аллергии у обследованных лиц не выявлено. Во всех группах сравнения наблюдалась прямая зависимость количества IgE и титра CAT к CagAH. pylori (р<0,05).
При оценке взаимосвязи исследуемых показателей определены отрицательная корреляция сывороточных концентраций slgA и PG-I, ослабевающая с увеличением стадии атрофии СОЖ (таблица 3), положительная корреляция количества slgA с уровнем PG-II и G-17, также ослабевающая при нарастании выраженности атрофических изменений слизистой. Выявленные зависимости позволяют рекомендовать исследование slgA в сыворотке крови в качестве маркера воспаления СОЖ и атрофических изменений, в большей мере, антрального отдела желудка.
Таблица 3. Взаимосвязь показателей у больных хроническим гастритом
| Группы | 1-я (n=42) | 2-я (n=40) | 3-я (n=36) | |||
| Показатель | slgA | igE | slgA | IgE | slgA | IgE |
| пепсиноген-1 | -0,351, р<0,05 | +0,454, р<0,01 | -0,345 р<0,05 | +0,408, р<0,05 | -0,320 р<0,05 | +0,376, р<0,05 |
| пепсиноген-И | +0,373, р<0,05 | +0,306, р<0,05 | +0,374, р<0,05 | +0,310, р=£0,05 | 0,296 | +0,337, р<0,05 |
| гастрин-17 | +0,406, р<0,01 | -0,136 | +0,347, р<0,05 | -0,157 | 0,252 | -0,145 |
Уровень IgE показал прямую взаимосвязь умеренной силы (р<0,05 - р<0,01) с количеством PG-I и PG-II, слабую отрицательную корреляционную зависимость от уровня G-17. Данные изменения указывают на возможность определения сывороточной концентрации IgE в качестве маркера воспаления СОЖ и атрофических изменений дна и тела желудка.
Заключение
При хроническом гастрите вследствие воспалительного и атрофического процессов нарушаются секреторная и защитная функции желудка. Проведенное исследование выявило наличие корреляционных зависимостей между сывороточными концентрациями гуморальных факторов мукозального иммунитета и протеолитических ферментов желудочного сока. Полученные результаты позволяют рекомендовать определение в сыворотке крови количества секреторного иммуноглобулина А и иммуноглобулина Ев качестве дополнительных маркеров, отражающих состояние слизистой оболочки желудка.
Литература
1. htpp://www.mednet.ru/statistika/zabolevaemost-naseleniya/zabolevaemost-vsego-naseleniya.html
2. Митракова Н.Н. Клинико-патогенетическая роль биоаминных и иммунных нарушений в патогенезе хронического гастрита и язвенной болезни желудка: автореф. дисс.докт. мед. наук. Н. Новгород, 2007. 28 с.
3. Чернин В.В. Болезни пищевода, желудка и двенадцатиперстной кишки: рук-во для врачей // М.: МИА, 2010. 528 с.
4. Бакланова О.А. Новые подходы к оценке прогрессии хронического атрофического гастрита: автореф. дисс. канд. мед. наук. Ставрополь, 2008. 16 с.
5. Пюрвеева К.В., Лапина Т.Л., Ивашкин ВТ. и др. Значение сывороточных показателей пепсиногена-І, пепсиногена-П и гастрина 17 в диагностике атрофического гастрита // Рос. журн. гастроэнтер., гепат., колопрокт. 2005. № 3. С. 48-51.
6. Молчанова А.Р., Сорокина Н.Н., Рукавишников М.Ю. Диагностическая значимость комплексного лабораторного исследования пепсиногенов // Новости «Вектор-Бест». 2010. № 2 (56). С. 7-10.
7. Маев И.В., Мельникова E.B., Крюкова Т.В. и др. Новые методы серологической и эндоскопической диагностики хронического атрофического гастрита и раннего рака желудка // Клин, перспект. гастроэнтер., гепат. 2009. № 6. С 30-34.
8. Павлович И.М. Атрофический гастрит (клиническая и функционально-морфологическая характеристика, критерии риска опухолевой трансформации): автореф. дисс.докт. мед. наук. СПб., 2006. 32 с.
9. Янкин А.В. Скрининг рака желудка // Практ. онкол. 2010. Т. 11. № 2. С. 96-101.
10. Oishi Y., Kiyohara Y., Kubo M. et al. The serum pepsinogen test as a predictor of gastric cancer. Amer. J. Epidemiol. 2006. Vol. 163. P. 629-637.
11. Sipponen P., Harkonen M., Alanko A. Diagnosis of Atrophic Gastritis from a Serum Sample. Clin. Lab. 2002. Vol. 48. P. 505-515.
12. Vaananen H., Vauhkonen M., Helsce T. et al. Non-Endoscopic Diagnosis of Atrophic Gastritis with a Blood Test. Correlation between Gastric Histology and Serum Levels of Gastrin-17 and Pepsinogen I. A Multicenter Study. Eur. J. Gastroenterol. Hepatol. 2003. Vol. 15. P. 885-891.
13. Амельчугова О.С. Клинико-морфологическая характеристика гастрита у коренных и пришлых жителей Эвенкии в зависимости от наличия СадА штаммов Helicobacter pylori: автореф. дисс. канд. мед. наук. Красноярск, 2009. 24 с.
14. Плужников M.C., Левин М.Я., Панова Н.В. и др. Мукозальная иммунная система // Нов. СПб. врачебные ведомости. 2005. № 4 (34). С. 41-43.
15. Raif S.G., Haifa H J., Scott R.B. Регуляция механизма рекомбинации переключения на синтез иммуноглобулина Е // Аллергол. и иммунол. 2005. Т. 6. № 1. С. 23-37.
16. Денисов Н.Л., Ивашкин ВТ., Лобзин Ю.В., Голофеевский В.Ю. Хронический гастрит с позиций взаимодействия иммунного, инфекционного и морфологического факторов // Рос. журн. гастроэнтер., гепат., колопрокт. 2008. Т. 18. №6. С. 22-26.
17. Соколова Г.Н., Потапова В.Б. Клинико-патогенетические аспекты язвенной болезни желудка // М.: Анахарсис, 2009. 328 с.
18. Кондрашина Э.А. Влияние местного иммунитета на течение язвенной болезни // Гастроэнтерол. СПб. 2006. № 1-2. С. 73.
19. Бережная Н.М., Чехун В.Ф., Сепиашвили Р.И. Эозинофилы, базофилы и иммуноглобулин Е в противоопухолевой защите // Аллергол. и иммунол. 2005. Т. 6. № 1С. 38-49.
Статья опубликована на сайте http://www.gastroscan.ru
материал MedLinks.ru