Содержание статьи
Дифференцированный подход к выбору тактики ведения пациентов с вирусно-бактериальными уретритами, ассоциированными с ВПЧ-инфекцией
Н. И. Скидан, кандидат медицинских наук
Д. В. Орехов
А. П. Горбунов, кандидат медицинских наук
Н. П. Евстигнеева, доктор медицинских наук, профессор
Ю. Н. Кузнецова, кандидат медицинских наук
ФГБУ УрНИИДВиИ МЗ РФ, Екатеринбург
В последние годы большое внимание исследователей и практикующих специалистов привлекают вопросы своевременной диагностики и эффективного лечения папилломавирусной инфекции (ПВИ) человека, что связано с неуклонным ростом ее распространенности, высокой контагиозностью и доказанной онкогенностью [1–3]. Вирус папилломы человека (ВПЧ) обусловливает многообразие поражений кожи и слизистых оболочек. Полагают, что папилломавирусная инфекция носит оппортунистический характер, и манифестация болезни происходит на фоне изменений в иммунной системе, которая становится несостоятельной в распознавании и элиминации трансформированных вирусом клеток [1, 4–6]. В то же время, несмотря на широкое распространение инфекции и большое количество посвященных ей исследований, до настоящего времени мало изучены факторы, лежащие в основе рецидивирования ПВИ, изменений специфической и неспецифической реактивности организма [7, 8].
Доминирующим кофактором, способствующим развитию ВПЧ-инфекции, является сексуальная активность. В целом рак гениталий, как и выявление ВПЧ, регистрируется чаще среди пациентов, рано начавших половую жизнь и имеющих большое количество половых партнеров [5, 9, 10]. Так, высок процент обнаружения этого вируса у сексуально активных подростков и молодых людей, не использующих барьерные методы контрацепции. Вторым важнейшим кофактором инфицирования, снижающим местный иммунитет, является наличие урогенитальных инфекций: хламидии, уреаплазмы, микоплазмы и условно-патогенная микрофлора [11].
Данные о частоте ПВИ урогенитального тракта в России недостаточно полны и основаны на статистике отдельных медицинских учреждений или врачей, занимающихся этой патологией [12].
Диагностика ПВИ представляет определенные трудности, особенно ее латентной формы, при которой, несмотря на наличие вируса папилломы человека, морфологических изменений в ткани не наблюдается [13].
Отягчающим фактором является длительная персистенция ВПЧ, на фоне которой развивается интраэпителиальная неоплазия, в 15,0–20,0% случаев приводящая к carcinoma in situ и инвазивному раку [2, 6, 11, 14]. Потенциальный риск озлокачествления эпителия при длительно существующей (персистирующей) папилломавирусной инфекции диктует необходимость обязательной санации при выявлении ВПЧ.
Материалы и методы исследования
На базе ФГБУ УрНИИДВиИ МЗ РФ было проведено комплексное клинико-лабораторное обследование 360 мужчин в возрасте от 21 до 46 лет (средний возраст составил 33,2 ± 2,2), обратившихся с различными жалобами со стороны органов мочеполового тракта. Из всех обследованных пациентов 54,0% имели половые контакты с одной половой партнершей, 32,0% имели половые контакты с двумя и 14,0% мужчин — с тремя и более. Клиническое обследование включало осмотр наружных половых органов, ректальное пальцевое исследование предстательной железы. По показаниям проводилось ультразвуковое исследование предстательной железы. Материалом для бактериоскопического и бактериологического исследования служило отделяемое уретры. Исследование проводилось в нативных препаратах и при микроскопии препаратов, окрашенных метиленовым синим и по Граму.
Исследование урогенитальной микрофлоры выполнялось в соответствии с методическими указаниями по применению унифицированных микробиологических (бактериологических) методов исследования в клинико-диагностических лабораториях, утвержденными приказом Минздрава СССР № 535 от 22 апреля 1985 г. «Об унификации микробиологических (бактериологических) методов исследования, применяемых в клинико-диагностических лабораториях лечебно-профилактических учреждений». Идентификацию выделенных дрожжеподобных грибов проводили на среде Candiselect, для определения чувствительности к антимикотикам использовали Фунгитест Bio-RAD (Франция). Для идентификации U. urealyticum и M. hominis был применен культуральный метод исследования, с использованием набора Mycoplazma IST 2 фирмы Bio-Meriux (Франция) с подсчетом колониеобразующих единиц и определением чувствительности к антимикробным препаратам. Полимеразная цепная реакция использовалась для выявления C. trachomatis, M. genitalium, Cytomegalovirus, Herpes simplex 1-го и 2-го типов и Human Papillomavirus 16-го/18-го, 31-го/33-го, 35-го/45-го типов.
Результаты и обсуждение
При первичном обращении основными жалобами пациентов были дискомфорт в мочеиспускательном канале (61,0%), дискомфорт в области промежности (18,0%), выделения из уретры слизистого или слизисто-гнойного характера (30,0%), жжение в уретре (43,0%), гиперемия и отечность губок уретры (54,0%), гиперемия кожи головки полового члена (36,0%), налет на головке полового члена (22,0%). Высыпания на половом члене в виде остроконечных кондилом наблюдались у 50 (14,0%) пациентов (табл. 1).
Результаты обследования пациентов на ВПЧ высокого онкогенного риска показали высокий уровень инфицированности мужчин, обратившихся на прием. ВПЧ был выявлен у 86 (24,0%) пациентов. Сравнительный анализ частоты встречаемости различных генотипов ВПЧ показал, что наиболее часто выявлялся 16-й тип ВПЧ (33,7%), 18-й тип определялся у 8,1% больных, 31-й тип — у 4,6%, 33-й тип — у 3,5%, 35-й тип — у 4,6%, 45-й тип — у 2,3%. У целого ряда пациентов было выявлено микст-инфицирование различными генотипами ВПЧ. Так, у 18 (20,9%) больных было выявлено два генотипа ВПЧ, у 15 (17,4%) пациентов — три генотипа, а у 4 (4,6%) мужчин — четыре генотипа ВПЧ (табл. 2).
Микст-инфицирование различными генотипами ВПЧ обусловливает менее благоприятный прогноз течения заболевания и устойчивость к терапии. При персистирующем течении ПВИ микст-инфицирование регистрируется чаще. Сочетание различных генотипов ВПЧ высокого канцерогенного риска (16-й/18-й тип) и потенциально канцерогенных способствует персистенции ПВИ. Генотипирование дает возможность дифференцирования персистирующей инфекции от вновь приобретенной. Микст-инфицирование различными генотипами ВПЧ снижает скорость элиминации вируса из организма при терапии и является неблагоприятным прогностическим признаком.
При проведении диагностики методом полимеразной цепной реакции (ПЦР) у 86 пациентов было выявлено сочетание ВПЧ с другими инфекциями, передающимися половым путем. Так, у 6 (7,1%) пациентов было обнаружено наличие Ch. trachomatis, у 25 (29,2%) — U. urealyticum, у 9 (10,0%) — M. genitalium (табл. 3). Сопутствующие инфекции, передаваемые половым путем, удлиняют сроки лечения и увеличивают риск развития рецидивов. При смешанной инфекции не исключается возможность синергического действия возбудителей на развитие и течение воспалительного процесса.

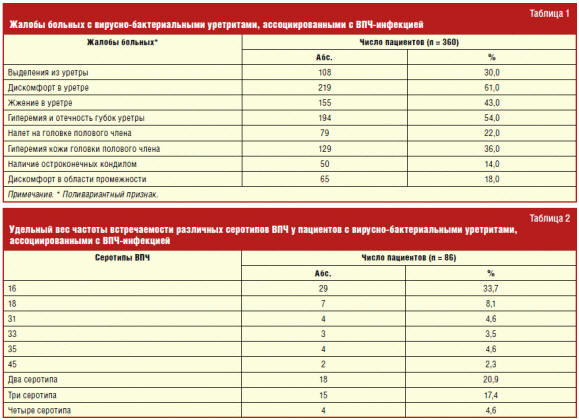
При бактериологическом исследовании отделяемого уретры больных с вирусно-бактериальными уретритами, ассоциированными с ВПЧ-инфекцией, наиболее часто обнаруживался Enterococcus faecalis (22,0%), у 15,0% больных был выделен Streptococcus agalactiae, у 11,0% — E. coli, у 4,0% — Staphilococcus aureus, у 4,0% — Haemophilus parainfluenzae, у 3,0% — Candida albicans, у 3,0% — Gardnerella vaginalis (рис. 1).
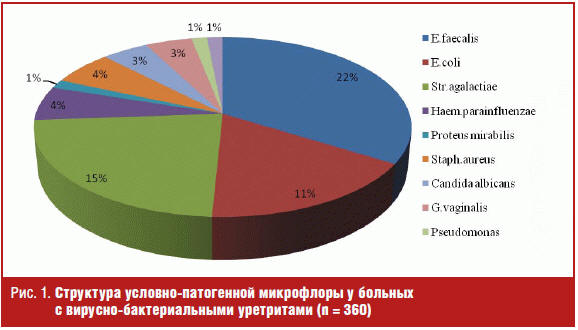
Таким образом, с учетом обозначенной проблемы и негативной роли папилломавирусной инфекции на органы репродуктивной системы приводим дифференцированный подход к выбору тактики ведения пациентов с урогенитальной ПВИ в зависимости от варианта течения (рис. 2).
Обследование на онкогенные типы ВПЧ показано пациентам с инфекциями, передаваемыми половым путем (ИППП), нарушением микробиоценоза урогенитального тракта, остроконечными кондиломами, воспалительными заболеваниями урогенитального тракта. По эпидемиологическим показаниям обследованию на онкогенные типы ВПЧ подлежат половые партнеры женщин с ИППП, в том числе вирусной этиологии, пациенты с ранним возрастом начала половой жизни, лица промискуитетного поведения.
Латентная форма ПВИ диагностируется только с помощью молекулярно-биологических методов исследования — выявление ВПЧ высокого онкогенного риска методом ПЦР при отсутствии клинических проявлений. Производится комплексное бактериологическое, бактериоскопическое, молекулярно-биологическое (ПЦР) исследование отделяемого уретры на N. gonorrhoeae, T. vaginalis, C. trachomatis, U. urealyticum, M. hominis, M. genitalium, G. vaginalis, дрожжеподобные грибы рода Candida, Herpes simplex virus I, II типов, Cytomegalovirus, определение микрофлоры урогенитального тракта с учетом количества, вида микроорганизмов и чувствительности микрофлоры к антибиотикам, выявление микст-инфицирования ИППП. При верификации сопутствующих ИППП и условно-патогенной микрофлоры в диагностически значимых титрах лечение пациенту назначается в соответствии с чувствительностью к антибактериальным препаратам.
На втором этапе — определение варианта течения папилломавирусной инфекции (транзиторный, персистирующий). Критериями персистирующего течения считаются случаи трехкратного и более выделения ВПЧ высокого онкогенного риска (16-го/18-го генотипов) в соскобах из уретры методом ПЦР при взятии материала с интервалом в 3–6 месяцев. Критерии транзиторного течения ПВИ: инфицирование ВПЧ высокого онкогенного риска эпителиальных клеток уретры в течение 3–6 месяцев, когда вирус папилломы человека выявлялся однократно, с последующими отрицательными результатами исследований.
При транзиторном варианте течения папилломавирусной инфекции урогенитального тракта, при отсутствии манифестных проявлений, необходимо диспансерное наблюдение в кожно-венерологическом учреждении с периодическим обследованием на ВПЧ один раз в 3–4 месяца в течение 1,5 лет. При установлении персистирующего варианта течения урогенитальной ПВИ рекомендовано назначение противовирусной и/или иммунотропной терапии, способствующее уменьшению степени риска развития неопластических процессов. При латентном течении ПВИ необходимо наблюдение и регулярное обследование в кожно-венерологических учреждениях.
Выводы
Таким образом, проведя анализ полученных данных, можно сделать вывод о высоком уровне инфицированности мужчин репродуктивного возраста ВПЧ высокого онкогенного риска (24,0%), при этом сопутствующие инфекции, передаваемые половым путем, удлиняют сроки лечения и увеличивают риск развития рецидивов, так как микст-инфицирование различными генотипами ВПЧ снижает скорость элиминации вируса из организма при терапии и является неблагоприятным прогностическим признаком.
Клиническими показаниями для обследования на онкогенные типы ВПЧ являются пациенты с инфекциями, передающимися половым путем, нарушением микробиоценоза урогенитального тракта, остроконечными кондиломами, воспалительными заболеваниями урогенитального тракта. При транзиторном варианте течения ВПЧ, при отсутствии манифестных проявлений необходимо диспансерное наблюдение в кожно-венерологических учреждениях с периодическим обследованием на ВПЧ один раз в 3–4 месяца в течение 1,5 лет. При установлении персистирующего варианта течения урогенитальной папилломавирусной инфекции рекомендовано назначение противовирусной и/или иммунотропной терапии.
Литература
- Евстигнеева Н. П. Папилломавирусная инфекция урогенитального тракта женщин: эпидемиология, факторы персистенции, оптимизация ранней диагностики и профилактики онкогенеза: автореф. дис. … д-ра мед. наук. М., 2007. 46 с.
- Евстигнеева Н. П., Кузнецова Ю. Н., Герасимова Н. М. Критерии диагностики урогенитальной персистирующей папилломавирусной инфекции // Инфекции, передаваемые половым путем. 2009. № 3–4. С. 25–31.
- Козлова В. И., Пухнер А. Ф. Вирусные, хламидийные и микоплазменные заболевания гениталий. Рук-во для врачей. М.: Изд-во «Триада-Х», 2003. 439 с.
- Akgül B., Cooke J. C., Storey A. HPV-associated skin disease // J. Pathol. 2006. Vol. 208. № 2. P. 165–175.
- Bosch F. X., Lorinez A., Munos N., Meijer С. J. L. M., Shacn K. V. The causal relation between papillomavirus and cervical cancer // Journal of clinical partology. 2002. Vol. 55, 4, P. 244–265.
- Sedlacek T. V. Advances in the diagnosis and treatment of human papillomavirus infection // Clin. Obstet. Gynnecol. 1999. V. 42, № 2. Р. 206–220.
- Bosch F. X., Lorincz A., Munos M., Meijer C. J., Shah K. V. The causal relation between human papillomavirus and cervical cancer // J Clin Pathol. 2002. 55. P. 244–265.
- Uschieri K., Whitley M., Cubie H. Human papillomavirus type specific DNA and RNA persistenceimplications for cervical disease progression and monitoring // J Med Virol. 2004 May. 73 (1) H. Р. 65–70.
- Giuliano A. R., Tortolero-Luna G. Epidemiology of Human Papillomavirus infection in men, cancers other than cervical and benign conditions // Vaccine. 2008. V. 26. Р. 17–27.
- Schlecht N. F., Kulaga S., Robitaille J. et al. Persistent human papillomavirus infection as a predictor of cervical intraepithelial neoplasia // JAMA. 2001; 286. P. 3106–3114.
- Wu R., Sun S., Steinberg B. M. Requirement of STAT3 activation for differentiation of mucosal stratified squamous epithelium // Mol. Med. 2003. Vol. 9 (3–4). Р. 77–84.
- Тихонова Л. И. Обзор ситуации с ИППП // Заболевания, передаваемые половым путем. 1999. № 1. С. 15–17.
- Минкина Г. Н., Манухин И. Б., Франк Г. А. Предрак шейки матки. М.: Аэрографмедиа, 2001.
- Молочков В. А., Киселев В. И., Рудых И. В. и др. Папилломавирусная инфекция, клиника, диагностика, лечение. М.: Изд-во РГМУ, 2004. 43 с.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru







