Болезни дыхательных путей
Ключевые слова: синдром Клиппеля – Треноне – Вебера – Рубашова, абсцесс легкого, клинический случай.
Для цитирования: Скорняков С.Н., Сабадаш Е.В., Медвинский И.Д., Бердников Р.Б., Хольный П.М., Дьячков И.А., Николаева М.О., Щиголев М.И., Масютина Д.Д., Иванчикова Е.Д. Хронический абсцесс легкого у пациента с синдромом Клиппеля – Треноне – Вебера – Рубашова // РМЖ. 2018. №3(I). С. 36-39
Skornyakov S.N.1,2, Sabadash Е.V.1,2, Medvinsky I.D.1,2, Berdnikov R.B.1,2, Holny P.M.2, Dyachkov I.A.1,2, Nikolaeva M.O.1,ShchigolevM.I.1, Masyutina D.D.1, Ivanchikova E.D.1
1 Ural State Medical University, Yekaterinburg
2 Ural research Institute of Phthisiopulmonology, Yekaterinburg
Klippel – Trenaunay – Weber (KTW) syndrome is a congenital angiodysplasia of peripheral vessels with the formation of pathological arteriovenous communications, the presence of which causes the violation of blood flow along the main veins of the affected limb with the development of varicose transformation of superficial veins of the extremities. The syndrome is characterized by a variety of clinical manifestations, so treatment requires a multidisciplinary approach. The disease needs surgical treatment, often with a large number of complications. In the vast majority of cases, staged surgical treatment is used, it is often traumatic and leads to a large number of complications (bleeding, trophic ulcers, hypertrophic and keloid scars). The frequency of postoperative relapse reaches 30–48%. The article presents a clinical case of chronic lung abscess in a patient with Klippel-Trenaunay-Weber syndrome. The presented clinical case is a unique example of the combination of the syndrome of congenital angiodysplasia and chronic lung abscess. Patients with KTW syndrome rarely come into the view of a pulmonologist or thoracic surgeon, and this clinical case is a clear illustration of the possible pulmonary manifestation of congenital angiodysplasia.
Key words: Klippel – Trenaunay – Weber syndrome, lung abscess, clinical case.
For citation: Skornyakov S.N., Sabadash Е.V., Medvinsky I.D. et al. The chronic lung abscess in a patient with Klippel – Trenaunay – Weber Syndrome // RMJ. 2018. № 3(I). P. 36–39.
В статье представлен клинический случай хронического абсцесса легких у пациента с синдромом Клиппеля – Треноне – Вебера – Рубашова, который является уникальным примером сочетания синдрома врожденной ангиодисплазии и хронического абсцесса легкого.
Введение
Синдром Клиппеля – Треноне – Вебера – Рубашова (СКТВР) — врожденная ангиодисплазия периферических сосудов с формированием патологических артериовенозных соустий, наличие которых обусловливает нарушение кровотока по магистральным венам пораженной конечности и как следствие — развитие варикозной трансформации поверхностных вен верхних и/или нижних конечностей с неуклонно прогрессирующим течением [1–6].
По данным литературы, в основе заболевания предполагается роль нарушения эмбриогенеза с дисплазией глубокой венозной системы, однако наследственный фактор в развитии СКТВР играет незначительную роль. В структуре причин, нарушающих отток крови по глубоким венам, как правило, выделяют аплазию или гипоплазию вен, сдавление вен эмбриональными тяжами или артериальными сосудами, врожденное недоразвитие клапанного аппарата с расширением просвета глубоких вен. Патологические врожденные артериовенозные фистулы-шунты неизменно приводят к варикозному расширению вен, артериовенозные соустья усиливают венозный отток и тем самым увеличивают минутный объем сердца, вызывают его перегрузку и в зависимости от локализации шунта, длительности его существования и калибра измененных артерий приводят к гипертрофии сердца и сердечно-сосудистой недостаточности. В дальнейшем наблюдается снижение артериального и повышение венозного давления, уменьшение общего периферического сопротивления. За счет артериовенозного сброса происходит повышение содержания кислорода в венозной крови, что является одним из наиболее выраженных и постоянных симптомов артерио
венозных фистул [2, 3, 6].
Для СКТВР характерна классическая триада симптомов: кожные ангиомы, расширение поверхностных вен, гипертрофия пораженной конечности (синдром Клиппеля – Треноне). Кроме того, может иметь место наличие артериовенозных анастомозов (синдром Паркса – Вебера) [1, 4]. Ряд авторов указывают на высокий процент распространенности таких системных проявлений СКТВР, как висцеромегалия и ангиоматоз висцеральных органов, гемангиомы желудочно-кишечного тракта, мочевой системы, добавочные крупные сосуды, аневризмы почечных артерий, гемангиомы почек, таза, матки [4, 5–7]. СКТВР обладает разнообразием клинических проявлений, что обусловливает необходимость мультидисциплинарного подхода к лечению заболевания с участием специалистов различных профилей (хирургов, педиатров, дерматологов, врачей лучевой диагностики) [1–4, 8]. В подавляющем большинстве случаев применяется этапное хирургическое лечение, зачастую травматичное и приводящее к большому количеству осложнений, по данным литературы, в 7,4–20% случаев (кровотечения, трофические язвы, гипертрофические и келлоидные рубцы). Частота послеоперационных рецидивов достигает 30–48% [2, 7, 9–11].
Клинический случай
В туберкулезное легочно-хирургическое отделение Уральского научно-исследовательского института фтизиопульмонологии 17 апреля 2017 г. поступил пациент П., 46 лет, с жалобами на периодический кашель с выделением светлой мокроты, одышку при умеренной физической нагрузке (вынужденная остановка при ходьбе на 2–3-лестничном пролете), множественные телеангиоэктазии латеральной, задней шейных, дельтовидной, грудной, локтевой областей слева.
История болезни.
В 2003 г. при прохождении обследования (подготовка к плановому оперативному лечению по поводу СКТВР) по результатам обзорной рентгенографии органов грудной клетки (ОГК) впервые диагностирован поликистоз нижней доли левого легкого. За медицинской помощью пациент не обращался. В октябре 2016 г. заболел остро, когда на фоне фебрильной лихорадки появился продуктивный кашель с отделением небольшого количества гнойной мокроты с геморрагическим компонентом (прожилки крови). В последующие дни стал отмечать усиление кашля по ночам при положении на правом боку. Выраженность кашлевого синдрома значительно снижалась при положении на левом боку и в дневное время суток. Самостоятельно не лечился, за медицинской помощью по-прежнему не обращался. В ноябре 2016 г. отметил некоторое улучшение в виде урежения ночных приступов кашля. В январе 2017 г. состояние вновь ухудшилось, появились выраженная общая слабость, снижение толерантности к физическим нагрузкам, кровохарканье. После обращения за медицинской помощью был обследован. По данным мультиспиральной компьютерной томографии (КТ) ОГК и КТ с внутривенным контрастным усилением диагностировано разрушенное левое легкое на фоне поликистозного поражения. Рекомендовано плановое оперативное лечение в объеме пульмонэктомии слева.
В анамнезе. В детстве на фоне интенсивных физических нагрузок (занимался спортивной греблей) было отмечено появление и медленное прогрессирование следующих симптомов: нарушение местной терморегуляции, периодические ноющие боли и варикозная деформация поверхностных вен левой верхней конечности (рис. 1). Диагностирована врожденная ангиодисплазия. После отказа от занятий спортом прогрессирование клинических проявлений заболевания замедлилось. В 2003 г. по поводу СКТВР было выполнено разобщение артериовенозных соустий левой верхней конечности. Впоследствии и по настоящее время синдром проявляется в виде редких эпизодов спонтанно возникающих непродолжительных ноющих болей в левой верхней конечности, особенно в указательном пальце, продолжительностью около 10 мин. Продолжительность периодов бессимптомного течения может достигать нескольких месяцев, чаще 4–6 нед.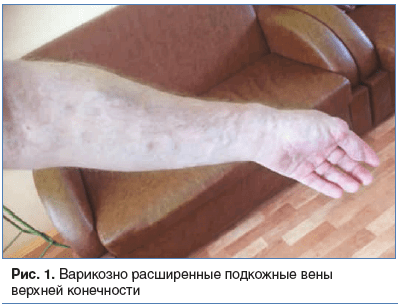
Прочие сопутствующие заболевания. С детства отмечает частые острые респираторные вирусные инфекции, бронхиты. Гипертоническая болезнь II стадии.
Семейный анамнез отягощен по заболеваниям сердечно-сосудистой системы.
При поступлении: общее состояние удовлетворительное. Телосложение гиперстеническое. Кожные покровы физиологической окраски. На коже левых латеральной, задней шейных областей располагается телеангиоэктатический сосудистый невус («винный» невус) неправильной формы, 4–6 см в диаметре, не возвышающийся над поверхностью кожи, а также множественные телеангиоэктазии дельтовидной, частично грудной и локтевой областей слева (рис. 2). Щитовидная железа не увеличена. Дыхание через нос свободное. Грудная клетка правильной формы. Обе половины ее одинаково участвуют в акте дыхания. Перкуторно над легкими справа: ясный легочной звук, слева: в верхних отделах коробочный, в нижних — тимпанит. В правом легком дыхание везикулярное, в левом выслушиваются разнокалиберные влажные хрипы. ЧДД — 16 в минуту. Границы сердца не смещены, не расширены. Тоны сердца ясные, ритм правильный, шумы отсутствуют. ЧСС — 89 в минуту, АД — 125/80 мм рт. ст. Пульс — 89 уд/мин, ритмичный, нормального наполнения и напряжения. Живот правильной формы, пальпаторно мягкий, безболезненный во всех отделах. Нижний край печени выше края реберной дуги. Поясничные области визуально и пальпаторно не изменены. Симптомы поколачивания отрицательные с обеих сторон. Дизурии нет. Очаговой неврологической симптоматики нет.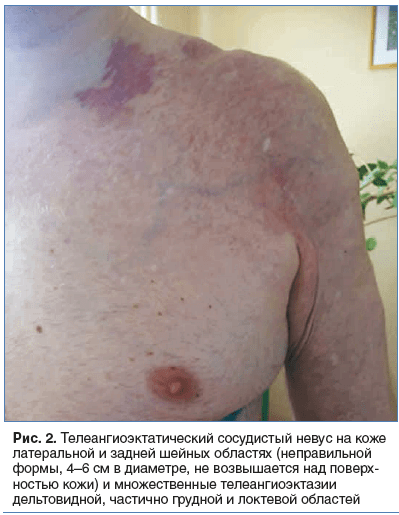
При обследовании: в общем анализе крови: лейкоциты — 9,8×109/л, эритроциты — 5,55×1012/л, тромбоциты — 263×109/л, гемоглобин — 143 г/л, гематокрит 43,1%, СОЭ —13 мм/ч. Общий анализ мочи: удельный вес — 1,030 г/л, рН — 5,0, уробилиноген — 3 мг/дл. Биохимия крови: глюкоза — 4,5 ммоль/л, общий белок — 73,4 г/л, альбумин — 39,6 г/л, АСТ — 19,0 Ед/л, АЛТ — 55,8 Ед/л, мочевина — 7,2 ммоль/л. Коагулограмма: тромбоциты — 450×109/л, активированное частичное тромбопластиновое время — 29,2 с, протромбиновое время — 13,3 с, международное нормализованное отношение — 1,26 (удлинение коагуляции по внешнему пути).
ФГДС: варикозно расширенные вены нижней трети пищевода II–III степени. ЭКГ: синусовая тахикардия до 90 уд/мин. Метаболические нарушения, неполная блокада правой ножки пучка Гиса. Дуплексное сканирование вен верхних конечностей с цветным картированием: поверхностные и глубокие вены правой верхней конечности проходимы. Посттромботическая болезнь левой верхней конечности, реканализация срединной подкожной вены, частичная реканализация латеральной подкожной вены в области локтевого сгиба, без флотации. Варикозная трансформация латеральной подкожной, срединной подкожной, лучевой, локтевой вен слева. КТ ОГК с внутривенным контрастным усилением: в паренхиме правого легкого очаговых и фокусных изменений нет. В левом легком во всех сегментах, преимущественно в нижней доле, определяются множественные крупные и средних размеров округлые полости (кисты, буллы), разделенные тонкими септами. Некоторые полости (в задних и нижних отделах) с жидкостью, дренируются соответствующими бронхами. Артерии левого легкого деформированы, сближены и расположены по контуру кист по касательной. Оставшаяся паренхима избыточно воздушна, сосудистый рисунок обеднен. Свободного выпота в плевральных полостях нет. Ствол легочной артерии не расширен. Костные элементы и мягкие ткани грудной стенки не изменены. Заключение: кистозно-буллезная трансформация паренхимы левого легкого (рис. 3).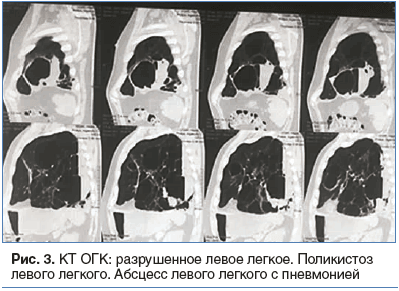
Осмотр офтальмолога: пигментный невус сетчатки левого глаза.
Предоперационный диагноз: разрушенное левое легкое. Поликистоз левого легкого (?). Абсцесс левого легкого с пневмонией (?).
15.05.17 пациенту была выполнена пульмонэктомия слева.
Интраоперационно: плевральная полость свободна, грубые рубцовые сращения в задних отделах и над диафрагмой. Легкое выделено из сращений остро-тупо. Легкое практически полностью выполнено кистами: воздушными и наполненными (напряженными). Элементы корня легкого обработаны раздельно: поочередно перевязаны и дважды прошиты легочная артерия, верхняя и нижняя легочные вены (DSTSeries™ TA™, typeTA30V3S, Covidien, NewHaven, CT, USA, 6 шт.). Культя главного бронха мобилизована до бифуркации, произведена ее реампутация на уровне 2–3-го полукольца. Культя ушита вручную узловыми швами атравматично проленом 3/0 по Суиту с шагом 1–1,5 мм. Дренаж. Послойные швы.
Послеоперационный период протекал гладко. Проведен курс антибактериальной профилактики гнойных осложнений. По дренажам из плевральной полости в 1-е сутки после операции выделилось 250 мл серозно-геморрагической жидкости, в течение 2-х дней после операции количество отделяемого в сутки уменьшилось до 100 мл, сброса воздуха по плевральному дренажу и явлений подкожной эмфиземы не отмечалось. На 3-и сутки после операции дренаж удален с подпусканием воздуха в плевральную полость. Операционная рана зажила первичным натяжением.
Патогистологическое исследование № 459/17. Практически всю нижнюю долю занимает гигантская полость многокамерного строения, с кожистой стенкой, заполненная большим количеством зеленоватых масс. Стенка полости 3-слойная: гнойно-некротический слой с большим количеством нейтрофилов, слой грануляционной ткани неспецифического вида, широкий фиброзный слой. Вокруг большое количество гемосидерофагов интраальвеолярно, участки организации, бронхоэктазы. В легочной ткани также определяются гемосидерофаги интраальвеолярно, имеется утолщение и перекалибровка сосудов с резким утолщением их стенки и сужением просвета. По линии резекции — склероз стенки бронха. Окраска по Цилю — Нильсену отрицательная.
Заключение: гигантский многокамерный хронический абсцесс в нижней доле левого легкого в активной фазе гнойного воспаления. Гемосидероз легкого (кровохарканье в анамнезе) (рис. 4).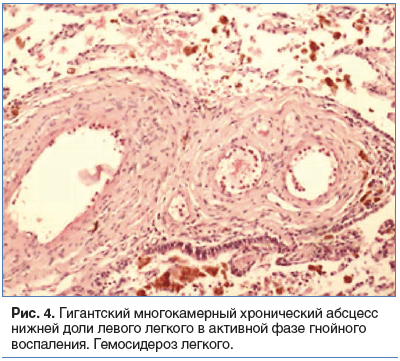
При контрольном осмотре через 1 мес.: жалобы на умеренные боли в области торакотомного разреза (рубец без признаков воспаления), температура тела в норме. Обзорная рентгенография ОГК: слева — остаточная полость частично заполнилась гомогенным содержимым. Других дополнительных затемнений и уровней жидкости нет; справа — очаговых и фокусных изменений нет.
Через 6 мес. после оперативного вмешательства состояние удовлетворительное, никаких жалоб пациент не предъявляет. При рентгенографии ОГК: слева — остаточная полость полностью заполнилась гомогенным содержимым, справа — очаговых и фокусных изменений нет.
Заключение
Приведенный клинический случай является уникальным примером сочетания синдрома врожденной ангиодисплазии и хронического абсцесса легкого. Поражение паренхимы легкого, вероятно, обусловило длительное бессимптомное прогрессирование кистозной гипоплазии левого легкого. На фоне вовлечения в процесс нижнедолевого бронха нарушения мукоцилиарного клиренса и кинетики бронхов достигли критических значений с последующей их колонизацией неспецифической микрофлорой, при этом заболевание манифестировало в виде острого абсцесса легкого с полным разрушением его паренхимы и последующей хронизацией процесса. Таким образом, данный процесс можно рассматривать как вариант системного проявления СКТВР.
В пользу предположения о сосудистом генезе поражения паренхимы легкого говорят данные: патоморфологического исследования (перекалибровка сосудов с резким утолщением их стенки и сужением просвета), КТ-исследования (артерии левого легкого деформированы, сближены и расположены по контуру кист по касательной). Кроме того, обращает на себя внимание локализация изменений: левосторонняя — наружных проявлений СКТВР и кистозно-буллезная трансформация паренхимы только левого легкого. В пользу того, что хронический абсцесс развился именно на фоне кистозной гипоплазии, свидетельствуют его гигантский многокамерный характер, локализация в нижней доле левого легкого (расположение наиболее выраженного кистозного изменения легочной паренхимы). Наличие в легочной ткани гемосидерофагов свидетельствует о выраженном внутрилегочном кровотечении, вызванном разрушением большого количества кистозных полостей.
В доступной литературе мы не встретили каких-либо упоминаний, подтверждающих нашу гипотезу.
Важно отметить, что пациенты с СКТВР редко попадают в поле зрения врача-пульмонолога или торакального хирурга, а приведенный клинический случай является наглядной иллюстрацией возможного легочного проявления врожденной ангиодисплазии. Такие клинические проявления СКТВР, как эпизоды кашля с мокротой и кровохарканье, долгое время не оценивались специалистами как клинически значимые, поскольку не сопровождались изменениями лабораторных показателей, наличием проявлений, характерных для интоксикационного синдрома. Но при более детальном обследовании пациента выявлен патологический процесс, который явился абсолютным показанием для плановой пульмонэктомии.
Литература
1. Конюшевская А.А., Ярошенко С.Я. Клинический случай редкой наследственной патологии — синдром Клиппеля — Треноне — Вебера — Рубашова в практике врача-педиатра // Здоровье ребенка. 2014. №2(53). С.117–122 [Konjushevskaja A.A., Jaroshenko S.Ja. Klinicheskij sluchaj redkoj nasledstvennoj patologii — sindrom Klippelja — Trenone — Vebera — Rubashova v praktike vracha-pediatra // Zdorov’e rebenka. 2014. №2(53). S.117–122 (in Russian)].
2. Попель Г.А. Диагностика и хирургическое лечение ангиодисплазий наружной локализации // Новости хирургии. 2015. Т.22. №5. С.601–610 [Popel’ G.A. Diagnostika i hirurgicheskoe lechenie angiodisplazij naruzhnoj lokalizacii // Novosti hirurgii. 2015. T.22. №5. S.601–610 (in Russian)].
3. Чен Д.Ч. Диагностика артериовенозных свищей // Insitu. 2016. №9. С.36–39 [Chen D.Ch. Diagnostika arteriovenoznyh svishhej // Insitu. 2016. №9. S.36–39 (in Russian)].
4. Чернуха Л.М., Каширова Е.В., Тодосьев А.В. Классификационные стратегические подходы в лечении врожденных сосудистых мальформаций: взгляд сосудистого хирурга // Новости хирургии. 2015. Т. 23. №5. С.539–551 [Chernuha L.M., Kashirova E.V., Todos’ev A.V. Klassifikacionnye strategicheskie podhody v lechenii vrozhdennyh sosudistyh mal’formacij: vzgljad sosudistogo hirurga // Novosti hirurgii.2015. T.23. №5. S.539–551 (in Russian)].
5. Kundzina L., Lejniece S. Klippel — Trenaunay — Weber syndrome with atypical presentation of hypersplenism and nephrotic syndrome: a case report // J Med Case Rep. 2017. Vol. 11(1). P.243. doi: 10.1186/s13256-017-1413-1.
6. Yoshinaga, T., Yagi, K., Morishita, T. et al. Cerebral and spinal cavernomas associated with Klippel — Trenaunay syndrome: case report and literature review// Acta Neurochir. 2017. Dec 1. P.1–4. doi: 10.1007/s00701-017-3408-5
7. Qazi S.A., Arabi M., Alharbi A. et. al. Pharmacomechanical Thrombectomy of Superficial Venous Thrombosis in Sturge — Weber and Klippel — Trénaunay Overlap Syndrome // J VascIntervRadiol. 2017. Vol. 28(11). P.1609–1611. doi: 10.1016/j.jvir.2017.06.010
8. Kim S.W., Song H. Multimodal Imaging in Klippel — Trénaunay — Weber Syndrome: Clinical Photography, Computed Tomoangiography, Infrared Thermography, and 99mTc-Phytate Lymphoscintigraphy // ClinNucl Med. 2017. Vol. 42(12). P.976–977. doi: 10.1097/RLU.0000000000001875
9. Диомидов И.А., Васильев И.С., Васильев Ю.С. Эффективность применения ND-YAG-лазерного излучения при лечении больных с сосудистыми аномалиями // Вестник Южно-Уральского гос. ун-та. Серия: Образование, здравоохранение, физическая культура. 2013. Т.13. №2. С.86–88 [Diomidov I.A., Vasil’ev I.S., Vasil’ev Ju.S. Jeffektivnost’ primenenija ND-YAG-lazernogo izluchenija pri lechenii bol’nyh s sosudistymi anomalijami // Vestnik Juzhno-Ural’skogo gos. un-ta. Serija: Obrazovanie, zdravoohranenie, fizicheskaja kul’tura. 2013. T.13. №2. S.86–88 (in Russian)].
10. Мусагалиев Д.Т., Абзалиев К.Б., Онласынов А.К. и др. Эффективность эндоваскулярного лечения врожденных ангиодисплазий // Педиатрия жане бала хирургиясы. 2015. №3(81). С.28–32 [Musagaliev D.T., Abzaliev K.B., Onlasynov A.K. i dr. Jeffektivnost’ jendovaskuljarnogo lechenija vrozhdennyh angiodisplazij // Pediatrija zhane bala hirurgijasy. 2015. №3(81). S.28–32 (in Russian)].
11. Степанов И.В., Олышанский М.С., Харитонов Д.Ю., Степанова Е.С. Хирургическое лечение больных с артериовенозными ангиодисплазиями в области головы и шеи // Стоматология. 2017. Т.96. №4. С.28–31 [Stepanov I.V., Olyshanskij M.S., Haritonov D.Ju., Stepanova E.S. Hirurgicheskoe lechenie bol’nyh s arteriovenoznymi angiodisplazijami v oblasti golovy i shei // Stomatologija. 2017. T.96. №4. S.28–31 (in Russian)].
Поделитесь статьей в социальных сетях
Порекомендуйте статью вашим коллегам
Информация с rmj.ru