Содержание статьи
- 1 Гастроинтестинальные проявления пищевой аллергии у детей
- 1.0.1 Немедленная гастроинтестинальная гиперчувствительность
- 1.0.2 Оральный аллергический синдром
- 1.0.3 Проктоколит, индуцированный пищевыми белками
- 1.0.4 Энтеропатия, индуцированная пищевыми белками
- 1.0.5 Эозинофильный эзофагит
- 1.0.6 Эозинофильный гастрит, гастроэнтерит, гастроэнтероколит (ЭГ)
- 1.0.7 Диета детей с гастроинтестинальными проявлениями пищевой аллергии
Гастроинтестинальные проявления пищевой аллергии у детей
Г. А. Новик, доктор медицинских наук, профессор
М. А. Ткаченко, кандидат медицинских наук, доцент
Санкт-Петербургская государственная педиатрическая медицинская академия, Санкт-Петербург
Среди всех неблагоприятных реакций на пищу пищевая аллергия является одной из самых обсуждаемых проблем как среди педиатров, так и среди врачей-специалистов (аллергологов, нутрициологов, гастроэнтерологов). К сожалению, на сегодняшний день отсутствуют точные данные о распространенности пищевой аллергической реакции в мире. Это связано, с одной стороны, с многочисленными проявлениями заболевания, затрагивающими многие органы и системы, а с другой стороны — с трудностями точной верификации диагноза в клинической практике. Предположительно в мире насчитывается примерно 220–520 млн человек, страдающих пищевой аллергией [29].
Далеко не все неблагоприятные реакции на пищу относятся к пищевой аллергии. Исходя из общепринятого определения, к пищевой аллергии относят только иммунологически обусловленные реакции. К неблагоприятным реакциям на пищу относятся и целый ряд метаболических заболеваний, токсических реакций, непереносимость пищевых продуктов и т. д. (рис. 1).
![Рис. 1. Неблагоприятные реакции на пищу [30]](https://medblog.su/wp-content/uploads/2019/08/gastrointestinalnye-proyavleniya-pishhevoj-allergii-u-detej.jpg)
Рис. 1. Неблагоприятные реакции на пищу [30]
К сожалению, существует как гипер-, так и гиподиагностика пищевой аллергии. По мнению большинства исследователей, именно 8 аллергенов вызывают подавляющее число аллергических реакций (рис. 2). По последним данным аллергия на коровье молоко (АБКМ) стабильно занимает второе место (после куриного яйца) как в Европе, так и в США и Японии. Жалобы родителей на аллергию к коровьему молоку колеблются в диапазоне от 1% до 17,5% у детей до 5 лет, от 1% до 13,5% у детей 5–16 лет и от 1% до 4% у взрослых [28, 29]. Пищевая аллергия чаще встречается у детей, чем у взрослых, и представляет собой серьезную глобальную проблему.

Рис. 2. Основные пищевые аллергены
Основные аллергены коровьего молока сосредоточены в сывороточной и казеиновой фракциях. К сывороточным аллергенам коровьего молока относятся: альфа-лактоальбумин (Bos d4), бета-лактоглобулин (Bos d5), бычий сывороточный альбумин (Bos d6), бычьи иммуноглобулины (Bos d7). Казеиновые аллергены (группа, известная как Bos d8) состоят из четырех разных белков (альфа1-, альфа2-, бета- и каппа-казеин). Чаще всего пациенты чувствительны к альфа- (100%) и каппа-казеинам (91,7%). Для практической работы важно помнить, что козье молоко очень близко по антигенному составу к коровьему молоку, поэтому перевод ребенка на козье молоко при наличии у него АБКМ неоправдан. Кроме того, аллергенами молока млекопитающих являются белки, поэтому назначение безлактозного молока детям, страдающим аллергией на коровье молоко, выглядит абсолютно абсурдным. Аллергены молока остаются биологически активны даже после кипячения, пастеризации, ультравысокотемпературной обработки и выпаривания. Получение гипоаллергенной смеси — это высокотехнологическая процедура, включающая в себя гидролиз с последующей термообработкой, ультрафильтрацией и применением высокого давления. В последнее время появились так называемые аминокислотные смеси, которые вообще не содержат белка, а в состав их входит необходимый набор аминокислот. Клинические проявления аллергии к белкам коровьего молока отличаются разнообразием и часто маскируются под хорошо известные проявления других заболеваний. Наиболее часто у детей с АБКМ обнаруживают кожные проявления (от 5% до 90%). Около 1/3 детей с атопическим дерматитом имеют молочную аллергию [30]. Острые реакции в виде анафилаксии встречаются значительно реже, но прогностически — это наиболее опасные проявления АБКМ. Поражения респираторного тракта проявляются и в виде аллергического ринита и в виде бронхиальной астмы при участии IgE-зависимых механизмов. Особой формой молочной аллергии является синдром Хейнера, или болезнь молочных преципитинов, обусловленная не-IgE-механизмами. Аллергическое поражение желудочно-кишечного тракта имеют по данным разных исследователей от 32% до 60% больных с молочной аллергией [30]. К сожалению, клинические проявления гастроинтестинального поражения у больных с АБКМ не всегда манифестны, что существенно затрудняют диагностику и, как следствие этого, адекватное лечение.

Существует целый спектр аллергических заболеваний пищеварительного тракта (табл. 1). Непосредственно к атопическим, т. е. IgE-опосредованным, относятся лишь немедленная гастроинтестинальная гиперчувствительность и оральный аллергический синдром. В основе белок-индуцированных энтеропатии и колита лежат клеточные реакции. Группировка этих заболеваний, исходя из ведущего иммунологического механизма, имеет практическое значение. Например, рrick-тесты (кожный тест-укол) и RAST (определение антител класса E) обладают высокой информативностью у пациентов с IgE-опосредованными заболеваниями и практически бесполезны при обследовании детей с заболеваниями, при которых ведущую роль играют клеточные механизмы. В отдельную группу выделяют эозинофильные заболевания пищеварительного тракта. В их патогенезе участвуют как IgE-зависимые, так и клеточные механизмы, где ключевое значение имеют эозинофилы. Морфологическими особенностями, характерными для этой группы заболеваний, являются преобладание в воспалительном инфильтрате эозинофилов, их группировка (эозинофильные микроабсцессы), внедрение в эпителий и дегрануляция.
Эозинофилы функционируют как антиген-презентирующие клетки, а также индуцируют воспалительный процесс при участии специальных белков — EDGP (Eosinophil-Derived Granule Proteins). В их состав входят катионные белки эозинофилов (ECP), эозинофильный нейротоксин (EDN), пероксидаза эозинофилов (EPO) и так называемый major basic protein (MBP). Эти белки обладают цитотоксическим эффектом на эпителий пищеварительного тракта, а также вызывают дегрануляцию тучных клеток с высвобождением цитокинов (IL-1, IL-3, IL-4, IL-5, IL-13, трансформирующий фактор роста), хемокинов (эотоксин) и нейромедиаторов (субстанция P, вазоактивный интестинальный полипептид) [1, 2].
Немедленная гастроинтестинальная гиперчувствительность
Немедленная гастроинтестинальная гиперчувствительность (НГГ) — это IgЕ-опосредованное заболевание, характеризующиеся появлением тошноты, рвоты и боли в животе спустя несколько минут/1–2 часа после употребления «причинных» продуктов. Диарея может присоединяться через 2–6 часов [3].
Часто симптомы со стороны желудочно-кишечного тракта сочетаются с реакциями гиперчувствительности I типа со стороны кожи, глаз, дыхательной системы, а также анафилактической реакцией. Однако гастроинтестинальные симптомы могут быть единственным проявлением пищевой аллергии даже у тех пациентов, у которых те же аллергены вызывают IgE-опосредованные реакции со стороны других органов и систем. Например, у ребенка с атопическим дерматитом, обусловленным сенсибилизацией к пищевому аллергену (и наличием специфических IgE) употребление «причинного» продукта может вызвать только проявления НГГ без каких-либо симптомов со стороны кожи [4].
Чаще всего НГГ вызывают молоко, яйца, арахис, соя, пшеница и морепродукты. Как и при других IgE-опосредованных заболеваниях, аллергия к молоку, яйцам, пшенице и сое с возрастом, как правило, проходит. Непереносимость арахиса, лесных орехов и морепродуктов может сохраняться в течение всей жизни.
В диагностике наряду с анамнестическими данными выявляют повышенный уровень специфических IgE и положительные кожные prick-тесты.
Оральный аллергический синдром
Оральный аллергический синдром (ОАС) — это IgЕ-опосредованное заболевание, характеризующееся появлением покраснения, зуда, жжения в ротовой полости, а также отеком губ, языка и неба [3]. Симптомы развиваются сразу после употребления некоторых свежих фруктов и овощей. Нередко дети отказываются есть «причинные» продукты. В 1–2% случаев могут развиваться тяжелые аллергические реакции [5]. ОАС дебютирует, как правило, после года (в дошкольном возрасте) и ассоциируется с сезонным аллергическим ринитом и/или конъюнктивитом. Дебюту этого синдрома почти всегда предшествует сенсибилизация пыльцой, содержащей белки, гомологичные тем, что находятся в определенных фруктах и овощах. При этом пациент, сенсибилизированный к пыльце, может реагировать на пищевой аллерген без предшествовавшего с ним контакта. Например, сенсибилизация к пыльце амброзии полыннолистной может сочетаться с ОАС после употребления дыни, а сенсибилизация к пыльце березы может приводить к появлению этого синдрома после употребления яблок, персиков и вишни. Кроме того, могут быть перекрестные реакции между латексом и бананом, авокадо, персиком, киви, абрикосом, грейпфрутом, маракуйей, ананасом, каштаном. Белки, индуцирующие ОАС, термолабильны, поэтому употребление фруктов и овощей, прошедших кулинарную обработку, не приводит к появлению симптомов. Диагностика ОАС базируется на типичном анамнезе и на основании результатов prick-тестов и IgE в сыворотке крови.
Проктоколит, индуцированный пищевыми белками
Проктоколит, индуцированный пищевыми белками (ПИПБ), — не-IgE-опосредованное заболевание, вызванное иммунным ответом против пищевых белков, характеризующееся наличием слизи и/или крови в стуле у внешне здорового младенца. Обычно заболевание дебютирует в течение первых 6 месяцев (в среднем в 2 месяца), хотя манифестировать болезнь может с первых дней жизни [6].
В 60% случаев ПИПБ встречается у детей, находящихся на естественном вскармливании. В этом случае иммунный ответ направлен на продукты, входящие в рацион матери. Чаще всего аллергическая реакция развивается на белки коровьего молока и сои. Несколько реже на яйца, орехи, арахис и морепродукты. У детей, находящихся на искусственном вскармливании, реакция, как правило, развивается на белки коровьего молока и сои, входящие в состав смесей [7].
ПИПБ является наиболее частой причиной ректального кровотечения у грудных детей. Появление крови в стуле связано с повышенной ранимостью воспаленной слизистой толстой кишки, а в ряде случаев с наличием эрозий [8]. Кровь может быть смешана со слизью или быть в виде вкраплений и прожилок (что часто ошибочно расценивают как проявление перианальных трещин). Кровопотеря, как правило, минимальна и не ведет к развитию гематологических изменений.
Слизь в кале (в виде прожилок или тяжей) может быть единственным проявлением ПИПБ (кровь макроскопически может не определяться). При микроскопии в слизи обнаруживают повышенное количество лейкоцитов, значительная часть которых представлена эозинофилами.
Иногда основные симптомы ПИПБ ассоциируются с кишечной коликой и увеличением частоты опорожнения кишечника. Важно помнить, что несмотря на наличие таких серьезных симптомов, как слизь и кровь в стуле, дети практически всегда выглядят здоровыми и хорошо прибавляют в весе. Это следует учитывать в дифференциальной диагностике ПИПБ с другими заболеваниями (например, кишечными инфекциями, воспалительными заболеваниями кишечника), при которых, как правило, наряду с симптомами гемоколита имеют место тяжелое состояние ребенка, обезвоживание, плохие весовые прибавки или похудание, а также выраженные гематологические изменения.
Необходимо иметь в виду, что у детей с ПИПБ маркеры атопии (атопический дерматит, отягощенный аллергический семейный анамнез, повышение уровня эозинофилов в крови) встречаются не намного чаще, чем в обычной популяции [7]. Редко можно обнаружить повышение титра общего и специфических IgE, а также положительные кожные prick-тесты. Это объясняется не-IgE-зависимым механизмом развития данного заболевания [3].
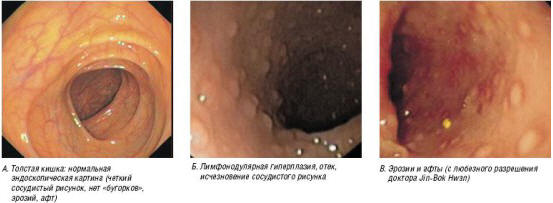
Рис. 3. Эндоскопические изменения при ПИПБ
Для диагностических целей эндоскопическое исследование обычно не требуется, но в тех случаях, когда его проводят, обнаруживают эритему, контактную ранимость, ослабление сосудистого рисунка и лимфонодулярную гиперплазию. В тяжелых случаях обнаружают эрозии. Изменения, как правило, локализуются в прямой кишке, но иногда захватывают всю толстую кишку [9] (рис. 3). При гистологическом исследовании обнаруживают увеличенное число эозинофилов в собственной пластинке слизистой оболочки (> 6 эозинофилов ×400). В тяжелых случаях наблюдают внедрение эозинофилов в эпителий крипт (эозинофильный криптит), скопления эозинофилов (эозинофильные микроабсцессы) и наличие нейтрофилов (активное воспаление) [10] (рис. 4). Несмотря на сообщения о периферической эозинофилии и выявлении IgE-специфических антител, они обнаруживаются редко [3].
Лечение ПИПБ заключается в элиминации аллергена из рациона кормящей матери (если ребенок находится на естественном вскармливании) или переводе на смеси с глубоким гидролизом белков (если ребенок получает смесь на основе коровьего молока или сои). Однако в 10% случаев развитие ПИПБ возможно у детей, получающих смеси на основе глубокогидролизованных белков коровьего молока. В этой ситуации ребенка переводят на аминокислотные смеси, что ведет к полному исчезновению симптомов [6].
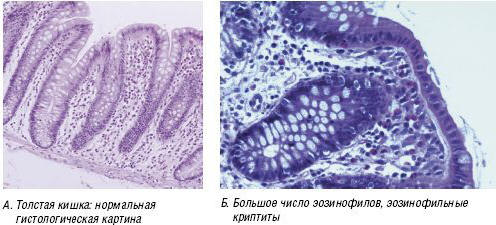
Рис. 4. Гистологические изменения при ПИПБ
Энтеропатия, индуцированная пищевыми белками
Энтеропатия, индуцированная пищевыми белками (ЭИПБ), характеризуется хронической диареей, рвотой, мальабсорбцией и плохой прибавкой в весе. Дополнительными признаками могут быть: вздутие живота, чувство быстрого насыщения и перианальный дерматит. В тяжелых случаях может развиться белоктеряющая энтеропатия, которая сопровождается гипопротеинемией и отеками.
Чаще всего заболевание развивается у детей первых месяцев жизни, находящихся на искусственном вскармливании, в результате иммунной реакции на белки коровьего молока или сои. Реже ЭИПБ может быть вызвана злаками, овсом, яйцами, рисом, рыбой и морепродуктами. В этих случаях заболевание дебютирует в зависимости от сроков введения «причинных» продуктов [6].
ЭИПБ может дебютировать после острого вирусного гастроэнтерита. Это может быть связано как с реализацией «замаскированной» гиперчувствительности, так и с патологической иммунной реакцией слизистой кишечника в ответ на поступление антигенов в период повышенной проницаемости кишечного барьера [11].
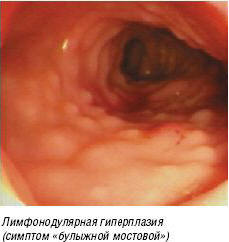
Рис. 5. Энтеропатия, индуцированная пищевыми белками
Нередко ЭИПБ развивается у детей, находящихся на естественном вскармливании. При этом симптомы могут появиться даже в течение первых 2 недель жизни [12]. У таких пациентов может быть реакция одновременно на многие продукты, входящие в рацион кормящей матери. В этой группе низкие прибавки в массе отмечаются примерно в 25% случаев, причем нередко с рождения [13].
Несмотря на то, что ЭИПБ относится к не-IgE-опосредованным заболеваниям, у этих пациентов могут быть сопутствующие состояния, обусловленные немедленными аллергическими реакциями. В частности, отягощенная наследственность, высокий уровень общего IgE, положительные prick-тесты, а также экзема, крапивница, ангионевротический отек и анафилактические реакции в анамнезе. Сочетание симптомов поражения пищеварительного тракта с симптомами гиперчувствительности немедленного типа позволяют врачу подумать об этом заболевании.
Гораздо сложнее заподозрить ЭИПБ в тех случаях, когда симптомы со стороны пищеварительного тракта не ассоциируют с отягощенной наследственностью и очевидными аллергическими реакциями на пищу. Общий IgE может быть нормальным, а специфические IgE и кожные тесты отрицательными. Редко думают об ЭИПБ при отсутствии одного из основных симптомов этого заболевания — низкой прибавке в массе тела. В этом случае на первый план выходят симптомы нарушения моторики: гастроэзофагеальный рефлюкс, кишечная колика, раздражительность [14].
Для диагностики необходимо сделать эндоскопию и гистологическое исследование. Наиболее характерным эндоскопическим признаком ЭИПБ является лимфонодулярная гиперплазия (симптом «булыжной мостовой») (рис. 5). При гистологическом исследовании обнаруживают атрофию, мононуклеарную инфильтрацию собственной пластинки слизистой тонкой кишки в сочетании с увеличением числа интраэпителиальных лимфоцитов [6]. Эти изменения очень напоминают целиакию. Но при ЭИПБ не повышается титр антител к тканевой трансглютаминазе и эндомизию и реже обнаруживают HLA-маркеры глютеновой энтеропатии (DQ2 и DQ8) [15]. В отличие от целиакии, ЭИПБ, как правило, проходит через 1–2 года и повышает риск малигнизации.
Окончательный диагноз устанавливают с помощью элиминационной диеты и провокационного теста.
АБКМ — одна из наиболее распространенных причин энтероколитического синдрома (FPIES), формы не-IgE-опосредованной аллергии, которая развивается в течение 1–3 часов после введения молочного белка. FPIES проявляется следующими симптомами: повторяющейся рвотой, гипотонией, бледностью, иногда — гипотензией и диареей. FPIES часто проявляется с первым введением коровьего молока в рацион, но не зафиксирован у детей на грудном вскармливании. Ремиссия обычно развивается в течение первых нескольких лет жизни. Вызванный коровьим молоком энтеропатический синдром — редкая болезнь, обычно проявляется диареей, потерей в весе, различными степенями рвоты, периодической гипопротеинемией и стулом с кровью. Хотя многие дети с этой болезнью положительно отвечают на высокогидролизные смеси, основанные на коровьем молоке, некоторым для достижения ремиссии заболевания необходим перевод на аминокислотные смеси.
Эозинофильный эзофагит
Эозинофильный эзофагит (ЭЭ) — заболевание, характеризующееся изолированной выраженной эозинофильной инфильтрацией пищевода и манифестирующее рефлюкс-подобными симптомами (отрыжка, боль в эпигастрии или за грудиной, рвота, изжога, трудности кормления и дисфагия), не отвечающими на антисекреторную терапию. ЭЭ встречается в любом возрасте и может осложняться стриктурами пищевода, образованием колец Schatzki и ахалазией. Эти осложнения связаны с тем, что эозинофильное воспаление может приводить к развитию фиброза и ремоделированию пищевода [16].
Распространенность ЭЭ точно не определена и колеблется в пределах от 1 до 9 на 100 000 населения. По данным детского госпиталя в Питсбурге (США), обслуживающего примерно 1 миллион детей, ежегодно диагностируется около 100 новых случаев ЭЭ. Мальчики болеют чаще девочек. Заболевание чаще встречается среди школьников и молодых взрослых [17].
Примерно у 50% детей отмечаются проявления аллергии со стороны других органов и систем: бронхоспазм, аллергический ринит, экзема. У 35% больных с этим заболеванием отягощен аллергологический анамнез, а у 50–80% имеются атопические заболевания [18].
У детей младшего возраста в клинической картине ЭЭ доминируют рефлюкс-подобные симптомы и трудности при кормлении (отказ от еды, избегание пищи определенной консистенции).
У подростков и взрослых ЭЭ чаще всего проявляется симптомами дисфагии и/или эпизодами застревания пищи в пищеводе. Эти явления могут быть вызваны как преходящим спазмом гладкой мускулатуры пищевода, так и ремоделированием пищевода (стриктуры, кольца), обусловленным хроническим эозинофильным воспалением [19].
Ключевую роль в диагностике играют эндоскопия и гистология. Однако в план обследования необходимо включить и рентгенологическое исследование с барием, позволяющее исключить аномалии развития пищевода, стриктуры и кольца Schatzki (которые могут быть пропущены при эндоскопическом исследовании).
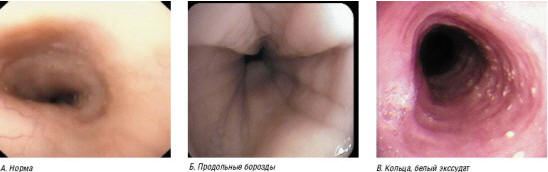
Рис. 6. Эозинофильный эзофагит: эндоскопическая картина
ЭЭ может быть заподозрен при обнаружении следующих эндоскопических признаков (рис. 6):
- Воспалительные изменения одинаково выражены как в дистальной, так и в средней части пищевода (в отличие от рефлюкс-эзофагита, при котором наибольшие изменения находят в дистальном отделе).
- Линейные вертикальные борозды.
- Циркулярные складки («кольца»).
- Налет на слизистой в виде белых «крупинок» (≈1 мм в диаметре).
- Контактная кровоточивость [19].
Биоптаты следует брать как из дистальной, так и из средней трети пищевода (где при ЭЭ обнаруживают наибольшее число эозинофилов). В связи с тем, что патологические изменения могут иметь «пятнистый» характер, необходимо брать не менее 5 биоптатов [20]. Диагноз «эозинофильный эзофагит» не может быть поставлен без проведения гистологического исследования. В норме слизистая оболочка пищевода у детей не содержит эозинофилов. При гастроэзофагеальном рефлюксе обнаруживают в среднем 1–5 интраэпителиальных эозинофила в поле зрения (при увеличении ×400) [20]. В случае тяжелого рефлюкс-эзофагита число интраэпителиальных эозинофилов может достигать 10–15 в поле зрения (×400) (рис. 7).
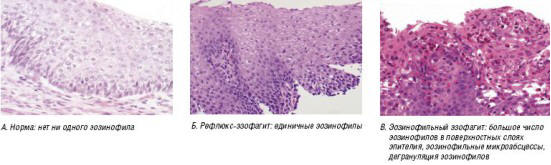
Рис. 7. Эозинофильный эзофагит: гистология
При ЭЭ обнаруживают более 15 интраэпителиальных эозинофилов, а в тяжелых случаях их число может достигать 45 и даже 100 клеток в поле зрения (×400). Для ЭЭ характерно поверхностное расположение эозинофилов, образование их скоплений (микроабсцессы — белые «крупинки», определяемые при эндоскопии) и дегрануляция [20].
Следует иметь в виду, что эозинофильная инфильтрация слизистой оболочки пищевода может встречаться не только при рефлюксной болезни и эозинофильном эзофагите, а также при болезни Крона, целиакии и васкулитах.
Подумать об ЭЭ необходимо в тех случаях, когда у пациента с симптомами рефлюкса и/или дисфагией эмпирическая антисекреторная терапия неэффективна. Особенно если это наблюдается у пациента с аллергическим заболеванием.
Окончательно ЭЭ подтверждается повторной эндоскопией с биопсией после лечения.
Лечение ЭЭ включает элиминационную диету и фармакотерапию, направленную на подавление эозинофильного воспаления (табл. 2).

В нетяжелых случаях элиминационная диета может быть использована как монотерапия. Те или иные продукты могут быть исключены из рациона как на основании аллергообследования, так и эмпирически. Поскольку ЭЭ не является «чистым» IgE-зависимым заболеванием, то, к сожалению, полагаться на результаты аллергопроб на 100% нельзя. В последние годы используют эмпирическую элиминационную диету с исключением 6 продуктов: молока, сои, яиц, пшеницы, арахиса и морепродуктов. Эффективность этого подхода превышает 80% [21]. Альтернативой является использование смесей на основе аминокислот. Иногда, учитывая вкусовые пристрастия пациентов, в смеси добавляют фруктовые соки [19]. Клинически улучшение наступает, в среднем, через 8 дней, а нормализация гистологической картины через 4 недели [22].
В тяжелых случаях, наряду с элиминационной диетой, используют противовоспалительные препараты. Системные стероиды (преднизолон, метилпреднизолон) эффективно подавляют воспаление и купируют симптомы. Однако их применение ограничено в связи с побочными эффектами и 90% вероятностью рецидива после отмены. Местное лечение стероидами (флютиказон и будесонид) эффективно в 80% случаев и не сопряжено с системными побочными эффектами. Флютиказон вводят через рот с помощью дозированного ингалятора (без спейсера). Аэрозоль, не вдыхая, распыляют в ротовую полость. Лекарство попадает в пищевод со слюной, оказывая местный противовоспалительный эффект. Вязкую суспензию будесонида готовят, используя содержимое небул. Наиболее частым побочным эффектом местного лечения стероидами является кандидоз пищевода, который встречается у 10–15% пациентов.
Монтелукаст обладает неплохим симптоматическим эффектом, однако не уменьшает эозинофильную инфильтрацию в пищеводе, что, теоретически, сохраняет вероятность ремоделирования пищевода. В настоящее время идут II и III фазы клинических испытаний препаратов на основе моноклональных антител к IgE (омализумаб) и IL-5 (реслизумаб, меполизумаб). Несмотря на обнадеживающие предварительные результаты, омализумаб, при хорошем симптоматическом эффекте, не снижает эозинофильную инфильтрацию, а реслизумаб и меполизумаб хоть и снижают тканевую эозинофилию, не устраняют симптомы [23].
Эозинофильный гастрит, гастроэнтерит, гастроэнтероколит (ЭГ)
ЭГ входят в семейство эозинофильных заболеваний желудочно-кишечного тракта. В отличие от ЭЭ эозинофильная инфильтрация редко ограничивается одним органом (только желудком или только тонкой кишкой). Обычно эозинофильное воспаление захватывает сразу несколько отделов пищеварительной трубки. Чаще одновременно поражается желудок и тонкая кишка (эозинофильный гастроэнтерит). Клиническая картина зависит от того, какой слой пищеварительной трубки инфильтрирован эозинофилами. Если в патологический процесс вовлечена только слизистая оболочка, то доминируют боль в животе, тошнота, рвота и диарея. Если эозинофилы сосредоточены в мышечном слое, то на первый план выходят симптомы непроходимости (тошнота, рвота, вздутие живота). В том случае, если эозинофилы сконцентрированы в субсерозном слое, то заболевание проявляется асцитом, а в асцитической жидкости обнаруживают большое число эозинофилов [17].
Эндоскопическое исследование с биопсией информативны только при поражении слизистой оболочки. Макроскопически обнаруживают эритему, эрозии, нодулярность или полипоидные разрастания в антруме и/или тонкой кишке. При гистологическом исследовании в воспалительном инфильтрате доминируют эозинофилы, количество которых превышает 20 клеток в поле зрения (×400). В связи с тем, что патологические изменения носят фокальный характер, необходимо брать не менее 5 биоптатов из каждого отдела пищеварительной трубки, причем биопсию следует делать как из измененных, так и из внешне нормальных участков [24].
Если эозинофилы инфильтрируют мышечный или субсерозный слои, то диагноз может быть установлен при гистологическом исследовании биоптатов, полученных интраоперационно, а также при цитологическом анализе асцитической жидкости.
При ЭГ наиболее эффективно лечение системными стероидами (20–40 мг в сутки), которые дают четкий положительный эффект уже через 1–2 недели. В одних случаях удается быстро снизить дозу (в течение 2 недель) и прекратить прием препарата. В других случаях пациенты вынуждены получать длительно поддерживающие дозы (5–10 мг/сут).
Как и при ЭЭ, неплохую эффективность показала эмпирическая элиминационная диета. Сообщалось об удовлетворительных результатах применения Кетотифена и Кромолина [26, 27].
Диета детей с гастроинтестинальными проявлениями пищевой аллергии
Необходимым методом лечения детей с аллергическими реакциями следует считать полную элиминацию причинного аллергена. Именно частичная элиминация аллергена (сознательная или случайная) является самой частой причиной безуспешного лечения детей с пищевой аллергией. Конечно, установление причинно-значимого аллергена — это очень трудная задача, но абсолютно необходимая. Современный алгоритм диагностики спектра причинных аллергенов включает в себя анализ клинической картины заболевания, оценку дополнительных методов исследования (рrick-тесты и уровня специфических IgE), эффекта элиминации и проведения провокационных тестов. В случае не-IgE-зависимых иммунных реакций отсутствуют общепризнанные методы лабораторной диагностики причинных аллергенов. При доказанной причинности выявленного аллергена следует устранить его в диете пациента на срок, зависящий от очень многих факторов. Одной из часто встречающихся ошибок при появлении признаков пищевой аллергии является перевод ребенка с естественного вскармливания на искусственное с использованием смесей с высокой степенью гидролиза. Такую практику следует признать как недопустимую. В настоящее время отсутствуют убедительные данные в пользу этого метода лечения пищевой аллергии. Следует назначить элиминационную диету матери с исключением всех причинных продуктов. Именно естественное вскармливание является оптимальным при пищевой аллергии у детей. Необходимо продумать способы, позволяющие избежать случайный прием, вдыхание или контакт с провоцирующей пищей. Врач должен также предупредить пациента о возможности перекрестных реакций (например, с молоком буйвола, козы, овцы), обеспечить полноценную диету матери и настроить ее на обязательное соблюдение диеты путем полного информирования и разъяснения необходимости данных лечебных мероприятий. Если ребенок находится на искусственном вскармливании, то необходимо перевести ребенка на аминокислотную смесь или на смесь с высокой степенью гидролиза белка. Любая попытка перевода ребенка на соевую смесь или гипоаллергенную молочную смесь следует трактовать как ошибку. Смеси на основе гидролиза сывороточных молочных белков — Nutrilon® Пепти Аллергия, Nutrilon® Пепти ТСЦ, Фрисопеп, Альфаре. Смеси на основе гидролиза казеина — Нутрамиген, Прегестимил, Фрисопеп АС. Молочные смеси с 40% гидролизом белка (Hipp HA 1, Hipp HA 2, Humana 0-HA, Humana HA 1, Humana HA 2) используются только для профилактики у детей, у которых существует угроза формирования пищевой аллергии.
Nutrilon® Пепти Аллергия с пребиотиками — специально разработанная смесь для питания детей, страдающих АБКМ. Она производится в соответствии с директивой FSMP 1999/21 ЕС Евросоюза в отношении лечебного питания [33] и отвечает рекомендациям ESPGHAN/ESPACI [31] и ААР [32] по лечению детей, страдающих АБКМ. Nutrilon® Пепти Аллергия применяется у детей с рождения. Белковый компонент в Nutrilon® Пепти Аллергия представлен глубокогидролизованным сывороточным белком, при этом на долю свободных аминокислот приходится 15–20%, а на долю короткоцепочечных пептидов — 80–85%. Сывороточный белок обладает лучшим аминокислотным профилем по сравнению с казеином и значительно лучшими вкусовыми качествами. Nutrilon® Пепти Аллергия содержит приблизительно на 50–60% меньше лактозы по сравнению с обычными смесями. Это качество смеси имеет особое значение у детей с гастроинтестинальными проявлениями пищевой аллергии, так как поражение слизистой оболочки желудочно-кишечного тракта, в частности тонкой кишки, приводит к снижению активности лактазы. Наличие в смеси комплекса пребиотиков Immunofortis способствует формированию пищевой толерантности, что доказано в ряде клинических исследований [34, 35].
Белковый компонент Nutrilon® Пепти ТЦС представлен глубокогидролизованным сывороточным белком, что и в Nutrilon® Пепти Аллергия. Nutrilon® Пепти ТЦС применяется у детей с синдромом мальабсорбции, нарушением всасывания жиров, воспалительными заболеваниями кишечника (болезни Крона и неспецифическом язвенном колите), множественной пищевой аллергии. Для облегчения всасывания жировой компонент в Nutrilon® Пепти ТЦС на 50% замещен среднецепочечными триглицеридами, что особенно важно для детей с мальабсорбцией. Nutrilon® Пепти ТЦС также содержит длинноцепочечные полиненасыщенные жирные кислоты (докозагексаеновую и арахидоновую) и обогащена нуклеотидами, играющими важную роль в регенерации поврежденных клеток кишечника.
Аминокислотные смеси и гидролизные смеси абсолютно безопасны и могут длительно использоваться в качестве заменителя коровьего молока у больных с АБКМ.
Следующей, довольно часто встречающейся ошибкой среди практикующих врачей является перевод ребенка на соевую смесь в случае выявления АБКМ. В настоящее время убедительно доказано, что в детской популяции отмечается высокая частота сенсибилизации к соевым продуктам. Кроме того, соевые смеси не предотвращают формирование сенсибилизации к аллергенам коровьего молока [36]. Соевые смеси не рекомендованы в лечении детей с АБКМ до 6 месяцев в США [37]. Соевые смеси должны быть ограничены к использованию не только за счет перекрестной сенсибилизации, но и за счет присутствия в них изофлавонов, которые могут оказать нежелательное воздействие [38, 39]. Попытка решения этой проблемы привела к созданию соевых гидролизных смесей и рисовых гидролизных смесей. Эти смеси обладают всеми преимуществами, характеризующими высокогидролизные смеси, и не содержат даже следов молочных белков. Рост, развитие, биохимические параметры сыворотки крови и толерантность к смесям у здоровых детей при кормлении экспериментальной частично гидролизной смесью на основе риса и на основе белков коровьего молока были нормальные [29]. В нашей стране эти смеси еще не зарегистрированы и не представлены на рынке лечебного питания, хотя во многих странах Европы и США активно используются.
К сожалению, и переход на молочную смесь с высокой степенью гидролиза может не привести к исчезновению симптомов АБКМ, так как и на них возможно развитие аллергической реакции. Поэтому «золотым стандартом» лечения и диагностики детей с АБКМ является перевод их на элементную смесь на основе аминокислот (Nutrilon® Аминокислоты и Неокейт). Аминокислотные смеси произведены на основе аминокислот, без применения белка, не запускают и не поддерживают аллергическую реакцию. Аминокислотные смеси хорошо переносятся, и дети легко переходят на элементную смесь, так как она лишена горького привкуса, характерного для всех смесей с высокой степенью гидролиза белка. Nutrilon® Аминокислоты — адаптированная смесь и может быть использована как на короткий период диагностики АБКМ, так и в качестве основной смеси для длительного вскармливания. Nutrilon® Аминокислоты создана для полноценного вскармливания детей первого года жизни, находящихся на безмолочной элиминационной диете. Nutrilon® Аминокислоты не содержит белок, лактозу и глютен. Состав полностью адаптирован и рассчитан на длительное вскармливание. Nutrilon® Аминокислоты — элементное питание, и при наличии IgE-опосредованных реакций не требуется постепенного перехода с предыдущей формулы. Постепенный переход удлиняет период сенсибилизации организма ребенка. В случае IgE-независимых реакций рекомендуется постепенное введение смеси в течение 5 дней.
Показания к назначению аминокислотных смесей [40]
• Тяжелое течение аллергии (при наличии одного и более критериев):
- гастроинтестинальные симптомы;
- дерматологические симптомы;
- респираторные симптомы;
- системные реакции — анафилаксия.
• При неэффективности диетотерапии смесями на основе высокогидролизованного белка (2–4 недели применения).
• При легком и среднетяжелом течении аллергии:
- при плохой переносимости смесей на основе высокогидролизованного белка (горький вкус, отказ от приема пищи);
- мнение специалиста (соотношение цена/эффективность, наличие в льготе).
• Диагностика пищевой аллергии/аллергии к белкам коровьего молока в ситуациях, когда недоступно обычное аллерготестирование или результаты обследования могут быть противоречивы.
Абсолютным показанием для перевода ребенка на аминокислотную смесь являются анафилактические реакции на белок коровьего молока, поражения желудочно-кишечного тракта (гастроэзофагеальная рефлюксная болезнь) и синдром Хейнера. При назначении аминокислотной смеси желудочно-кишечные симптомы проходят в течение 1–3 дней [41]. Другие симптомы постепенно ослабевают и окончательно исчезают к 14-му дню [42]. Прием аминокислотной смеси приводит к значимому улучшению клинических симптомов атопического дерматита [43]. При назначении аминокислотных смесей симптомы со стороны желудочно-кишечного тракта исчезают значительно быстрее, чем при использовании гидролизных смесей [44]. При использовании аминокислотной смеси рост и прибавки веса детей значимо выше, чем при использовании смесей на основе гидролизных белков [43, 44]. Аминокислотная смесь должна использоваться для диагностики аллергии на гидролизные смеси. При аллергии на гидролизные смеси использование смеси на основе аминокислот обеспечивает безопасную альтернативу [44].
Лечение детей, страдающих гастроинтестинальными проявлениями пищевой аллергии, представляет собой сложную проблему. Отсутствие клинических проявлений заболевания, непосредственно связанных с приемом продукта, наличие не-IgE-зависимых механизмов формирования заболевания, затрудняющих лабораторное подтверждение сенсибилизации, желание лечащего врача трактовать появления симптомов поражения желудочно-кишечного тракта как сопутствующее заболевание — все это создает проблемы адекватной и своевременной диагностики и лечения аллергических поражений пищеварительного тракта.
Литература
- Rankin S. M., Conroy D. M., Williams T. J. Eotaxin and eosinophil recruitment: Implication for human disease // Mol Med Today. 2000, 6: 20.
- Hogan S. P., Rothenberg M. E., Forbes E. et al. Chemokines in eosinophil-associated gastrointestinal disorders // Curr Allergy Asthma Rep. 2004, 4: 74.
- Sicherer S. H. Clinical aspects of gastrointestinal allergy in childhood // Pediatrics. 2003; 111: 1609–1616.
- Burks A. W., James J. M., Hiegel A. et al. Atopic dermatitis and food hypersensitivity reactions // J Pediatr. 1998. 132: 132–136.
- Ortolani C., Pastorello E. A., Farioli L. et al. IgE-mediated allergy from vegetable allergens // Ann Allergy. 1993; 71: 470–476.
- Lake A. M. Food protein-induced proctitis/colitis, enteropathy, and enterocolitis of infancy. UpToDate, September 2011.
- Lake A. M., Whitington P. F., Hamilton S. R. Dietary protein induced colitis in breast-fed infants // J Pediatr. 1982; 101: 906–910.
- Jenkins H. R., Pincott J. R., Soothill J. F. et al. Food allergy: the major cause of infantile colitis // Arch Dis Child. 1984; 59: 326–329.
- Jin-Bok Hwang, Moon Ho Park, Yu Na Kang et al. Advanced Criteria for Clinicopathological Diagnosis of Food Protein-induced Proctocolitis // J Korean Med Sci. 2007; 22: 213–217.
- Winter H. S., Antonioli D. A., Fukagawa N. et al. Allergy-related proctocolitis in infants: diagnostic usefulness of rectal biopsy // Mod Pathol. 1990; 3: 5–10.
- Leinman R. E. Milk protein enteropathy after acute infectious gastroenteritis: experimental and clinical observations // J Pediatr. 1991; 118: S111–S115.
- Iyngkaran N., Yadav M., Boey C. et al. Severity and extent of upper small bowel mucosal damage in cow’s milk protein-sensitive enteropathy // J Pediatr Gastroenterol and Nutr. 1988; 8: 667–674.
- Heine R. G., Elsayed S., Hill D. J. Cow’s milk allergy in infancy // Curr Opin Allergy Clin Immunol. 2002; 2: 217–225.
- Latcham F., Merino F., Lang A. et al. A consistent pattern of minor immunodeficiency and subtle enteropathy in children with multiple food allergy // J Pediatr. 2003; 143: 39–47.
- Sampson H. A., Anderson J. A. Summary and Recommendations: Classification of Gastrointestinal Manifestations Due to Immunologic Reactions to Foods in Infants and Young Children // J of Ped Gastroenterol and Nutr. 2000, Vol. 30, Issue 1, p. S87–94.
- Liacouras C. A., Bonis P., Putnam P. E. et al. Summary of the First International Eosinophil Research Symposium // Journal of Ped gastroenterol and Nutr. 2007. 45: 370–391.
- Khan S., Orenstein S. Eosinophilic Disorders of Gastrointestinal tract. In: Gastrointestinal and Liver Disease. Pathophysiology/Diagnosis/Management. 8 th ed. 2007: 543–556.
- Spergel J. M., Beausoleil J. L., Mascarenhas M. et al. The use of skin prick tests and patch tests to identify causative foods in eosinophilic esophagitis // J Allergy Clin Immunol. 109: 363, 2002.
- Bonis P. A. L., Furuta G. T. Clinical Manifestation and Diagnosis of Eosinophilic Esophagitis. UpToDate, January 2011.
- Dahms B. B. Reflux Esophagitis: Sequelae and Differential Diagnosis in Infants and Children Including Eosinophilic Esophagitis. In: Perspectives in Pediatric Pathology. Alimentary Tract Pathology in Infants and Children. Vol. 25: 57–72.
- Kagalwalla A. F., Sentongo T. A., Ritz S. et al. Effect of six-food elimination diet on clinical and histologic outcomes in eosinophilic esophagitis // Clin Gastroenterol Hepatol. 2006; 4: 1097.
- Markowitz J. E., Spergel J. M., Ruchelli E., Liacouras C. A. Elemental diet is an effective treatment for eosinophilic esophagitis in children and adolescents // Am J Gastroenterol. 2003; 98: 777.
- Bonis P. A. L., Furuta G. T. Treatment of Eosinophilic Esophagitis. UpToDate, Feb., 2011.
- Lee M., Hodges W. G., Huggins T. L., Lee E. L. Eosinophilic gastroenteritis // South Med J. 1996; 89: 189.
- Rothenberg M. E. Eosinophilic gastrointestinal disorders (EGID) // J Allergy Clin Immunol. 2004; 113: 11.
- Van Dellen R. G., Lewis J. C. Oral administration of cromolyn in a patient with protein-losing enteropathy, food allergy, and eosinophilic gastroenteritis // Mayo Clin Proc. 1994; 69: 441.
- Bolukbas F. F., Bolukbas C., Uzunkoy A. et al. A dramatic response to ketotifen in a case of eosinophilic gastroenteritis mimicking abdominal emergency // Dig Dis Sci. 2004; 49: 1782.
- Vandenplas Y., De Greef E., Devreker T., Hauser B. Soy infant formula: is it that bad? // Acta Paediatr. 2011, Feb; 100 (2): 162–166. doi: 10.1111/j.1651–2227.2010.02021.x. Epub 2010 Oct 13.
- World Allergy Organization (WAO). Diagnosis and Rationale for Action against Cow_s Milk Allergy (DRACMA) Guidelines // Pediatr Allergy Immunol. 2010: 21 (Suppl. 21): 1–125.
- Guidelines for the Diagnosis and Management of Food Allergy in the United States: Report of the NIAID-Sponsored Expert Panel // J Allergy Clin Immunol. 2010: V. 126, № 6.
- Host A., Koletzko B., Dreborg S., Muraro A., Wahn U., Aggett P., Bresson J. L., Hernell O., Lafeber H., Michaelsen K. F., Micheil J. L., Rigo J., Weaver L., Heymans H., Strobel S., Vandenplas Y. Dietary products used in infants for treatment and prevention of food allergy. Joint Statement of ESPACI and, ESPGHAN // Arch Dis Child.1999; 81: 80–84.
- American Academy of Pediatrics. Committee on Nutrition. Hypoallergenic infant formulas // Pediatrics. 2000; 106: 346–349.
- Commission DIRECTIVE 1999/21/ЕС of 25 March 1999 on dietary foods for special medical purposes.
- Moro G., Arslanoglu S., Stahl B., Jelinek J., Wahn U., Boehm G. A mixture of prebiotics oligosaccharides reduces the incidence of atopic dermatitis during the first six months of age // Arch of Child. 2006: 91: 814–819.
- Gruber C., van Stuijvenberg M., Mosca F., Moro G., Chirico G., Braegger C. P., Riedler J., Boehm G., Wahn U. MIPS 1 Working Group. Reduced occurrence of early atopic dermatilis because of immunoactive prebiotics among low-atopy-risk infants // J Allergy Clin immunol. 2010; 126: 791–797.
- Osborn D. A., Sinn J. Soy formula for prevention of allergy and food intolerance in infants // Cochrane Database Syst Rev. 2006; 4: CD003741
- Agostoni C., Axelsson I., Goulet O., Koletzko B., Michaelsen K. F., Puntis J., Rieu D., Rigo J., Shamir R., Szajewska H., Turck D. Soy protein infant formulae and follow-on formulae: a commentary by the ESPGHAN Committee on Nutrition // J Pediatr Gastroenterol Nutr. 2006; 42: 352–361.
- Bhatia J., Greer F. American Academy of Pediatrics Committee on Nutrition. Use of soy-protein based formulas in infant feeding // Pediatrics. 2008; 121: 1062–1068.
- Vandenplas Y., De Greef E., Devreker T., Hauser B. Soy infant formula: is it that bad? // Acta Paediatr. 2011, Feb; 100 (2): 162–166. doi: 10.1111/ j.1651–2227.2010.02021.x. Epub 2010 Oct 13.
- Vandenplas Y. et al. Guidelines for the diagnosis and management of cow’s milk protein allergy in infants // Arch Dis Child. 2007; 92: 902–908.
- De Boissieu D., Dupont C. Allergy to extensively hydrolyzed cow’s milk proteins in infants: safety and duration of amino acid-based formula // J Pediatr. 2002, Aug; 141 (2): 271–273.
- Vanderhoof J. A. et al. Intolerance to protein hydrolysate infant formulas: an under recognized cause of gastrointestinal symptoms in infants // J Pediatr. 1997; 131: 741–744.
- Niggemann B. et al. Prospective, controlled, multi-center study on the effect of an amino acid based formula in infants with cow’s milk allergy/intolerance and atopic dermatitis // Pediatr Allergy Immunol. 2001, Apr; 12 (2): 78–82.
- De Boissieu D. et al. Allergy to extensively hydrolyzed cow milk proteins in infants: identification and treatment with an amino acid-based formula // J Pediatr. 1997; 131: 744–777.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru







