Функциональное состояние и особенности микробиоценоза кишечника у детей с метаболическим синдромом
Т. А. Бокова, кандидат медицинских наук, доцент
Е. В. Лукина
ГБУЗ МОНИКИ им. М. Ф. Владимирского, Москва
Ожирение является одной из наиболее актуальных медицинских и социальных проблем современного здравоохранения. Увеличение количества детей с избыточной массой тела происходит одновременно с процессами децелерации, дефицитом макро- и микронутриентов, ростом патологии органов пищеварения, дыхания и костно-мышечной системы. Одной из главных причин распространения ожирения в детской популяции является снижение физической активности, неадекватная учебная нагрузка, использование компьютерных технологий в различных сферах деятельности. Важнейшее значение имеет алиментарный фактор. Современные дети употребляют много жиров, легкоусваиваемых белков и углеводов, при недостаточном количестве растительной клетчатки, богатой макро- и микроэлементами и пищевыми волокнами.
По данным эпидемиологических исследований, проведенных в шести федеральных округах нашей страны, около 12% подростков в возрасте от 12 до 17 лет имеют избыточный вес, из них 2,3% — ожирение, при этом у каждого третьего подростка с ожирением выявляются признаки метаболического синдрома (МС) [4].
Как известно, с увеличением частоты ожирения связан рост заболеваемости ишемической болезнью сердца (ИБС), артериальной гипертензией (АГ), сахарным диабетом (СД), желчнокаменной болезнью (ЖКБ), злокачественными новообразованиями. Больные ожирением III–IV степени живут в среднем на 15 лет меньше. При этом формирование МС начинается задолго до клинической манифестации заболеваний и долгое время протекает бессимптомно.
МС — это не заболевание и не диагноз, а комплекс метаболических, гормональных и клинических нарушений, тесно ассоциированных с СД 2-го типа и являющихся факторами риска развития сердечно-сосудистых заболеваний (ССЗ), в основе которого лежит инсулинорезистентность (ИР) и компенсаторная гиперинсулинемия (ГИ).
Согласно классификации ВОЗ (1999) к главным или «большим» признакам МС относятся: СД 2-го типа и другие нарушения обмена глюкозы и/или ИР с относительной ГИ. Малыми признаками являются АГ, висцеральное ожирение, снижение фибринолитической активности крови, атерогенная дислипидемия, микроальбуминурия, гиперурикемия, гиперандрогения у женщин, гипоандрогения у мужчин и пр.
Международная Федерация диабета (International Diabetes Federation, IDF, 2007) разработала новое определение МС для подростков 10–16 лет [10]. МС в этой возрастной группе диагностируется при наличии абдоминального ожирения (окружность талии более 90 перцентили) в сочетании с двумя и более из приведенных ниже критериев:
- уровень триглицеридов не ниже 1,7 ммоль/л;
- уровень липопротеидов высокой плотности менее 1,03 ммоль/л;
- артериальное давление не ниже 130/85 мм рт. ст.;
- уровень глюкозы венозной плазмы натощак не ниже 5,6 ммоль/л или выявленный СД 2-го типа.
В последние годы установлена четкая взаимосвязь нарушений липидного и углеводного обмена с гастроэнтерологическими заболеваниями [5, 6, 8]. Дисфункция гипоталамуса и, в частности, вегетативной нервной системы способствует нарушению перистальтики и тонуса гладкой мускулатуры пищеварительного тракта, гиперпродукции гастрина и соляной кислоты. Гиперсекреция катехоламинов, глюкагона, кортизола приводит к прогрессированию этих нарушений, что проявляется снижением резистентности слизистой оболочки желудка и кишечника, повреждением паренхимы поджелудочной железы и печени.
Кроме того, нарушение обмена веществ в организме сопровождается и/или поддерживается недостаточной гомеостатической функцией индигенной микрофлоры в результате формирования дисбиотических нарушений в ЖКТ.
Известно, что взаимоотношения в системе «макроорганизм–микрофлора» реализуются путем дистанционных и контактных взаимодействий. Основной вклад в поддержание этих взаимоотношений вносит обмен низкомолекулярными метаболитами, к которым относятся короткоцепочечные жирные кислоты (КЖК) и их соли. Они выполняют в организме ряд важных функций, в числе которых энергообеспечение различных тканей, в первую очередь эпителиальных, участие в поставке субстратов липо- и глюконеогенеза, влияние на уровень некоторых гормонов гипофиза, регуляция детоксикационной функции печени, участие в энтерогепатической циркуляции желчных кислот и многое другое [1, 3]. Отдельные кислоты продуцируются различными родами сахаролитической микрофлоры толстой кишки (бифидо-, лактобактериями, бактероидами, фузобактериями, пептострептококками, клостридиями и др.) в процессе микробного пищеварения. Кислоты с разветвленной цепью (изокислоты), образуются при метаболизации белков микроорганизмами.
Цель исследования: изучить функциональное состояние и особенности микробиоценоза кишечника у детей с МС.
Материалы и методы. Обследовано 20 детей с МС (IDF, 2007) в возрасте от 11 до 16 лет. Всем детям проводился комплекс клинических, лабораторных и инструментальных методов обследования по стандартным методикам. Состояние микробиоценоза кишечника оценивалось по результатам исследования качественного и количественного состава КЖК1 в кале методом газожидкостной хроматографии (Ардатская М. Д., лаборатория Учебно-научного центра МЦ УДП РФ). Определялись профили КЖК с числом углеродных атомов С2-С4 (т. е. относительное содержание отдельной кислоты в пуле С2-С4 кислот: рСn = Cn/Σ(C2 + C3 + C4)), вносящих основной вклад в общий пул кислот.
Результаты исследования. Установлено, что абсолютное большинство детей имели наследственную отягощенность по ожирению, СД 2-го типа и АГ. У каждого третьего ребенка родственники страдали заболеваниями печени и желчного пузыря, поджелудочной железы, органов ЖКТ.
У большинства детей (13, 65%) отмечалось повышение артериального давления. Они предъявляли жалобы на головную боль, утомляемость, эмоциональную лабильность.
Особенности липидного спектра крови в наблюдаемой группе характеризовались повышением уровня общего холестерина (7, 35%), липопротеидов низкой плотности (ЛПНП) (3, 15%) и триглицеридов (6, 30%), снижением уровня липопротеидов высокой плотности (ЛПВП) (5, 25%).
Изменения углеводного обмена проявлялись в виде повышения уровня глюкозы натощак (3, 15%), нарушения толерантности к глюкозе (2, 10%). Все дети имели ИР в виде повышения индекса НОМА-IR, треть из них (6, 30%) — компенсаторную ГИ.
Периодические боли в животе различной локализации в анамнезе имелись у трети (6, 30%) обследованных детей, практически половина из них (9, 45%) жаловались на отрыжку после еды, каждый четвертый (5, 25%) — на изжогу, у каждого второго ребенка (10, 50%) отмечался метеоризм. Треть детей (6, 30%) предъявляли жалобы на запоры, у каждого четвертого (5, 25%) отмечался неустойчивый характер стула, у одного ребенка (5%) отмечался энкопрез.
Патология верхнего отдела пищеварительного тракта выявлена у большинства детей с МС. У 16 (80%) детей регистрировались морфофункциональные изменения желудка и 12-перстной кишки. Наиболее часто при эндоскопическом исследовании выявлялись гастродуодениты (8, 40%); среди моторно-эвакуаторных нарушений преобладали недостаточность кардии (6, 30%) и дуоденогастральный рефлюкс (5, 25%). У абсолютного большинства диагностированы реактивные изменения поджелудочной железы (19, 95%), у 2/3 детей (13, 65%) имелись признаки неалкогольной жировой болезни печени, у половины (10, 50%) — нарушения функции билиарного тракта. Синдром раздраженного кишечника регистрировался у 4 (20%) детей.
По результатам копрологического исследования у 6 (30%) детей кал имел плотную консистенцию, у 3 (15%) отмечался «овечий» кал. В 30% случаев обнаруживался нейтральный жир, в 15% — жирные кислоты, а в 20% — соли жирных кислот в большом количестве.
Был проанализирован профиль КЖК, который не зависит ни от количества продуцирующих и утилизирующих метаболиты микроорганизмов, ни от числа клеток (эпителиоцитов) всасывающей поверхности, ни от характера моторных расстройств.
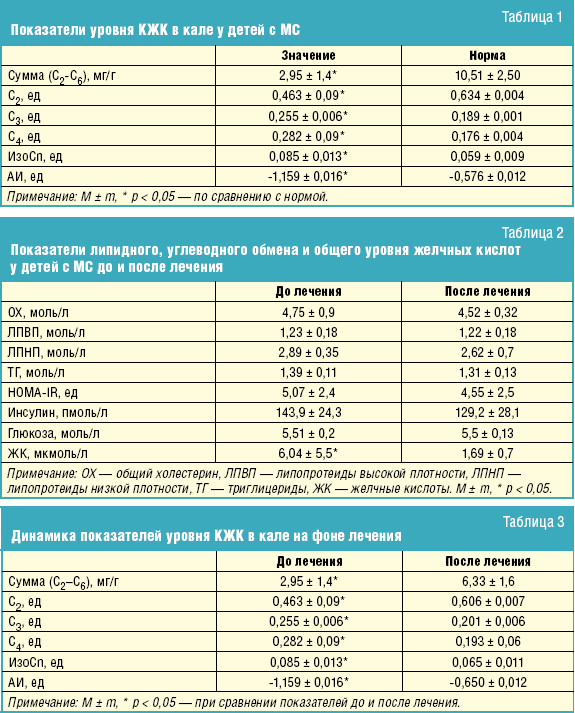
Выявлены характерные изменения относительного содержания отдельных кислот, что свидетельствует об изменении в родовом составе микрофлоры, продуцирующей различные короткоцепочечные кислоты (табл. 1).
Установлено, что у детей имеет место снижение доли уксусной кислоты (С2) на фоне повышения долей пропионовой (С3) и масляной кислот (С4).
Как известно, уксусная кислота является одним из основных продуктов жизнедеятельности индигенной микрофлоры и ее уменьшение может указывать на снижение метаболической активности бифидо- и лактобактерий.
Выявленное повышение уровня пропионовой (С3) и масляной кислот (С4) может объясняться активизацией строгих анаэробов (бактероидов, фузобактерий, эубактерий, клостридий и т. д.). Об этом свидетельствует и значение анаэробного индекса (АИ)2, смещенного в область резко отрицательных значений, при котором, как известно, активизируются анаэробные штаммы. Именно эти анаэробные микроорганизмы вышеуказанных родов не только принимают участие в энтерогепатической циркуляции желчных кислот, осуществляя 7-альфа-дегидроксилирование желчных кислот, но и также участвуют в холестериновом обмене.
Отмечено повышение суммарного содержания изокислот у детей с МС, которое может быть связано с активацией процессов протеолиза за счет повышенного времени транзита, приводящего к длительной экспозиции кишечного содержимого с микрофлорой, а также длительного контакта последней еще с одним источником пептидов — пристеночной слизью.
Таким образом, полученные результаты исследования свидетельствуют не только о высокой частоте функциональных нарушений кишечника, сопровождающихся замедлением пассажа кала, но и о выраженных нарушениях метаболитного статуса у детей с МС, обусловленных снижением численности и метаболической активности индигенной микрофлоры и изменением активности анаэробных микроорганизмов.
С целью коррекции выявленных нарушений все дети помимо диетотерапии, препаратов с гепатопротективным и холеретическим действием (Урсофальк, Хофитол) получали Дюфалак по 5 мл — 2 раза в день в течение 1 месяца. Использование данного препарата в комплексной терапии обусловлено тем, что действующим веществом Дюфалака является лактулоза, которая не только улучшает консистенцию кала и его пассаж по кишечнику, но и обладает пребиотическими свойствами, являясь источником энергии и питательным субстратом, главным образом для бифидо- и лактобактерий.
На фоне проведенного курса лечения была отмечена тенденция к нормализации показателей липидного и углеводного обмена: снизился уровень инсулина и ИР (индекс HOMA-IR), уменьшились показатели липидного спектра сыворотки крови, а также общего уровня желчных кислот (табл. 2).
Возможно, снижение уровня плазменных липидов и желчных кислот обусловлено не только восстановлением функции гепатоцитов под действием гепатотропных препаратов, но и нормализацией интестинального цикла метаболизма холестерина на фоне приема лактулозы.
Известно, что микроорганизмы ЖКТ вмешиваются в холестериновый метаболизм, непосредственно воздействуя на ферментные системы клеток хозяина, синтезирующие эндогенный холестерин. Бифидобактерии, ингибируя активность ГМГ-КоА-редуктазы, уменьшают выход эндогенного холестерина из гепатоцитов. Лактулоза, обладающая бифидогенными свойствами, способствует повышению их активности.
Кроме того, одним из механизмов действия лактулозы является торможение активности рН-зависимой 7-альфа-дегидроксилазы, что изменяет численность и метаболическую активность микроорганизмов, принимающих участие во вторичном обмене желчных кислот. Опосредованно изменяется количество желчных кислот и холестерина в толстой кишке и их всасывание [9]. Снижение уровня общих желчных кислот в сыворотке крови приводит к активации их синтеза печенью. Это способствует возрастанию поверхностных рецепторов ЛПНП, повышению скорости удаления ЛПНП из плазмы и в конечном итоге к уменьшению уровня холестерина в крови [2].
У абсолютного большинства детей на фоне лечения отмечена положительная динамика со стороны частоты и характера стула. Оформленный стул, мягкой консистенции стал регистрироваться у 85% наблюдаемых детей; у 80% — улучшились показатели копрограммы (реакция кала, количество нейтрального жира, жирных кислот и их солей).
После лечения отмечается тенденция к изменению показателей в сторону формирования нормального профиля С2-С4 кислот (табл. 3).
восстановительный потенциал внутрипросветной среды, сместилось в область нормальных значений (разность показателей АИ до и после лечения составила 0,509 ед).
Выводы
- У детей с МС с высокой частотой регистрируются функциональные нарушения кишечника, характеризующиеся изменением характера стула и результатов копрологического и биохимического исследований.
- У детей с МС имеются выраженные дисбиотические нарушения в виде снижения численности и метаболической активности индигенной микрофлоры, изменения активности анаэробных микроорганизмов, что проявляется характерными изменениями качественного и количественного состава КЖК в кале и сыворотки крови.
- На фоне комплексного лечения с использованием препарата на основе лактулозы (Дюфалак) отмечается достоверное изменение изучаемых параметров КЖК, свидетельствующее о тенденции к восстановлению (в ряде случаев о восстановлении) кишечного микробиоценоза, которое заключалось в повышении активности облигатных микроорганизмов (в т. ч. представителей молочнокислой флоры: бифидо- и лактобактерий), снижении активности анаэробных штаммов, а также а- и анаэробных микроорганизмов, обладающих протеолитической активностью (за счет восстановления кишечного транзита).
Литература
- Ардатская М. Д. Клиническое значение КЖК при патологии желудочно-кишечного тракта. Автореф. дис. докт. мед. наук. М., 2003, 45 с.
- Бышевский А. Ш., Терсенов О. А. Биохимия для врача. Екатеринбург: Изд-во «Уральский рабочий», 1994, с. 383
- Готтшалк Г. Метаболизм бактерий. Перевод с англ. М.: МИР, 1982.
- Доскина Е. В. Метаболический синдром — это очень серьезно // Диабет. Образ жизни. 2007, № 3, с. 57–58.
- Новикова В. П., Комисарова М. Ю. и др. Дислипидемии у детей и подростков с хроническим гастродуоденитом // Terra medica nova. 2007, № 2, с. 36–39.
- Успенский Ю. П. Метаболический синдром у больных с заболеваниями органов пищеварения // Клиническое питание. 2004, № 1, с. 23–28.
- Шендеров Б. А. Медицинская микробная экология и функциональное питание. Т. 2. М.: Грантъ, 1998.
- Язвенная болезнь и метаболический синдром. Учебное пособие. СПб, 2006, 30 с.
- Berge Henegouwen G. P., Werf S. D. J. Effect of lactulose on billiary lipid composition // J. Hepatology. 1986; 3: 328–332.
- Zimmet P. et al. The metabolic syndrome in children and adolescents // Lancet. 2007; 369: 2059–2961.
1 К короткоцепочечным жирным кислотам (фракции С2-С6) с изомерами относят уксусную (С2), пропионовую (С3), изомасляную (изоС4), масляную (С4), изовалериановую (изоС5), валериановую (С5), изокапроновую (изоС6) и капроновую (С6) кислоты.
2 АИ — это отношение суммы концентраций (С) восстановленных кислот к менее восстановленным: (Спропионовая + Смасляная)/Суксусная (Гунзалус И., Стайнер Р., 1963).
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru






