Экспериментально-клиническое обоснование механизмов многоцелевого терапевтического действия комплексного биорегуляционного препарата
Актуальность
Современный спорт предъявляет повышенные требования к организму человека, при этом достижение высоких результатов зачастую сопровождается снижением активности саногенетических процессов в восстановительном периоде после травмы или при обострении застарелых соматических заболеваний [1–3]. Современная фармакология представлена огромным спектром различных препаратов, которые, как правило, обладают мощным лечебным воздействием при острых состояниях, но в случае хронического процесса, требующего длительного лечения, при применении лекарственных средств могут проявляться нежелательные побочные эффекты [4]. Кроме того, эффективный фармацевтический препарат может вступать в конфликт с требованиями антидопингового комитета, что ограничивает сферу его применения, особенно в соревновательный период [5].
Одной из наиболее частых проблем современного спорта являются травмы опорно-двигательного аппарата и ассоциированные с ними воспалительные процессы: бурситы, тендовагиниты, эпикондилиты, периартриты и т. п. [6, 7]. Известно, что вследствие травм резко нарушаются трофические процессы в поврежденном участке опорно-двигательного аппарата. В свою очередь, нарушения трофического обеспечения поврежденных тканей ведут к снижению адаптационных возможностей клеток, функциональным расстройствам и дистрофическим изменениям [8].
Вызывая прогрессивное нарушение трофики и обменных процессов в тканях, травматические повреждения в большинстве случаев сами являются результатом нарушения кровообращения и обмена веществ в тканях при локальных повреждениях и перенапряжениях. Возникающая при этом гипоксия, обменные нарушения захватывают и сосудистую стенку, что способствует возникновению мелких кровоизлияний и повторных микротравм при чрезмерных спортивных нагрузках [9]. На этом фоне достаточно быстро могут развиваться различные воспалительные заболевания.
Как упоминалось выше, классическая фармакотерапия не лишена недостатков, поэтому в качестве альтернативы можно рассмотреть возможность применения гомеопатических препаратов, эффективность действия которых, впрочем, нуждается в серьезных доказательствах и, особенно, в исследованиях, посвященных изучению механизмов их действия [10, 11].
В связи с этим целью настоящего исследования было изучение терапевтических эффектов препарата Траумель С в условиях моделирования воспалительного процесса у экспериментальных животных и у спортсменов с заболеваниями опорно-двигательного аппарата воспалительного генеза.
Материал и методы
Экспериментальная часть наших исследований была проведена на 45 белых крысах линии Вистар, у 30 из которых воспроизводилась модель адъювантного артрита по модифицированной методике Сура с соавт. путем однократного введения в подушечки задних лап адъюванта следующего состава: вакцина БЦЖ 20 мг, физиологический раствор 20 мл, ланолин 1,5 мл, вазелиновое масло 8,5 мл (тщательно перемешиваемое при температуре 56 °С в течение 30 мин). Терапевтические воздействия начинались после хронизации воспалительного процесса (через 30 дней после инициации адъювантного артрита). У лабораторных животных определяли различные показатели, характеризующие состояние иммунной системы: лейкоцитарная формула крови, в сыворотке крови определяли лизоцим по методике О.В. Бухарина и содержание циркулирующих иммунных комплексов (ЦИК) по методике В. Гашковой. Кроме того, в сыворотке крови животных определяли некоторые параметры ноцицептивной системы (гистамин, серотонин, бета-эндорфин и субстанция Р), а также измеряли периметр пораженного сустава. В качестве контроля выступали 15 здоровых крыс.
В клинической серии исследований приняли участие 27 спортсменов высокой квалификации (мастера спорта по легкой атлетике), у которых были выявлены воспалительные заболевания опорно-двигательного аппарата. Эффективность терапевтических мероприятий оценивали по визуальной аналоговой шкале (ВАШ) боли, также проводилось определение различных типов иммунокомпетентных клеток методом непрямой иммунофлуоресценции с использованием соответствующих моноклональных антител (АО «Сорбент ЛТД», Россия): для Т-лимфоцитов — CD3, для Т-хелперов/индукторов — CD4, для цитотоксических Т-лимфоцитов — CD8, для В-лимфоцитов — CD20, для естественных киллерных клеток (NK) — CD16. Учет полученных результатов проводился на лазерном проточном цитофлуориметре Epix-XL Coulter (Франция). Определение содержания иммуноглобулинов IgA, IgM и IgG в сыворотке крови проводили методом радиальной иммунодиффузии в геле (по G. Manchini et al.) В работе использовали моноспецифические сыворотки, изготовленные в НИИВС
им. И.И. Мечникова.
В качестве метода воздействия применяли мазевую форму Траумель С, которую наносили на пораженный сустав 2–3 р./сут в течение 2 нед. При проведении экспериментов у животных контрольной группы по такой же методике применяли вазелин.
Результаты и обсуждение
Моделирование воспалительного процесса в суставах задних конечностей у экспериментальных животных сопровождалось значительным изменением активности иммунной системы и дисбалансом ноцицептивных показателей (табл. 1). Выявлено, что внешние проявления воспаления в виде увеличения периметра лапок более чем на 50% ассоциировались с выраженным увеличением количества лейкоцитов и сегментоядерных нейтрофилов (на 37 и 39% соответственно), увеличением показателя завершенности фагоцитоза на 13,5%, возрастанием концентрации лизоцима на 30%. При этом отчетливо видна активация биохимических маркеров боли (субстанции Р и гистамина) на фоне снижения концентрации в крови антиноцицептивных параметров (серотонина и бета-эндорфина). Таким образом, адъювантный артрит у крыс достаточно разнообразно представляет собой модель воспалительного процесса.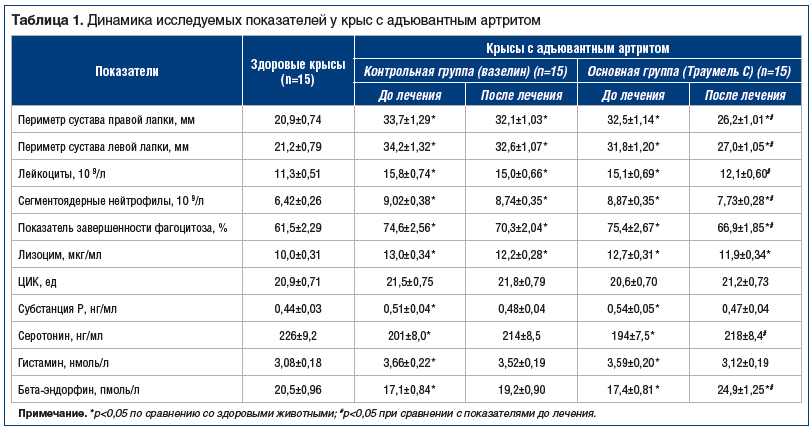
В контрольной группе животных существенных изменений при применении вазелина не произошло, если некоторые показатели после такого воздействия и менялись, то незначительно и не достигали статистической достоверности. В то же время в основной группе животных, получавших в течение 2 нед. мазь Траумель С, были выявлены существенные изменения многих параметров. Во-первых, снизилась активность воспалительного процесса (уменьшился периметр отека нижних конечностей на 19%, лейкоцитоз стал менее выраженным, на 13% упал уровень сегментоядерных нейтрофилов). Во-вторых, отмечалась достоверная динамика иммунологических показателей, которые приближались к референтным значениям у здоровых крыс. В-третьих, достоверно отмечалась активация антиноцицептивных показателей (серотонина и бета-эндорфина), хотя следует отметить, что биохимические маркеры боли (гистамин и субстанция Р) изменились незначительно. Таким образом, экспериментальные исследования подтвердили наличие выраженного терапевтического эффекта препарата Траумель С при моделировании хронического воспалительного процесса.
Аналогичные исследования были проведены и у спортсменов высокой квалификации с воспалительными заболеваниями опорно-двигательного аппарата. Из 27 испытуемых у 12 был выявлен бурсит, у 8 — тендовагинит, у 7 — периартрит. Как и в экспериментальных исследованиях, спортсмены применяли втирание мази Траумель С 2–3 р./сут в течение 2 нед. По динамике клинических проявлений заболевания улучшение было выявлено у 22 спортсменов, без изменений — у 4 и только у 1 отмечалось некоторое ухудшение. Эти факты были подкреплены значимой динамикой различных параметров иммунокомпетентной системы, биохимических маркеров боли и показателя ВАШ боли (табл. 2).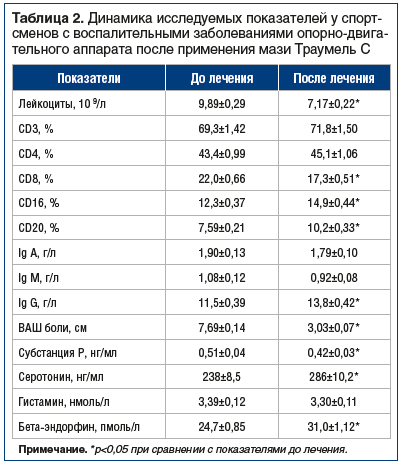
Выявлено, что на фоне снижения воспаления (лейкоцитоз уменьшился на 28%) отмечалось достоверное падение уровня цитотоксических Т-лимфоцитов (CD8), увеличение числа естественных киллерных клеток (NK) (CD16) и В-лимфоцитов (CD20). Одновременно наблюдалось увеличение синтеза Ig G на 20%.
Одновременно уменьшалось проявление боли по шкале ВАШ (более чем в 2 раза), что ассоциировалось со значительным увеличением концентрации в крови антиноцицептивных параметров (серотонина — на 20%, бета-эндорфина — на 26%).
Заключение
Комплексный биорегуляционный препарат Траумель С подтвердил свою клиническую эффективность при лечении воспалительных заболеваний опорно-двигательного аппарата у спортсменов и при экспериментальном моделировании воспаления суставов у лабораторных животных. Препарат может быть рекомендован для применения при различных воспалительных заболеваниях опорно-двигательного аппарата у лиц, занимающихся спортом, и у других категорий пациентов, подверженных риску травматизации суставов.
Информация с rmj.ru






