Содержание статьи
Введение
Хроническая обструктивная болезнь легких (ХОБЛ) остается основным респираторным неинфекционным заболеванием, которое вызывает рост смертности во всем мире. Во многом это обусловлено невозможностью диагностировать заболевание на начальном этапе из-за небольшого количества респираторных симптомов или их полного отсутствия [1–3].
В последнем пересмотре рекомендаций Глобальной инициативы по хронической обструктивной болезни легких (Global Initiative For Chronic Obstructive Lung Diseases, GOLD) от 2022 г. вводится термин «ранняя ХОБЛ», отражающий самые первые этапы патогенеза, которые задолго предшествуют клинической манифестации заболевания [4]. В настоящее время концепция ранней стадии ХОБЛ становится приоритетной областью исследований и применения новых методов лечения, поскольку была выдвинута гипотеза о том, что вмешательство на этой стади и потенциально может остановить или обратить вспять развитие заболевания [5]. Более 70% пациентов с ХОБЛ находятся на ранней стадии болезни, возникающей в результате взаимодействия многочисленных факторов (генетических, экологических, инфекционных) на протяжении всего жизненного цикла в любом возрасте — у пожилых, молодых, детей и даже у плода [6, 7]. Раннее выявление и своевременные профилактические меры могли бы предотвратить серьезное повреждение легких и прогрессирование заболевания. Но, к сожалению, стандартных критериев диагностики и биомаркеров ранней ХОБЛ не существует [3, 7]. ХОБЛ формируется в течение длительного «инкубационного» (доклинического) периода — от хронического воспаления и структурного ремоделирования дыхательных путей до обнаруживаемых (диагностируемых) нарушений функции легких [3, 7–9].
В настоящее время считается, что на момент постановки диагноза у пациентов с ХОБЛ симптомы проявлялись не менее 5 лет, и это подчеркивает необходимость выявления заболевания и эффективных вмешательств на ранней стадии [10]. По мнению ряда авторов, самой ранней стадией развития ХОБЛ является поражение мелких дыхательных путей, когда прогрессирование заболевания клинически незаметно, но при этом оно коррелирует с последующим развитием обструкции воздушного потока и предшествует развитию эмфиземы [5–7, 11]. Ранняя стадия ХОБЛ протекает на молекулярно-клеточном уровне в эпителии мелких дыхательных путей, а происходящие в эпителии структурные/воспалительные изменения представляют собой основной очаг формирующегося заболевания [6]. Если его своевременно диагностировать (на начальном этапе структурных изменений легких), то с помощью фармакологических методов лечения можно предотвратить или значительно замедлить прогрессирование ХОБЛ и снизить заболеваемость, инвалидизацию и смертность [12]. На роль профилактических средств могут претендовать противовоспалительные препараты, реализующие свой потенциал на уровне малых дыхательных путей — зо edы манифестации патологического процесса. Использование различных бронходилататоров и ингаляционных глюкокортикостероидов в качестве медикаментозных средств для лечения ранней стадии ХОБЛ пока вызывает споры и требует дополнительных исследований [6, 11, 12]. Ранее в опытах на модели ХОБЛ, индуцированной длительным во здействием диоксида азота, нами был продемонстрирован лечебный эффект применения экстрамелкодисперсной композиции глюкокортикостероида беклометазона и агониста β2-адренорецепторов длительного действия формотерола на стадии сформированной картины морфофункциональной перестройки легких, характерной для ХОБЛ [13].
Цель исследования: оценить эффект применения экстрамелкодисперсной комбинации глюкокортикостероида беклометазона и длительно действующего β2-адреномиметика формотерола на ранней стадии формирования экспериментальной модели ХОБЛ.
Материал и методы
Опыты выполнены на крысах-самцах линии Вистар массой 150–170 г разводки питомника лабораторных животных «Рапполово» РАН. Исследования проводились в соответствии с приказом Минздравсоцразвития России № 708н от 23.08.2010 «Об утверждении правил лабораторной практики».
Модель этапного формирования ХОБЛ (от острой реакции на повреждение до выраженной перестройки бронхолегочной ткани) воспроизводили с помощью ингаляционного воздействия диоксида азота, являющегося важным компонентом табачного дыма и оксидантным поллютантом [13, 14]. Под влиянием ингаляционного воздействия диоксида азота происходят нарастающие нарушения в структуре эпителия бронхов и легочного интерстиция, характерные для стадийного формирования ХОБЛ [14, 15]. Крыс помещали в камеру, смонтированную в вытяЦ 6ном шкафу, которая соединялась шлангом с лабораторной установкой для получения диоксида азота. В результате химической реакции нитрита натрия с серной кислотой образовывалась смесь оксидов азота, которая нагнеталась в камеру с животными. Под влиянием кислорода воздуха бесц ветный оксид азота переходил в наиболее стабильный желто-бурый диоксид. Концентрация диоксида азотав камере определялась колориметрическим методом и составляла 30–40 мг/м3. Экспозицию диоксида азотапроводили в прерывистом режиме (три экспозиции в день по 30 мин с 30-минутным интервалом между ними) на протяжении 60 дней.
После 15 дней экспозиции крысы были разделены случайным образом на 2 группы. Животные опытной группы (n=11) ежедневно с 16-го по 60-й день получали ингаляции аэрозольной комбинации глюкокортикостероида беклометазона дипропионата и длительно действующего b2-адреномиметика формотерола фумарата (МНН: беклометазон + формотерол, «Кьези Фармацевтичи С.п.А.», Италия). Экстрамелкодисперсная структура аэрозоля обеспечивает лучшую доставку действующих веществ в мелкие периферические дыхательные пути. Препарат ингалировали через специальную маску, которая надевалась на морду крысы и в отверстие которой вставляли распылительную насадку аэрозольного ингалятора. Для распыления одной дозы препарата (100 мкг беклометазона и 6 мкг формотерола) совершали одно нажатие и выдер e6ивали 10 с, в течение которых крыса совершала 20–25 дыхательных движений. Животным контрольной группы (n=11) проводили аналогичную процедуру с использованием плацебо. Девять особей составили интактную группу. По окончании 60-дневной экспозиции диоксида азота осуществляли эвтаназию всех животных методом ингаляции диоксида углерода.
Бронхоальвеолярный лаваж выполняли на изолированных легких стерильным физиологическим раствором (35–37 °С). Лаважную жидкость собирали в силиконированные пробирки и после центрифугирования определяли общее и дифференциальное содержание клеток в 1,0 мл. В пробах бронхоальвеолярной лаважной жидкости (БАЛЖ) определяли содержание интерлейкина (ИЛ) 8, ИЛ-17, фактора некроза опухоли (ФНО-α), нейтрофильной эластазы (neutrophil elastase, NE), иммуноглобулина А (secretory IgA, SIgA) и сурфактантного протеина В (surfactant protein B, SP-B) и сурфактантного протеина D (surfactant protein D, SP-D) методом иммуноферментного анализа ELISA с использованием видоспецифичных тест-систем фирмы Cusabio Biotech (Китай). Для гистологических исследований легкие расправляли введением через трахею 10% раствора формальдегида. Материал заключали в парафин, срезы толщиной 5–7 мкм окрашивали гематоксилином и эозином и по методу Ван Гизона. Статистическую обработку выполняли с помощью пакета программ Statistica 6.0 (Windows) с применением критерия достоверности Стьюдента. Количественные данные представляли как среднее ± ошибка среднего (М±m). Статистически значимыми считали различия при р<0,05.
Результаты исследования
В легких животных контрольной группы по окончании 60-дневной экспозиции выявлялись выраженные признаки структурной перестройки и ремоделирования дыхательных путей, соответствовавшие морфологическому паттерну ХОБЛ, которые ранее послужили отправной точкой при исследовании эффекта терапевтического применения комбинации беклометазон/формотерол и аписанные ранее [13]. Основные отличительные признаки включают десквамацию бронхиального эпителия, гиперплазию бокаловидных клеток, плоскоклеточную метаплазию, лейкоцитарно-лимфоцитарную инфильтрацию, инверсию соотношения числа реснитчатых и бокаловидных клеток (5:4, в норме 5:1), признаки очагового склероза и эмфиземы.
Содержание нейтрофилов в БАЛЖ крыс, не получавших лечения, превышало значения этого показателя у интактных животных в 10 раз (31,8±2,9% и 2,9±0,7% соответственно, р<0,05), а лимфоцитов — в 3 раза (20,2±2,1% и 6,3±1,8% соответственно, р<0,05). Концентрации провоспалительных цитокинов и нейтрофильной эластазы двукратно превышали интактный уровень (табл. 1). В результате повреждения бронхоальвеолярного эпителия, индуцированного воздействием диоксида азота, ухудшались показатели его функциональной активности: отмечалось снижение содержания в БАЛЖ SIgA и гидрофильного SP-D и увеличение концентрации гидрофобного SP-B (табл. 2).
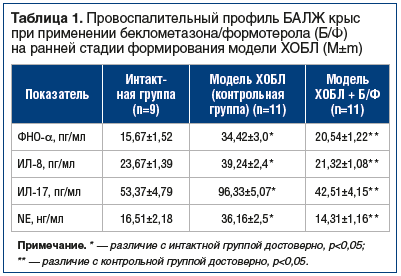
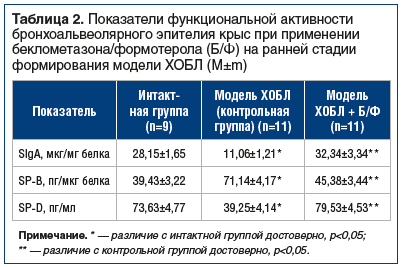
По окончании 60-дневной экспозиции диоксида азота процентное содержание нейтрофилов и лимфоцитов в БАЛЖ животных опытной группы составляло соответственно 6,4±1,2% и 9,3±1,8% и было близко к значениям у интактных животных (р<0,05 по сравнению с показателем у животных из контрольной группы). При гистологическом исследовании легочной ткани крыс этой группы в бронхиальном эпителии не выявлялись дисрегенераторные изменения с участками оголенной базальной мембраны, плоскоклеточной метаплазии, дистрофии и атрофии, признаки ремоделирования дыхательных путей и эмфиземы. Соотношение реснитчатых и бокаловидных клеток практически соответствовало норме (5:2). Концентрации провоспалительных цитокинов ФНО-α, ИЛ-8, ИЛ-17 и нейтрофильной эластазы оказались достоверно ниже по сравнению с контрольной группой и практически не отличались от показателей интактных животных (см. табл. 1). Содержание SIgA, SP-В и SP-D в БАЛЖ крыс опытной группы достоверно не отличалось от значений в интактной группе (см. табл. 2), что могло рассматриваться как свидетельство сохранения морфофункциональной целостности и иммунобарьерной функции бронхоальвеолярного эпителия.
Обсуждение
Ранее было показано, что после 15-дневной экспозиции диоксида азота в легких наблюдаются острые структурные изменения — отек и лейкоцитарно-лимфоцитарная инфильтрация подслизистого слоя, перибронхиальной и периваскулярной клетчатки, очаговая пролиферация бронхиального эпителия, гиперплазия бокаловидных клеток, слущивание эпителия с обнажением базальных отделов, участки перерастяжения легочной ткани [14, 15]. На э том сроке (этап острой реакции на повреждение, индуцированное токсическим воздействием вдыхаемого диоксида азота) содержание нейтрофилов в БАЛЖ возрастает до 25–30%, а лимфоцитов — до 20–25% [15]. Нейтрофильное воспаление, развивающееся вследствие повреждения легочного эпителия экзогенными факторами, такими как сигаретный дым или оксидантные поллютанты (диоксид азота), служит характерным признаком ХОБЛ [16–20]. Недавние исследования позволяют полагать, что нейтрофилы и их протеиназы являются ключевым патогенетическим фактором развития ХОБЛ начиная с самой ранней стадии болезни и последующего прогрессирования [3, 21]. Уже на этапе острого повреждения эпителия, вызванного вдыхаемы ec диоксидом азота, содержание нейтрофилов в БАЛЖ достигает 30% от общего клеточного состава и сохраняется на высоком уровне вплоть до окончания экспозиции. Рекрутирование нейтрофилов в легкие происходит под влиянием хемоаттрактантов, высвобождающихся из поврежденной эпителиальной оболочки (ИЛ-1, ИЛ-8, ФНО-α и др.) [22]. Важная роль в привлечении нейтрофилов в дыхательные пути принадлежит ИЛ-17 благодаря активации эпителиальных клеток бронхов и индукции экспрессии нейтрофильных хемокинов, в частности ИЛ-8 [23]. Нейтрофилы, как известно, играют решающую роль во врожденном иммунном ответе, однако в процессе формирования ХОБЛ они приобретают аберрантные функции, что способствует образованию воспалительной микросреды и прогрессированию заболевания [18, 24–26].
Присутствие дисфункциональных фенотипов нейтрофил eeв, отличающихся повышенной миграционной активностью в отношении хемоаттрактантов и аномальной реакцией на воспалительные стимулы, может повышать вероятность повреждения легочной ткани и, следовательно, восприимчивость к развитию ХОБЛ [3, 24, 27]. Дисфункция нейтрофилов может быть e3енетически детерминирована, но может отражать и эпигенетические изменения, происходящие под воздействием факторов окружающей среды [3, 27]. Нейтрофильная эластаза препятствует восстановлению эпителия, способствуя клеточному апоптозу и старению, активирует воспаление, увеличивая экспрессию и высвобождение провоспалительных цитокинов [28]. Расщепляя эластин внеклеточного матрикса легочной паренхимы, эластаза нейтрофилов способствует формированию участков эмфиземы. Недавно описан новый механизм индуцированного нейтрофильной эластазой повреждения легких при ХОБЛ, связанный с образованием в дыхательных путях устойчивого к ингибированию α1-антитрипсином активного пула нейтрофильной эластазы, локализованного на поверхности экзосом [29].
Отражением повреждения бронхоальвеолярного эпителия и дисфункции альвеолоцитов 2-го типа служат изменения содержания SP-B и SP-D в БАЛЖ крыс контрольной группы. SP-D является важным противовоспалительным белком, регулирующим иммунную защиту легких. Вызванные болезнью разрушение или модификации SP-D способствуют его системной «утечке» из легких, а циркуляторный SP-D рассматривается как перспективный биомаркер повреждения легких [30]. Гипотеза о том, что пневмотоксическое воздействие сигаретного дыма опосредует «утечку» SP-D из легких в кровь, нашла подтверждение в 12-летнем исследовании [31]. Установлено, что уровень SP-D в сыворотке крови значительно повышен у курильщиков с исходно нормальной функцией легких, у которых за время наблюдения функциональные показатели легких значительно снижались и от
‘ecечался повышенный риск развития ХОБЛ, по сравнению с теми курильщиками, у кого легочная функция не страдала. Мыши с дефицитом SP-D оказались более восприимчивы к индуцированному сигаретным дымом воспалению дыхательных путей, а введение в легкие рекомбинантного фрагмента SP-D человека позволяло снизить локальное содержание провоспалительных циток e8нов [32]. Следствием нарушения структуры SP-B под влиянием вдыхаемых оксидантных поллютантов может быть утрата их способности взаимодействовать с фосфолипидами сурфактантной выстилки, что может сказаться на снижении альвеолярного поверхностного натяжения и газообменной функции легких [33].
Важным компонентом поверхностного иммунного барьера мелких дыхательных путей, контактирующего с внешней средой, является SIgA, синтезируемый плазматическими клетками базальной мембраны и транспортируемый на поверхность эпителия полимерным рецептором. Потеря SIgA часто встречается в мелких дыхательных путях па¶ 6иентов с ХОБЛ и может способствовать прогрессированию заболевания, особенно с фенотипом эмфиземы [34]. Исследование образцов дыхательных путей диаметром меньше 2 мм у пациентов с ХОБЛ показало, что патологические изменения (аномальная морфология эпителия, накопление нейтрофилов, фиброзное ремоделирование) локализовались преимущественно в дыхательных путях с дефицитом SIgA [35]. У мышей с отсутствием SIgA в дыхательных путях из-за генетического дефицита полимерного рецептора Ig обнаружили увеличение процентного содержания нейтрофилов в легких и признаки спонтанного развития эмфиземы [36].
По современным представлениям дисфункция мелких дыхательных путей с повреждением эпителиальной выстилки представляет собой ранний и ключевой элемент функциональных последствий и прогрессирования ХОБЛ [5–7, 11]. Выяснение точной роли дисфункции мелких дыхательных путей как специфической «фармакологической мишени» в лечении ранней стадии ХОБЛ стало важным направлением проводимых исследований. Воспаление и ремоделирование мелких дыхательных путей являются основными признаками ХОБЛ, поэтому способность экстрамелкодисперсного аэрозольного препарата беклометазон/формотерол достигать периферических отделов респират eeрного тракта представляется крайне важной в плане терапии ранней стадии ХОБЛ. На сегодняшний день преимущества этой сверхтонкой рецептуры продемонстрированы в лечении пациентов с умеренной и тяжелой ХОБЛ, у которых отмечалось улучшение функции легких и снижение частоты обострений [37]. Применение экстрамелкодисперсной комбинации беклометазон/формотерол в терапии больных ХОБЛ с выраженной обструкцией воздушного потока (объем форсиро e2анного выдоха за 1 секунду 43%) улучшало функциональные показатели, связанные с заболеванием мелких дыхательных путей (отношение остаточного объема к общей емкости легких), а также клинический статус и качество жизни пациентов [38]. Противовоспалительный эффект терапевтического применения ультрамелкодисперсного аэрозоля беклометазон/формотерол был подтвержден нами в опытах на крысах [13]. В настоящей работе профилактическое применение экстрамелкодисперсного комбинированного препарата беклометазон/формотерол на раннем этапе формирования модели ХОБЛ (этапе острой реакции на повреждение) минимизировало повреждение эпителиальных структур дыхательных путей под влиянием пневмотоксического воздействия диоксида азота, что способствовало снижению активности нейтрофильного воспаления и сохранению функциональной активности бронхоальвеолярного эпителия на базальном уровне.
Заключение
В последние годы концепция ранней ХОБЛ приобретает все больше сторонников и становится приоритетным направлением исследований и разработки новых подходов к лечению, поскольку считается, что терапевтическое вмешательство на этой стадии заболевания потенциально может остановить развитие и прогрессирование патологического процесса. Предполагается, что дисфункция мелких дыхательных путей, ассоциированная с повреждением респираторного эпителия, является самой ранней стадией развития ХОБЛ. Однако стратегии лечения ранних стадий заболевания, которые предшествуют развитию обструкции воздуш edого потока и эмфиземы, остаются спорными и неопределенными, чему в немалой степени способствует отсутствие на сегодняшний день результативных противовоспалительных лекарственных препаратов. Превентивное применение экстрамелкодисперсной комбинации беклометазон/формотерол на этапе начальных структурных повреждений дыхательных путей, вызванных воздействием пневмотоксиканта диоксида азота, позволило предотвратить чрезмерное повреждение эпителиальных структур дыхательных путей, значительно снизить активность нейтрофильного воспаления, сохранить иммунобарьерную функцию бронхоальвеолярного эпителия и предотвратить формирование морфофункциональной картины модели ХОБЛ, наблюдаемой в группе контрольных животных, не получавших лечения. Экстрамелкодисперсная аэрозольная рецептура использованного препарата способствовала максимальной эффективности его компонентов на уровне малых дыхательных путей — основного «плацдарма» развития патологического процесса. Для профилактики и снижения заболеваемости ХОБЛ у лиц с предполагаемой бессимптомной или малосимптомной ранней стадией заболевания и при наличии у них факторов риска (генетических, экологических и др.) целесообразно проведение исследований по определению минимальной эффективной превентивной дозы экстрамелкодисперсных противовоспалительных препаратов и оптимального режима их использования.
.
Информация с rmj.ru






