Введение
В настоящее время в стратегии оказания помощи пациентам с сердечно-сосудистыми заболеваниями (ССЗ) сохраняется проблема неэффективного управления кардио-васкулярными факторами риска вследствие недостаточного и несвоевременного их выявления [1]. Влияние этих факторов реализуется через изменение свойств сосудистой стенки. Именно поэтому сосудистая жесткость служит предметом активного изучения в качестве параметра для оценки вероятности развития ССЗ [2]. Помимо кумулятивного влияния факторов риска на сосудистую жесткость известен негативный вклад психологических факторов риска, которые могут ускорить атеросклеротический процесс и развитие сердечно-сосудистых событий [3, 4]. С одной стороны, психологический стресс может привести к ожирению, дислипидемии, гипертонии (традиционные кардиометаболические риски) посредством поведенческих механизмов. С другой стороны, существует прямой биологический механизм, который включает активацию автономной нервной и нейроэндокринной систем, вызывая сокращение гладких мышц сосудов, нарушение коагуляции и воспаление эндотелия. Согласно данным исследований [5, 6] повышение сосудистой жесткости рассматривается как независимый предиктор развития сердечно-сосудистых осложнений у пациентов с ишемической болезнью сердца (ИБС). В этой связи представляется привлекательным использование интегрального показателя для оценки жесткости сосудистой стенки в качестве мониторинга как для контроля сохраняющегося риска, так и для оптимизации лечения. Однако на сегодняшний день сложно оценить, какие именно факторы, помимо антигипертензивного лечения, непосредственно связаны со снижением сосудистой жесткости [7, 8].
Измерение каротидно-феморальной скорости пульсовой волны (cfСПВ) считают «золотым стандартом» для оценки сосудистой жесткости, однако ее измерение трудозатратно и малодоступно [9]. Вместе с тем было показано, что скорость пульсовой волны на плече-лодыжечном участке аналогична cfСПВ при прогнозировании клинических событий [10]. Именно поэтому в последнее время для оценки сосудистой жесткости наиболее широко используют сердечно-лодыжечный сосудистый индекс (cardio-ankle vascular index, CAVI), который является модифицированным индексом жесткости β и отражает жесткость артериального дерева от начала аорты до лодыжки [11]. Ранее в исследованиях [5, 12] было показано, что CAVI не только ассоциируется с факторами риска и тяжестью коронарного атеросклероза, но и служит независимым маркером неблагоприятных клинических событий у пациентов с ИБС.
Широкое применение CAVI в российской клинической практике ограничено, так как данный показатель можно получить только при использовании коммерческого устройства VaSera (Fukuda Denshi, Япония), а его референсные значения были получены при исследовании преимущественно японской популяции [13]. С учетом этих недостатков CAVI в России был разработан новый, национальный показатель сосудистой жесткости — индекс START (stiffness of arteries). Этот индекс основан на математической модели упругих гидродинамических волн в трубе и описывает упругость стенок сосуда при большой разнице систолического артериального давления (САД) и диастолического артериального давления (ДАД)1 [14].
Ранее нами была изучена возможность использования индекса жесткости START у пациентов с ИБС и показана высокая корреляция этого нового индекса с CAVI [15]. Тем не менее необходимы дальнейшие исследования в этой области.
Цель исследования: оценить динамику индекса сосудистой жесткости START и определить потенциально влияющие на него факторы риска у пациентов с ИБС через 1 год после коронарного шунтирования (КШ).
Содержание статьи
Материал и методы
В одноцентровое исследование были включены 269 пациентов с ИБС, которым было проведено КШ (205 мужчин и 64 женщины в возрасте от 35 до 75 лет). Исследование проведено на базе НИИ КПССЗ г. Кемерова, одобрено локальным этическим комитетом учреждения, протокол исследования соответствовал этическим принципам Хельсинкской декларации.
Критерии включения в исследование: диагностированная ИБС, информированное согласие пациента на проведение исследования.
Критерии невключения: противопоказания к проведению объемной сфигмографии, значение лодыжечно-плечевого индекса (ЛПИ) ≤0,9 (наличие гемодинамически значимого стеноза артерий нижних конечностей искажает истинные показатели жесткости сосудистой стенки).
Перед операцией всем участникам исследования было проведено стандартное лабораторно-инструментальное обследование. Для диагностики «дистрессорного» (англ.: distressed — истощенный) типа личности Д, который характеризуется повышенной склонностью к развитию депрессивных реакций [16], низкой приверженностью лечению [17] и представляет собой один из факторов риска развития ССЗ, использовали опросник DS-14 [18]. Перед хирургическим лечением оценивали жесткость периферических артерий с использованием сфигмографа VaSera VS-1000 (Fukuda Denshi, Япония), с помощью которого автоматически рассчитывали ЛПИ на основании измерения САД и ДАД на верхних и нижних конечностях и CAVI по сердечно-лодыжечной скорости пульсовой волны (haСПВ) на участке от клапана аорты до артерий правой и левой голени [11]. По основным показателям, полученным из отчетов сфигмографии, рассчитывали новый, отечественный индекс жесткости START [14]. С учетом подхода разработчиков отечественный индекс обозначается соответственно измеряемому сердечно-лодыжечному сосудистому участку: haSTART. Рассчитывали индекс haSTART при помощи онлайн-калькулятора2.
После операции всем участникам была назначена оптимальная медикаментозная терапия (ОМТ) и даны рекомендации по изменению образа жизни.
Через 1 год пациенты были приглашены для очной консультации. Удалось отследить динамику индекса haSTART: у 72 пациентов на протяжении 12 мес. значение индекса не изменилось, у 107 пациентов индекс уменьшился на ≥1 ед., а у 90 — увеличился на ≥1 ед. В окончательный анализ были включены 197 пациентов, которых распределили в 2 группы: I группу составили пациенты с уменьшением показателя haSTART (n=107), а II группу — с увеличением (n=90).
Для статистической обработки данных использовали программу Statistica 8.0 (StatSoft, USA). Количественные показатели оценивали на предмет соответствия нормальному распределению с помощью критерия Шапиро — Уилка. При анализе переменных, отличающихся от нормального распределения, количественные данные описывали с помощью медианы (Me), а также первого и третьего квартилей [Q1; Q3]. Для сравнения групп применяли критерий Манна — Уитни, Краскелла — Уоллиса и χ2. При малом числе наблюдений использовали точный критерий Фишера с поправкой Йейтса. Корреляционный анализ взаимосвязи с клиническими показателями проводили с использованием коэффициента корреляции Спирмена. Критический уровень значимости р принимали равным 0,05.
Результаты исследования
В таблице 1 приведены исходные предоперационные данные пациентов с ИБС. Средний возраст участников составил 59,4±8,3 года. В обеих группах преобладали мужчины, однако во II группе их было статистически значимо больше, чем в I группе (82,2% против 68,2%, р=0,024). Статистически значимых различий в исходных клинических параметрах и лабораторно-инструментальных показателях между группами не было. Группы различались по количеству пациентов с психологическим типом Д: в I группе такой тип диагностирован в 32,7% случаев, во II группе — в 52,2% (р=0,006). При анализе ОМТ на догоспитальном этапе были выявлены статистически значимые различия в приеме АКК: в I группе их получали 26,2% пациентов, а во II группе — 12,2% (р=0,013).
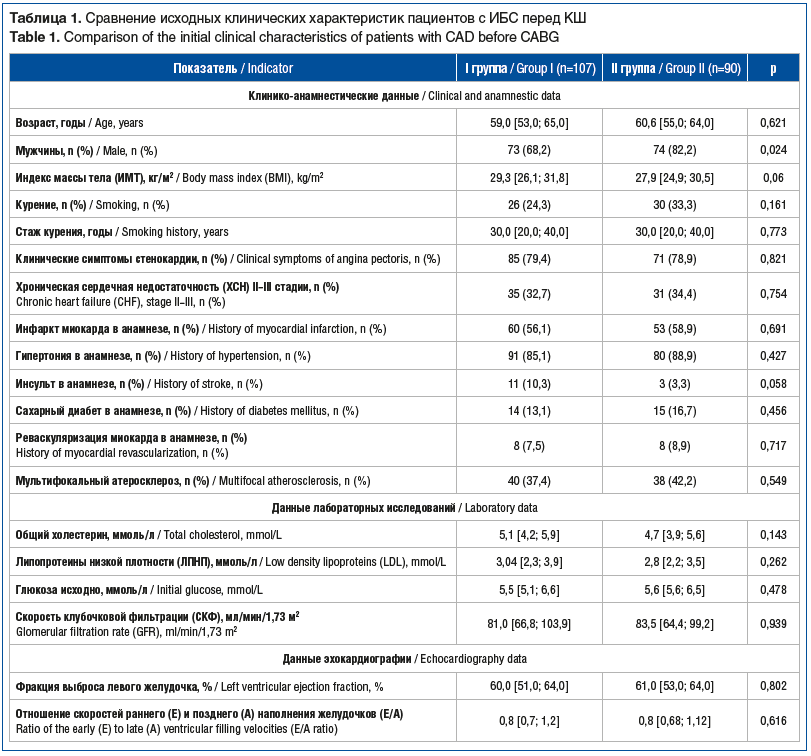

Среди пациентов обеих групп не было статистически значимых различий в поражении коронарного русла и основных параметрах интраоперационного периода (табл. 2).
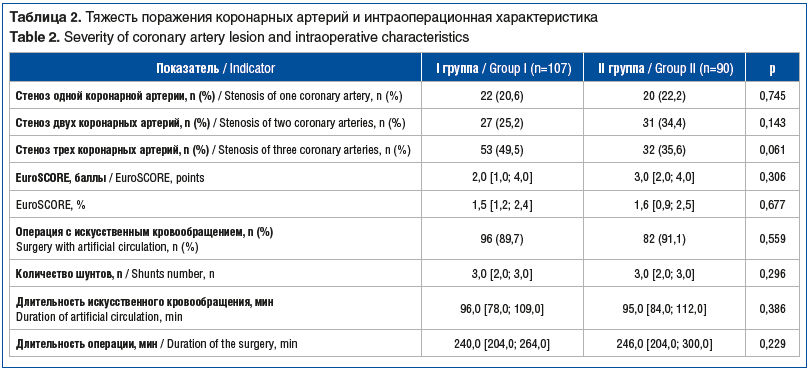
Динамика клинических, лабораторно-инструментальных характеристик, а также ОМТ спустя 1 год после хирургического вмешательства представлена в таблице 3. За прошедшее время больших сердечно-сосудистых нежелательных событий (летальный исход, инфаркт миокарда, инсульт) зарегистрировано не было. Среди всех пациентов повторная реваскуляризация миокарда была выполнена в 2% случаев, госпитализации по поводу ССЗ отмечены в 14,7% случаев — без межгрупповых различий.
За время наблюдения отмечено улучшение состояния пациентов: уменьшилась выраженность симптомов коронарной недостаточности и ХСН в обеих группах. Однако статистически значимых различий выявлено не было. Не отмечено различий в лабораторных показателях между сравниваемыми группами. По данным эхокардиографии у всех пациентов фракция выброса левого желудочка оставалась сохранной (Me=62%) через год после операции, другие показатели также не различались между группами.
Отмечено, что пациенты стали чаще придерживаться ОМТ, однако межгрупповых различий не наблюдалось (р>0,05). Доли пациентов, посещавших кардиолога в течение года, в обеих группах оказались сопоставимыми (в I группе — 75,7% пациентов, во II группе — 73,3%), однако суммарное количество консультаций было больше в I группе (р=0,013).
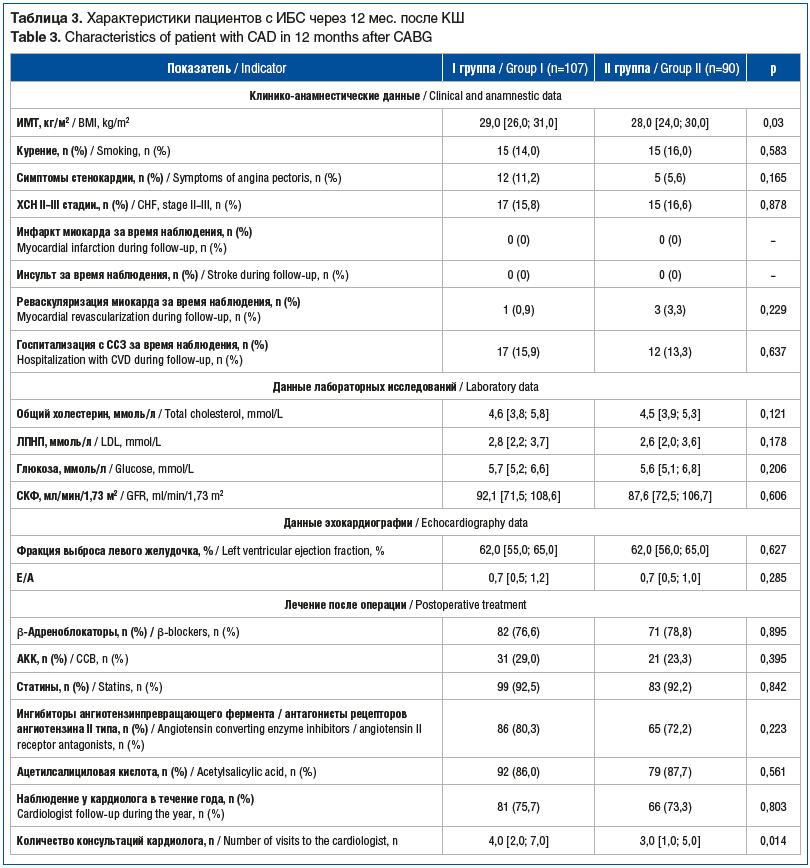
Показатели объемной сфигмографии (гемодинамики и сосудистой жесткости) исходно и через год после КШ представлены в таблице 4. Через год в обеих группах увеличились показатели САД и ДАД по сравнению с исходными. Соответственно, с учетом ранее описанной методики вычисления нового индекса, закономерно увеличилась haСПВ во II группе по сравнению с I группой (p<0,001). Та же тенденция наблюдалась и в отношении CAVI (p<0,001).
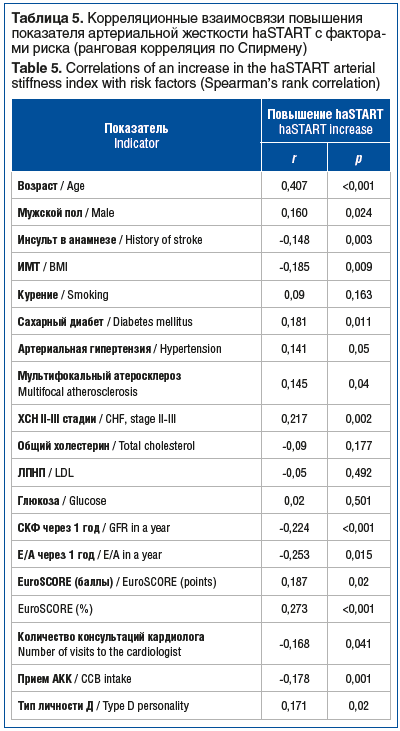
При помощи корреляционного анализа были изучены возможные факторы, влияющие на увеличение индекса haSTART после хирургического вмешательства на коронарных артериях (табл. 5). Продемонстрирована связь повышения индекса haSTART с увеличением возраста (r=0,407, p<0,001), мужским полом (r=0,160, p=0,024), артериальной гипертензией (r=0,141, p=0,05), сахарным диабетом (r=0,181, p=0,048), мультифокальным атеросклерозом (r=0,145, p=0,04), ХСН (r>0,217, p=0,009) и типом личности Д (r=0,171, p=0,02). Также продемонстрированы слабые, но достоверные корреляции с показателями модели риска по шкале EuroSCORE II, которая позволяет рассчитать риск смерти после операции на сердце (r≤0,30, p<0,001). Помимо этого, наблюдалась обратная зависимость между увеличением haSTART и ИМТ (r=-0,185, p=0,024), СКФ (r=-0,224, p<0,001), Е/А (r=-0,253, p=0,015), приемом АКК (r=0,145, p=0,04) и количеством консультаций у кардиолога (r=-0,168,145, p=0,041) в течение одного года наблюдения.
Обсуждение
В нашем исследовании впервые изучена динамика нового индекса артериальной жесткости haSTART, разработанного отечественными учеными. Поскольку фактически он разработан как альтернатива CAVI, то предыдущие публикации были посвящены сопоставлению данных этих индексов как у здоровых лиц [19], так и у пациентов с ССЗ [13, 15].
В настоящем исследовании показано, что через 1 год после КШ более чем у половины пациентов отмечалось уменьшение индекса haSTART. Среди этих пациентов было больше женщин, они чаще принимали АКК, чаще посещали кардиолога в течение года после операции, до операции у них были зарегистрированы высокие значения индекса haSTART.
Возраст пациентов, наличие сахарного диабета, мультифокального атеросклероза и ХСН, больший риск операции КШ согласно шкале EuroSCORE, а также предрасположенность к развитию психологического дистресса оказались ассоциированы с увеличением индекса haSTART через 1 год после операции.
Для CAVI ранее было показано, что профилактические и медикаментозные воздействия способны благоприятно влиять на его динамику. Так, в недавнем обзоре [20] продемонстрировано, что снижение массы тела, прекращение курения, физические тренировки способствуют уменьшению CAVI. Применение антигипертензивных (АКК, ингибиторы ренин-ангиотензин-альдостероновой системы, включая блокаторы рецепторов ангиотензина, ингибиторы ангиотензинпревращающего фермента, блокаторы минералокортикоидных рецепторов, прямые ингибиторы ренина), липидоснижающих (статины, эйкозапентаеновая кислота) и антидиабетических (ингибирующие SGLT2, ингибиторы α-глюкозидаз, пиоглитазон) препаратов способствует улучшению CAVI [7, 8, 20].
Представляется важным оценить клиническое и прогностическое значение динамики показателей артериальной жесткости. Для CAVI было проведено не много подобных исследований. Например, в исследовании A. Saiki et al. [21] показано, что у пациентов с дислипидемией и другими факторами риска неблагоприятная динамика CAVI в течение первого года наблюдения положительно коррелировала с развитием основных неблагоприятных сердечно-сосудистых событий (major adverse cardiac events, МАСЕ) при последующем наблюдении в течение пяти лет. У пациентов с впервые выявленной ИБС T. Otsuka et al. [22] показали, что при оценке CAVI через 6 мес. индекс улучшился только у половины пациентов, у остальных он оставался стойко повышенным. Аналогичное соотношение динамики показателя сосудистой жесткости отмечено и в нашем исследовании. При наблюдении в течение трех лет стойко повышенный CAVI был независимым предиктором МАСЕ в будущем. В недавнем исследовании [23] было показано, что при положительной динамике значений CAVI в течение года после КШ в дальнейшем, при наблюдении в течение 10 лет, отмечается уменьшение смертности от всех причин и числа МАСЕ.
В то же время отмечено и обратное: при существенном повышении CAVI в ответ на сильный стресс (землетрясение в Японии) увеличилось число МАСЕ у больных ИБС [3]. В исследовании T. Tajima et al. [4] получены сведения о связи уровня стресса и артериальной жесткости. При обследовании здоровых лиц было показано, что у женщин повышение активности α-амилазы слюны связано с увеличением CAVI. У здоровых молодых лиц тест с устным счетом в течение 5 мин приводил к существенному повышению артериальной жесткости на протяжении 30 мин [24]. Интересные наблюдения приведены в статье K. Shimizu et al. [25]: непосредственно перед МАСЕ (инфаркт миокарда, кровоизлияние в мозг и диссекция аорты) у пациентов наблюдалась тенденция к быстрому увеличению CAVI от ~0,5 до ~1,0 в течение нескольких недель, непосредственно предшествующих событию. Вышеперечисленные научные и клинические данные позволили выдвинуть гипотезу «сокращения гладких мышечных клеток» как причины разрыва бляшки. Авторы этой гипотезы предположили, что МАСЕ происходят из-за разрыва бляшки вследствие ишемического повреждения и некроза, вызванного быстрым увеличением CAVI на фоне исходно повышенных значений этого индекса [26].
В настоящем исследовании тип личности Д, характеризующийся предрасположенностью к развитию психологического дистресса, чаще встречался в группе с возрастанием индекса haSTART через год наблюдения. С одной стороны, это согласуется с данными об ассоциации стрессорных воздействий с повышением артериальной жесткости. С другой стороны, это объясняет, почему наличие типа личности Д неблагоприятно влияет на прогноз у пациентов с ИБС [27–29].
Заключение
У больных ИБС через год после КШ индекс сосудистой жесткости haSTART уменьшился в 54% случаев. Динамическое измерение сосудистой жесткости с помощью индекса haSTART помогает оценить эффективность лечения и предоставляет важную прогностическую информацию относительно пациентов с ИБС в клинической практике, что открывает широкие возможности для его применения в программах первичной и вторичной профилактики ССЗ.
Клиническое значение исследования трудно пере-оценить. В руках кардиологов появился надежный маркер артериальной жесткости, высококоррелирующий с известными ранее индексами (прежде всего, CAVI) и обладающий схожими прогностическими возможностями. Отсутствие зависимости данного индекса от аппаратуры зарубежного производства позволяет использовать отечественные приборы.
Сведения об авторах:
Щеглова Анна Викторовна — к.м.н., старший научный сотрудник лаборатории коморбидности при сердечно-сосудистых заболеваниях отдела клинической кардиологии НИИ КПССЗ; 650002, Россия, г. Кемерово, б-р им. акад. Л.С. Барбараша, д. 6; ORCID iD 0000-0002-4108-164X.
Сумин Алексей Николаевич — д.м.н., заведующий лабораторией коморбидности при сердечно-сосудистых заболеваниях отдела клинической кардиологии НИИ КПССЗ; 650002, Россия, г. Кемерово, б-р им. акад. Л.С. Барбараша, д. 6; ORCID iD 0000-0002-0963-4793.
Барбараш Ольга Леонидовна — академик РАН, директор НИИ КПССЗ; 650002, Россия, г. Кемерово, б-р им. акад. Л.С. Барбараша, д. 6; ORCID iD 0000-0002-4642-3610.
Контактная информация: Щеглова Анна Викторовна, e-mail: nura.karpovitch@yandex.ru.
Прозрачность финансовой деятельности: исследование проведено при поддержке Российской Федерации в лице Министерства науки и высшего образования РФ в рамках Соглашения о предоставлении из федерального бюджета
грантов в форме субсидий от 30.09. 2022 № 075-15-2022-1202, комплексной научно-технической программы полного инновационного цикла «Разработка и внедрение комплекса технологий в областях разведки и добычи твердых полезных ископаемых, обеспечения промышленной безопасности, биоремедиации, создания новых продуктов глубокой переработки из угольного сырья при последовательном снижении экологической нагрузки на окружающую среду и рисков для жизни населения» (утвержденной распоряжением Правительства Российской Федерации от 11.05.2022 № 1144-р).
Конфликт интересов отсутствует.
Статья поступила 08.07.2024.
Поступила после рецензирования 31.07.2024.
Принята в печать 23.08.2024.
About the authors:
Anna V. Shcheglova — C. Sc. (Med.), Senior Researcher at the Laboratory of Comorbidity in Cardiovascular Diseases of the Department of Clinical Cardiology, Research Institute of Complex Problems of Cardiovascular Diseases; 6, Boulevard named after academician L.S. Barbarash, Kemerovo, 650002, Russian Federation; ORCID iD 0000-0002-4108-164X.
Alexey N. Sumin — Dr. Sc. (Med.), Head of the Laboratory of Comorbidity in Cardiovascular Diseases of the Department of Clinical Cardiology, Research Institute of Complex Problems of Cardiovascular Diseases; 6, Boulevard named after
academician L.S. Barbarash, Kemerovo, 650002, Russian Federation; ORCID iD 0000-0002-0963-4793.
Olga L. Barbarash — Academician of the Russian Academy of Sciences, Director of the Research Institute of Complex Problems of Cardiovascular Diseases; 6, Boulevard named after academician L.S. Barbarash, Kemerovo, 650002, Russian Federation; ORCID iD 0000-0002-4642-3610.
Contact information: Anna V. Shcheglova, e-mail: nura.karpovitch@yandex.ru.
Financial Disclosure: the study was supported by the Agreement on the provision of grants from the federal budget in the form of subsidies dated 30.09.2022 No. 075-15-2022-1202 on a comprehensive scientific and technical program of the full innovation cycle «Development and implementation of a set of technologies in the areas of exploration and production of solid minerals, industrial safety, bioremediation, creation of new deep processing products from coal raw materials while consistently reducing the environmental burden on the environment and risks to the lives of the population» (approved by the order of the Government of the Russian Federation dated May 11, 2022 No. 1144-r) of the Russian Federation represented by the Ministry of Science and Higher Education of the Russian Federation.
There is no conflict of interest.
Received 08.07.2024.
Revised 31.07.2024.
Accepted 23.08.2024.
1Заявление о выдаче патента Российской Федерации на изобретение. Регистрационный № 2022121862 от 11.08.2022. (Электронный ресурс.) URL: https://patents.google.com/patent/RU2796752C1/ru (Stelari Start — тов.знак № 910488). (дата обращения: 15.06.2024.)
2https://stelari-start.com/
Информация с rmj.ru






