Содержание статьи
Диабетическая стопа: современные принципы комплексного
лечения
О. В. Галимов, доктор медицинских наук, профессор
В. О. Ханов, доктор медицинских наук, профессор
Р. Р. Сайфуллин
Т. Р. Ибрагимов
Г. Р. Валиева
В. П. Окроян
ГБОУ ВПО БГМУ МЗ РФ, Уфа
Синдром диабетической стопы (СДС) является одной из важнейших проблем,
требующих качественного подхода в лечении, как медикаментозного, так и
хирургического. Согласно официальным статистическим данным, в России в 2011 г.
зарегистрировано 3,27 млн больных сахарным диабетом [1, 2]. Однако реальная
численность в 3–4 раза превышает зарегистрированную, достигая 10 млн человек [3,
4].
Заболеваемость и смертность больных сахарным диабетом от сердечно-сосудистых
заболеваний в 5 раз выше, поражение магистральных артерий нижних конечностей в
3–5 раз чаще, а частота критической ишемии в 5 раз выше, чем в остальной
популяции. Сахарный диабет — полиэтиологическое заболевание, и факторы,
способствующие развитию его осложнений, требуют вовлечения всех современных
профилактических, диагностических и лечебных возможностей [5, 6].
Пациенты и методы исследования
Нами проведен анализ результатов лечения 201 пациента с нейроишемической
формой СДС, разделенных на две группы: основная (n = 69), пациентам которой
проводился комплекс лечебных мероприятий, включающий ангиографию с чрескожной
транслюминальной баллонной ангиопластикой и стентированием артерий, применение
комбинированных перевязочных материалов и использование ортопедических изделий
для разгрузки стопы; и контрольная, где осуществлялся ретроспективный анализ
лечения 132 пациентов, которым проводились стандартная терапия с использованием
медикаментозных средств для компенсации углеводного обмена, выполнение
некрэктомии и наложение марлевых повязок с водорастворимыми мазями.
Среди исследуемых пациентов было 158 (78,6%) женщин и 43 (21,4%) мужчины.
Возраст больных был от 43 до 74 лет, а средний возраст составил 62,5 ± 11,2
года. Группы были сопоставимы по полу и возрасту. В экстренном порядке в
отделение доставлено 63 (31,3%) пациента, в плановом — 138 (68,7%). Время от
начала проявлений заболевания до поступления в стационар составило от 1 до 3
месяцев (в среднем 38,4 ± 17,1 дня). Сахарный диабет на момент госпитализации
был компенсирован у 17 (8,5%) пациентов (уровень гликемии 9–11 ммоль/л),
субкомпенсирован у 21 (10,4%) и декомпенсирован у 163 (81,1%). Следует отметить,
что длительность заболевания при нейроишемической форме в 119 (59,2%) случаях
была более 10 лет. Чаще всего трофические язвы приходились на возраст 50–59 и
60–69 лет — 24,4% и 40,3% случаев соответственно, величина лодыжечно-плечевого
индекса не превышала 0,6, также у подавляющего большинства наблюдалась
диабетическая сенсомоторная полинейропатия со снижением болевой
чувствительности.
Пациенты, вошедшие в исследование, имели следующие сопутствующие заболевания:
гипертоническая болезнь (80,1%), ишемическая болезнь сердца (66,7%), ретинопатия
(41,8%), цереброваскулярные заболевания (30,3%), инфаркт миокарда в анамнезе
(21,9%), хроническая почечная недостаточность (14,4%), нарушение сердечного
ритма (11,9%).
По локализации трофических язв выявлено следующее: при сохранной пульсации на
задней большеберцовой артерии и артерии тыла стопы в основном локализация язв
соответствует местам наибольшего давления на подошвенной поверхности, а на
наиболее дистальных участках стопы при ослабленной пульсации или ее отсутствии
(табл. 1).
Глубина и степень инфицирования язв по Вагнеру (Wagner) в большинстве случаев
соответствовала 2–3 степени (табл. 2). Степень язв по Вагнеру коррелировала с
частотой язв в анамнезе (r = 0,68, р < 0,001), длительностью и размерами
язвенного дефекта (r = 0,47 и r = 0,39 соответственно, р < 0,01).
Бактериологическое исследование материала из инфицированных язв показало, что
основными возбудителями инфекционного процесса у больных обеих групп являлись
стафилококки — 65,2% пациентов, реже — грамотрицательные микроорганизмы.
Высевались стафилококки, стрептококки и другие микроорганизмы, как в
монокультуре, так и в ассоциации.
Для оперативного восстановления магистрального кровотока главным критерием
отбора считали наличие критической ишемии конечности с поражением тканей стопы
без вовлечения костно-суставного аппарата конечности.
После проведенной ангиографии, из 69 пациентов с язвенно-некротическими
поражениями стоп и критической ишемией условия для реваскуляризации были
выявлены у 65 пациентов (94,2%). У остальных 4 пациентов (5,8%) условий для
реваскуляризации не выявлено и лечение заключалось в медикаментозной терапии,
что уменьшало шансы сохранения конечности и предотвращения высокой ампутации.
В случае флегмоны стопы ее дренирование и резекционные операции на стопе
выполнялись до реваскуляризации. В случае сухого некротического процесса на
стопе без риска развития флегмоны вначале выполнялась реваскуляризирующие, а
затем резекционные операции на стопе.
Консервативное лечение пациентов с СДС включало: препараты α-липоевой
кислоты, витамины группы В, антиоксиданты, инфузии солевых растворов,
анальгетики, по показаниям — сердечные и гипотензивные препараты. Дополнительно
назначались лекарственные средства, направленные на улучшение реологических
свойств крови, дезагреганты и антикоагулянты (под контролем глазного дна каждые
10 дней). Использовали также препарат Актовегин, рекомендуемый в стандартах
лечения пациентов с диабетической полинейропатией от 28 декабря 2012 г. № 1577н
«Об утверждении стандарта первичной медико-санитарной помощи при диабетической
полиневропатии». Актовегин использовался в дозировках 1000–2000 мг в/в капельно
в течение 10–14 дней, далее по 1–2 таблетке 3 раза в день 1–2 месяца.
Применялась иммуномодулирующая терапия с использованием препарата Ликопид.
Первичные хирургические обработки ран были выполнены 13 (18,8%) пациентам,
поступившим в экстренном порядке, в течение первых суток. При появлении
признаков инфицирования назначался антибиотик широкого спектра действия, чаще
всего цефалоспоринового ряда. Далее антибиотикотерапия осуществлялась с учетом
антибиотикограммы.
Лечение 6 (8,7%) пациентов проводилось без антибиотикотерапии, так как не
было признаков инфицирования и имелись отрицательные результаты
бактериологического исследования. Для поддержания уровня гликемии в пределах
6,0–9,0 ммоль/л натощак и 9–10 ммоль/л через 2 часа после еды, больных
переводили на дробное введение инсулина короткого действия. При тяжелых случаях
проводили комбинированное введение инсулина (внутривенно и подкожно) под
контролем уровня гликемии. Коррекция схемы гипогликемической терапии
потребовалось 63 (91,3%) больным.
После некрэктомии в первой фазе раневого процесса использовали обработку
такими антисептиками, как йодовидон, диоксидин, хлоргексидин, мирамистин.
Перекись водорода использовалась лишь при значительном количестве отделяемого.
При наличии большого количества некротических масс первые сутки использовали
повязки с протеолитическими ферментами: трипсином, химотрипсином, мазью Ируксол
с наложением современных сорбирующих повязок. Во второй фазе раневого процесса
использовались комбинированные гидрофильные повязки, а также разработанный в
клинике «Способ лечения длительно незаживающих ран, послеоперационных ран и
рубцовой ткани» (положительное решение на заявку на изобретение РФ).
Данный способ лечения осуществляется следующим образом: проводят обработку
поверхности раны, затем наносят гель по всей площади дефекта кожи. В его состав
входит: действующее вещество — ксимедон (гидроксиэтилдиметилдигидропиримидин),
гелеобразователь — каррагинан, стабилизатор — аубазидан и консервант — экстракт
грейпфрутовых косточек. Данные компоненты разрешены для медицинского применения.
После этого с помощью ультразвукового электрода производится облучение области
раны по лабильной методике работы в импульсном режиме 4 мс, при частоте 830 кГц,
интенсивности 0,3–0,7 Вт/см2. Меняя мощность ультразвуковой волны, воздействуем
на структуры ткани на различной глубине. Продолжительность процедуры составляет
от 10 до 25 минут, а курс лечения 8–12 процедур. Предлагаемый способ прошел
апробацию в Клинике БГМУ, отмечено положительное терапевтическое действие.
Отрицательных побочных явлений не наблюдалось.
Показаниями для баллонной ангиопластики и стентирования передней
большеберцовой артерии считали стенозы 60% и более. Баллонная ангиопластика
предшествовала имплантации стента в 2 (2,9%) случаях, когда стеноз достигал 80%
и более. Прямое стентирование было выполнено в 7 (10,1%) случаях. Антеградный
доступ при выполнении эндоваскулярных вмешательств на подколенной артерии
использовался в 5 (7,2%) случаях. Баллонная ангиопластика выполнена 13 (18,8%)
пациентам. В 8 (11,6%) случаях баллонная ангиопластика была дополнена
стентированием и в 1 (1,4%) выполнено прямое стентирование.
Исключительно баллонная ангиопластика была проведена в 15 (21,7%) случаях.
При выявлении диссекции интимы 4 (5,8%) пациентам проведено стентирование с
использованием коронарных стентов.
При технической невозможности выполнения рентгенэндоваскулярных вмешательств
выполнены открытые реваскуляризирующие вмешательства. Структура вмешательств
представлена в табл. 3.
Важную роль в лечении диабетической стопы и заживлении раневого дефекта
играет разгрузка пораженной конечности. Силиконовые ортопедические стельки
применялись у 13 (18,8%) пациентов во вторую и третью фазу раневого процесса, 11
из них констатировали уменьшение болей при ходьбе; ортопедическая обувь
использовалась у 17 (24,6%) больных, усиление болей отмечалось у 4 из 17
человек, уменьшение у 6, остальные же не отметили разницы по сравнению с обычной
обувью.
Результаты и обсуждение
Положительная динамика течения раневого процесса в раннем послеоперационном
периоде сопровождалась повышением ТсрО2 до значений 35–40 мм рт. ст.
Использование реваскуляризирующих методик позволило достичь заживления раневого
дефекта после однократной некрэктомии в 25 (43,1%) случаях, в то время как в
контрольной группе этот показатель составил 21 (15,9%).
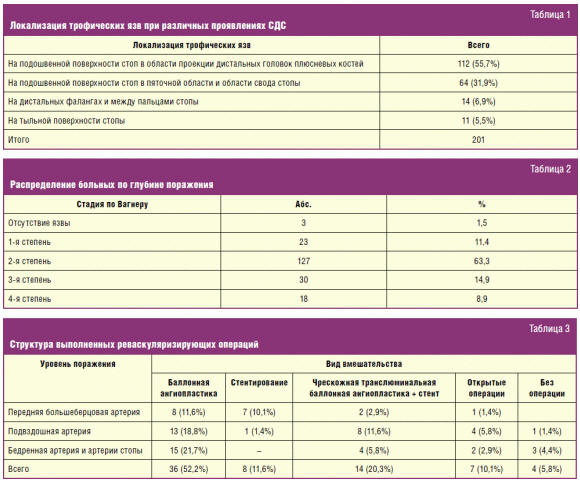
С высокой долей достоверности (р < 0,001) выявлены различия между количеством сохраненных конечностей после реваскуляризации в контрольной и основной группах. При этом достоверных различий между количеством сохраненных конечностей без реваскуляризации не выявлено (р = 0,502) (рис. 1). За изучаемый период в стационаре умерло 3 (2,3%) пациента контрольной группы и 1 (1,4%) пациент основной. Всем четверым были выполнены высокие ампутации нижней конечности.
Применение современных комбинированных коллагеновых покрытий,
реваскуляризации конечности и разгрузки стопы в период реабилитации позволило
достоверно уменьшить число больных основной группы, перенесших ампутацию нижней
конечности на уровне бедра (х = 6,186; р = 0,013). Достоверно увеличилось число
больных, которым для достижения заживления раны стопы потребовалось проведение
одной некрэктомии (х = 19,038; р < 0,001). Соответственно меньшим оказалось
число больных, которым выполнили несколько этапных операций (х = 5,153; р =
0,023). Таким образом, это позволило уменьшить сроки лечения в среднем на 13,8 ±
2,2 суток.
В отдаленном периоде (от 6 мес до 2 лет) результаты оценены у 51 (73,9%)
больного основной группы и у 59 (44,7%) контрольной. После выписки из стационара
отмечено, что у пациентов, использовавших разгрузку стопы и ортопедические
стельки, рецидивы трофических язв были у 2 (3,9%) больных, а у тех, кто не
следовал рекомендациям по уходу за стопой, рецидивы отмечены у 7 (13,7%)
человек.
В течение года после рентгенэндоваскулярных вмешательств отсутствие рецидива
ишемии нижних конечностей отмечено у 33 (64,7%) больных. Полная проходимость
восстановленного сегмента артериального русла была сохранена у 29 (56,9%)
больных.
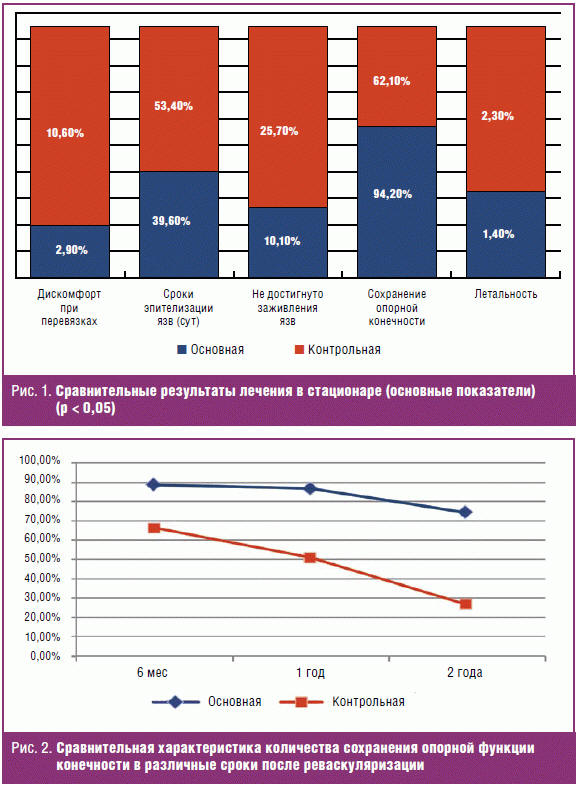
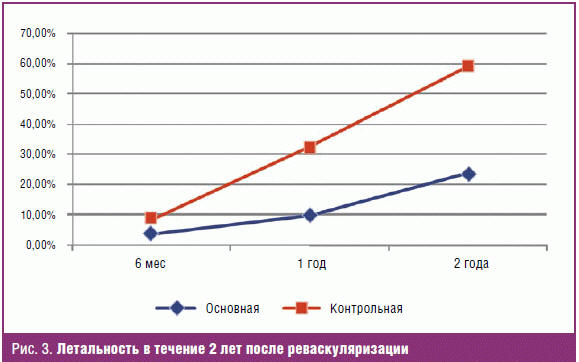
Динамика сохранения опорной функции конечности и летальности на протяжении
последующих двух лет после реваскуляризации представлена на рис. 2 и 3.
Выводы
- Предложенный комплексный подход с применением современных комбинированных
коллагеновых покрытий, реваскуляризации конечности и разгрузки стопы в период
реабилитации позволил уменьшить сроки пребывания в стационаре. - При соблюдении пациентами необходимых рекомендаций данный метод позволяет
избежать развития рецидива критической ишемии в отдаленные сроки, способствует
повышению выживаемости пациентов в ближайшие 2 года, улучшает качество жизни. - Баллонная ангиопластика зарекомендовала себя как эффективный способ
лечения критической ишемии нижних конечностей. Данная методика является подчас
единственным способом сохранения конечности.
Литература
-
Галимов О. В., Ханов В. О., Иванов А. В. и др. Комплексный подход
в терапии больных с синдромом диабетической стопы // Хирург. 2014, № 3, с.
80–85. -
Morbach S., Furchert H., Gröblinghof et al. Long-Term Prognosis
Of Diabetic Foot Patients And Their Limbs: Amputation And Death Over The
Course Of A Decade // Diabetes Care. 2012; 35 (10): 2021–2027. -
Гавриленко А. В., Котов А. Э., Лоиков Д. А. Результаты лечения
критической ишемии нижних конечностей у больных сахарным диабетом // Анналы
хирургии. 2013, № 6, с. 48. -
Шумков О. А., Любарский М. С., Алтухов И. А. и др. Реализация
мультидисциплинарного подхода к лечению синдрома диабетической стопы: роль
ангиохирурга // Хирургия. Журнал им. Н. И. Пирогова. 2013, № 11, с. 9–15. -
Князевская Е. Э., Яхина В. В. Эндоваскулярные технологии в
лечении больных с нейроишемической формой синдрома диабетической стопы //
Бюллетень медицинских интернет-конференций. 2014, № 4, с. 4. -
Удовиченко О. В., Коротков И. Н., Герасименко О. А. Доступность и
эффективность реваскуляризирующих вмешательств у амбулаторных больных с
нейроишемической формой синдрома диабетической стопы // Эндокринная хирургия.
2011, № 2, с. 39–48.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru



