Содержание статьи
Введение
Сахарный диабет (СД) является хроническим прогрессирующим заболеванием и ярким примером междисциплинарной проблемы. Заболевание характеризуется широкой палитрой разнообразных патологических процессов в системах и органах в результате нарушения метаболизма, обусловленного гипергликемией. У пациента с СД 2 типа увеличен риск развития сопутствующих заболеваний, поскольку его организм более восприимчив к воздействию разнообразных патогенных факторов, а течение самих болезней — более тяжелое, с менее благоприятными исходами. В частности, продемонстрирована связь СД 2 типа и риска развития новой коронавирусной инфекции (COVID-19), отличающейся более тяжелым течением и увеличением числа летальных исходов [1].
Распространенность СД в популяции достигает 10%, значительно увеличиваясь с возрастом [2], а учет нарушений углеводного обмена, или состояния предиабета, в 5 раз превышает представленность СД, способствуя дальнейшему росту заболеваемости [3]. Согласно результатам проведенного в РФ исследования NATION более половины пациентов с СД 2 типа не знают о наличии болезни [3]. В 2019 г. установленный диагноз «сахарный диабет 2 типа» имело 463 млн пациентов [4], при этом, согласно прогнозам экспертов Международной диабетической ассоциации (International Diabetic Federation, IDF), их число к 2040 г. достигнет 642 млн [5].
Диабетическая невропатия
Диабетическая невропатия представляет собой комплекс полиморфных клинических и субклинических синдромов, характеризующихся диффузным или очаговым поражением волокон периферической и/или автономной нервной системы в результате метаболических, сосудистых и других нарушений, сопутствующих СД. Диабетическая невропатия имеет характерные проявления и течение [6]. Диабетическая невропатия наряду с нефропатией и ретинопатией представляет собой одно из наиболее значимых осложнений диабета, которое приводит к нарушению трудоспособности, выраженной дезадаптации, ранней инвалидизации и смерти этих пациентов. В ряде исследований показано [2, 6, 7], что в зависимости от используемых у пациентов с СД критериев диагностики и методологии обследования частота диабетических невропатий варьирует в широких пределах — от 25% до 90%, причем эти показатели существенно возрастают по мере увеличения длительности и степени тяжести заболевания, возраста и выраженности гипергликемии у пациентов с СД 1 и 2 типа. Нередко диабетическая невропатия развивается за несколько лет до клинической манифестации СД, и на момент установления этого диагноза разнообразные проявления поражения нервной системы наблюдаются уже у четверти пациентов.
Сахарный диабет приводит к развитию широкого спектра поражений периферической нервной системы (табл. 1), среди которых самым частым вариантом является дистальная симметричная сенсомоторная полиневропатия, распространенность которой во всем мире, согласно оценке экспертов ассоциации IDF, уже в 2015 г. достигала 30–40 млн человек [5]. Ее характерными клиническими особенностями являются чувствительные, вегетативно-трофические и двигательные нарушения, главным образом в нижних конечностях, причем именно сенсорные расстройства в виде невропатической боли, онемения и разнообразных парестезий являются доминирующими. Это связано с более ранним поражением тонких миелинизированных и немиелинизированных волокон, преимущественно аксональным поражением и значительно более поздним и менее выраженным поражением крупных миелинизированных волокон [7, 8]. Выраженность сенсорных расстройств может быть как минимальной (обнаруживаться лишь при дополнительном обследовании больных), так и достигать степени тяжелых нарушений, сочетающихся с двигательным дефицитом. Наблюдаются как безболевой вариант с минимальной клинической симптоматикой и постепенным развитием сенсомоторного дефицита, так и болевая форма диабетической невропатии, нередко сочетающаяся с дисфункцией вегетативной нервной системы, течение которой может быть острым или хроническим, с чередованием периодов ремиссии и обострений. Как правило, диабетическая невропатия отражает длительность, тяжесть СД и выраженность имеющейся у пациента гипергликемии, вместе с тем она может быть и первым проявлением скрыто протекающего заболевания или наблюдаться даже при легкой гипергликемии [8].
![Таблица 1. Классификация диабетических невропатий [с изм., 8] Таблица 1. Классификация диабетических невропатий [с изм., 8]](https://medblog.su/wp-content/uploads/2022/04/diabeticheskaya-nevropatiya-mezhdistsiplinarnaya-problema-v-klinicheskoj-praktike-ekusheva-e-v.png)
Как и сам СД, диабетическая невропатия достаточна разнообразна в своих клинических проявлениях, зависящих у каждого конкретного пациента от того, какие периферические волокна поражаются в большей степени (табл. 2), при этом чаще всего наблюдается смешанный вариант с вовлечением в разной степени выраженности толстых миелинизированных А-дельта волокон и тонких немиелинизированных С-волокон [7]. Следует отметить, что мозаичность поражения периферических нервов в дебюте диабетической невропатии с преобладанием некоторых из них нередко ошибочно трактуется как мононевропатия. При клинической диагностике необходимо проанализировать, какие симптомы наблюдаются (двигательные, чувствительные или вегетативные); какой клинический паттерн («рисунок») у исследуемого пациента (дистальные/проксимальные, симметричные/асимметричные нарушения, в верхних и/или нижних конечностях), как быстро развивались данные расстройства.
![Таблица 2. Особенности некоторых форм диабетической полиневропатии [с изм., 7–10] Таблица 2. Особенности некоторых форм диабетической полиневропатии [с изм., 7–10]](https://medblog.su/wp-content/uploads/2022/04/1649494473_643_diabeticheskaya-nevropatiya-mezhdistsiplinarnaya-problema-v-klinicheskoj-praktike-ekusheva-e-v.png)
Отдельного внимания заслуживает диабетическая автономная (вегетативная) невропатия (ДАН), связанная с поражением периферического и/или центрального отделов вегетативной нервной системы, поскольку ее наличие значимо влияет на течение СД и структуру смертности при этом заболевании. Частота развития ДАН достигает 40%, прогрессивно увеличиваясь до 65% у пациентов с возрастом, при плохом гликемическом контроле и наличии СД более 10 лет [9]. Это осложнение относится к числу наименее изученных и редко диагностируемых при СД, несмотря на весомую представленность ДАН (при СД 1 типа — у 25% пациентов, при СД 2 типа — у 34% пациентов), существенное негативное влияние на качество их жизни и степень дезадаптации [10]. В частности, кардиальная автономная невропатия играет ключевую роль в клинике и прогнозе заболевания как важнейший неблагоприятный фактор развития СД, особенно у пациентов пожилого возраста [11, 12]. ДАН может протекать субклинически или проявляться широким спектром полиморфных симптомов с изолированным нарушением функции отдельных органов и систем, а также встречаться в различных сочетаниях в практике врачей многих специальностей.
Среди ведущих патогенетических механизмов развития диабетической невропатии выделяют: микроангиопатию, приводящую к эндотелиальной дисфункции и ишемическому повреждению нервных волокон, метаболические расстройства в нейрональных и шванновских клетках на фоне дефицита миоинозитола и накопления нейротоксичного сорбитола [6] и митохондриальную дисфункцию с последующим развитием необратимых повреждений нейронов [8]. Другими механизмами патологического процесса являются оксидативный стресс, гипертриглицеридемия, а также генетические и иммунные факторы, которые могут сочетаться друг с другом [6, 7].
Каждому пациенту с СД, независимо от наличия характерных жалоб, необходимо ежегодно проводить диагностический скрининг диабетической невропатии, включающий анализ анамнестических данных, полноценный неврологический осмотр с тестированием болевой, вибрационной и температурной чувствительности с помощью камертона с частотой 128 Гц и монофиламента массой 10 г, а также с осмотром стоп, поскольку раннее выявление и своевременная адекватная терапия позволят уменьшить риск тяжелых осложнений. Тщательное лабораторное обследование является важным этапом ведения больных с СД и позволяет динамически наблюдать за уровнем глюкозы в крови и исключать иные дисметаболические или токсические состояния или заболевания, своевременное выявление и коррекция которых могут привести к существенному регрессу или значительному уменьшению выраженности поражения периферической нервной системы.
С целью выявления вегетативной недостаточности, в том числе субклинической, применяют 5 тестов для диагностики патологии сердечно-сосудистой системы (для исследования, в частности кардиоваскулярных рефлексов) [13]. Это тесты Вальсальвы, Шеллонга (ортостатическая проба), проба с изометрической нагрузкой, «30:15» и изменение частоты сердечных сокращений при глубоком медленном дыхании (6 раз в 1 мин). Использование данных тестов в клинической практике считается достаточным для обнаружения раннего субклинического вегетативного поражения. Они предложены как стандарт для диагностики ДАН.
Подходы к терапии диабетической невропатии
Стратегические направления терапии пациентов с СД заключаются в лечении основного заболевания, включая строгий гликемический контроль, а также коморбидных заболеваний, коррекции имеющихся факторов риска и соблюдении поведенческих рекомендаций; применении лекарственных средств, влияющих на различные звенья патогенеза, при необходимости — симптоматической терапии [14–16].
В настоящее время не существует лекарственных средств или методов терапии, которые могли бы предотвратить развитие диабетической невропатии. При этом основным условием стабилизации и регресса проявлений поражения периферической нервной системы является нормализация уровня сахара в крови, при этом показатель гликированного гемоглобина (HbA1c) должен быть менее 7% [3]. В частности, в широкомасштабном исследовании UKPDS (United Kingdom Prospective Diabetes Study — Британское проспективное исследование сахарного диабета) с участием более 5 тыс. больных СД 2 типа, уровень глюкозы которых поддерживался на уровне ниже 6 ммоль/л, было показано, что частота развития диабетической невропатии к концу 9-го года исследования была на 16% ниже, к концу 15-го года — на 40% ниже, чем в группе пациентов с уровнем глюкозы на более высоком уровне (≤15 ммоль/л) [17]. Особенно важно в этой связи выявлять пациентов с предиабетом и поражением нервных волокон, поскольку ранняя коррекция может быть наиболее эффективной для данной группы больных.
Важным патогенетическим направлением терапии диабетической невропатии является восстановление функциональной активности и анатомической целостности нервного волокна, что напрямую влияет на улучшение проведения нервного импульса, снижая таким образом выраженность симптомов и предотвращая прогрессирование невропатии. Среди препаратов, воздействующих на основные звенья патогенеза диабетической невропатии, тиоктовая, или α-липоевая, кислота является единственным лекарственным средством с подтвержденной эффективностью в многочисленных экспериментальных и клинических рандомизированных плацебо-контролируемых исследованиях с уровнем рекомендаций класса А [18–25]. Крайне важно начинать применение тиоктовой кислоты у пациентов с СД как можно раньше, что позволит уменьшить выраженность основных симптомов заболевания и замедлить прогрессирование поражения периферических нервов.
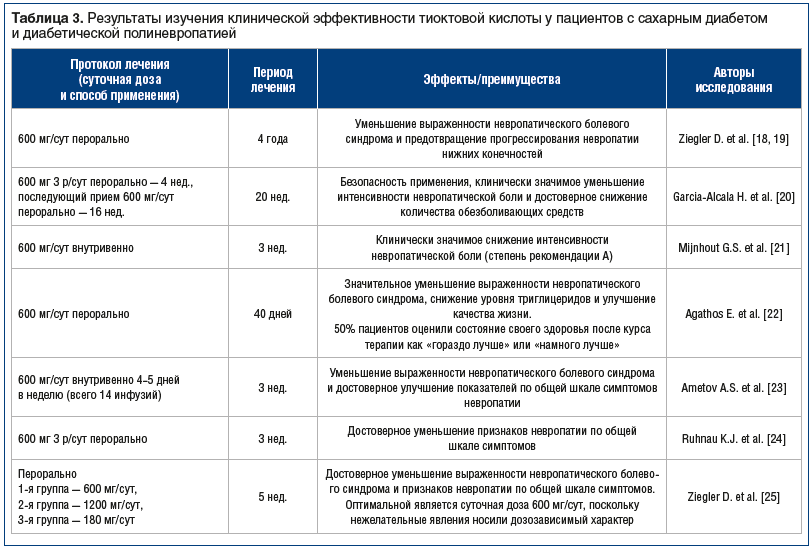
Известно, что тиоктовая кислота является мощным эндогенным антиоксидантом и кофактором важнейших митохондриальных ферментных комплексов, участвующих в процессах окислительного метаболизма нормально функционирующей клетки [7, 26]. В настоящее время убедительно показан большой спектр мультимодальных механизмов влияния тиоктовой кислоты: прямое влияние на метаболизм глюкозы и липидов (посредством активации переносчиков глюкозы типа 1 и 4 в инсулинозависимых тканях фосфорилирование тирозиновых остатков инсулиновых рецепторов); антиоксидантное действие (элиминация и снижение продукции свободных радикалов, регенерация эндогенных антиоксидантов — глутатиона, витаминов Е и С); метаболический эффект (кофермент комплексов окислительного декарбоксилирования пировиноградной и α-кетокислот, активация пируватдегидрогеназы и подавление пируваткарбоксилазы, участие в энергообразовании); влияние на эндотелиальную дисфункцию (ингибирование процессов экспрессии молекул межклеточной адгезии, сосудистого эндотелия и адгезии моноцитов к эндотелиоцитам интимы, блокирование активации и поступления в ядро клеток эндотелия NF-kB), а также противовоспалительное действие (снижение уровня интерлейкинов 6 и 17, пролиферации Т-клеток и подавление активности естественных киллеров) [27–29]. Метаанализы результатов рандомизированных двойных слепых плацебо-контролируемых исследований (ALADIN I, II, III, ORРIL, QUALITY, SYDNEY, SYDNEY2, NATHAN I и II и др.), проведенных в Европе и США, убедительно продемонстрировали клиническую эффективность и патогенетическое действие тиоктовой кислоты при диабетической полиневропатии в виде существенного уменьшения выраженности неврологического дефицита и значимого улучшения результатов электрофизиологического исследования [18–20, 23, 25, 26, 30–35]. Согласно проведенному метаанализу рандомизированных клинических исследований [21] внутривенное применение тиоктовой кислоты в дозе 600 мг/сут в течение 3 нед. приводит к существенному уменьшению интенсивности невропатической боли, что позволяет рекомендовать ее как монотерапию у пациентов с диабетической невропатией при интенсивности боли до 3 баллов по визуальной аналоговой шкале. Кроме того, результаты исследования NATHAN I [18] продемонстрировали возможность замедления прогрессирования патологического процесса при диабетической невропатии при длительном пероральном приеме тиоктовой кислоты, что крайне важно для этой категории пациентов.
Важно отметить терапевтическую эффективность тиоктовой кислоты при лечении кардиальной автономной нев-ропатии, показанную в исследованиях ALADIN и DECAN, а результаты исследования QUALITY продемонстрировали, что данное лекарственное средство способно потенцировать эффект ингибиторов ангиотензинпревращающего фермента, улучшать функцию эндотелия и уменьшать протеинурию [19, 32, 35, 36]. Важно заметить, что оптимальной терапевтической, клинически эффективной и безопасной суточной дозой тиоктовой кислоты являются 600 мг при парентеральном и пероральном приеме, причем внутривенное применение этого лекарственного средства на протяжении 2 нед. и более приводит к существенному уменьшению неврологического дефицита у пациентов с СД (табл. 3).
Среди препаратов тиоктовой кислоты можно выделить представленные на российском рынке препараты Тиогамма®: таблетки, покрытые пленочной оболочкой, 600 мг, и раствор для инфузий 12 мг/мл во флаконах по 50 мл (активное вещество — меглуминовая соль тиоктовой кислоты 1167,70 мг, что эквивалентно 600 мг тиоктовой кислоты). Наличие различных лекарственных форм позволяет подобрать каждому пациенту оптимальный протокол терапии. Рекомендуемая схема лечения: тиоктовая кислота600 мг внутривенно капельно ежедневно в течение 2–4 нед. с последующим пероральным приемом препарата в дозе 600 мг ежедневно (1 р/сут натощак, желательно утром) на протяжении не менее 2 мес. Длительность курса терапии выбирается индивидуально, в зависимости от тяжести клинических проявлений заболевания у пациента и эффективности стартовой терапии. Регулярные курсы патогенетической терапии с применением препаратов Тиогамма® (не менее 2 раз в год) являются важной стратегией при ведении этой категории пациентов, учитывая хронический характер основного патологического процесса.
Симптоматическая терапия при диабетической невропатии включает в себя лекарственные средства, которые уменьшают выраженность болевого синдрома, что позволяет восстановить или улучшить функционирование больного и качество его жизни, однако данные препараты не замедляют процесс повреждения периферических волокон. Среди средств симптоматической терапии с доказанной эффективностью наиболее эффективными (с наилучшим соотношением безопасности и переносимости) являются антиконвульсанты — модуляторы кальциевых каналов (габапентиноиды): габапентин и прегабалин и антидепрессанты из группы ингибиторов обратного захвата серотонина и норадреналина: дулоксетин и венлафаксин [8, 9]. Как правило, полное купирование болевого синдрома не всегда достижимо, и хорошим результатом лечения является уменьшение выраженности боли на 50%. Вместе с тем выбор любого лекарственного средства должен быть основан не только на его доказанной эффективности, но и на переносимости препарата с учетом профиля и возраста пациента, наличия сопутствующих заболеваний и приема иной терапии, как и имеющегося предшествующего опыта применения тиоктовой кислоты.
Клиническое наблюдение
Пациент Т., 63 года, обратился с жалобами на нарушение сна, жжение и онемение в стопах, неустойчивость при ходьбе и общую слабость. Из анамнеза известно, что Т. болеет СД 2 типа в течение 16 лет, регулярно принимал метформин (2000 мг/сут), последние 2 года получает инсулинотерапию. У пациента ожирение 1-й степени и артериальная гипертензия 3-й степени, II стадии, риск сердечно-сосудистых осложнений 4-й степени.
При неврологическом осмотре: умеренно выраженные явления орального автоматизма (Маринеску — Радовичи, хоботковый), сухожильные и периостальные рефлексы на руках и коленные рефлексы снижены с обеих сторон, ахилловы рефлексы отсутствуют, парез разгибателей стопы до 4 баллов. Снижение болевой и температурной чувствительности до середины голени с обеих сторон, снижение вибрационной чувствительности (до 3–4 баллов). Легкая постуральная неустойчивость, затруднение при выполнении тандемной ходьбы.
Данные дополнительных методов исследования: биохимический анализ крови: повышение показателей триглицеридов до 2,68 ммоль/л (норма — до 1,7 ммоль/л), ЛПНП до 6,69 ммоль/л (норма — до 2,6 ммоль/л) и общего холестерина до 9,6 ммоль/л (норма — до 6,2 ммоль/л). Другие исследования (клинические анализы крови и мочи, гликированный гемоглобин, коагулограмма, гормоны щитовидной железы) — значимой патологии не выявлено. Регулярное измерение артериального давления выявило колебание показателей от 150/95 до 175/105 мм рт. ст. Электронейромиография: признаки сенсомоторного аксонального поражения длинных нервов нижних конечностей. Магнитно-резонансная томография головного мозга (1,5 Тл): расширение субарахноидальных пространств, более выраженное в теменно-височных областях, перивентрикулярный лейкоареоз, мелкие очаги повышенного МР-сигнала на Т2 и Flair МР-изображениях без признаков перифокального отека. Ультразвуковое исследование брахиоцефальных артерий головного мозга: признаки атеросклероза в виде гемодинамически незначимых атеросклеротических бляшек.
Таким образом, у пациента Т. имелись осложнения СД: дистальная сенсомоторная диабетическая полиневропатия, артериальная гипертензия, ожирение, атеросклероз и гиперлипидемия IIb.
Было рекомендовано:
соблюдение поведенческих рекомендаций: регулярная умеренная физическая нагрузка, диета с пониженным содержанием животных жиров, поваренной соли, легко усваиваемых углеводов и увеличенным потреблением клетчатки;
регулярный прием сахароснижающей, антигипертензивной терапии и лекарственных средств из группы статинов по рекомендованной схеме;
тиоктовая кислота 600 мг внутривенно капельно ежедневно в течение 2 нед. с последующим пероральным приемом тиоктовой кислоты 600 мг утром натощак на протяжении 2 мес.
При повторной консультации через 2 мес. у пациента Т. отмечался отчетливый клинический эффект в виде улучшения общего состояния, отсутствия пошатывания при ходьбе. Жжение и онемение в стопах возникают гораздо реже, улучшился сон. В целом чувствует себя активнее, меньше утомляется, несмотря на насыщенный рабочий график. Повторные лабораторные и инструментальные исследования подтвердили достижение целевых показателей и нормализацию уровня артериального давления в течение суток, липидограммы (общего холестерина и липопротеинов низкой плотности). Таким образом, последовательный и регулярный прием сахароснижающей, антигипертензивной, гиполипидемической терапии вместе с тиоктовой кислотой, обладающей доказанным патогенетически обоснованным влиянием, продемонстрировал достаточно быстро высокую эффективность и улучшение качества жизни больного Т. Было рекомендовано: соблюдать поведенческие рекомендации, регулярно принимать препараты из группы сахароснижающих и антигипертензивных средств и статинов, продолжить пероральный прием тиоктовой кислоты 600 мг утром натощак на протяжении 2 мес. В дальнейшем показаны регулярные курсы тиоктовой кислоты по аналогичной схеме (парентерально с последующим переходом на пероральное применение препарата) 2 раза в год.
Заключение
Представленное клиническое наблюдение демонстрирует широкие возможности применения тиоктовой кислоты у пациентов с СД и сочетанной коморбидной патологией. В частности, при использовании тиоктовой кислоты наблюдается стабилизация показателей углеводного обмена, она обладает гепатопротективным, гиполипидемическим и гипохолестеринемическим эффектами. Тиоктовая кислота хорошо переносится, частота нежелательных явлений сопоставима с таковой при приеме плацебо, что, безусловно, служит важным стимулом для пациентов с СД при выборе именно этого препарата для лечения диабетической невропатии.
Стремительный рост заболеваемости СД наряду с поздней диагностикой его осложнений, особенно прогностически наиболее неблагоприятных, в частности диабетической невропатии, приводит к ранней дезадаптации, значительному снижению качества жизни и инвалидизации таких пациентов. Своевременная диагностика поражения нервной и вегетативной системы позволяет назначить патогенетическую терапию — тиоктовую кислоту на ранних сроках патологического процесса и тем самым предотвратить тяжелые, часто фатальные осложнения.
Благодарность
Редакция благодарит компанию «Верваг Фарма ГмбХ и Ко. КГ» за оказанную помощь в технической редактуре настоящей публикации.
.
Информация с rmj.ru






