Введение
Острые респираторные инфекции (ОРИ) по-прежнему являются основными в структуре инфекционной патологии у детей. При этом установлено, что наиболее весомый вклад в заболеваемость ОРИ вносят так называемые «часто болеющие дети» (ЧБД). Негативные социальные, педагогические и экономические последствия высокого уровня заболеваемости ОРИ у ЧБД по-прежнему определяют повышенное внимание педиатрического сообщества к данному контингенту1 [1–9].
Часто болеющие дети: трансформация подходов к проблеме
В отечественной педиатрии выделение этих детей в особую группу диспансерного наблюдения (группа ЧБД) было предложено в 80-е годы ХХ столетия [4]. Для этого были разработаны статистические критерии, определяющие у ребенка более высокий, чем у сверстников, уровень заболеваемости ОРИ, что и позволяло отнести его к указанной диспансерной группе [4, 5]. Основной целью диспансерного наблюдения за этими пациентами являлось снижение у них частоты ОРИ за счет проведения оздоровительных мероприятий. Однако на практике это зачастую принимало формальный характер. Кроме того, в связи с предположением, что в основе повышенной восприимчивости детей из группы ЧБД к инфекциям лежат универсальные механизмы, возникло ложное представление о том, что «ЧБД» — это нозологическая форма (!). Более того, понятие «ЧБД» стали ошибочно считать окончательным диагнозом (!), лечение при котором проводилось без учета индивидуальных особенностей состояния здоровья детей и, как правило, по единому трафарету. Так как оздоровительные мероприятия при этом в подавляющем большинстве случаев носили шаблонный характер, их лечебно-профилактическая эффективность была недостаточной. Так, анализ результатов проведенного нами в 1990-е годы обследования 2436 детей дошкольного возраста, направленных на санаторное оздоровление по поводу высокой заболеваемости ОРИ, позволил установить, что у 65,4% пациентов имела место недооценка клинико-анамнестических данных [10]. Все это определило диагностические ошибки в трактовке их состояния здоровья и, как следствие, лежало в основе низкой эффективности проводимых оздоровительных мероприятий. Особое внимание также было обращено на то, что в 37,2% случаев дети направлялись в санаторий с диагнозом «ЧБД» (!). Проведенное же нами обследование этих пациентов позволило верифицировать у них различные заболевания и патологические состояния (рецидивирующий средний отит, аллергический ринит, бронхиальная астма, первичные иммунодефицитные состояния и др.), которые на протяжении ряда лет служили основанием для отнесения их в группу «ЧБД». Кроме того, у 84,5% детей были впервые выявлены сопутствующие заболевания и различные функциональные нарушения (кариес, инфекция мочевыводящих путей, реактивный панкреатит, синдром раздраженного кишечника, гастроэзофагеальный рефлюкс, нарушения сердечного ритма и проводимости и др.). Реализация персонифицированных лечебно-оздоровительных комплексов, включающих базовые мероприятия (рациональный режим дня и питания, лечебная физкультура, вакцинация в соответствии с национальным календарем прививок и др.), адекватную неспецифическую иммунопрофилактику, рациональную терапию основного заболевания и коррекцию сопутствующей патологии, позволила в дальнейшем существенно снизить заболеваемость ОРИ и улучшить в целом состояние здоровья этих детей [10].
Полученные данные определили целесообразность существенного изменения методологических подходов к проблеме ЧБД. Особое внимание при этом было обращено на необходимость широкого обсуждения указанной проблемы на всех уровнях дискуссий педиатрического сообщества (в рамках региональных совещаний и конференций, а также федеральных и международных конгрессов и съездов). В ходе обсуждения удалось выявить наиболее острые вопросы, большинство из которых имели четкое практическое значение и требовали быстрейшего решения. Стала также очевидна необходимость срочного изменения терминологии, критериев включения и, конечно же, подходов к ведению детей с высоким уровнем заболеваемости ОРИ. Кроме того, практикующими врачами были высказаны предложения о том, что для врачей амбулаторного звена (в первую очередь для участковых педиатров и оториноларингологов) целесообразно подготовить и начать реализовывать тематические курсы повышения квалификации, посвященные возрастным особенностям иммунитета у детей, а также иммунодефицитным состояниям. В результате проведенных дискуссий было высказано также пожелание, чтобы ведущие отечественные ученые педиатрических специальностей (педиатры, детские аллергологи-иммунологи, оториноларингологи, пульмонологи) разработали консенсус, в котором для практических врачей на основе последних научных достижений были бы представлены ключевые положения по основным вопросам ведения детей с рекуррентными респираторными инфекциями (РРИ). Активное обсуждение актуальных проблем ЧБД в кругу наиболее авторитетных экспертов педиатрического профиля позволило получить конкретные ответы на наиболее острые вопросы, и в 2002 г. под эгидой Союза педиатров России была подготовлена научно-практическая программа «Острые респираторные заболевания у детей: лечение и профилактика», один из разделов которой был целиком посвящен ЧБД1.
Ключевыми положениями указанной научно-практической программы являлись следующие: 1) ЧБД — это не диагноз; 2) у детей с РРИ на первом этапе необходимо как можно быстрее установить этиологию и провоцирующие факторы, приводящие к повышенной заболеваемости ОРИ, что позволит своевременно провести нозологическую верификацию; 3) диспансерное наблюдение за пациентом с РРИ должно проводиться с учетом основного заболевания и сопутствующей патологии; 4) лечебно-профилактические мероприятия, направленные на снижение респираторной заболеваемости, должны быть персонифицированы; 5) программа оздоровления детей с РРИ должна обязательно включать общеукрепляющие мероприятия (режим дня и питания, диета и физическая активность — в соответствии с возрастными особенностями, прививки — строго по календарю и т. д.), своевременное рациональное лечение основного и сопутствующих заболеваний и, при необходимости, адекватную неспецифическую иммунопрофилактику; 6) максимальный эффект лечебно-профилактических мероприятий возможен только при устранении или снижении неблагоприятного влияния причин и провоцирующих факторов, а также при планомерной и систематической реализации программы индивидуального оздоровления1. Для активного внедрения в практическое здравоохранение основных положений Программы нами были предприняты следующие действия: подготовлены и опубликованы в педиатрических изданиях тематические статьи и лекции, проведены симпозиумы по проблеме РРИ у детей в рамках городских, областных и краевых конференций, а также на конгрессах и съездах, проводимых под эгидой Союза педиатров России. В программы общего усовершенствования для врачей-педиатров были включены лекционные, семинарские и практические занятия, посвященные возрастным особенностям иммунитета у детей, иммунодефицитным состояниям, причинам РРИ и тактике ведения пациентов с высоким уровнем респираторной заболеваемости. Кроме того, для врачей-педиатров первичного звена были разработаны и реализованы короткие циклы повышения квалификации по указанным темам. Аналогичные образовательные и научно-практические мероприятия проводились нашими коллегами из других медицинских университетов и научных центров. Все это способствовало тому, что практикующие педиатры стали менять свое отношение к детям с РРИ, понимая, что под маской единой характеристики «ЧБД» могут скрываться различные заболевания. Гетерогенность этого контингента пациентов определила необходимость первоочередного поиска причин и провоцирующих факторов повышенной респираторной заболеваемости, а нозологическая верификация нарушений состояния здоровья у детей с РРИ стала обязательной [7–9].
Важным звеном персонифицированных комплексных программ оздоровления детей с РРИ, разработанных с учетом индивидуальных особенностей их состояния здоровья, является иммунопрофилактика1. При этом подчеркивается обязательность вакцинации детей в строгом соответствии с графиком иммунизации, который определен национальным календарем прививок. В связи с ограниченными возможностями вакцинации для предупреждения инфекций органов дыхания (прививки против гриппа, против пневмококковой и Hib-инфекции) у детей с РРИ рекомендуется использовать и неспецифическую иммунопрофилактику (иммуномодуляторы) [9]. Современный арсенал средств для неспецифической иммунопрофилактики представлен целым рядом препаратов. Среди них: интерфероны и различные их индукторы, пептидные лекарственные средства, бактериальные лизаты (БЛ), синтетические аналоги мурамилдипептида и др. При этом среди всех иммуномодулирующих препаратов БЛ являются наиболее изученными и по механизму действия, и по клинико-иммунологической эффективности [11–17]. Учитывая, что традиционные представления о механизме действия БЛ подробно представлены в современной литературе, мы остановимся лишь на ключевых звеньях их позитивного иммуномодулирующего влияния, которое и определяет высокую лечебно-профилактическую эффективность (рис. 1).
![Рис. 1. Бактериальные лизаты: традиционные представления о механизме действия (ключевые звенья, схематично) (адаптировано по [17]) Fig. 1. Bacterial lysates: classical ideas about mechanism of action (key elements in simplified form) (adapted from [17]) Рис. 1. Бактериальные лизаты: традиционные представления о механизме действия (ключевые звенья, схематично) (адаптировано по [17]) Fig. 1. Bacterial lysates: classical ideas about mechanism of action (key elements in simplified form) (adapted from [17])](https://medblog.su/wp-content/uploads/2025/01/Deti-s-rekurrentnymi-respiratornymi-infektsiyami-sovremennoe-sostoyanie-problemy.png)
Содержание статьи
Бактериальные лизаты и их роль в формировании тренированного иммунитета
Бактериальные лизаты — это лекарственные препараты, содержащие компоненты бактерий, разрушенных физическим или химическим способом. В состав БЛ входят фрагменты клеточной стенки разрушенных бактерий и их антигенные структуры [13]. В основе механизма действия БЛ — активация иммунных механизмов в ответ на поступление в организм структур, которые распознаются как чужеродные, присущие нативным инфекционным возбудителям. В качестве этих универсальных молекул патогенности выступают фрагменты клеточной стенки бактерий. Наиболее изученными из них являются протеогликаны, широко представленные в клеточной стенке грамположительных бактерий, и липополисахариды, которые типичны для грамотрицательных бактерий. Клетки врожденного иммунитета (нейтрофилы, циркулирующие в кровотоке моноциты, тканевые макрофаги) за счет специфического взаимодействия своих рецепторов с универсальными молекулами патогенности (Toll-подобные рецепторы 2-го типа комплементарны протеогликанам, а Toll-подобные рецепторы 4-го типа комплементарны липополисахаридам) распознают их вторжение в организм. Результатом является активация нейтрофилов и циркулирующих моноцитов. При этом возрастает спонтанная миграция и хемотаксис нейтрофилов и моноцитов, повышается их адгезия и фагоцитарная активность в целом. Одновременно с этим происходит стимуляция тканевых макрофагов и натуральных киллеров. Активация натуральных киллеров сопровождается увеличением их цитотоксичности и миграционной способности. Все эти процессы сопровождаются синтезом в клетках врожденного иммунитета цитокинов. Последующая продукция цитокинов способствует адекватному взаимодействию между различными звеньями иммунитета. При этом стимулируется созревание и дифференцировка дендритных клеток, происходит презентация информации об антигенах, поступающих в организм в составе БЛ, активируются Т- и В-лимфоциты. В результате этого увеличивается количество плазмоцитов с последующим повышением продукции специфических антител к антигенам разрушенных бактерий, которые входят в состав БЛ. Особо следует отметить, что указанный вакциноподобный эффект БЛ обнаруживается преимущественно в системе местного иммунитета. Все это позволяет сформировать адекватный иммунный ответ и определяет клиническую эффективность препаратов, относящихся к БЛ (см. рис. 1). При этом особо следует подчеркнуть, что иммунные реакции в ответ на поступление в организм БЛ идентичны ответу иммунной системы на нативные инфекционные агенты, но не сопровождаются развитием патологических изменений. Это обусловлено тем, что БЛ, в отличие от неповрежденных возбудителей, лишены вирулентности/патогенности и поэтому не приводят к развитию воспаления [11–17].
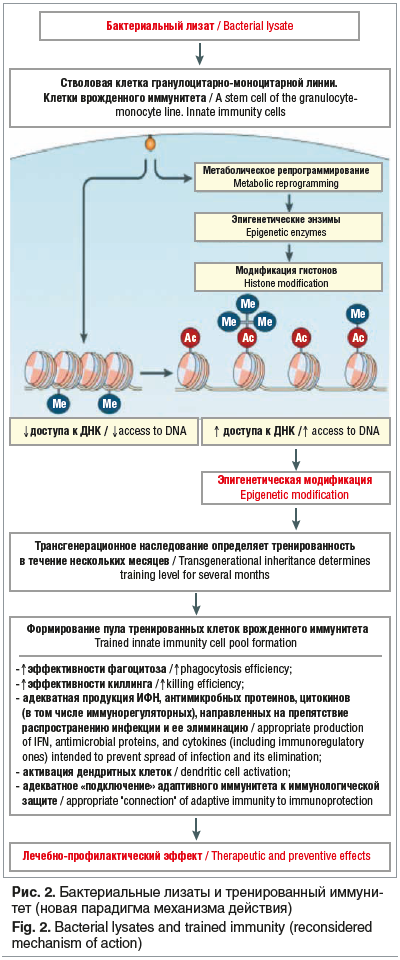
Кроме традиционных представлений о механизме действия БЛ, который тезисно был представлен выше, в последние годы стала активно обсуждаться возможность потенциального влияния препаратов этого класса и их аналогов на формирование тренированного иммунитета [18–22]. При этом высказывается предположение о том, что сохраняющийся в течение нескольких месяцев после окончания курса лечения БЛ профилактический эффект обусловлен именно состоявшейся под действием БЛ «тренировкой» клеток врожденного иммунитета. В основе концепции тренированного иммунитета лежит открытие феномена эпигенетической модификации в клетках врожденного иммунитета, которая возникает при инфекции [23–25]. При этом установлено, что эпигенетическая модификация не сопровождается изменениями, которые приводили бы к нарушениям нуклеотидной последовательности ДНК. Установлено, что в процессе активации клеток врожденного иммунитета в ответ на вторжение в организм инфекционного агента происходит метаболическое репрограммирование, в результате которого возрастает образование эпигенетических энзимов. Последние приводят к модификации гистонов, в результате чего ремоделируется хроматин. Благодаря этому ослабевает плотность укладки нитей ДНК в гистонах, что увеличивает доступность к генам, отвечающим за активацию факторов врожденного иммунитета (по старой терминологии — «неспецифический иммунитет»). Все это способствует более быстрой мобилизации факторов врожденного иммунитета и определяет формирование эффективной универсальной противоинфекционной резистентности, направленной на эрадикацию возбудителя из организма. Установлено, что процессы эпигенетической модификации, происходящие в клетках врожденного иммунитета во время инфекции, могут возникать и в гемопоэтических стволовых клетках. Именно с этим связывают сохранение тренированности иммунитета в течение нескольких месяцев после окончательной элиминации инфекционного агента. В качестве основного механизма, который лежит в основе этого феномена, рассматривают трансгенерационное наследование. В соответствии с этими представлениями эпигенетическая модификация, развившаяся в период инфекции в стволовой клетке гранулоцитарно-моноцитарной линии, при ее последующей дифференцировке передается зрелым клеткам врожденного иммунитета (нейтрофилы, циркулирующие моноциты), что и определяет состояние тренированности в течение нескольких месяцев [26–29]. Экстраполируя представленные выше данные на БЛ, можно предположить, что одним из дополнительных механизмов их иммуномодулирующего эффекта как раз и является эпигенетическая модификация (рис. 2). Если результаты последующих научных исследований подтвердят высказанные предположения, то сохраняющийся на протяжении нескольких месяцев терапевтический эффект после окончания курса лечения БЛ можно будет связывать не только с развивающимся вакциноподобным действием препарата, но и с тренировкой иммунитета.
Среди всех БЛ стоит обратить особое внимание на поливалентный механический БЛ (ПМБЛ) Исмиген®, который существенно отличается от всех остальных препаратов данного класса, так как в технологии его производства применяется метод физического разрушения бактерий, и является единственным в России представителем ПМБЛ2. Считается, что за счет этого ПМБЛ, в отличие от БЛ, изготовленных при помощи химического лизиса, содержит большее количество неповрежденных антигенов и фрагментов клеточных стенок бактерий, определяющих его более высокую иммуногенность [30, 31]. ПМБЛ содержит компоненты разрушенных бактерий, наиболее часто вызывающих инфекции респираторного тракта, среди которых Streptococcus pneumoniae (серотипы: TY1, TY2, TY3, TY5, TY8, TY47), Staphylococcus aureus, Streptococcus pyogenes, Streptococcus viridans, Klebsiella pneumoniae, Klebsiella ozaenae, Haemophilus influenzae b, Neisseria catarrhalis. Препарат предназначен для лечения и профилактики инфекций органов дыхания у детей старше 3 лет и у взрослых, выпускается в таблетках для сублингвального применения2. Следует особо отметить, что особенность применения препарата (сублингвальный прием) позволяет добиться его максимальной эффективности. Это обусловлено несколькими моментами. В первую очередь этому способствует эффект «хоминга» (от англ. home — дом), благодаря которому формирование и реализация в дальнейшем основных эффектов (активация нейтрофилов, моноцитов, тканевых макрофагов, натуральных киллеров, коммитированных лимфоцитов) будет осуществляться преимущественно в зоне первичного воздействия препарата — на слизистой верхних дыхательных путей, являющейся первым барьером для респираторных патогенов. Кроме того, сублингвальное использование позволяет избежать разрушительного воздействия энзимов желудка и кишечника на компоненты препарата, что способствует сохранению иммуногенности и определяет более высокую его клинико-иммунологическую эффективность2.
Результаты многочисленных клинико-иммунологических исследований по изучению лечебно-профилактической эффективности ПМБЛ у детей с РРИ свидетельствуют о его высокой безопасности, хорошей переносимости и высокой терапевтической результативности2 [30–37]. Основные результаты таких исследований изложены ниже.
Результаты исследований эффективности ПМБЛ у детей
F. Rosaschino et al. [31] провели пилотное рандомизированное, контролируемое исследование по изучению без-опасности, переносимости и терапевтической эффективности ПМБЛ у детей с РРИ (n=89; возраст 1 год — 10 лет). Анализ полученных результатов позволил авторам сделать вывод о безопасности, хорошей переносимости и высокой клинико-иммунологической эффективности препарата, а также комплаентности пациентов. При этом авторы особо отмечают, что применение ПМБЛ позволило значительно снизить частоту эпизодов респираторных инфекций у детей с РРИ не только в сопоставлении с предыдущим годом, но и по сравнению с группой контроля в течение исследуемого периода. Так, если среднее количество ОРИ или эпизодов обострений при рецидивирующих формах заболевания до лечения составляло 7,84 на 1 ребенка в год, то после терапии с использованием ПМБЛ — 4,78 на 1 ребенка в год (p<0,05). При сравнении уровня респираторной заболеваемости у детей, получавших ПМБЛ, с аналогичным показателем в группе контроля в период текущего сезона наблюдения был также отмечен достоверно положительный результат. Так, если среднее количество ОРИ или эпизодов обострений при рецидивирующих формах заболевания в основной группе было не выше 4,78 на 1 ребенка в год, то в группе контроля оно было выше на 29,5% и составило 6,78 (p<0,05) [31].
О. Aksic et al. [32] в двойном слепом рандомизированном плацебо-контролируемом клиническом исследовании также изучали терапевтическую эффективность ПМБЛ у детей с РРИ. В исследование было включено 180 детей (возраст 5–10 лет), регулярно посещающих организованные коллективы и находящихся под наблюдением в связи с РРИ. Анализ полученных результатов свидетельствовал о том, что у пациентов, в лечении которых использовали ПМБЛ, существенно сократилось число инфекционных эпизодов. При этом уровень респираторной заболеваемости у детей, получавших ПМБЛ, уменьшился на 54% по сравнению с пациентами, принимавшими плацебо (р<0,01). Кроме того, было отмечено, что у детей с РРИ на фоне лечения ПМБЛ достоверно снизилась частота использования антибиотиков и сократилось число пропусков детских коллективов [32].
В рандомизированное сравнительное контролируемое клиническое исследование [33] было включено 120 детей с РРИ (возраст 4–9 лет). Методом случайной рандомизации пациенты были распределены на 3 группы по 40 человек в каждой. При этом в первой (основной) группе использовали ПМБЛ, во второй (группе сравнения) — БЛ на основе химического бактериолиза, в третьей (контрольной) группе терапия не проводилась. Анализ полученных результатов позволил авторам сделать вывод о хорошей переносимости и высокой терапевтической эффективности ПМБЛ у детей с РРИ. Так, уже в течение первых 3 мес. лечения было отмечено достоверное снижение респираторной заболеваемости у детей, получавших лечение, более выраженное у пациентов, использующих ПМБЛ: в основной группе ни разу не болели ОРИ 67,5% детей, в группе сравнения — 37,5%, а в группе контроля — только 22,5% (p<0,016). Кроме того, авторы отметили существенное сокращение медикаментозной нагрузки (антипиретики + антибиотики + противовоспалительные) в группе ПМБЛ. Так, среднее число назначений указанных медикаментов на 1 ребенка в течение 3 мес. терапии в основной группе было практически в 2 раза меньше по сравнению с группой сравнения и в 3 раза — по сравнению с контролем (p<0,016). Аналогичные соотношения при сравнении изучаемых показателей сохранялись и в последующие 5 мес. наблюдения после окончания лечения. При этом авторы подчеркивают, что среди детей, получавших ПМБЛ, количество неболевших было в 1,83 раза выше, чем среди принимавших химический БЛ, и в 5,5 раза — чем в группе контроля (p<0,016) [33].
Результаты, полученные нами в ходе наблюдательных программ, реализованных в условиях рутинной педиатрической практики, также свидетельствуют о хорошей переносимости, отсутствии нежелательных явлений и высокой лечебно-профилактической эффективности ПМБЛ Исмиген® у детей, посещающих организованные коллективы [34, 35]. При этом было установлено не только достоверное снижение частоты респираторных инфекций, но и более легкое их течение в случае развития заболевания. В группе из 27 детей с РРИ (средний возраст 4,3±0,6 года) использование ПМБЛ было эффективно в 77,8% наблюдений. Благодаря применению препарата удалось не только снизить заболеваемость респираторными инфекциями в 2,8 раза (р<0,05), но и уменьшить медикаментозную нагрузку за счет уменьшения числа осложнений. При этом было отмечено снижение частоты применения противовирусных препаратов в 2,7 раза (р<0,05) и антибиотиков в 1,7 раза [34]. Анализ результатов наблюдательной программы, в которой изучалась профилактическая эффективность ПМБЛ у детей школьного возраста в период их адаптации к вновь организованному коллективу, позволил сделать вывод о высокой результативности проведенного лечения [35]. Так, у 74 детей (средний возраст 11,6±0,7 года), не имеющих серьезных нарушений здоровья, профилактический прием препарата в стандартном режиме дозирования (1 таблетка сублингвально 1 р/сут ежедневно в течение 10 дней с последующим 20-дневным перерывом — 1 курс; общее количество курсов — 3) сопровождался низким уровнем заболеваемости ОРИ (в среднем менее 0,27 эпизода на ребенка в месяц), редкими бактериальными осложнениями и низкой частотой (5,4%) использования антибиотиков. Благодаря высокому профилактическому эффекту, полученному в результате использования ПМБЛ, у подавляющего большинства детей не было нарушений графика посещения учебных занятий и отмечался адекватный уровень адаптации к новому организованному коллективу. Особо следует отметить, что за счет низкого уровня респираторной заболеваемости и малого числа временных медицинских отводов от прививки у детей, получавших ПМБЛ, иммунизация против сезонного гриппа была выполнена в запланированные сроки у 85,1% детей.
Учитывая, что наиболее высоким уровнем доказательности является систематический обзор и метаанализ, особое внимание следует обратить на следующий факт: достоверное снижение заболеваемости респираторными инфекциями и их более легкое течение у детей с РРИ за счет использования ПМБЛ было отмечено в опубликованном в 2012 г. систематическом обзоре и метаанализе [36]. При этом выводы были основаны на анализе данных, полученных при изучении результатов рандомизированных плацебо-контролируемых клинических исследований, проведенных с участием 345 детей (возраст от 1 года до 10 лет; 192 ребенка получали ПМБЛ, 153 — плацебо) с рекуррентными и рецидивирующими заболеваниями органов дыхания. Проведенные M. Cazzola et al. [36] статистические расчеты и анализ полученных данных свидетельствуют о том, что благодаря применению ПМБЛ удалось предупредить, в среднем 2,2 эпизода заболевания (ОРИ или обострения при рецидивирующих формах патологии) респираторного тракта у каждого ребенка, который получал препарат (Q-value: 0,82; df=2 (р=0,960); I2 0%; Tau2=0,00; Test of overall effect: Z=-4,089 от -3,260 до -1,147).
Подводя итог краткому обзору, посвященному применению ПМБЛ у детей с РРИ, можно сделать вывод о его без-опасности, хорошей переносимости и высокой лечебно-профилактической эффективности, а также комплаентности пациентов [30–37]. Особо при этом следует подчеркнуть позицию Комитета по лекарственным средствам для человека (Committee for Medicinal Products for Human Use, CHMP) Европейского медицинского агентства (EMA), который, рассмотрев результаты клинических исследований и позицию экспертной группы по инфекционным заболеваниям, в 2019 г. рекомендовал продолжить применение БЛ для профилактики рецидивирующих инфекций дыхательных путей3.
Заключение
Изменение подходов к детям с более высокой частотой респираторных инфекций, чем у сверстников, позволило существенно улучшить своевременную диагностику различных патологических состояний (аллергические заболевания, персистирующие герпетические инфекции, иммунодефициты и др.), которые ранее нередко ошибочно определялись как «ЧБД». При этом отказ в педиатрической практике от обобщенного понятия «ЧБД» (тактическая задача) и обязательный поиск причин и провоцирующих РРИ факторов позволит решить стратегическую задачу, заключающуюся в своевременном оказании адекватной медицинской помощи ребенку и улучшении качества его жизни в целом.
Сведения об авторах:
Заплатников Андрей Леонидович — д.м.н., профессор, заведующий кафедрой неонатологии им. проф. В.В. Гаврюшова, профессор кафедры педиатрии им. акад. Г.Н. Сперанского ФГБОУ ДПО РМАНПО Минздрава России; 123995, Россия, г. Москва, ул. Баррикадная, д. 2/1, стр. 1; ORCID iD 0000-0003-1303-8318
Гирина Асия Ахмедовна — к.м.н., доцент кафедры фармакологии, педиатрии и инфекционных болезней БУ «Ханты-Мансийская государственная медицинская академия»; 628011, Россия, г. Ханты-Мансийск, ул. Мира, д. 40; ORCID iD 0000-0002-5281-1564
Бурцева Елена Ивановна — д.м.н., заведующая лабораторией этиологии и эпидемиологии гриппа Института вирусологии им. Д.И. Ивановского ФГБУ «НИЦЭМ им. Н.Ф. Гамалеи» Минздрава России; 123098, Россия, г. Москва, ул. Гамалеи, д. 18; ORCID iD 0000-0003-2518-6801
Леписева Инга Владимировна — главный врач ГБУЗ ДРБ им. И.Н. Григовича; 185000, Россия, г. Петрозаводск, ул. Парковая, д. 58; ORCID iD 0000-0001-8989-6103
Свинцицкая Виктория Иосифовна — к.м.н., доцент кафедры педиатрии им. акад. Г.Н. Сперанского ФГБОУ ДПО РМАНПО Минздрава России; 123995, Россия, г. Москва, ул. Баррикадная, д. 2/1, стр. 1; ORCID iD 0000-0002-9272-2339
Лешик Мария Владимировна — ассистент кафедры педиатрии им. акад. Г.Н. Сперанского ФГБОУ ДПО РМАНПО
Минздрава России; 123995, Россия, г. Москва, ул. Баррикадная, д. 2/1, стр. 1; ORCID iD 0000-0002-9331-1419
Контактная информация: Заплатников Андрей Леонидович, e-mail: zaplatnikov@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов: А.Л. Заплатников принимал участие в наблюдательной программе по изучению клинико-профилактической эффективности поливалентного механического бактериального лизата Исмиген® у детей в условиях рутинной педиатрической практики.
Остальные авторы подтвердили отсутствие конфликта интересов, финансовой поддержки, о которых необходимо сообщить.
Статья поступила 07.10.2024.
Поступила после рецензирования 30.10.2024.
Принята в печать 25.11.2024.
About the authors:
Andrey L. Zaplatnikov — Dr. Sc. (Med.), professor, Head of the Prof. V.V. Gavryushov Department of Neonatology, Professor of the Acad. G.N. Speransky Department of Pediatrics, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0000-0003-1303-8318
Asiya A. Girina — C. Sc. (Med.), associate professor of the Department of Pharmacology, Pediatrics and Infectious Diseases, Khanty-Mansiysk State Medical Academy; 40, Mira str., Khanty-Mansiysk, 628011, Russian Federation; ORCID iD 0000-0002-5281-1564
Elena I. Burtseva — Dr. Sc. (Med.), Head of the Laboratory of the Etiology and Epidemiology of Flu, D.I. Ivanovskiy Institute of Virology, N.F. Gamaleya National Research Center of Epidemiology and Microbiology, 16, Gamalei str., Moscow, 123098, Russian Federation; ORCID iD 0000-0003-2518-6801
Inga V. Lepiseva — Chief Physician, N.I. Grigovich Children’s Republican Hospital; 58, Parkovaya str., Petrozavodsk, 185000, Russian Federation; ORCID iD 0000-0001-8989-6103
Victoria I. Svintsitskaya — C. Sc. (Med.), associate professor of the Acad. G.N. Speransky Department of Pediatrics, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0000-0002-9272-2339
Maria V. Leshik — assistant of the Acad. G.N. Speransky Department of Pediatrics, Russian Medical Academy of Continuous Professional Education; 2/1, Barrikadnaya str., Moscow, 125993, Russian Federation; ORCID iD 0000-0002-9331-1419
Contact information: Andrey L. Zaplatnikov, e-mail: zaplatnikov@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
Conflict of interest: A.L. Zaplatnikov participated in an observational program to study clinical and preventive efficacy of Ismigen® (i. e., a polyvalent mechanical bacterial lysate) in children in routine pediatric practice. The remaining authors confirmed the absence of a conflict of interest and financial support to be reported.
Received 07.10.2024.
Revised 30.10.2024.
Accept 25.11.2024.
1Часто болеющие дети. Острые респираторные заболевания у детей: лечение и профилактика. Научно-практическая программа Союза педиатров России. М.: Международный фонд охраны здоровья матери и ребенка; 2002:38–41
2Инструкция по медицинскому применению лекарственного препарата Исмиген®. (Электронный ресурс.) URL: https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=4b4a8cd7-ed2c-4749–8937–93cc4e846bafandt= (дата обращения: 08.10.2024).
3Committee for Medicinal Products for Human Use (CHMP). Bacterial lysate medicines for respiratory conditions to be used only for prevention of recurrent infections. Amsterdam, The Netherlands: European Medicines Agency; 2019 28 June. Contract No.: EMA/351772/2019. (Electronic resource.) URL: https://www.ema.europa.eu/en/documents/press-release/bacterial-lysate-medicines-respiratory-conditio… ( access date: 15.11.2024).
Информация с rmj.ru