Введение
Принятая в настоящее время концепция синтеза и метаболизма гормонов яичников, надпочечников и периферических тканей с учетом их биотрансформации и гонадотропного влияния обусловлена не только генетическими, но и эпигенетическими факторами. Участниками регуляции менструального цикла и овуляции являются эстрогены, прогестерон и тестостерон [1], в связи с чем важным считается определение их плазменных фракций. Продукция указанных гормонов контролируется центральной нервной системой, а именно гипоталамусом и гипофизом. Известно, что 25% андрогенов у женщин образуются в яичниках, 25% — в надпочечниках, остальные синтезируются в периферических тканях из одних и тех же исходных субстратов-прогормонов (дегидроэпиандростерон (ДГЭА) и дегидроэпиандростерона сульфат (ДГЭАС)), синтез которых осуществляется надпочечниками. Циркулирующий же в крови тестостерон у женщин способен к конверсии в 5α-дигидротестостерон и 17β-эстрадиол в тканях-мишенях. Периферическая конверсия тестостерона и его воздействие на ткани-мишени осуществляются при достаточном количестве рецепторов [1–3].
Формирование дисфункции яичников и реализация факторов бесплодия рассматриваются с позиций нарушений взаимодействия этажей регуляции, а также патогенетических паттернов изменений митохондриального обмена и снижения сенситивности рецепторного аппарата в репродуктивных органах [2, 3]. Так, например, латентный и тканевый дефицит железа проявляется нарушением ферментативной активности и дыхательной функции тканей [4, 5]. В свою очередь, возникновение хронической гипоксии в клетках и тканях, в том числе репродуктивных органов, отражается на функционировании эндотелия сосудов и механизмах созревания ооцитов и овуляции. Последняя является квинтэссенцией баланса молекулярно-клеточных механизмов, состоятельной рецепции и гормонального взаимодействия.
Выявление факторов риска при гинекологических заболеваниях предполагает назначение препаратов и биологически активных добавок с профилактической целью [6, 7]. Антиоксидантные и противовоспалительные свойства витаминов и микронутриентов, необходимые белкам в цикле клеточного метаболизма [6, 8], известны давно. Нормальные процессы роста, созревания ооцитов и лютеолиз связаны с достаточным содержанием витаминов группы В, витаминов С и D, которые выступают кофакторами ферментов, медиаторами системы «гипоталамус — гипофиз — яичники» и ответственны за формирование рецепторов к гормонам в органах-мишенях [9–11]. По данным многих исследователей [6, 8, 9, 12, 13], микронутриенты обеспечивают нормализацию содержания гормонов репродуктивной системы и устранение нарушений менструального цикла (НМЦ). Тенденция к увеличению частоты бесплодия и снижению овариального резерва яичников в последнее время заставляет исследователей искать новые пути воздействия на механизмы ооцито- и фолликулогенеза, что, в свою очередь, привлекает внимание и к стратегии использования витаминных комплексов [14], которые являются одним из важных этапов коррекции клеточного метаболизма. Это все равным образом способствует нормализации гонадотропных взаимоотношений яичников и надпочечников в организме женщины.
Дефицит витаминов и микронутриентов в настоящее время рассматривается как один из пусковых механизмов формирования дисфункций репродуктивной системы. Среди причин их развития рассматриваются не только стресс, переутомление, но и изменение массы тела, и в большей мере ее увеличение. Сформированные нейроэндокринные и обменные нарушения у женщин взаимо-связаны также с проявлениями системного воспалительного ответа [10, 15]. Адаптация женского организма к различным нагрузкам требует повышенного потребления витаминов и минералов. Недостаточные знания и недопонимание проблемы в настоящее время приводят к несбалансированному использованию витаминно-минеральных комплексов, не оказывающему должного эффективного воздействия.
Цель исследования: выявить особенности содержания некоторых витаминов и микронутриентов в крови у молодых женщин.
Материал и методы
Проведено проспективное одноцентровое исследование, в которое включали молодых женщин в возрасте 18–24 лет, обратившихся на прием к гинекологу в Медицинский научно-образовательный центр Института медицины и психологии В. Зельмана Новосибирского государственного университета с жалобами на НМЦ или проявления андрогензависимой дермопатии (акне, себорея, алопеция).
Критерии включения: нарушения менструального цикла (олигоменорея, аномальные маточные кровотечения, дисменорея), молодой возраст, информированное добровольное согласие на обследование.
Критерии исключения: наличие пороков развития половых органов, острые воспалительные заболевания половых органов, беременность.
Проведен анализ клинико-анамнестических и антропометрических данных, параметров репродуктивных гормонов плазмы крови в 1-ю фазу менструального цикла, участвующих в реализации репродуктивной функции (ФСГ, ЛГ, пролактин, эстрадиол, 17-ОН прогестерон, ДГЭАС, тестостерон, кортизол), и биохимического профиля с оценкой уровня глюкозы, ферритина, фолиевой кислоты, витамина В12 и 25(OH)D сыворотки крови, а также уровня гомоцистеина и соотношения лимфоцитов/моноцитов крови [16], интерпретированы данные эхографического исследования органов малого таза.
Для обработки полученных данных использовали программный пакет Statistics 18.0 for Windows (Biostat). Нормальность распределения оценивали с помощью критерия Шапиро — Уилка. Значения показателей представлены в виде среднего (M) и стандартного отклонения (SD), достоверность различий показателей в группах определяли по t-критерию Стьюдента и считали статистически значимыми при p<0,05. Различия между группами оценивали с использованием однофакторного дисперсионного анализа, критерия Манна — Уитни и критерия Фишера.
Результаты исследования
В исследование вошло 133 женщины, которые были распределены в 4 группы. Первую группу составили молодые женщины (n=53) с НМЦ (шифр по МКБ-10): олигоменорея N91.3, аномальные маточные кровотечения N92.0-N92.2, дисменорея N94.4-N94.5); 2-ю группу (n=44) — женщины с проявлениями гиперандрогении (ГА) (акне и постакне, алопеция, себорея) и НМЦ; 3-ю группу (n=9) — женщины с проявлениями ГА без НМЦ, 4-ю группу (n=27) — женщины без ГА и НМЦ (проходившие мед-осмотр, условно здоровые).
Согласно результатам физикального обследования наибольший индекс массы тела (ИМТ), хотя и находившийся в пределах нормальных значений, установлен у женщин с НМЦ в 1-й и 2-й группах (табл. 1). ИМТ соответствовал нормативным значениям, однако измерение окружности талии позволило определить наибольшие значения у женщин с проявлениями ГА. Это, в свою очередь, отражало накопление абдоминальной подкожной жировой ткани у женщин 2-й и 3-й групп. Характерно, что у здоровых женщин окружность талии оказалась наименьшей.
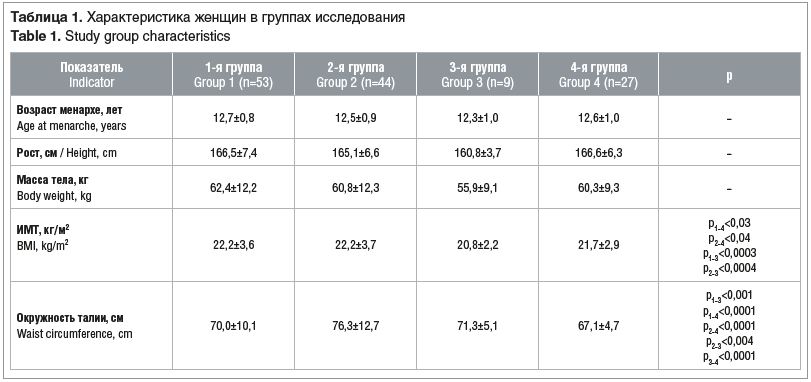
В ходе проведенного исследования установлено, что показатели гонадотропинов статистически не различались в группах сравнения (табл. 2). Полученные параметры анализировали с учетом референсных нормативных показателей лаборатории, в которой проводилось исследование. Однако соотношение ЛГ/ФСГ оказалось больше, хотя и недостоверно, у женщин 2-й группы — 1,2±1,3 (медиана 0,9) в сравнении с остальными: в 1-й и 3-й группах — 1,16±2,8 (медиана 0,7) и 1,0±0,4 (медиана 0,7) соответственно. Средние значения пролактина плазмы крови определены ближе к пограничным, наибольшим оказался уровень пролактина в группе женщин с НМЦ и ГА (см. табл. 2). Между тем у каждой четвертой женщины 1, 2 и 3-й групп определена гиперпролактинемия (диапазон значений от 737 до 1079 мЕд/л): 25,8% женщин с НМЦ и ГА, 23,3% и 22,2% женщин 1-й и 3-й групп.
У каждой третьей женщины 1, 2 и 3-й групп обнаружены эхографические отклонения в объеме яичников: у 41% женщин 1-й и 2-й групп и у 44% женщин 3-й группы установлены признаки увеличения объема яичников и изменения их структуры (мультифолликулярные или поликистозные яичники). Одновременно эхографические признаки ановуляции выявлены у 26,1, 32,3 и 35% женщин 1, 2 и 3-й групп соответственно.
Анализ уровня андрогенных стероидов в группах сравнения не выявил статистически значимых различий. Однако во 2-й и 3-й группах определены пограничные уровни кортизола и более высокие, чем в 1-й группе, значения 17-ОН прогестерона плазмы крови (см. табл. 2).
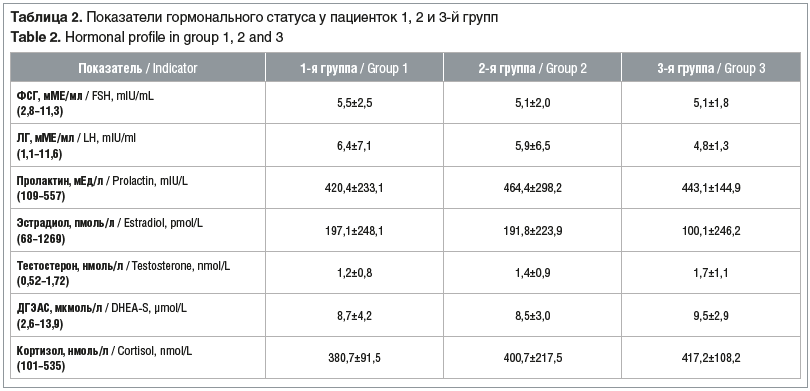
Низкие уровни 25(OH)D сыворотки крови обнаружены у женщин 1, 2 и 3-й групп. У пациенток 4-й группы уровни 25(OH)D не определялись из-за отсутствия показаний. Известно, что низкие уровни витамина D коррелируют с риском развития инсулинорезистентности. При изучении уровней глюкозы крови установлены статистически значимые различия. В 4-й группе у женщин без НМЦ и ГА средние значения глюкозы крови (4,7±0,4 ммоль/л) и окружность талии были наименьшими (см. табл. 1). У женщин 1-й и 2-й групп (p<0,001) определены высоконормальные значения глюкозы крови — 5,1±0,5 и 5,2±0,9 ммоль/л, тогда как в 3-й и 4-й группах они были статистически меньше — 4,9±0,3 и 4,7±0,4 ммоль/л соответственно.
В ходе исследования установлены статистически значимые (p<0,0002) различия в уровне гомоцистеина плазмы крови, хотя значения были расценены как пограничные: у женщин 1-й группы 11,5±2,9 мкмоль/л, во 2-й и 3-й группах ниже — 9,7±2,8 и 9,4 ±2,7 мкмоль/л соответственно.
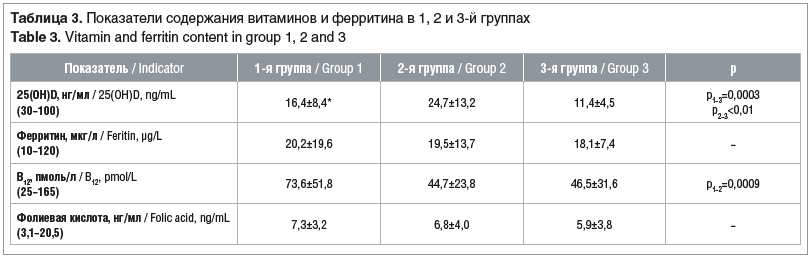
Характерно, что в 1, 2 и 3-й группах у женщин обнаружены погранично низкие значения фолиевой кислоты и витамина В12, что могло способствовать более высоким уровням гомоцистеина крови. Также в этих группах выявлены низкие значения ферритина сыворотки крови, свидетельствующие о латентном дефиците железа [4, 5]. Уровни ферритина крови оказались погранично низкими во всех трех группах женщин, имеющих репродуктивные нарушения. Наименьшие значения ферритина установлены у женщин с проявлениями ГА (табл. 3).
Учитывая найденные пограничные значения гомоцистеина у женщин с НМЦ, была проанализирована численность моноцитов периферической крови у пациенток групп сравнения. Важную роль в сохранении равновесия гемостатических реакций играют фрагменты мембран, отделяемые при активации и апоптозе клеток, обладающие прокоагулянтной активностью. К ним относятся не только тромбоциты и эндотелиоциты, но и моноциты [17]. Кроме того, именно моноциты, являющиеся источниками дендритных клеток, участвуют в формировании иммунологической толерантности организма, а значит, и его устойчивости к бактериальным и вирусным инфекциям. Обнаружено, что наименьшая численность моноцитов периферической крови наблюдалась у женщин 1-й и 2-й групп, имеющих НМЦ, — 9,17±1,3% и 8,88±1,8% соответственно, бóльшая численность в 3-й и 4-й группах — 9,5±1,7% и 9,7±1,8% соответственно.
Для оценки иммунологической устойчивости было рассчитано соотношение лимфоцитов/моноцитов, которое в 1-й и 4-й группах составило 3,8 и 3,9 соответственно; в 3-й группе — 4,0; во 2-й группе оказалось наиболее высоким — 4,4 (p<0,0001).
Обсуждение
Проведенный анализ выявил латентный дефицит железа, пограничные уровни витаминов группы В и недостаточность витамина D, наиболее выраженные у женщин, имевших проявления ГА и НМЦ. У каждой третьей пациентки 1, 2 и 3-й групп установлена ановуляция, сопровождавшаяся низкими уровнями 25(OH)D, участие которого доказано в повышении чувствительности клеток к ФСГ и в механизмах синтеза прогестерона [16, 18, 19].
Важную роль в процессах овуляции отводят витамину В12 [8, 12, 14, 15], погранично низкие уровни которого обнаружены у пациенток с НМЦ и ГА. Известно, что гипоксия, возникшая на фоне недостаточности и последующего дефицита витаминов и железа, снижает метаболизм всех звеньев репродуктивной системы, а также влияет на концентрацию и периферическую конверсию гормонов. Показано, что при недостаточном содержании в плазме крови витаминов группы В и витамина D нарушается метилирование ДНК, микроРНК и гистонов [11, 14, 20]. Витамин В6, оказывающий эстрогеноподобное воздействие, влияет на механизмы метаболизма γ-аминомасляной кислоты, участвуя таким образом в восполнении уровня прогестерона. Дефицит витаминов С, В6 и фолиевой кислоты сопровождается снижением процессов инактивации эстрогенов в печени [11–13, 20] и нарушением гонадотропных, антиоксидантных и нейропротективных эффектов.
Необходимо диагностировать первые проявления инсулинорезистентности, которые отражаются на состоятельности овуляторных циклов в организме женщины. Увеличение окружности талии и повышение уровней глюкозы крови у женщин с ГА и НМЦ позволяют отнести их в группу высокого риска возникновения ановуляторных циклов.
Сравнительный анализ численности лимфоцитов и моноцитов периферической крови, а также расчет соотношения лимфоцитов/моноцитов позволили установить наибольшую лабильность иммунологических показателей у женщин с проявлениями ГА и НМЦ. У трети из них обнаружены эхографические критерии ановуляторных циклов, которые сопровождались дисфункцией гипоталамо-гипофизарно-надпочечниково-яичниковой оси.
У женщин с ГА определены пограничные уровни гомоцистеина крови, что способствовало формированию проявлений сосудисто-эндотелиальной дисфункции. Гомоцистеин легко вступает в химические реакции за счет сульфгидрильной группы (SH-) с образованием агрессивных кислородных радикалов, повреждающих ткани [19, 21]. Дефицит фолиевой кислоты обусловливает накопление гомоцистеина — аминокислоты, которая синтезируется из метионина и обратно конвертируется при помощи витаминов группы В. В исследовании определены низкие пороговые уровни фолиевой кислоты в сыворотке крови у женщин с НМЦ и ГА. Фолиевая кислота является переносчиком метильных групп между органическими соединениями, а также участвует в метаболизме липидов и образовании гомоцистеина, тем самым оказывая непосредственное влияние на состояние сосудистой стенки, в том числе и в репродуктивных органах.
Увеличение частоты необъяснимого бесплодия в последнее время заставляет исследователей искать новые пути влияния на механизмы ооцито- и фолликулогенеза. В связи с тем, что важная роль в процессах обеспечения овуляции отводится витаминам группы В (фолиевой кислоте, В6, В12), одним из привлекательных путей считается использование витаминных комплексов для улучшения взаимодействия гормонов с рецепторным аппаратом клеток. Возможно применение в этом случае отечественного комплексного лекарственного препарата Ангиовит®, созданного для коррекции и лечения гипергомоцистеинемии, включающего: фолиевую кислоту в специальной терапевтической дозе 5 мг; пиридоксина гидрохлорид (витамин В6) 4 мг и цианокобаламин (витамин В12) 0,006 мг. На протяжении двух десятков лет Ангиовит® широко применяется в различных областях медицины, в том числе в акушерстве и гинекологии, доказав свою эффективность и безопасность. Для проведения стандартного курса терапии достаточно приема 1 таблетки в день в течение 1 мес. с последующим контролем уровня гомоцистеина в крови. Терапию данным препаратом можно повторять, ориентируясь на уровни фолиевой кислоты и витамина В12 у женщин с НМЦ.
Заключение
Таким образом, у молодых женщин с НМЦ и проявлениями ГА установлены признаки латентного дефицита железа и недостаточности витамина D, а также погранично низкие уровни фолиевой кислоты и витамина В12 в сыворотке крови, что необходимо учитывать при коррекции выявляемых нарушений и формировании плана лечения. Использование лекарственных средств в этой группе может способствовать нормализации уровней витаминов и минералов в крови и профилактике репродуктивных нарушений.
Контактная информация: Кудинова Евгения Геннадьевна, e-mail: e.kudinova@g.nsu.ru.
Прозрачность финансовой деятельности: автор не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 03.07.2022.
Поступила после рецензирования 26.07.2022.
Принята в печать 18.08.2022.
About the author:
Evgeniya G. Kudinova — Dr. Sc. (Med.), associate professor of the Department of Obstetrics and Gynecology, V. Zelman Institute of Medicine and Psychology, Novosibirsk State University; 1, Pirogov str., Novosibirsk, 630090, Russian Federation; ORCID iD 0000-0002-1987-0343. Contact information: Evgeniya G. Kudinova, e-mail: e.kudinova@g.nsu.ru.
Financial Disclosure: the author has no a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 03.07.2022.
Revised 26.07.2022.
Accepted 18.08.2022.
.
Информация с rmj.ru

