Содержание статьи
Болезнь депонирования кристаллов пирофосфата кальция (пирофосфатная артропатия)
С. М. Носков*, доктор медицинских наук, профессор
С. Д. Дыбин*, кандидат медицинских наук
В. В. Цурко**, доктор медицинских наук, профессор
* ГБОУ ВПО ЯГМА МЗ РФ, Ярославль
** ГБОУ ВПО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
В последнее время пристально изучается роль кристаллов пирофосфата кальция (ПФК) дигидрата в развитии патологии опорно-двигательного аппарата. Распространенность болезней, связанных с отложением кристаллов кальция, нарастает с увеличением возраста пациентов, составляя 10–15% у больных 65–75 лет и достигая 40% у лиц старше 80 лет. Понятие частоты встречаемости пирофосфатной артропатии достаточно условно, так как болезнь может маскироваться остеоартрозом (ОА), ревматоидным артритом, подагрой, проявляться в виде недифференцированного артрита, что затрудняет ее своевременную диагностику [1].
Кристаллы ПФК в хряще и в синовиальной жидкости при ОА определяются у 65% больных гонартрозом [2, 3]. ПФК в большом количестве образуется хондроцитами, но быстро разрушается неорганической пирофосфатазой. В культуре хондроцитов кристаллы ПФК стимулируют митогенез, продукцию матричных металлопротеиназ, простагландинов и провоспалительных цитокинов. Полагают, что при болезни депонирования кристаллов ПФК в суставном хряще локально нарушается обмен пирофосфата: повышается его образование или снижается активность пирофосфатазы. Ингибирование последней при некоторых указанных патологических процессах может быть обусловлено повышенным содержанием железа и меди, которые служат ядрами кристаллизации, вокруг которых формируются кристаллы ПФК. Свободные кристаллы ПФК активируют систему комплемента и, как хемотаксический фактор для нейтрофильных лейкоцитов, вызывают их приток в синовиальную оболочку и суставную полость. При фагоцитозе кристаллов нейтрофилами они выделяют лизосомальные ферменты и медиаторы воспаления, резко усиливается и секреция ими кислородных радикалов. В результате в синовиальной оболочке возникает воспалительная реакция. Кроме того, в развитии синовита могут принимать участие продукты разрушения дегенеративно измененного хряща и фрагменты известковых отложений, которые нередко визуализируются в синовиальной жидкости при травме и хронической микротравматизации. Кристаллы ПФК первоначально откладываются в толще суставного хряща, затем на его поверхности, а впоследствии — в синовиальной оболочке и периартикулярных тканях [4].
Диагностика депозиции ПКФ
При подозрении на отложение кристаллов ПФК следует анализировать у пациента факторы риска и сопутствующие болезни, включая ОА, частую микротравматизацию суставов, лучевую нагрузку, нормофосфатемическую гиперфосфатурию и др. У больных в возрасте до 60 лет необходимо диагностировать метаболические болезни с нарушением кальциевого обмена (первичный гиперпаратиреоз, гипомагниемия, гемохроматоз) и семейную предрасположенность, особенно в случаях полиартикулярного поражения.
Подтверждают депозицию ПФК поляризационной световой микроскопией в виде характерных кристаллов (параллелепипедной формы, преимущественно внутриклеточных, со слабым светоотражением или его отсутствием) в синовиальной жидкости. Следует учитывать, что при исследовании в поляризованном свете определяется примерно 1/5 часть всех кристаллов ПФК. В последнее время для визуализации кристаллов ПФК предлагается использовать люминесцентную микроскопию с применением кальций-чувствительного флуоресцентного зонда Fluo-4. Данный метод позволяет проводить и проточную цитометрию для быстрого полуколичественного анализа кристаллов.
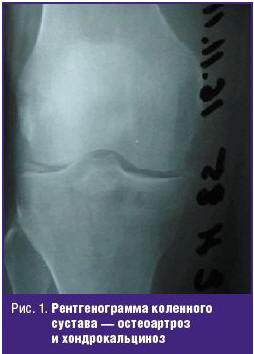
Рентгенологически выявляемый хондрокальциноз (ХК) подтверждает наличие депозитов ПФК, но его отсутствие не исключает этих депозитов. Рентгенограммы соответствующего качества являются легким и надежным методом возможного обнаружения депозитов ПФК как в суставных, так и периартикулярных тканях [5]. Рентгенологическая картина ХК (рис. 1) напоминает деформирующий остеоартроз, но локализация изменений отличается от него. Отличительный признак ХК — обызвествление хряща как крупных опорных, так и мелких суставов, а также суставной капсулы и мягких тканей. Как правило, в начале болезни наблюдается поражение одного или обоих (медиального и латерального) бедренно-большеберцовых сочленений и тяжелое поражение бедренно-надколенникового сочленения (иногда бывает изолированным). Заподозрить ХК позволяет слабо выраженное обызвествление суставов запястья и суставного диска лучезапястного сустава. Ультразвуковое исследование на приборе высокого разрешения может визуализировать депозиты кристаллов ПФК обычно в виде гиперэхогенных включений внутри гиалинового и/или фиброзного хряща в 68,7% случаев при ХК.
Однако отсутствие признаков ХК при рентгенологическом и ультразвуковом методах исследования не должно быть причиной пересмотра диагноза, так как может быть связано со значительным разрушением хряща и небольшими размерами депозитов [1].
Сцинтиграфия и магнитно-резонансная томография (МРТ) в диагностике ХК в настоящее время не применяются, поскольку обызвествление дисков и связок лучше визуализируется при компьтерной томографии (КТ). Предварительный диагноз, как правило, ставят по данным рентгенологического исследования и подтверждают наличием кристаллов в синовиальной жидкости.
Клинические формы болезни депонирования ПФК
Отложение кристаллов ПФК характеризуется большим спектром клинических фенотипов — от бессимптомной формы до острой (псевдоподагра) и хронической (остеоартроз с депозицией кристаллов ПФК, хронический артрит с кристаллами ПФК, ХК).
Острый артрит, или псевдоподагра, составляет 25% случаев болезни депонирования ПФК. Распространенность данной патологии среди взрослых пациентов в возрасте 40–79 лет составляет 2,4–4,5%. Острый артрит — результат образования и депонирования кристаллов ПФК в суставах с развивающимся в этой связи воспалением иммунного характера. Псевдоподагра характеризуется болью, гиперемией и отеком сустава, достигающих пика за 12–36 ч. Заболевание встречается с равной частотой у мужчин и женщин. Приступ псевдоподагры характеризуется менее выраженным болевым синдромом и медленнее достигает пика клинических проявлений по сравнению с подагрой. Как правило, поражается один сустав (в 50% случаев коленный), хотя описаны случаи олиго- и полиартритических атак псевдоподагры. Острая атака псевдоподагры с поражением лучезапястного сустава может привести к развитию запястного туннельного синдрома. Приступ псевдоподагры проходит самостоятельно (без лечения) в течение месяца. В период между атаками клинически не проявляется.
Пациенты с идиопатической псевдоподагрой, как правило, старше 55–60 лет. Важную роль в возникновении острой атаки играют изменения электролитного баланса с колебаниями концентрации кальция в сыворотке крови. Как и при истинной подагре, провоцирующими факторами могут быть травма, хирургическое вмешательство, нарушение мозгового кровообращения и инфаркт миокарда. Отмечена сезонность — приступы достоверно чаще возникают весной.
Хронический артрит с кристаллами ПФК составляет 5% болезней депонирования ПФК. Он предполагает наличие суставного синдрома с системным воспалением (подъем уровня С-реактивного белка (СРБ) в крови и увеличение скорости оседания эритроцитов (СОЭ)), утренней скованностью движений, семейным артрологическим анамнезом. Суставной синдром проявляется симметричным поражением пястно-фаланговых (обычно II–III пальцев), коленных, лучезапястных и локтевых суставов. Воспалительный процесс вялотекущий, может длиться недели и месяцы. При осмотре обнаруживают ограничение подвижности сустава и сгибательную контрактуру (псевдоревматоидная форма). У 10% больных, как и у здоровых пожилых людей, определяется ревматоидный фактор в низком титре.
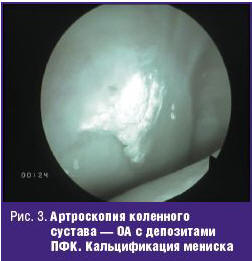
Остеоартроз с депозитами ПФК возникает у пациентов с клиническими и рентгенологическими признаками остеоартроза, однако, в отличие от него, рентгенологически обычно обнаруживают хондрокальциноз. При этом, в отличие от ОА без отложения кристаллов ПФК, наблюдается больше воспалительных признаков и атипичное поражение (лучезапястный или среднезапястный, плечевой, суставы средней части стопы), менее выраженный остеофитоз и кистовидная перестройка.
При ОА с депозитами ПФК развиваются выраженные дегенеративные изменения в пястно-фаланговых, лучезапястных, локтевых, плечевых и коленных суставах. Чаще поражается латеральная часть коленного сустава, с двусторонней или односторонней вальгусной деформацией или «стучащими коленями». Нередко наблюдается также изолированный пателлофеморальный ОА. Характерные признаки ОА с депонированием ПФК — сгибательная контрактура пораженных суставов и симметричность процесса. Более чем у 50% больных наблюдаются периодически приступы псевдоподагры.
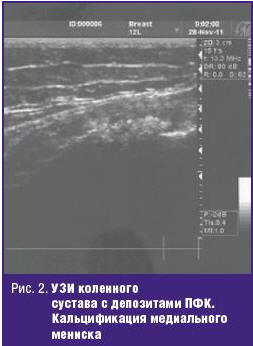
«Излюбленная» локализация депозитов кристаллов ПФК — мениски коленных суставов (рис. 2, 3). Последние играют жизненно важную роль в передаче нагрузки, амортизации и стабильности сустава. Дегенерация и кальцификация менисков — ключевые особенности ОА коленных суставов. Появляется все больше данных, что мениски коленных суставов не остаются пассивными в процессе развития ОА. Дегенерация менисков способствует сужению межсуставной щели. Кальцификация менисков нарастает с возрастом и коррелирует с поражением хряща у лиц без симптомов артрита в анамнезе. Высказывается предположение, что кальцификация менисков и крестовидных связок с провокацией воспаления и потерей стабилизирующей сустав функции может первично инициировать ОА коленных суставов. Тем не менее следует отметить, что больным с ОА и депозитами кристаллов ПФК не требовалась более ранняя артропластика по сравнению с пациентами без ПФК. Кристаллы ПФК могут откладываться и в позвоночнике. Депозиты кристаллов обнаруживаются при КТ или МРТ и часто интерпретируются как спондилодисцит или остеомиелит. Клинически проявляется, как правило, ригидностью позвоночника, иногда вместе с костным анкилозом или диффузным идиопатическим гиперостозом. Может быть люмбоишиалгия, напоминающая клинику пролапса межпозвонкового диска. Описываются клинические проявления депозитов ПФК в шейном отделе позвоночника, височно-нижнечелюстном суставе, лобковом симфизе.
Хондрокальциноз — кальцификация суставного хряща чаще не сопровождается клиническими проявлениями. Старение — главный фактор риска спорадического ХК. У пациентов в возрасте около 60 лет распространенность ХК составляет 7–10%, у лиц в возрасте 70 лет — около 15%. К вторичному ХК предрасполагают гемохроматоз, гиперпаратиреоидизм и гипомагниемия. ХК выявляется рентгенологически, но достоверный диагноз должен быть подтвержден наличием кристаллов ПФК, присутствие которых коррелирует с рентгенологическими признаками дегенерации гиалинового хряща. Однако большее патогенетическое и диагностическое значение при ОА, как полагают, имеет присутствие депозитов кристаллов ПФК в менисках.
Артроскопия при ХК позволяет определить отсутствие депозитов ПФК в синовиальной оболочке, морфологические признаки воспаления при этом менее выражены, но участки атрофии обширны. Мелкоточечные депозиты пирофосфата кальция обнаруживаются в суставном хряще у всех больных с ХК. У большинства обследованных старше 40 лет имелись также признаки ОА.
Лечение
В рекомендациях Европейской противоревматической лиги (European League Against Rheumatism, EULAR) [6] сформулированы ключевые пункты для лечения и профилактики болезни депонирования, кристаллов ПФК, включающие немедикаментозное и медикаментозное лечение. Так, в случае острого артрита с кристаллами ПФК оптимальное лечение включает холодовые аппликации, покой, аспирацию синовиальной жидкости и внутрисуставное введение длительно действующих глюкокортикоидов. Эффективны нестероидные противовоспалительные препараты (НПВП) (перорально) и низкие дозы колхицина (0,5 мг 3–4 раза в день с начальной дозы в 2 мг или без нее), но применение последних лимитируется коморбидностью пациентов и токсичностью колхицина.
ОА с пирофосфатной кальцификацией протекает с упорным болевым и воспалительным синдромом, что является показанием для постоянной потребности в НПВП. При обсуждении вопроса о выборе НПВП у этих пациентов следует учитывать следующие положения [7]: при пероральном приеме, учитывая наличие «микрокристаллических атак», должна достаточно быстро создаваться терапевтическая концентрация НПВП в крови и синовиальной жидкости, то есть он должен хорошо проникать через синовиальную мембрану. НПВП должен обладать достаточно выраженными противовоспалительными свойствами, подавляя не только синтез провоспалительных цитокинов (интерлейкинов (ИЛ) ИЛ-1 бета и ИЛ-6, фактора некроза опухоли альфа, простогландина Е2) в синовии, но и ингибируя фагоцитарную и хемотаксическую активность моноцитарных макрофагов, а также не оказывать негативного воздействия на метаболизм хондроцитов. Учитывая преимущественно пожилой возраст данной группы больных, применяемый НПВП должен характеризоваться высоким профилем безопасности, то есть, как минимум, обладать селективностью к циклооксигеназе-2 (ЦОГ-2-селективностью) и не увеличивать риск сердечно-сосудистых осложнений.
В фокусе внимания и интереса российских врачей и пациентов, впрочем, как и европейских, уже достаточное время находится препарат из группы НПВП — ацеклофенак (Аэртал), показанный для лечения боли и воспаления при суставном синдроме, в том числе при остеоартрозе и боли в спине. Ведущим механизмом противовоспалительной и анальгетической активности его является преимущественное подавление активности ЦОГ-2.
Ацеклофенак (Аэртал) обладает улучшенной переносимостью из-за слабого угнетения простагландинов слизистой оболочки желудка. Коэффициент ЦОГ-2/ЦОГ-1, то есть средняя ингибирующая концентрация, для Аэртала равняется 0,26 мкМ. Клинические исследования ацеклофенака (Аэртала) показали, что и после перорального приема препарат быстро и хорошо абсорбируется и связывается с белками плазмы до 99%, выделяется с мочой в виде гидроксилированных метаболитов. Пик его плазменной концентрации достигается через 1–3 ч, время жизни препарата составляет 4 часа. Приблизительно 60% плазменного уровня ацеклофенака проникает в синовиальную жидкость, подавляя местную активность, что особенно важно для пожилых пациентов с остеоартрозом. Важно отметить, что не выявлено взаимодействия Аэртала с диуретиками, не отмечено тенденции к повышению артериального давления и осмолярности мочи, а при совместном приеме с ингибиторами ангиотензинпревращающего фермента, антикоагулянтами, антидиабетическими препаратами не выявлено отрицательного клинического взаимовлияния друг на друга.
Наболее значимым из исследований по применению ацеклофенака на сегодня принимается Европейское когортное исследование, включающее 23 407 пациентов с острой и хронической болью воспалительного происхождения и/или вследствие ревматических заболеваний, таких как остеоартроз, ревматоидный артрит, анкилозирующий спондилоартрит с целью получения практического опыта по применению препарата, а также оценки степени удовлетворенности пациентов и врачей проводимой терапией и накопления опыта применения ацеклофенака вне условий контролируемых клинических испытаний. Пациенты были переведены на терапию ациклофенаком либо потому, что предыдущий прием НПВП не был эффективным (45,5%), либо из-за плохой переносимости препарата (35%), или из-за комбинации этих двух причин (19,5%). Ацеклофенак назначали по 100 мг 2 раза в день, диклофенак в эквивалентной дозе — по 75 мг 2 раза в сутки (соотношение больных, принимавших эти препараты, было 3:1). Период лечения составлял 12 мес. При клинической оценке ацеклофенака 90% пациентов и 84% врачей подтвердили его высокую терапевтическую эффективность и были удовлетворены результатами лечения. Обезболивающий эффект препарата наступал быстро и на протяжении всего периода наблюдения продолжал усиливаться. Интенсивность боли при первом визите к врачу была оценена как тяжелая у 41% больных, при втором визите — только у 5%, а при третьем — у 2%. Пациенты с умерено выраженным болевым синдромом на втором визите в 32% случаев отрицали наличие боли, остальные пациенты описывали болевой синдром как легкий. Общее состояние 84% больных на втором визите было оценено врачами как значительное улучшение. При этом оценки врача и пациента полностью совпадали. Авторы отмечают высокую комплаентность (94%), то есть аккуратное выполнение пациентами всех назначений врача на фоне приема этого препарата [8].
Исследование Y. Henrotin и соавт. [9] показало, что ацеклофенак способен подавлять процессы деградации матрикса хряща за счет ингибирования активности ИЛ-1 бета, а за счет этого сохранять в нем физиологическую стимуляцию глюкозаминогликанов и восстанавливать синтез антагониста рецепторов ИЛ-1 бета и как результат их совместного эффекта — подавлять продукцию металлопротеиназ.
А. Yanagawa и cоавт. [10] провели сравнительное исследование с гастроскопическим контролем в динамике, которое показало, что диклофенак в значительной степени нарушает содержание гексозамина и локальный кровоток в слизистой оболочке желудка, а при терапии ацеклофенаком, напротив, содержание гексозамина в слизистой оболочке желудка было достоверно выше при неизмененном локальном кровотоке. Клинико-эндоскопические исследования показали более значимую безопасность ацеклофенака.
Последний метаанализ с 3-этапным отбором исследований состоял из 28 исследований, соответствующих критериям для включения по применению НПВП и анализом осложнений на фоне их приема со стороны верхних отделов желудочно-кишечного тракта. После обработки материала минимальный относительный риск (ОР) наблюдался при применении ацеклофенака, целекоксиба и ибупрофена, а максимальный — пироксикама, кеторолака и азапропазона. Промежуточный ОР был выявлен для рофекоксиба, сулиндака, диклофенака, мелоксикама, нимесулида, кетопрофена, теноксикама, напроксена, индометацина и дифлунизала [11].
В 2010–2011 гг. в России проведено многоцентровое открытое рандомизированное сравнительное исследование эффективности и безопасности ацеклофенака в сравнении с диклофенаком у 200 амбулаторных пациентов с остеоартрозом коленных суставов. I группа (100 пациентов) получала Аэртал 200 мг/сут. II группа (100 пациентов) — диклофенак 100 мг/сут в течение 3 мес. На основании полученных результатов Аэртал сопоставим по эффективности с диклофенаком. Аэртал показал более быстрое влияние на болевой синдром, скованность и выявил более эффективное действие на улучшение функционального состояния суставов, что коррелировало со снижением риска гастроэнтерологических побочных эффектов и значительно меньшей отменой терапии в связи с побочными эффектами [12].
При недостаточной эффективности терапии острого и/или обострении хронического артрита с кристаллами ПФК может быть использован также короткий курс глюкокортикоидов внутрь, а также пероральное или парентеральное применение адренокортикотропного гормона (по 40–80 ЕД внутримышечно через 12 ч по необходимости, обычно 1–3 инъекции).
При хроническом воспалительном артрите применяют НПВП (при необходимости — гастропротекторную терапию), колхицин (0,5–1 мг в день), низкие дозы глюкокортикоидов, метотрексат и гидроксихлорохин. Предполагается, что метотрексат как противовоспалительный препарат может быть эффективен в дозе 10–20 мг/нед при неуспехе других методов лечения.
Проведенное сравнительное исследование по оценке локальной терапии (1–4-кратное внутрисуставное введение глюкокортикоидов или метатрексата) у пациентов с хроническим резистентным синовитом у больных I группы с остеоартрозом и II группы с остеоартрозом в сочетании с депозицией кристаллов ПФК показало, что у пациентов II группы, в отличие от пациентов I группы, отмечался низкий клинический ответ на локальную перфузионную терапию и внутрисуставное введение кортикостероидов. Во II группе средством выбора может быть локальная терапия метотрексатом [13].
Профилактику частых атак артрита с кристаллами ПФК можно проводить низкими дозами колхицина (0,5–1 мг ежедневно) или низкими дозами НПВП (с гастропротекцией при необходимости).
В отличие от подагры, в настоящее время не созданы препараты, модифицирующие формирование кристаллов ПФК или позволяющие их растворять. Бессимптомные депозиты ПФК — не показание для терапии. Теоретически ингибировать кальцификацию можно воздействием либо на отложение кальция (физическая цель), или на клетки (биологическая мишень). Ориентация терапии на клеточный, генетический или эпигенетический уровень будет не только препятствовать образованию и росту отложений кальция, но и конвертировать измененные при ОА клетки хряща и мениска в более физиологически функционирующее состояние.
В заключение о некоторых новых аспектах лекарственной терапии, имеющих отношение к болезни депонирования кристаллов ПФК. В работе M. Fahey и соавт. [14] исследовалось действие дексаметазона на формирование кристаллов ПФК in vitro в культуре свиных хондроцитов при инкубации с АТФ. Оказалось, что дексаметазон дозозависимо увеличивают АТФ-обусловленную минерализацию и активность только трансглутаминазы, а активность щелочной фосфатазы и пирофосфат-фосфогидролазы не изменялась. Логично предположить, что ингибиторы трансглутаминазы подавляли формирование кристаллов ПФК. Эти данные позволяют по-новому взглянуть на важную роль трансглутаминазы и акцентируют внимание на возможной инициирующей роли локальной глюкокортикоидной терапии в отложении кристаллов ПФК.
Колхицин подавляет вызываемое кристаллами ПФК воспаление, а также ингибирует эластазу и матричную металлопротеиназу. Эти два фермента играют важную патогенетическую роль в первичном ОА. Возможно, колхицин может, подавляя их активность, оказывать хондропротекторное действие.
Учитывая патогенез болезни депонирования кристаллов ПФК, представляется перспективным исследование широкого спектра локальной антифлогистической терапии, начиная с таких известных средств, как препараты гиалуроновой кислоты и метотрексата.
Таким образом, болезнь депонирования кристаллов пирофосфата кальция занимает лидирующее положение среди болезней суставов. В основе его лежат активные процессы как дегенеративно-деструктивные, так и репаративные. Они развиваются в ответ на различные повреждения и осуществляются с помощью саморегулирующейся системы со стереотипной динамикой, принципиально не зависящей от типа повреждения. В разные фазы болезни меняются типы клеточного взаимодействия, переходя от одних популяций клеток к другим через межклеточное взаимодействие путем синтеза различных медиаторов, в том числе цитокинов, факторов роста и экспрессии их рецепторов.
Достаточно высокая эффективность ацеклофенака (Аэртала) связана с его уникальной в известной мере способностью многокомпонентно подавлять воспаление, воздействуя в том числе и на цитокиновую активность, а не только на ЦОГ-2 и простагландин Е2. К особенностям действия этого препарата относится и способность его главного метаболита (4-гидроксиацеклофенака) подавлять воспалительную активность хондроцитов при ОА и стимулировать продукцию глюкозоаминогликанов, позволяющую обсуждать его уникальность как препарата, обладающего хондропротективными свойствами [7].
Результаты полученных российских и европейских крупномасштабных исследований позволяют говорить о бесспорных преимуществах терапии ацеклофенаком (Аэрталом) воспалительных и дегенеративно-дистрофических заболеваний, сопровождающихся суставным синдромом в повседневной клинической практике.
Литература
- Ильиных Е. В., Владимиров С. А., Кудаева Ф. М. и соавт. Маска пирофосфатной артропатии: разоблачение // Современ. ревматол. 2011: 2: 35–36.
- Носкова Т. С., Широкова К. Ю., Бахтиярова Т. И., Филимонова Н. С. Болезни отложения кристаллов кальция: клиника и лечение // Клин. геронтол. 2012; 3–4: 59–63.
- Fahey M., Mitton E., Muth E., Rosenthal A. K. Dexamethasone promotes calcium pyrophosphate dihydrate crystal formation by articular chondrocytes // J. Rheumatol. 2009; 36 (1): 163–169.
- Liu Y. Z., Jackson A. P., Cosgrove S. D. Contribution of calcium-containing crystals to cartilage degradation and synovial inflammation in osteoarthritis // Osteoarthritis Cartilage. 2009; 17 (10): 1333–1340.
- Носков С. М., Дыбин С. Д., Цурко В. В. Поражение суставов при депонировании кристаллов кальция (микрокристаллическая артропатия) // Практикующий врач, сегодня. 2012; 3: 2–10.
- Zhang W., Doherty M., Pascual E. et al. EULAR recommendations for calcium pyrophosphate deposition. Part II: management // Ann. Rheum. Dis. 2011; 70 (4): 571–575.
- Насонова В. А. Ацеклофенак (аэртал) в клинике ревматолога // Тер. архив. 2005; 5: 87–90.
- Леммел У. М., Лееп Б., Баст Дж., Асландис С. Удовлетворенность пациентов и врачей препаратом ацеклофенак: результаты Европейского обсервационного когортного исследования (опыт применения ацеклофенака при болях воспалительного происхождения в повседневной практике) // РМЖ. 2003; 7: 410–415.
- Henrotin Y. et al. In vitro effects of aceclofenac and its metabolits on the production by chondrocytes of inflammatory mediators // Inflamm. Res. 2001; 50: 391–399.
- Yanagawa A., Kudo T., Shimada J. et al. Endoscopic stady of the damaging action of diclofenac Na, aceclofenac and its placebo on the gastric and duodenal mucosa // Jap. J. Rheumatol. 1998; 8: 245–259.
- Castellsague J., Riera-Guardia N., Calingaert B. et al. Individual NSAIDs and upper gastrointestinal complications a systematic review and meta-analysis of observational studies (the SOS project) // Drug Saf. 2012; 35 (12): 1127–1146.
- Шарапова Е. П., Таскина Е. А., Гукосян Д. А. и соавт. Нестероидные противовоспалительные препараты в лечении остеоартроза (сравнительное исследование ацеклофенака с диклофенаком) // Справочник поликлин. врача. 2012; 10: 61–64.
- Носкова Т. С., Дыбин С. Д., Бахтиярова Т. И. и соавт. Локальная терапия хронического синовита коленных суставов у больных остеоартрозом с депозицией кристаллов пирофосфата кальция // Клин. геронтол. 2013; 1–2: 17–21.
- Fahey M., Mitton E., Muth E., Rosenthal A. K. Dexamethasone promotes calcium pyrophosphate dihydrate crystal formation by articular chondrocytes // J. Rheumatol. 2009; 36 (1): 163–169.
Статья опубликована в журнале Лечащий Врач
материал MedLinks.ru




