Введение
Острые респираторные инфекции (ОРИ) лидируют
в структуре заболеваемости во всех возрастных группах и во всех странах. Большинство
сезонных ОРИ являются плохо контролируемыми заболеваниями вследствие уникальной
способности респираторных вирусов к генетической трансформации, что обусловливает
появление новых штаммов, в отношении которых сложившийся популяционный иммунитет
оказывается несостоятельным [1]. Дети, особенно раннего возраста, проявляют повышенную
чувствительность к инфекционным агентам со склонностью к более тяжелому и генерализованному
течению заболеваний с высоким риском осложнений и даже летальных исходов, что делает
их наиболее уязвимым контингентом для респираторных вирусов.
Частые ОРИ у детей связаны с высокой трансмиссивностью,
контагиозностью, вирулентностью, гетерогенностью и широкой распространенностью большинства
респираторных возбудителей; полиэтиологичностью, появлением новых, ранее неизвестных
штаммов; изменчивостью антигенной структуры циркулирующих вирусов в связи с постоянными
и множественными мутациями респираторных патогенов; в основном воздушно-капельным
и контактным путем передачи инфекции; недлительным (от 6 мес. до 2 лет) противовирусным, чаще типоспецифическим
иммунитетом. Все это лежит в основе не только сезонных эпидемических вспышек и даже
пандемий, но и быстрого развития резистентности к этиотропным препаратам, а также
определяет трудности в создании противовирусных вакцин [2]. В то же время разработка
и внедрение в клиническую практику новых методов иммунопрофилактики респираторных
инфекций влечет за собой изменение антигенной структуры вирусов, по отношению к
которым создаются вакцинные препараты, что в свою очередь диктует необходимость
поиска новых противовирусных средств [3].
В процессе длительного филогенетического
сосуществования человека с вирусами последние выработали стратегии (активные и пассивные)
ускользания (эвазии) от противовирусного действия факторов врожденного иммунитета
путем ингибирования или блокирования синтеза интерферонов (IFN) или инактивации
их рецепторов, а также нарушения IFN-сигналинга, что препятствует синтезу собственных
эндогенных IFN [4–7]. Следствием этого может стать не только формирование высокой
вирусной нагрузки на организм ребенка или взрослого, но и более тяжелое течение
заболевания с развитием токсических форм, «цитокинового шторма», что диктует необходимость
применения противовирусных препаратов на самых ранних этапах инфекции.
Известно, что первые IFN начинают определяться
в тканях плода на 10–11-й неделе гестации, а с 10–22-й недели IFN-α уже можно найти во всех органах (легкие, сердце,
кишечник, кожа, мышцы, мозг) [8–11], но эти IFN называются «ранними», так как они
характеризуются низкой гидрофобностью, сниженной противовирусной и иммуномодулирующей
активностью (действие направлено не на защиту, а на участие в развитии и дифференциации
клеток плода и новорожденного), а их метаболизм происходит в почках, в то время
как поздних — в печени, что свидетельствует об их структурном различии. У детей
в возрасте от 1 мес. до 1 года способность к продукции IFN клетками периферической
крови снижена в 9 раз, в возрасте от 1 года до 3 лет — в 6 раз по сравнению со взрослыми
[11], а у детей с ОРИ нарушения IFN-статуса характеризуются снижением способности
к индуцированной продукции IFN-α [12].
Качественный этап перехода системы IFN от «незрелого» типа к «зрелому» приходится
на период раннего детства (от 1 года до 3 лет), когда исчезают ранние IFN. Для лиц
пожилого возраста характерно появление иммуностарения — комплекса структурных и
функциональных изменений адаптивного и врожденного иммунитета при низкой продукции
IFN, что влияет как на восприимчивость, так на тяжесть и исходы респираторной патологии
[13].
Одним из последствий пандемии COVID-19 стало
формирование поствирусного иммунодефицита. В то же время сезонные эпидемические
подъемы заболеваемости ОРИ характеризуются появлением новых субтипов респираторных
вирусов и наличием микст-вирусной инфекции (вирусно-вирусные, вирусно-бактериальные
ассоциации при главенствующей роли атипичных микроорганизмов, представителей семейства
Herpesviridae и др.),
а также большой вариабельностью клинических проявлений при отсутствии патогномоничных
симптомов и значительным количеством осложненных форм [11]. При этом выраженность
и скорость развития клинических проявлений ОРИ обусловлены не только свойствами
возбудителя и массивностью инвазии, но и активностью факторов иммунной защиты, направленных
на ограничение репродукции возбудителя и его последующую элиминацию [14].
Особую роль в защите организма от возбудителей
вирусных и бактериальных инфекций играют IFN — гликопротеины (низкомолекулярные
белки, цитокины), синтезируемые практически всеми клетками нашего организма в ответ
на вторжение чужеродных агентов или антигенное воздействие. В настоящее время известно
более 20 IFN, различающихся по генетической структуре, составу, биологическим свойствам
и механизму действия. Наиболее изученными и обладающими выраженным противовирусным
эффектом являются IFN I типа, включающие 19 различных подтипов: IFN-α, IFN-β,
а также IFN-δ, IFN-ε, IFN-αω,
IFN-κ, IFN Н-τ,
IFN-ω, IFN-ν
и IFN-ζ (или лимитин) [11, 15]. Синтез IFN I начинается через 30–40 мин
после контаминации слизистой оболочки дыхательных путей вирусами, достигает максимума
в течение 2 ч и сохраняет свой эффект 2–4 дня после первого включения. IFN I характеризуются
выраженным противовирусным эффектом в отношении ДНК/РНК-содержащих вирусов, бактерий
и других инфекционных агентов (действуют на все вирусы независимо от таксономического
профиля и на все этапы размножения вирусов в клетке); обладают прямым противовирусным
действием [11, 14]. IFN
I ингибируют процессы транскрипции и трансляции вирусных частиц; тормозят размножение
клеток, несущих чужеродную генетическую информацию; увеличивают число Fc-рецепторов
на мембранах фагоцитов, что усиливает фагоцитоз; повышают активность антигенпрезентирующих
клеток путем усиления экспрессии антигенов главного комплекса гистосовместимости
(MHC) I класса; усиливают цитотоксичность естественных киллеров (NK) и цитотоксических
Т-лимфоцитов (CTL); способствуют выработке цитокинов, являющихся факторами роста
для различных субпопуляций лимфоцитов [11], и др. Следствием действия IFN является
прекращение проникновения вирусов в клетки, нарушение транскрипции и трансляции
структурных белков вируса, что препятствует образованию новых вирионов и/или выделению
их в межклеточное пространство; удаление с помощью NK и CTL инфицированных вирусами
клеток; защита IFN окружающих незараженных клеток от возможного заражения, что в
большинстве случаев приводит к прерыванию инфекционного процесса и прекращению дальнейшего
распространения инфекции. Кроме того, IFN лимитируют распространение вирусных частиц
путем активации белка p53, что ведет к апоптозу инфицированной клетки [11]. Будучи
плейотропными цитокинами, IFN обладают и непрямым противовирусным эффектом — являются
связующим звеном между врожденным и адаптивным иммунитетом, усиливая огромное количество
иммунных реакций, направленных на подавление репликации вирусов и снижение вирусной
нагрузки [11, 16]. IFN I обладают также выраженным антибактериальным эффектом, в
том числе и в отношении атипичных микроорганизмов, что дает возможность применять
их при лечении не только ОРИ, но и бактериальных инфекций: IFN I участвуют в подавлении
таких патогенов, как Chlamydia
psittaci, Mycobacterium avium, Staphylococcus aureus, Toxoplasma gondii,
Leishmania tropica и
Candida albicans, Legionellaе, Cryptococcus и др. путем активации
механизмов захвата и переваривания бактерий, а также повышают чувствительность бактерий
к ряду антибиотиков [17, 18].
Острые респираторные инфекции — заболевания,
требующие в первую очередь этиопатогенетического лечения, что определяется трудностями
лабораторной верификации возбудителя, скоростью появления клинических симптомов,
тяжестью течения и возможностью формирования осложнений. Поэтому целью терапии ОРИ
является предотвращение развития воспалительного процесса и связанных с ним последствий
для пациента на самых ранних этапах инфекции. При этом тропность респираторных вирусов
к определенным тканям органов дыхания, общие для патогенов закономерности течения
воспаления, а также особенности врожденного и адаптивного противовирусного иммунитета
позволяют предположить, что система IFN не только является одной из наиболее перспективных
мишеней при разработке схем лечения и профилактики ОРИ, но и представляет собой
механизм, который может запустить, кроме локальных мукозальных процессов противовирусной
барьерной функции слизистой, и системные гуморальные и клеточные реакции. Поэтому
«доставка» IFN непосредственно в очаг попадания вирусов на слизистой оболочке может
способствовать как минимизации дозы лекарственного препарата, так и снижению риска
развития нежелательных лекарственных явлений, характерных для парентерального введения
препаратов. При этом коррекция иммунных механизмов в очаге воспаления дает больший
эффект, чем воздействие на иммунокомпетентные клетки кровеносного русла при системном
использовании препаратов. Такие процессы, как фагоцитоз, презентация антигенов,
цитотоксичность лимфоцитов и др., могут быть потенцированы непосредственно при местном
введении IFN [19].
Следовательно, логичным подходом к терапии
ОРИ, большинство возбудителей которых экспрессируются в основном через слизистую
носовых ходов и поражают клетки респираторного эпителия, может и должно быть интраназальное
применение препаратов IFN, обеспечивающих максимальный противовирусный и иммуномодулирующий
эффекты в месте проникновения респираторных патогенов и развития инфекционного воспалительного
процесса. Интраназальное назначение IFN в первые часы после появления признаков
ОРИ позволяет избежать дальнейшего развития заболевания более чем в 80% случаев,
а использование IFN совместно с противогриппозной вакциной оказывается более эффективно
для профилактики ОРИ, чем изолированное применение вакцины, при этом у детей профилактика
интраназальными препаратами IFN по сравнению с вакцинацией оказалась более действенной
и лучше переносимой [19, 20].
Одним из наиболее часто применяемых и хорошо
изученных топических противовирусных лекарственных средств является отечественный
препарат ВИФЕРОН® (гель/мазь для наружного и местного применения),
в состав которого входят человеческий рекомбинантный IFN α-2b в качестве основного
действующего вещества и антиоксиданты — α-токоферола
ацетат, лимонная и бензойная кислоты, чья антиоксидантная активность подтверждена
многочисленными клиническими исследованиями и многолетним опытом применения как
в нашей стране, так и за рубежом. Мембраностабилизирующие компоненты препарата ВИФЕРОН® гель/мазь (α-токоферола ацетат, лимонная
и бензойная кислоты) оказывают нормализующее действие на перекисное окисление липидов
и усиливают антиокислительную активность плазмы крови. Кроме того, в присутствии
антиоксидантов возрастает специфическая противовирусная активность IFN, усиливается
его иммуномодулирующее действие, что позволяет повысить эффективность собственного
иммунного ответа, а сами антиоксиданты способны стимулировать синтез эндогенного
IFN [16, 17]. Препарат ВИФЕРОН® гель/мазь используется для
лечения и профилактики ОРВИ, гриппа, разрешен к применению у детей, беременных женщин
и взрослых. Наличие в препарате липофильной основы и жирорастворимого витамина Е
(α-токоферола ацетат) повышает проницаемость многослойного
назального эпителия для рекомбинантного IFN α-2b,
что способствует его проникновению через слизистую оболочку носа в кровеносное русло
и оказанию системного противовирусного действия, что значительно отличает местные
формы препарата ВИФЕРОН® от других представителей рекомбинантных
IFN на водной основе, которые не могут проникать в системное кровеносное русло и
не способны оказывать системный противовирусный эффект, а действуют только местно1,2.
Содержание IFN α-2b в 1 г препарата ВИФЕРОН® гель составляет 36 000 МЕ, в 1 дозе препарата (полоска геля длиной
0,5 см) содержится 2400 МЕ действующего вещества; в 1 г препарата ВИФЕРОН® мазь — 40 000 МЕ, в 1 дозе (полоска мази длиной 0,5 см) —
2600 МЕ. Применение препарата ВИФЕРОН® гель/мазь 2–3 р/сут
позволяет достигать клинической эффективности при меньшей кратности введения и меньшем
количестве доз препарата, что значительно повышает эффективность терапии и комплаентность
пациента, которая в современном мире при лечении детей и взрослых с ОРИ играет очень
важную роль1,2 [17, 19, 20].
Таким образом, препарат ВИФЕРОН® гель/мазь по показаниям, разрешенному возрасту использования,
составу основных и вспомогательных веществ, дозированию, кратности назначения в
течение суток, отсутствию побочных эффектов и возможности развития нежелательных
явлений имеет преимущества перед другими препаратами: может назначаться с первых
дней жизни (гель разрешен к использованию с 1 мес., мазь — с 1 года), а также детям
всех возрастов, взрослым пациентам, беременным и кормящим1,2.
Цель исследования:
оценить эффективность и безопасность топического интраназального применения препаратов
на основе рекомбинантного IFN α-2b в комплексе с антиоксидантами
(α-токоферола ацетат, лимонная и бензойная кислоты;
гель/мазь для наружного и местного применения) в терапии и профилактике инфекций
вирусной этиологии у детей, взрослых, а также беременных.
Содержание статьи
Материал и методы
Проведен систематический обзор и метаанализ
доступных публикаций, посвященных изучению эффективности и безопасности применения
препарата ВИФЕРОН® гель/мазь в терапии, а также профилактике
вирусных инфекций дыхательных путей у детей, взрослых и беременных. Результаты представлены
в соответствии со стандартами, установленными в Положении о качестве представления
научного обзора и метаанализа (Quality of Reporting of Meta-analyses, QUOROM,
1999) [21].
Критерии включения работ. Отбирались
рандомизированные, сравнительные, контролируемые, в том числе плацебо-контролируемые
двойные слепые исследования, в которых препарат ВИФЕРОН® гель/мазь
сравнивали с плацебо или отсутствием дополнительной терапии. По возрастному составу участников отбирались
исследования, включавшие детей, взрослых, а также беременных на различных сроках
гестации; по типу патологии
включали исследования острых респираторных заболеваний вирусной этиологии. По типу вмешательства включали
исследования, в которых представлены характеристики сравниваемых групп (основная,
контрольная / группа сравнения), при этом пациенты основной группы получали препарат
в качестве дополнения к базисной терапии, а пациенты в группе сравнения/контроля
получали только базисную терапию, а также учитывали, чтобы в исследованиях были
проведены количественный и качественный анализ полученных результатов и соответствующая
статистическая обработка данных. Все пациенты лечились амбулаторно. По типу исходов в анализ
были включены только те исследования, в которых в качестве конечных точек использовались
следующие параметры: частота ОРИ, продолжительность заболевания; выраженность и
продолжительность основных клинических симптомов ОРИ; этиологическая расшифровка
возбудителей; время элиминации вирусов; биохимические маркеры, показатели гемо-
и иммунограммы. Для этого был проведен систематический поиск исследований по электронным
базам PubMed, eLibrary, «КиберЛенинка» (cyberleninka.ru), свободный поиск в «ГуглАкадемии»,
«Яндексе», SciHub за период с 1985 г. по сентябрь 2025 г. Стратегия поиска включала
использование валидизированного фильтра для идентификации рандомизированных испытаний
в сочетании с контекстным поиском. Поиск осуществлен по ключевым словам: «дети»,
«взрослые», «беременные», «острые респираторные инфекции», «интерфероны», «интерферон
α-2b человеческий рекомбинантный с антиоксидантами», «ВИФЕРОН гель/мазь», «интерферон
α-2b», «топические интерфероны», «Interferons», «Interferon
alfa 2b», «Topical interferons for children, adults and pregnant
women». Кроме того, были просмотрены все списки источников литературы найденных
оригинальных статей и обзоров, а также установлены контакты с производителем препарата
ВИФЕРОН® гель/мазь для выявления дополнительных опубликованных
и неопубликованных материалов. Ограничений в связи с языком публикаций не было.
После отбора всех потенциально подходящих статей был проведен анализ их полного
содержания для установления соответствия принятым критериям включения. Статьи, опубликованные
на языках, которыми эксперты не владели, были предварительно переведены. Расхождения
в результатах отбора данных были устранены при совместном обсуждении.
Составным компонентом проведенного систематического
научного обзора явился метаанализ публикаций, направленный на изучение качественных
(odds ratio, отношение шансов возникновения изучаемого исхода) и количественных
(unstandardized mean difference, нестандартизованная разница средних значений показателей,
standardized mean difference, стандартизованная разница средних показателей) параметров
выраженности эффекта назначения препарата ВИФЕРОН® гель/мазь.
Оценивали 95% доверительные интервалы (ДИ) рассматриваемых показателей выраженности
эффекта, что соответствовало уровню статистической значимости р<0,05. Использовали
модель случайных эффектов (random-effects model). Оценивали выраженность гетерогенности
данных, представленных в публикациях, на основе критериев τ2, Q-теста и показателя I2. Наличие ошибки
в отборе публикаций оценивали при помощи диаграммы funnel plot и изучения ее асимметрии
с использованием коэффициента ранговой корреляции. Метаанализ осуществляли с помощью
прикладной программы Comprehensive Meta-Analysis (CMA) v. 2.
Результаты исследования
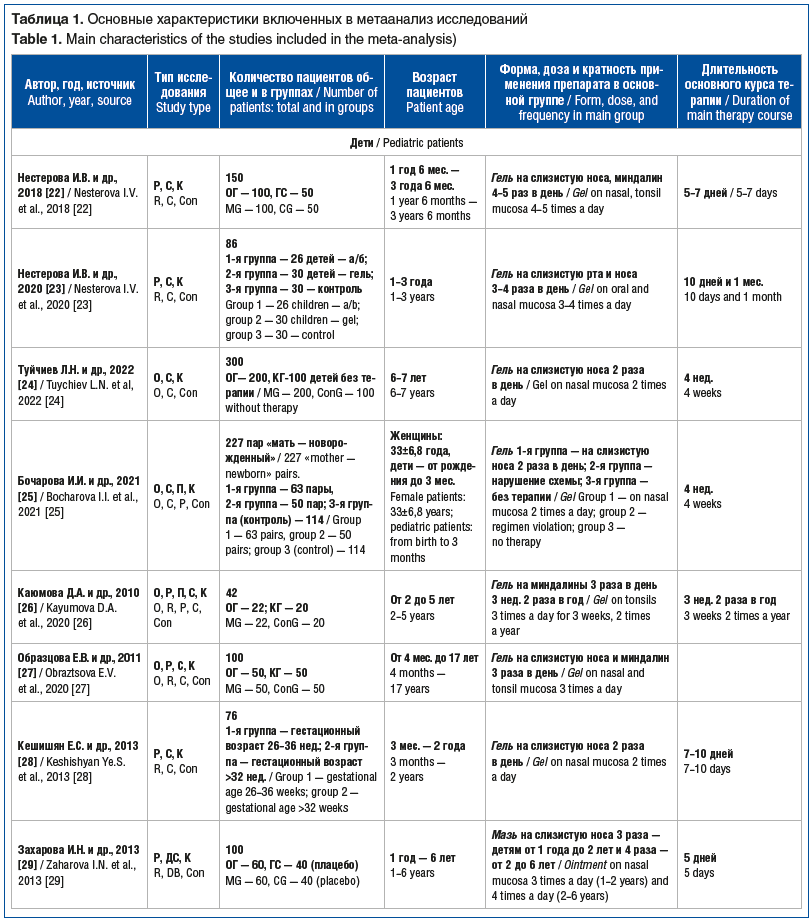
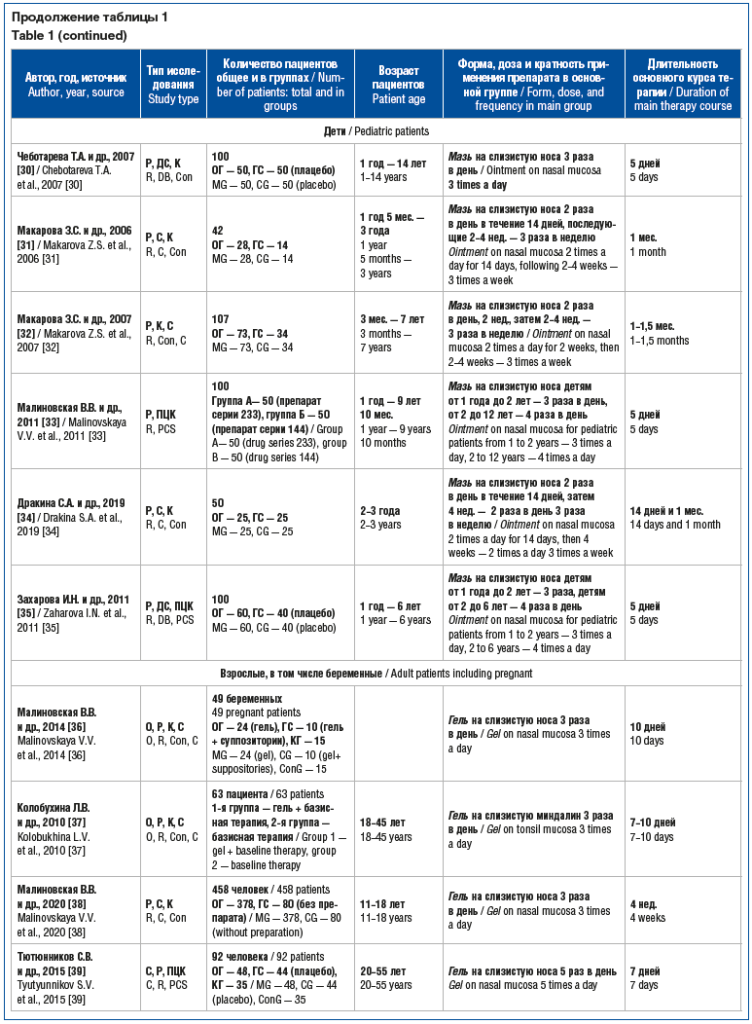
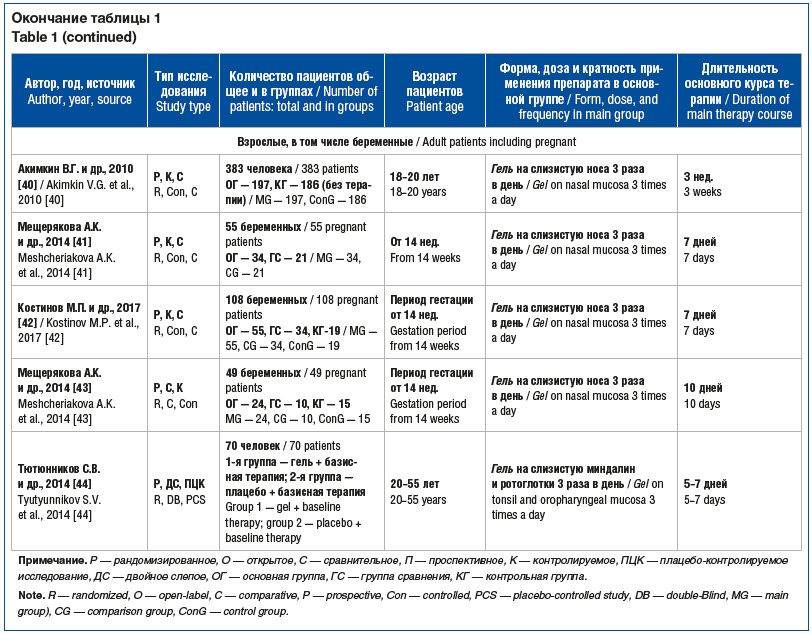
В ходе поиска было обнаружено 56 источников,
23 из которых соответствовали критериям включения в систематический обзор и метаанализ
(табл. 1). Все остальные исследования были исключены из-за несоответствия критериям
включения или недостаточно полного представления результатов. Все исследования,
включенные в метаанализ, по дизайну были открытыми, рандомизированными, контролируемыми,
сравнительными, двойными слепыми [29, 30, 35, 44] и плацебо-контролируемыми
[33, 35, 39, 44], выполнены в РФ. В 23 включенных исследованиях участвовали
1580 детей в возрасте от периода новорожденности до 14 лет, 1362 взрослых пациента
в возрасте от 18 до 45 лет, из которых 261 беременная с ОРИ при сроке гестации свыше
14 нед. При этом в 7 исследованиях у детей [22, 27–30, 33, 35] и 6 исследованиях
[36, 37, 39, 41–44] у взрослых изучали эффективность
местной интерферонотерапии при ОРИ, в том числе гриппе, а в 7 исследованиях у детей
[22, 27–30, 33, 35] и 2 исследованиях у взрослых [38, 40] — профилактический эффект
препарата (см. табл. 1).
Эффективность местного применения препарата
ВИФЕРОН® гель оценивали в 16 исследованиях [22–28,
36–44], в том числе у детей в 7 [22–28], у взрослых в 9 [36–44], а ВИФЕРОН® мазь — в 7 исследованиях [29–35], которые проводились только у
пациентов детского возраста.
Длительность назначения препарата ВИФЕРОН® гель у детей в острый период ОРИ составляла от 5–7 [22] до
7–10 дней [27, 28]. С профилактической целью гель использовался у детей от 4 нед.
[24, 25] до 10 дней + 1 мес. [23], по 3 нед. 2 раза в год [26]. Длительность назначения
препарата ВИФЕРОН® мазь у детей в острый период ОРИ составляла
5 дней [29, 30, 33, 35], с профилактической целью — от 1 [31] до 1,5 мес. [32,
34]. У взрослых пациентов ВИФЕРОН® гель в острый период заболевания
применялся от 5–7 [44] до 7–10 дней [36, 37, 39, 41–43], с профилактической целью
— от 3 [40] до 4 нед. [38].
Отмечена клиническая гомогенность проведения
исследований как среди детей, так и среди взрослых. Выбор пациентов осуществлялся
случайным методом, распределение в группы проводилось с помощью методов рандомизации;
во всех исследованиях был выполнен качественный полноценный анализ полученных результатов
с помощью методов современной статистики.
Нежелательных явлений, связанных с приемом
топических интраназальных препаратов на основе рекомбинантного IFN α-2b (мазь/гель для наружного и местного применения),
зарегистрировано не было.
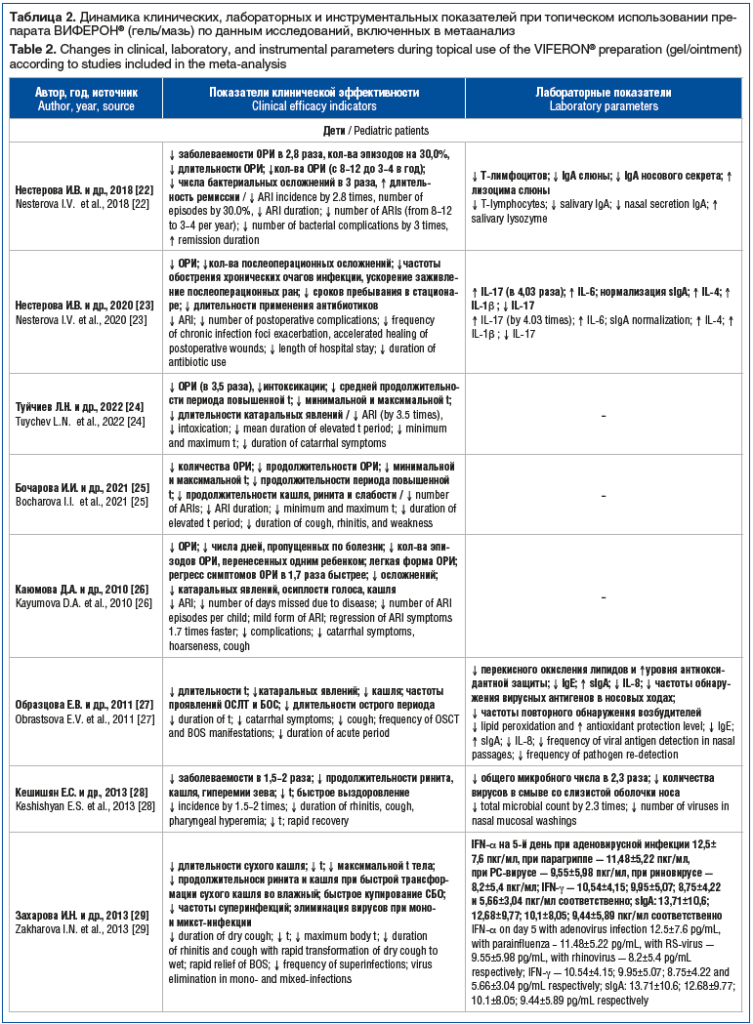
Во всех исследованиях (табл. 2) подтверждена
эффективность применения препарата в комплексной терапии ОРИ. Это выражалось в положительном
клиническом эффекте у пациентов детского возраста в виде уменьшения продолжительности синдрома интоксикации (с
3,3±0,7 до 2,3±0,6 дня, р<0,05 [29] и с 3,7±0,27 до 3,15±0,31 дня [30]) и его
выраженности (через 1–2 дня от начала лечения симптомы интоксикации отсутствовали
у 66,7% детей ОГ и 54,4% в группе плацебо, p>0,05 [29], у 40,8% детей, получавших
топическую терапию, и лишь у 10,4% в ГС (р<0,05)) [31]. У пациентов, получавших
мазь, средняя продолжительность снижения аппетита была меньшей, чем у больных из
группы плацебо (2,65±1,0 и 3,22±1,15 дня соответственно, р<0,05) [35]. При этом
значимым оказалось различие в сроках восстановления двигательной активности у детей:
на 3-й день топической терапии вялость сохранялась у 4,5% детей, получавших мазь,
и у 30,7% детей в группе плацебо (р<0,05) [32], а у детей старше 7 лет —
1,7±0,4 дня против 2,8±0,4 дня соответственно (p<0,05) [29]. У пациентов, получавших
мазь, отмечалось также более быстрое купирование лихорадки (на 3–4-й день болезни)
[29], сокращение ее длительности (с 2,66±0,16 до 2,2±0,16 дня, р<0,05 [27]; с
3,25±0,6 до 2,75±0,4 дня, р>0,05) [35].
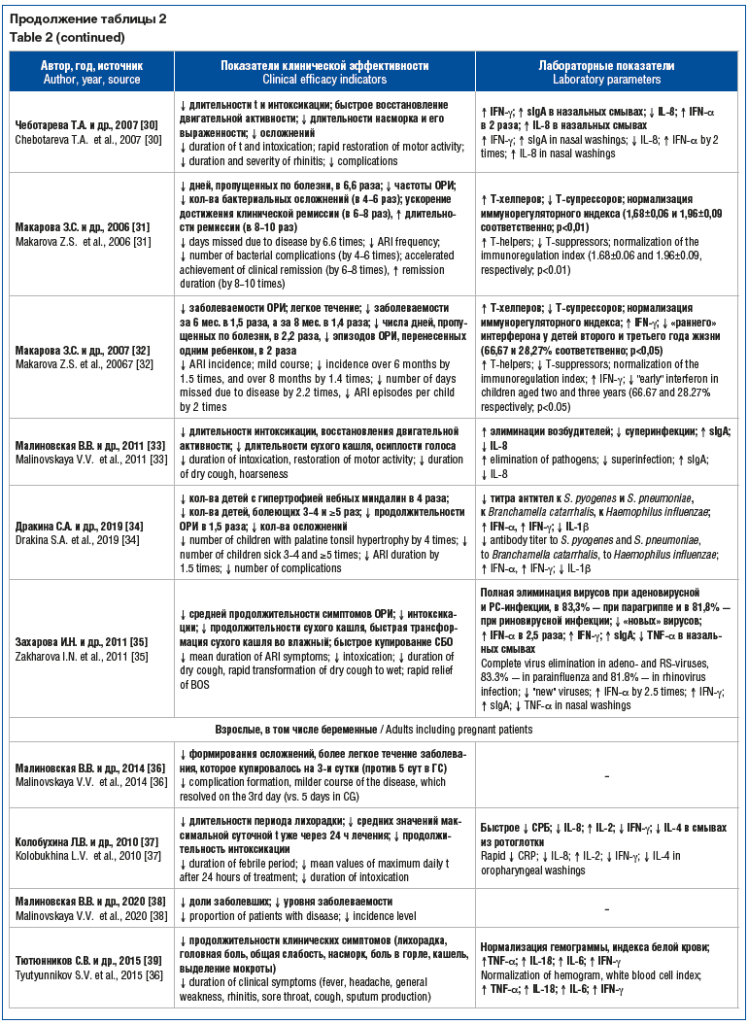
Применение топических препаратов при лечении
ОРИ приводило к сокращению длительности катаральных явлений
(с 8,96±0,35 до 6,4±0,25 дня, р<0,05) [27] при уменьшении средней продолжительности
ринита (с 3,89±1,0 до 3,25±0,98 дня, р<0,05 [28, 35] и с 4,4±0,5 до 3,5±0,2 дня,
p<0,05) [30] (у детей, получавших мазь, проявления ринита устранялись через
1–3 дня от начала лечения, таких детей было существенно больше, чем в КГ (59,7 и
38,4% соответственно, p<0,05) [28]); к уменьшению продолжительности кашля (с 7,73±0,47 до
5,83±0,36 дня, р<0,01) [31], в том числе сухого кашля (с 1,95±0,22 до
1,25±0,14 дня, р<0,05) [28, 32], при средней длительности кашля при использовании
мази 3,85±1,1 дня, плацебо — 4,5±1,0 дня (р<0,05) [29]; отмечалась быстрая трансформация
сухого кашля во влажный (с 2,98±0,15 до 2,2±0,1 дня, р<0,05 [31]; с 2,8±0,15
до 2,25±0,1 дня, р<0,05 [32]), что в целом облегчало общее состояние детей; к уменьшению продолжительности острого обструктивного
ларингита (ООЛ) (с 2,59±0,21 до 2,0±0,22 дня, р<0,05) [31], при
этом мазь оказывала положительное влияние на продолжительность осиплости голоса
— купирование симптома происходило на 15 ч быстрее, чем в группе плацебо
(2,3±0,23 дня против 3,0±0,24 дня, р<0,05) [32]; к снижению продолжительности синдрома бронхиальной обструкции
(СБО) (с 6,0±1,33 до 2,75±0,15 дня, р<0,05) [31]; к ускорению времени
купирования СБО (с 1,99±0,3 до 1,23±0,3 дня, р<0,05) [28, 35]. При этом уменьшалась продолжительность острого периода
заболевания до 6,44±0,31 дня в группе детей, получавших топическую
противовирусную терапию гелем, против 9,12±0,31 дня у пациентов без интраназальной
топической терапии (р<0,05) [31].
Элиминация респираторных
вирусов была зарегистрирована в 85,2% случаев при
использовании мази против 37,1% в группе детей без местной топической терапии независимо
от моно- (90,1 и 18,2% соответственно, р<0,05 [28]; 91,6 и 28,0% соответственно,
р<0,05 [32]) или микст-инфекции (76,2 и 45,8% соответственно, р<0,05
[28]; 88,5 и 55,5% соответственно, р<0,05 [32]) на слизистой оболочке органов
дыхания. Также в группе детей, получавших мазь, имела место полная (100%) элиминация
вируса при аденовирусной и респираторно-синцитиальной (РС) инфекции, при парагриппозной
инфекции — в 83,3%, при риновирусной — в 81,8% случаев [35], а контаминация вирусами
в период реконвалесценции встречалась значительно реже, чем у детей, не получавших
противовирусную интраназальную терапию (21,7 и 57,5% соответственно, р<0,05)
[28]. Наиболее выраженное протективное действие мази выявлено при инфицировании
аденовирусом, контаминация которым у пациентов ОГ была в 1,7 раза реже, чем в КГ
[28, 32]. Использование геля способствовало сокращению периода обнаружения вирусных
антигенов в носовых ходах больных (через 1–2 дня после начала лечения, в отличие
от детей КГ, имело место статистически значимое сокращение числа их повторного обнаружения
с 72 до 50%). Различия были более значимыми на 3–4-й день обследования (р<0,05)
[31]. Следовательно, использование препарата в форме геля интраназально при лечении
ОРИ более активно способствует очищению слизистой от возбудителей, в том числе от
аденовирусов, которые статистически значимо длительнее других сохранялись у детей
КГ (33,4%) (p<0,05) [31]. В группе детей, получавших мазь, отмечалось уменьшение частоты регистрации
осложнений (23,7% против
45% в группе плацебо, р<0,05). При этом у половины пациентов, получавших мазь,
вирус не обнаруживался уже на 5–6-й день болезни, тогда как в группе плацебо элиминация
вируса была отмечена только у каждого третьего больного (p<0,05) [29].
При изучении иммунологических показателей
было установлено, что у большинства детей, получавших терапию топическими формами
рекомбинантного IFN α-2b (гель), установлено повышение
секреторного IgA (sIgA) (80% и 1,5±0,05 мкг/мл против 14,3% и 1,0±0,04 мкг/мл в
ГС, р<0,05) [31], а у детей, получавших мазь, — с 6,45±0,8 до 10,02±1,97 мг/л
(p<0,05) [32] и 5,16±4,22 пкг/мл в ОГ и всего 0,65±0,25 пкг/мл в ГС [28,
29]. Концентрация sIgА в периоде реконвалесценции в группе детей, получавших мазь,
возрастала с 8,04±6,8 до 13,2±9,17 пкг/мл (р<0,05) и была значимо выше, чем в
группе плацебо (с 9,64±8,4 до 10,29±5,79 пкг/мл, р>0,05) [35]. Также показатели
sIgA увеличивались к 5-му дню болезни у детей раннего возраста, получавших мазь,
с 6,3±5,75 до 9,2±9,17 пкг/мл (р<0,05) [35]. При этом влияние препарата в форме
мази на показатели местного иммунитета в процессе лечения детей, больных ОРИ, было
более выраженным при аденовирусной инфекции. Так, уровень sIgA при аденовирусной
инфекции составлял 13,71±10,6 пкг/мл, при парагриппе — 12,68±9,77 пкг/мл, при РС-вирусе
— 10,1±8,05 пкг/мл и риновирусе — 9,44±5,89 пкг/мл [29].
IL-8 — основной хемокин и активный участник
острой воспалительной реакции, его средние значения снижались в 1,5 раза в группе
детей, получавших гель, что свидетельствует о более быстром купировании местной
воспалительной реакции на фоне проводимого лечения (p<0,05). В 85% случаев в
ОГ и 90,3% случаев в ГС регистрировалось снижение уровня IL-8, в то время как у
детей КГ снижение показателя отмечалось только в 61,9% случаев, а в 38,1% — даже
его повышение [31]. Средние значения IL-8 до начала лечения были довольно высокими
(ОГ — 945,5±233,96 пг/мл, группа плацебо — 526,41±269,53 пг/мл). По окончании лечения
в группе плацебо показатели практически не изменились (564,89±270,03 пг/мл,
p>0,05), а в группе детей, получавших мазь, отмечено существенное снижение содержания
IL-8 (420,68±128,13 пг/мл, p<0,05), что может свидетельствовать об уменьшении
выраженности воспалительного процесса на слизистой оболочке органов дыхания
[32]. По данным [29], при использовании мази отмечалось отсутствие изменения концентрации
IL-8 в назальных смывах, тогда как на фоне плацебо она достоверно увеличивалась
(с 386,4±49,0 до 640,9±122,6 пкг/мл, p<0,05); в работе [35] концентрация
IL-8 на фоне лечения изменялась незначительно (с 506,13±165,7 до 458,13±161,8 пкг/мл,
р>0,05), тогда как на фоне плацебо она достоверно увеличивалась (с
549,9±150,3 до 651,48±170,3 пкг/мл, р<0,05) [35].
Отмечено значимое снижение концентрации
TNF-α в назальных смывах при местном применении мази
(с 25,30±16,4 до 9,86±7,84 пкг/мл, р<0,05). У больных ОРИ, получавших плацебо,
его снижение было недостоверным и менее интенсивным — с 28,64±14,9 до
19,8±12,95 пкг/мл (р>0,05) [35]. В группе пациентов, получавших мазь, отмечалось
отсутствие увеличения уровня IL-1, а у 30% детей КГ выявлялось его повышение, сопровождавшееся
более длительным течением ОРИ [31]. Кроме того, включение в комплексную терапию
ОРИ у детей препарата в форме геля способствовало снижению интенсивности процессов
перекисного окисления липидов и повышению уровня антиоксидантной защиты [27].
Индуцированная продукция IFN-α увеличивалась у пациентов, получавших мазь, в
2 [29] и 2,5 раза (с 4,31±3,47 до 10,75±5,34 пкг/мл, р<0,05) [35] и достоверно
отличалась в периоде реконвалесценции от аналогичного показателя у детей, получавших
плацебо (увеличение лишь с 5,91±4,8 до 6,79±2,58 пкг/мл, р<0,05 [35]). Уровень
IFN-α в группе детей, получавших мазь, повышался по
сравнению со стартовыми значениями, а в группе плацебо динамики отмечено не было,
при этом средние значения IFN-α к 5-му дню лечения достоверно
увеличились при среднетяжелом течении ОРИ на 6,44±4,38 пкг/мл, а в КГ — на
0,88±0,55 пкг/мл, составив 9,66±5,3 и 6,98±3,5 пкг/мл соответственно
(p<0,05) [28]. У детей раннего возраста к 5-му дню болезни отмечено достоверное
увеличение уровня IFN-α (с 3,36±3,87 до
6,79±2,58 пкг/мл), а у детей старшего возраста значения IFN-α
превышали таковые у детей раннего возраста (11,75±5,34 пкг/мл против 6,79±2,58 пкг/мл
в ОГ; 9,75±4,78 пкг/мл против 3,56±1,86 пкг/мл в ГС и 13,29±5,79 и 9,2±9,17 пкг/мл
в КГ соответственно, р<0,05) [35]. Также к 5-му дню наблюдения у детей, получавших
мазь, уровни IFN-γ в назальных смывах были
достоверно выше (9,73±1,76 и 2,55±1,6 пкг/мл соответственно, p<0,05), чем у пациентов
без терапии [28], средние показатели IFN-γ
в ОГ выросли на 5,49±3,31 пкг/мл, в ГС — на 0,58±0,35 пкг/мл (р<0,05) [35]. Динамика
IFN-γ была достоверной только в ОГ (с 4,26±3,16 до
9,75±4,78 пкг/мл, р<0,05). В ГС хотя и отмечено повышение в назальных смывах
уровня IFN-γ (с 2,98±2,2 до
3,56±1,86 пкг/мл), однако указанные изменения не были статистически значимыми (р>0,05)
[35]. При этом влияние препарата в форме мази на показатели местного иммунитета
в процессе лечения детей, больных ОРИ, было более выраженным при аденовирусной инфекции:
на 5-й день лечения уровень IFN-γ при аденовирусной
инфекции составил 10,54±4,15 пкг/мл, при парагриппе — 9,95±5,07 пкг/мл, при РС-вирусе
— 8,75±4,22 пкг/мл и при риновирусе — 5,66±3,04 пкг/мл [29].
На 5-й день интраназального введения мази
достоверные различия (р<0,05) при недифференцированном ОРИ и при ОРИ с установленным
причинно-значимым вирусом были в отношении IFN-α
(9,71±6,32 и 7,75±2,51 пкг/мл соответственно) и TNF-α
(9,85±7,6 и 9,85±7,6 пкг/мл соответственно). При моноинфекции на 5-й день лечения
уровень IFN-α составлял 10,72±5,3 пкг/мл,
при микст-инфекции — 6,79±4,7 пкг/мл (р<0,05), показатели IFN-γ — соответственно 8,66±5,74 и 5,05±1,86 пкг/мл
(р<0,05) [35].
При изучении профилактического эффекта от
применения местных топических форм препаратов рекомбинантного IFN α-2b в виде геля и мази основными критериями эффективности
являлись: частота заболеваемости ОРИ в течение 3 мес. после включения ребенка в
исследование; длительность и выраженность клинических симптомов, их тяжесть; частота
нежелательных явлений, связанных с применением исследуемого препарата. Как показали
проведенные исследования, в группе пациентов, получавших гель, отмечалось статистически
значимое снижение количества заболевших ОРИ (единичные случаи) по сравнению с группой
контроля, в которой доля пациентов с ОРИ значительно повысилась (через 30 дней
7 и 23% (р1–3=0,048 и p2–3=0,009 соответственно),
через 60 и 90 дней — 2 и 12% (р1–3=0,024 и p2–3=0,006 соответственно) и 4% против 15% (р1–3=0,048
и p2–3=0,009 соответственно) [24]), кроме того, среди детей,
получавших гель, 23,8% вообще не заболели в период наблюдения, остальные перенесли
от 3 до 5 эпизодов ОРИ за период наблюдения против 5–9 ОРИ различной степени тяжести
в ГС [26]. Количество дней, пропущенных по болезни в группе, получавшей гель, было
в 1,5 раза (4,2 против 6,4 соответственно) и число эпизодов ОРИ, перенесенных одним
ребенком, в 2 раза (3,6±0,6 и 7,8±1,3) меньше, чем в ГС (р<0,05) [26]. Число
дней, пропущенных одним ребенком по болезни, в группе детей, получавших мазь, оказалось
в 6,6 раза меньше, чем в ГС (р<0,01), а число эпизодов ОРИ, перенесенных одним
ребенком, почти в 4 раза меньше (р<0,01). При этом все перенесенные ОРИ в ОГ
протекали в легкой форме и не требовали применения антибактериальной терапии
[26, 30, 34].
Дети в возрасте от 1,5 до 3 лет (41%), которые
в период адаптации к детским дошкольным учреждениям получали мазь, не заболели в
первые 3,5 мес., в то время как в ГС все дети за этот период перенесли от 1 до
4 эпизодов ОРИ различной степени тяжести; число дней, пропущенных по болезни, в
ОГ было в 2,2 раза, а число эпизодов ОРИ, перенесенных одним ребенком, в 2 раза
меньше, чем в ГС (p<0,01) [31]. Если заболеваемость детей ОРИ за первые 3,5 мес.
профилактического приема мази была в 2 раза ниже, чем в ГС, то за 6 мес. — в
1,5, а за 8 мес. — в 1,4 раза ниже, чем в группе, не получавшей препарат [31].
На фоне интраназального применения геля
положительный эффект отмечался у 86,6% детей, у 10% произошла санация, а у
13,3% уменьшилось количество вирусов на слизистой оболочке дыхательных путей
[27]. При этом в случае возникновения заболевания средняя продолжительность лихорадочного
периода у пациентов ОГ была самой низкой и составила 3,1±0,4 дня в 1-й, 3,8±0,5
дня во 2-й группе против 5,4±1,1 дня в группе контроля (р1–3=0,002,
p2–3=0,003, U-критерий Манна — Уитни с поправкой на множественные
сравнения) [25]. Также установлено, что интенсивность и длительность симптомов интоксикации
и катаральных явлений у детей с ОРИ в группах, получавших гель, были менее выраженными
и значимо короче, чем в КГ. Отмечено уменьшение длительности клинических проявлений
заболевания: интоксикационного, бронхолегочного синдрома и катаральных явлений.
Минимальные и максимальные данные термометрии составили в 1-й группе 37,1 и
37,6 °С (в среднем 37,3±0,2 °С), во 2-й — 37,1 и 37,4 °С (в среднем 37,2±0,2 °С)
и в 3-й — 37,3 и 38,1 °С (в среднем 37,4±0,4 °С) [24]. При попарном сравнении показателей
температуры тела в период ОРИ между группами было установлено, что уровень гипертермии
был значимо ниже в 1-й и 2-й основных группах по сравнению с группой контроля (р<0,001)
[24]. Осложнения в виде ООЛ (стеноз гортани I степени) за время наблюдения регистрировались
всего у 2 детей ОГ, в то время как в ГС — в 9 случаях, причем у 1 ребенка дважды,
у трех детей была II степень стеноза, у одного ребенка — III степень, дети со
II и III степенью стеноза были госпитализированы [26]. Назначение геля способствовало
уменьшению количества ОРИ в 3 раза, а регресс клинических проявлений наступал в
1,7 раза быстрее, при этом количество осложнений в ОГ было в 3,3 раза меньше
[26].
При регулярном назначении препарата в форме
геля согласно инструкции в парах мать — дитя как матери, так и их дети болели меньше
(7,9 и 20,2%, р=0,034), а среднее число дней заболевания у детей ОГ составило
2,8±0,7, в то время как в ГС (получали препарат нерегулярно с нарушением схемы)
и группе контроля (препарат не получали) — 5,3±0,7 и 5,7±1,1 (значимость критерия
Шапиро — Уилка 0,031, 0,086 и 0,018 соответственно). Уровень гипертермии был значимо
ниже у пациентов ОГ (минимальные и максимальные данные термометрии в 1-й группе
составили 37,0 и 37,8 °С (σ=37,4±0,3), во 2-й —
37,6 и 37,8 °С (σ=37,8±0,2), в группе контроля
— 37,8 и 38,5 °С (σ=37,9±0,2); различия были
статистически значимы как между 1-й и 2-й группой (р=0,017), так и между 1-й группой
и группой контроля (p=0,015). Средняя продолжительность лихорадочного периода у
детей в 1-й группе была самой низкой — 3,2±0,7 дня, во 2-й группе она составила
4,7±0,9 дня, в КГ — 4,4±1,1 дня (p=0,012 и p=0,021). Также у пациентов 1-й группы
минимальной была продолжительность кашля (3,3±0,5 дня против 4,8±0,7 дня во 2-й
группе, р=0,032), а также ринита и ухудшения самочувствия в виде слабости — в
1-й группе 4,6±0,5 дня, во 2-й группе 5,3±0,5 дня, p=0,033) [25].
Частота ОРИ в группе детей, получавших мазь,
снижалась с 10–18 до 2–3 раз в году, сокращалось число бактериальных осложнений
(в 4–6 раз), ускорялось достижение клинической ремиссии в 6–8 раз, а длительность
ремиссии увеличилась в 8–10 раз (с 7–10 до 100–150 дней) [34]. В группе детей, получавших
гель, все перенесенные ОРИ протекали в легкой форме, реже наблюдались бактериальные
осложнения, ООЛ (13,6%) [26, 27, 30], в то время как в группе сравнения в 3 раза
чаще отмечалось развитие среднего отита, в 2,7 раза чаще — синусита, а ООЛ регистрировался
почти у половины (45%) пациентов [26].
При сравнении заболеваемости ОРИ в течение
1 года до и после профилактического использования мази установлено снижение количества
пациентов, переносящих ≥5 эпизодов ОРИ (с 28 до 4%, р=0,0244), в то время как в
ГС число детей, болеющих 3–4 и ≥5 раз, осталось неизменным и статистически значимо
отличалось от числа детей ОГ (р=0,0311, р=0,0116), а продолжительность заболевания
была в 1,5 раза меньше, чем в ГС (8,22±0,86 и 14,08±1,05 дня соответственно, р=0,0462)
[33]. Кроме того, среди детей ОГ не было отмечено случаев пневмонии (р=0,0111),
а в ГС ее перенес каждый пятый ребенок (р=0,0048), также в ОГ достоверно чаще регистрировались
отиты (4 и 32% соответственно, р=0,0016) [33].
Мониторинг фарингоскопических признаков
воспалительного процесса глотки показал, что на 3-й день от начала лечения гелем
наблюдался значительный регресс: гиперемия и отечность исчезали в среднем на 3-й
день в основной и на 5-й день в группе сравнения; в 1,5 раза уменьшилось количество
детей с гиперемией задней стенки глотки и дужек, в 2 раза — с гипертрофией небных
миндалин I–II степени (р=0,0001), в 4 раза снизилось количество детей с налетом
на миндалинах и языке (р=0,0369) [33]; длительность ринита в ОГ составила
4,1±0,18 дня против 5,6±0,33 дня в ГС, а осиплости голоса — 2,2±0,14 дня против
2,7±0,08 дня, длительность кашля — 4,2±0,22 и 5,4±0,28 дня соответственно (р<0,05)
[26]; средняя продолжительность ринита в группе детей с проведенной местной интерферонопрофилактикой
была почти вдвое короче, чем у детей, не получавших профилактику (3,4 и 6,27 дня
соответственно); кашля — в 1,5 раза короче (3,65 и 5,6 дня), гиперемии зева — в
1,3 раза меньше (3,8 и 5,1 дня), а гипертермическая реакция, достигающая фебрильных
значений, отмечалась более чем в 2,5 раза чаще в группе, не получавшей гель в качестве
профилактики (3,6 и 1,5 соответственно) (р<0,05) [27]. При использовании мази
у детей ОГ отмечалось значимое уменьшение и исчезновение патологических признаков
в носоглотке относительно детей ГС. Специфическая профилактика с местным применением
препарата в форме геля позволила снизить уровень общей заболеваемости в соматическом
отделении примерно в 1,5–2 раза [27].
Местное применение препаратов рекомбинантных
IFN с профилактической целью приводило не только к положительным клиническим эффектам,
но и к изменению иммунологических и микробиологических параметров. Так, использование
препарата в форме геля способствовало снижению общего микробного числа в 10–100
раз (р=0,84), а количество ассоциаций микроорганизмов сокращалось с 14 (р=0,56)
до 6 (р=0,24), т. е. в 2,3 раза (χ2=9, р<0,05) [33]; достоверному (р<0,01) увеличению субпопуляции
Т-хелперов (с 38,2±0,45 до 41,73±0,67%), уменьшению Т-супрессоров (с 22,98±0,52
до 21,27±0,62%, р<0,05), нормализации иммунорегуляторного индекса (с
1,68±0,06 до 1,96±0,09 соответственно, р<0,01), в то же время достоверных различий
в динамике иммунологических показателей у детей ГС не получено (р>0,05) [30,
34]; достоверному (р<0,01) увеличению IFN-γ
у часто болеющих детей (ЧБД) [30]; снижению циркулирующего «раннего» IFN-α у детей второго и третьего года жизни
(66,67% детей до терапии и 28,27% — после окончания лечения, р<0,05) [30]; уменьшению
титра антител III класса к S.
pyogenes (р=0,0251) и S. pneumoniae (р=0,0491), титра антител II класса к Branchamella catarrhalis
(р=0,0369), титра антител I класса к Haemophilus influenzae (р=0,0251) [33]. При использовании
мази среди детей ОГ статистически значимо увеличился уровень противовоспалительных
цитокинов, обладающих выраженным противовирусным эффектом, — IFN-α (р=0,0088) и IFN-γ
(р=0,0014), тогда как среди детей ГС эти показатели остались неизменными. Статистически
значимо снизилась концентрация провоспалительных цитокинов (IL-1, р=0,0072)
[33].
В двух работах изучалась эффективность и
безопасность препарата в форме геля при иммунореабилитации ЧБД. Так, после завершения
программы двухэтапной иммунореабилитации в группе ЧБД, получавших гель, произошло
снижение заболеваемости ОРИ в 2,8 раза (с 8–12 до 3–4 раз в год, р<0,05)
[22]; уменьшилась частота ОРИ (в 75,18±2,335% случаев), в том числе в 2,5–3 раза
— осложненных и неосложненных форм; снизилось количество обострений хронических
очагов инфекции верхних дыхательных путей (в 63,15±4,53% случаев) [23]; значительно
сократилась длительность эпизодов ОРИ (на 45,5%, т. е. в 1,87 раза (р<0,05)),
а также число бактериальных (в 3 раза) [22] осложнений, а эффективность реабилитации
возросла в 100% случаев [23]. Кроме клинической эффективности отмечено улучшение
иммунологических параметров: снизилось количество Т-лимфоцитов (р<0,05)
[23], IL-17 в ротовой жидкости, а также IL-4 (до 17,3 [15,9; 18,96] пг/мл, р<0,05)
и IFN-γ [23]; повысилось содержание IL-17 (в 4,03 раза,
до 21,8 [10,0; 37,8] пг/мл против 5,4 [3,8; 5,9] в контроле, p<0,05), IL-6 (до
3,8 [1,37; 4,3] пг/мл против 2,63 [2,41; 2,85] пг/мл, p<0,05) [23], а также
sIgA слюны и носового секрета (р<0,05) [22], лизоцима слюны (р<0,05) [22]
и IL-1β (до 57,3 [45,9; 63,96] пг/мл, p<0,05)
[23]. Это может свидетельствовать о регрессии воспалительного процесса в очагах
хронической инфекции [23] и компенсации некоторых дефектов мукозального иммунитета,
что клинически сопровождалось снижением респираторной заболеваемости у пациентов
группы ЧБД.
Оценка эффективности применения препарата
в форме геля при лечении ОРИ у взрослых проводилась в 9 работах [36–44], при этом
в остром периоде заболевания — в 7 работах [36, 37, 39, 41–44] и с профилактической
целью — в 2 работах [38, 40]. Анализ полученных результатов показал, что применение
геля интраназально в остром периоде ОРИ способствовало более легкому течению инфекции
(в группе контроля — среднетяжелое) [43]; купированию симптомов заболевания на
3-й день (против 5-го дня в группе контроля) [36]; уменьшению продолжительности
лихорадки, головной боли, общей слабости, насморка, боли в горле, кашля
(p<0,05) [39]. При этом нормализация температуры происходила в течение 36 ч
(при раннем начале терапии у 88% пациентов, при позднем — у 49% (р<0,05)); снижение
средних значений максимальной суточной температуры отмечалось через 24 ч от начала
лечения [37]. Также установлено уменьшение количества осложнений со стороны верхних
дыхательных путей (параназальные синуситы развивались в 16,7% случаев при раннем
начале лечения [36], в 40% — при позднем [43] и в 53,3% — при использовании только
симптоматической терапии).
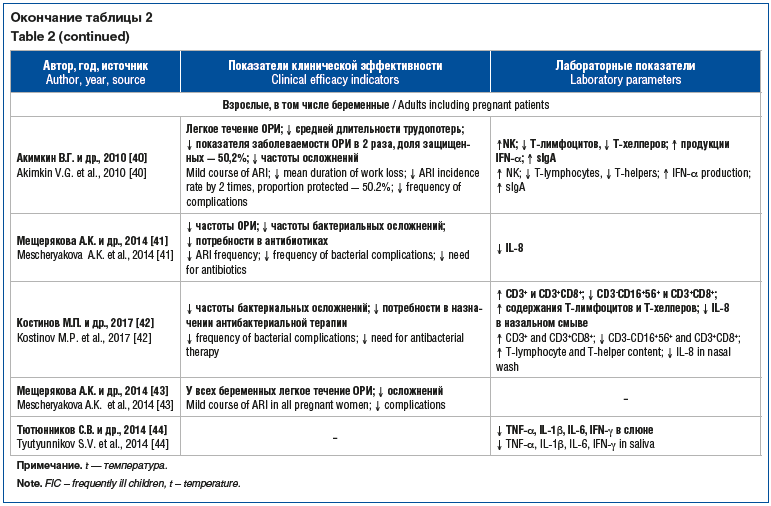
У беременных ОГ частота проявлений острого
фарингита при использовании геля уменьшалась с 29,4 до 5,9% (р<0,05) против
23,8% в ГС [41], бактериальные осложнения регистрировались у 11,8% пациентов с ОРИ,
что значительно снижало потребность в антибиотиках (11,8±5,5 и 39±11,5% соответственно,
р<0,05) [42], в то время как в ГС осложнения регистрировались у 38,1% [42] и
40% [43] беременных (р<0,05) в виде острого гнойного синусита, в половине случаев
сопровождавшегося острым гнойным средним отитом [43]. Даже при позднем начале терапии
препаратом в форме геля (после 48 ч от начала ОРИ) осложнения со стороны верхних
дыхательных путей регистрировались у 30% беременных, в то время как у женщин, получавших
только симптоматическую терапию, осложнения диагностированы в 46,7% случаев (р<0,05)
[43].
Улучшение клинического течения ОРИ сопровождалось
гематологическими сдвигами в виде нормализации показателей гемограммы, индекса белой
крови — 1,705±0,023 у.е. против 1,792±0,024 у.е. в группе плацебо (р<0,05); уровня
про- и противовоспалительных цитокинов: TNF-α
(1,34±0,68 и 1,96±0,87 пг/мл соответственно, р<0,05); IL-1β (2,60±0,63 и 2,88±0,62 пг/мл соответственно,
р<0,05); IL-6 (2,41±0,54 и 5,77±0,64 пг/мл соответственно, р<0,05), IFN-γ (1,33±0,70 и 3,72±0,79 пг/мл соответственно,
р<0,05) [39]. Изменения уровня С-реактивного белка на фоне терапии гелем были
более выражены у пациентов ОГ (84,4±9,0 и 4,0±1,2 мкг/мл соответственно, р<0,05;
111,2±10,1 и 10,2±2,3 мкг/мл соответственно, р<0,02) [37].
Наиболее значимые изменения в мукозальном
иммунитете касались основного провоспалительного цитокина — IL-8, содержание которого
на фоне терапии гелем значительно снижалось (у 87% больных ОГ до 277,08±61,89 пг/мл
и у 72% пациентов ГС до 287,76±72,44 пг/мл, р<0,05) [37], что может свидетельствовать
о более раннем разрешении воспалительного процесса на слизистых оболочках верхних
дыхательных путей [41]; содержание IL-4 уменьшалось до 11,13±1,13 и 26,99±3,16 пг/мл
соответственно (p<0,05) [37]; а IFN-γ
— до 8,24±1,76 и 16,79±4,31 пг/мл соответственно (p<0,05). В то же время значения
sIgA в ОГ характеризовались тенденцией к повышению (с 47,24±3,79 до 51,21±2,33 мг/л),
а в ГС снижались (до 43,28±3,13 мг/л) [37].
При этом у беременных, получавших гель интраназально,
отмечено снижение уровня IL-8 до 623 пкг/мл (495–1024, р<0,05), в назальном смыве
уровень IL-8 уменьшался с 1353 [781; 1007] до 623 [495; 1024] пг/мл (р<0,05)
при наличии тенденции к снижению NK-клеток, что наблюдается при физиологическом
течении беременности [42]; происходила нормализация содержания TNF-α (1,35±0,62 пг/мл), IL-1β
(2,61±0,57 пг/мл), IL-6 (2,43±0,48 пг/мл), IFN-γ
(1,35±0,64 пг/мл) в слюне [44]. В группе пациенток, получавших только симптоматическую
терапию, значения IL-8 не изменялись и составили 912 (651–1679) пкг/мл
(p>0,05), а концентрация IFN-α и
sIgA не отличалась от исходной и составила 16,3 (0–53) пкг/мл и 14,3 (11,5–21) мкг/мл;
27,7 (8,9–54,2) пкг/мл и 14 (11,4–16,9) мкг/мл соответственно (р>0,05) [41].
На фоне терапии гелем выявлено нарастание содержания Т-лимфоцитов (с 73,36±0,99
до 77,85±1,5%, р<0,01), Т-хелперов (с 42,94±1,04 до 45,9±0,8%, р<0,01)
[42]. Включение в комплекс базисной терапии беременных препарата в форме геля в
первые дни заболевания оказывало системное влияние на клеточное звено иммунитета
и приводило к восстановлению субпопуляционного состава лимфоцитов крови (CD3+; CD16+56+; CD3+CD8+), характерного для физиологического
течения беременности [42].
Применение препарата в форме геля с профилактической
целью у взрослых показало, что в ОГ в период терапии и в течение 2 мес. после не
было выявлено ни одного случая заболевания ОРИ (p<0,001), в то время как в ГС
ОРИ диагностированы у 37,5% пациентов, а показатели помесячной заболеваемости колебались
от 7,5 до 22,5 эпизода [38] и от 6,0 до 203,2 на 100 человек против значений от
12,7 до 343,4 на 100 человек [40]. Профилактическое применение геля привело к снижению
показателя заболеваемости ОРИ в 2 раза (71,2 на 100 человек и 143,0 на 100 человек
соответственно, р<0,05), а доля пациентов ОГ, защищенных от ОРИ, составила
50,2% [40].
Местное профилактическое применение геля
влияло на тяжесть течения ОРИ. Так, в группе пациентов, получавших гель, в
89,7% случаев регистрировалось легкое течение, тяжелых случаев ОРИ не было, а в
группе без терапии пациенты с легким течением заболевания составляли 2/3, со средним
и тяжелым течением — 1/3 случаев [40]. Средняя длительность одного случая трудопотерь
у пациентов ОГ составила 4,5–6 дней против 5,7–9,3 дня в ГС, что привело к увеличению
количества дней трудопотерь в 2,5 раза [40]. Анализ частоты осложнений ОРИ при использовании
геля показал, что в ОГ отмечалось уменьшение осложненных форм внебольничной пневмонии
и бронхитов в 2,4 и 2,1 раза соответственно (p<0,05) по сравнению с КГ, а показатели
защищенности составили соответственно 58 и 52,8% [40].
Эффективность препарата в форме геля выражалась
в нарастании активности системы IFN. Так, в ОГ до применения местных препаратов
у 64% пациентов IFN-α не определялся в сыворотке
крови, не было его спонтанной продукции, а способность клеток периферической крови
к индуцированной продукции IFN-α была крайне
низкой, у 36% пациентов, напротив, выявлялся высокий уровень IFN-α в сыворотке при его низкой индуцированной продукции
клетками крови. После применения препарата в форме геля у всех пациентов ОГ способность
клеток к продукции IFN-α в ответ на индукцию восстановилась,
в то время как у 80% пациентов КГ выявлялось отклонение от нормы, которое выражалось
в значительном снижении способности продуцировать IFN-α
(менее 50 пкг/мл), а у 40% пациентов с изначально нормальным уровнем активности
системы IFN через 3 нед. наблюдалось отсутствие IFN-α
в сыворотке, не было спонтанной продукции IFN-α
клетками периферической крови, а индуцированная продукция снижалась вплоть до ее
полного отсутствия [40]. Кроме того, в ОГ, прошедшей профилактический курс интерферонотерапии,
через 10 дней после его окончания наблюдалось значимое (p<0,05) увеличение доли
NK-клеток, а также относительное снижение доли Т-лимфоцитов, главным образом за
счет Т-хелперов, что свидетельствует о нормализации основных показателей клеточного
иммунитета, которые играют ключевую роль в эффективной защите организма от вирусных,
в том числе респираторных, инфекций (см. табл. 2) [40]. После начала профилактического
применения геля средний уровень sIgA в ОГ повысился с 16,53±3,38 до 26,70±3,07 мг/л
(p<0,05) и был значимо выше, чем в КГ, а через 1 мес. от начала профилактической
терапии уровень sIgA в КГ был ниже, чем в ОГ, в 3 раза.
При проведении метаанализа было установлено,
что топическое использование препарата на основе рекомбинантного IFN α-2b в комплексе с антиоксидантами (α-токоферола ацетат, лимонная и бензойная кислоты)
для местного и наружного применения при лечении пациентов с ОРИ способствовало статистически
значимому снижению продолжительности
заболевания (обобщенный показатель эффекта (рандомный эффект) составил
-4,372 дня (95% ДИ -7,272… -1,471). При изучении длительности и выраженности клинических
симптомов ОРИ было установлено, что основным клиническим показателем эффективности
интраназального использования препарата ВИФЕРОН® гель/мазь
была длительность лихорадочного
периода. Обобщенный показатель эффекта (рандомный эффект) составил
-1,066 дня (95% ДИ -1,511… -0,620), что свидетельствует о статистически значимом,
хотя клинически и не столь существенном снижении продолжительности лихорадки на
фоне местного назначения препарата. При этом выявлена статистически значимая гетерогенность
эффекта (Q=10,42; d.f.=4; p=0,034; I2=61,6).
Анализ иммунологических параметров у пациентов,
получавших препарат ВИФЕРОН® гель/мазь, показал, что наиболее
значимыми параметрами для оценки эффективности топической терапии ОРИ стали TNF-α, IL-10 и IL-8 в назальных
смывах. При этом уровни TNF-α свидетельствовали о статистически
значимом, хотя и малом эффекте назначения препарата, проявлявшемся в более выраженном
снижении уровня TNF-α в динамике заболевания
(обобщенный показатель эффекта (рандомный эффект) составил -0,297 (95% ДИ
-0,543… -0,050)). Значимая гетерогенность эффекта в исследованиях, включенных в
анализ, отсутствовала (Q=2,729; d.f.=3; p=0,437; I2=0). Результаты
оценки уровня IL-10 в назальных смывах в динамике ОРИ у обследованных пациентов
свидетельствуют о статистически значимом, среднем по своей выраженности эффекте
от топической терапии препаратом на основе рекомбинантного IFN α-2b, проявлявшемся в более выраженном снижении
уровня IL-10 в динамике заболевания: обобщенный показатель эффекта (рандомный эффект)
составил -0,476 (95% ДИ -0,847… -0,106). Хорошо известно, что IL-10 является противовоспалительным
цитокином и обладает множественным плейотропным воздействием на иммунорегуляцию
и воспаление, в том числе активирует IFN-связанные гены, что способствует синтезу
большого количества противовирусных молекул, следствием чего является ограничение
и прекращение воспалительного процесса в очаге попадания возбудителей на слизистую
оболочку. Кроме того, IL-10 снижает экспрессию цитокинов Th1-иммунного ответа, антигенов
MHC класса II и костимулирующих молекул на макрофагах, ингибирует индукцию секреции
воспалительных цитокинов (TNF-α, IL-1β, IL-12, IFN-γ
и др.), увеличивает выживаемость B-клеток, их пролиферацию и продукцию противовирусных
антител [16]. Значимая гетерогенность эффекта в исследованиях, включенных в анализ,
отсутствовала (Q=2,786; d.f.=2; p=0,248; I2=28,2). Исследование
уровня IL-8 в назальных смывах в динамике ОРИ у обследованных пациентов свидетельствует
о статистически значимом, малом по своей выраженности эффекте назначения препарата
ВИФЕРОН® гель/мазь, проявлявшемся в более выраженном снижении
уровня IL-8 в динамике респираторного заболевания (обобщенный показатель эффекта
(рандомный эффект) составил -0,391 (95% ДИ -0,663… -0,120). Значимая гетерогенность
эффекта в исследованиях, включенных в анализ, отсутствовала (Q=3,41; d.f.=3;
p=0,333; I2=12,0). Известно, что IL-8 является ключевым медиатором
воспаления, играющим важную роль в привлечении нейтрофилов и других клеток в очаг
воспаления и их дегрануляции, а также запуска окислительного взрыва, разрушения
внеклеточного матрикса и базальной мембраны. Секретируется любыми клетками, участвующими
в реакциях врожденного иммунитета и имеющими толл-подобные рецепторы на своей мембране
[16]. Следовательно, топическое применение препаратов на основе рекомбинантного
IFN (ВИФЕРОН® гель/мазь) способствует более быстрому завершению
воспалительного процесса на слизистой оболочке дыхательных путей.
Заключение
Таким образом, проведенный обзор и метаанализ
позволили установить, что использование препарата на основе рекомбинантного IFN
α-2b в комплексе с антиоксидантами (α-токоферола ацетат, лимонная и бензойная кислоты)
ВИФЕРОН® (гель/мазь для наружного и местного применения) приводило
к значительному клиническому эффекту у детей, взрослых, в том числе беременных.
Это выражалось в сокращении частоты ОРИ, уменьшении длительности течения заболевания
и его тяжести, снижении степени выраженности основных клинических симптомов, уменьшении
или отсутствии формирования осложнений, ускорении достижения клинической ремиссии
с увеличением ее длительности.
Клиническая эффективность интраназального
применения препаратов ВИФЕРОН® гель/мазь всегда сопровождалась
не только местными иммунологическими и микробиологическими сдвигами в виде санации
слизистых, активации мукозального иммунитета, изменения баланса про- и противовоспалительных
цитокинов в назальных смывах и др., но и системными эффектами — повышением показателей
функциональной активности системы IFN, а также адаптивного иммунитета, что сочеталось
с восстановлением гемограммы, субпопуляционного состава лимфоцитов и уровня про-
и противовоспалительных цитокинов периферической крови и др.
При этом основными и значимыми показателями,
определяющими клинический, микробиологический и иммунологический эффекты интраназального
применения препаратов ВИФЕРОН® гель/мазь, являются сокращение
длительности ОРИ, лихорадочного периода, более быстрая отрицательная динамика основных
противовоспалительных цитокинов (TNF-α,
IL-10) и главного медиатора воспаления — IL-8. Ни в одном из исследований не отмечено
нежелательных лекарственных реакций.
Сведения об авторах:
Косенкова Тамара Васильевна
— д.м.н., профессор; профессор кафедры детских болезней с клиникой педиатрического
факультета Института медицинского образования ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава
России; 197341, Россия, г. Санкт-Петербург, ул. Аккуратова, д. 2; ORCID iD 000-0002-6022-3420
Кельмансон Игорь Александрович
— д.м.н., профессор; профессор кафедры детских болезней с клиникой педиатрического
факультета Института медицинского образования ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава
России; 197341, Россия, г. Санкт-Петербург, ул. Аккуратова, д. 2; ORCID iD 0000-0002-4449-2786
Балахонова Яна Игоревна
— ассистент кафедры детских болезней с клиникой педиатрического факультета Института
медицинского образования ФГБУ «НМИЦ им. В.А. Алмазова» Минздрава России;
197341, Россия, г. Санкт-Петербург, ул. Аккуратова, д. 2; ORCID iD 0009-0001-6297-5052
Контактная информация:
Косенкова Тамара Васильевна, e-mail: tamara.kosenkova1955@gmail.com
Прозрачность финансовой
деятельности: никто из авторов не имеет финансовой заинтересованности в представленных
материалах или методах.
Конфликт интересов отсутствует.
Статья поступила
15.10.2025.
Поступила после рецензирования
25.10.2025.
Принята в печать
28.10.2025.
About the authors:
Tamara V. Kosenkova —
Dr. Sc. (Med.), Professor of the Department of Pediatric Diseases with Clinic,
Faculty of Pediatrics of the Institute of Medical Education, V.A. Almazov
National Medical Research Center; 2, Akkuratov str., St. Petersburg, 197341,
Russian Federation; ORCID iD 000-0002-6022-3420
Igor A. Kelmanson —
Dr. Sc. (Med.), Professor of the Department of Pediatric Diseases with Clinic,
Faculty of Pediatrics of the Institute of Medical Education, V.A. Almazov
National Medical Research Center; 2, Akkuratov str., St. Petersburg, 197341, Russian Federation; ORCID
iD 0000-0002-4449-2786
Yana I. Balakhonova —
Assistant Peofessor of the Department of Pediatric Diseases with Clinic,
Faculty of Pediatrics of the Institute of Medical Education, V.A. Almazov
National Medical Research Center; 2, Akkuratov str., St. Petersburg, 197341,
Russian Federation; ORCID iD 0009-0001-6297-5052
Contact information:
Tamara V. Kosenkova, e-mail: tamara.kosenkova1955@gmail.com
Financial Disclosure:
no authors have a financial or property interest in any material or method
mentioned.
There is no conflict
of interest.
Received 15.10.2025.
Revised 25.10.2025.
1Инструкция по медицинскому применению лекарственного
препарата для медицинского применения. Виферон® гель для наружного и местного применения.
(Электронный ресурс.). URL:
https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=807f73f5-f50e-4755-86da-33f973895f96
(дата обращения: 08.09.2025.)
2Инструкция по медицинскому применению лекарственного
препарата для медицинского применения. Виферон® мазь для наружного и местного применения.
(Электронный ресурс.). URL:
https://grls.rosminzdrav.ru/Grls_View_v2.aspx?routingGuid=c8ad0fd4-c88b-4ae6-9189-caa8f0ee471d
(дата обращения: 08.09.2025.)
Информация с rmj.ru






