Введение
Вагинальный микробиом характеризуется доминированием одного вида бактерий — лактобацилл. Эта микробиота отличается низкой степенью разнообразия и высокой динамикой изменения состава под воздействием экзогенных и эндогенных факторов [1, 2]. Увеличение разнообразия парадоксальным образом может быть связано с таким видом дисбиоза, как бактериальный вагиноз (БВ), который в настоящее время рассматривается как результат нарушения вагинальной экосистемы, т. е. замещение лактофлоры анаэробными бактериями, такими как Gardnerella vaginalis, Atopobium vaginae, Mobiluncus spp. Prevotella, и другими БВ-ассоциированными бактериями [3–5]. Таким образом, БВ представляет собой экологический дисбаланс микробиоты влагалища, который развивается в основном у женщин репродуктивного возраста в результате замены нормальных видов Lactobacillus, вырабатывающих перекись водорода и молочную кислоту, высокими концентрациями анаэробных бактерий. БВ — наиболее распространенная (до 30% случаев) причина выделений из влагалища у женщин детородного возраста [6–8]. Несмотря на отсутствие такой нозологии в Международной классификации болезней 10-го пересмотра (МКБ-10), в большинстве медицинских и научно-исследовательских организаций мира БВ рассматривается как заболевание и в настоящий момент является одним из самых распространенных заболеваний нижних отделов полового тракта (частота встречаемости, по данным различных источников, колеблется в диапазоне 16–65%) [9–11].
Этиология БВ до сих пор вызывает множество дискуссий, но его последствия для здоровья значительны, включая акушерские осложнения, повышенный риск инфекций, передающихся половым путем, и инфертильность [12–15]. Вагинальный дисбиоз на фоне БВ способствует развитию локальных иммунных, цитобиохимических и оксидативных нарушений, что повышает восприимчивость женщин к другим инфекциям урогенитального тракта, может приводить к активации неопластических процессов во влагалище и шейке матки, а также к репродуктивным неудачам от инфертильности до привычных потерь беременности, развитию послеродовых инфекционных осложнений [16, 17]. Диагноз БВ основан на клинико-микроскопических критериях Амселя и Ньюджента. Хотя оба этих метода широко применяются во всем мире в течение примерно трех десятилетий, оценка Ньюджента по-прежнему считается «золотым стандартом» в диагностике БВ [18, 19]. При этом, учитывая ограниченность микроскопических методов диагностики, исследования, основанные на методах молекулярной биологии, были разработаны в качестве альтернативных рациональных стратегий его диагностики [20, 21].
Лечение БВ в первую очередь направлено на деконтаминацию/контаминацию влагалища, т. е. остановку размножения условно-патогенных микроорганизмов с последующим восстановлением баланса флоры [1, 5, 11, 12, 16, 22]. Несмотря на наличие антибактериальных препаратов (в основном это 5-нитроимидазолы и клиндамицин), применяемых в терапии БВ, его рецидивы могут достигать 30–60% в течение годичного срока наблюдения, что интерпретируется исследователями как наличие непоследовательных схем терапии и изменения чувствительности флоры к наиболее часто применяемым лекарственным средствам [1, 12, 23]. Изменение чувствительности флоры способствует поиску новых (альтернативных) схем лечения данной патологии. В связи с вышесказанным создание адекватных алгоритмов терапии БВ является весьма актуальным.
В существующих отечественных клинических рекомендациях[1], как и в американских протоколах[2], первой линией терапии БВ является пероральное или вагинальное применение метронидазола или клиндамицина в течение 7 дней. Кроме того, предлагаются альтернативные схемы с однократным пероральным применением 2000 мг секнидазола или тинидазола 1000–2000 мг в течение 2–5 дней. Клиническая эффективность однократного приема секнидазола у пациенток с БВ изучалась в двух основных двойных слепых рандомизированных плацебо-контролируемых исследованиях. В обоих исследованиях секнидазол в дозе 2 г оказался эффективнее плацебо и приводил к клиническому излечению на 30-й день 53,3 и 67,7% пациенток соответственно, а к микробиологическому излечению — 43,9 и 40,3% соответственно [24, 25].
Относительно сформировавшейся резистентности G. vaginalis и связанной в том числе и с этим фактором высокой частотой рецидивов заболевания было установлено, что более половины пациенток, получавших перорально метронидазол по поводу БВ, испытывают рецидивы: 58% пациенток сообщили о рецидиве через 1 год в проспективном исследовании эффективности перорального приема метронидазола 400 мг 2 р/сут в течение 7 дней, а 52% пациенток сообщили о рецидиве при среднем периоде наблюдения 6,9 года [26].
На сегодняшний день вступило в действие Распоряжение Правительства РФ от 16 мая 2022 г. № 1180-р, которое определяет «перечень заболеваний или состояний (групп заболеваний или состояний), при которых допускается применение лекарственного препарата в соответствии с показателями (характеристиками) лекарственного препарата, не указанными в инструкции по его применению» (в частности, по коду МКБ-10 N76.8 (Другие уточненные воспалительные болезни влагалища и вульвы, в группу которых входит и Бактериальный вагиноз))[3]. При этом в российских клинических исследованиях в настоящее время было получено недостаточно данных по эффективности и комплаенсу при применении альтернативных схем терапии при БВ. Учитывая вышесказанное, целью исследования стал сравнительный анализ клинико-микробиологической эффективности и комплаенса терапии 5-нитроимидазолами пациенток с БВ.
Содержание статьи
Материал и методы
Дизайн исследования
Проведено проспективное открытое рандомизированное исследование результатов лечения 96 женщин с БВ (шифр по МКБ-10: N76.8 Другие уточненные воспалительные болезни влагалища и вульвы либо N89.8 Другие невоспалительные заболевания влагалища). Средний возраст пациенток составил 26,2±4,6 года (95% доверительный интервал (ДИ) 19; 45).
База исследования: ФГБОУ ВО КубГМУ Минздрава России. Лечебные учреждения, принимающие участие в исследовании: женские консультации г. Краснодара (ГБУЗ «ККБ № 2», ГБУЗ ДККБ, МБУЗ Роддом г. Краснодара МЗ КК).
Время проведения исследования: с января 2021 г. по январь 2023 г.
В исследовании соблюдались этические принципы Хельсинкской декларации ВМА (пересмотр 2013 г., Форталеза, Бразилия), правила Надлежащей клинической практики Евразийского экономического союза[4] и Правила клинической практики в Российской Федерации (приказ Минздрава России № 200н 2016 г.)[5]. Дизайн исследования одобрен локальным этическим комитетом ФГБОУ ВО КубГМУ Минздрава России (выписка из протокола № 24 от 19.12.2021).
Критерии включения в исследование: наличие верифицированного диагноза БВ; отрицательные результаты исследований по выявлению патогенной флоры (N. gonorrhoeae, T. vaginalis, C. trachomatis, M. genitalium); информированное согласие.
Всем женщинам, включенным в исследование, было рекомендовано в течение всего периода наблюдения пользоваться барьерными методами контрацепции (мужские презервативы).
Обследование проводилось согласно приказу Минздрава России от 20.10.2020 № 1130н «Об утверждении Порядка оказания медицинской помощи по профилю «акушерство и гинекология»[6].
Все пациентки методом слепой выборки были разделены на 2 репрезентативные группы в зависимости от продолжительности контаминационной терапии: I группа (n=48) — деконтаминационная (перорально метронидазол (ATX J01XD01) 500 мг 2 р/сут 7 дней) и контаминационная (интравагинально L. casei rhamnosus Doderleini (не менее 1×108 колониеобразующих единиц (КОЕ))) 14 дней) терапия; II группа (n=48) — деконтаминационная (перорально секнидазол (АТХ P01AB07) Секнидокс® (World Medicine Ilach San. ve Tij A.Ş., Turkey) 2000 мг однократно) и контаминационная терапия (интравагинально L. casei rhamnosus Doderleini).
Методы исследования и контроль эффективности лечения
Включенным в исследование пациенткам проводились:
клинико-анамнестическое обследование (оценка критериев Амселя не проводилась ввиду ее недостаточной достоверности, связанной с отсутствием пробы с 10% раствором KOH, запрещенным в РФ для хранения в амбулаторных условиях[7]);
рН-метрия отделяемого влагалища (Кольпотест, «Биосенсор АН», РФ);
бактериоскопия отделяемого из цервикального канала и влагалища с оценкой окрашенного по Граму мазка по критериям Ньюджента (0–3 балла — физиологический микробиоценоз; 4–6 баллов — промежуточный вариант микробиоценоза; 7–10 баллов — БВ);
ПЦР в режиме реального времени для определения условно-патогенной микрофлоры (ПЦР-РВ) — «АмплиПрайм® Флороценоз-Бактериальный вагиноз» (ООО «НекстБио», РФ) с расчетом коэффициента соотношений (КС): разница логарифмов концентраций ДНК Lactobacillus spp. (Lac) и анаэробных микроорганизмов G. vaginalis и A. vaginae (Gv+Av): KC=lg [ДНК Lac] / lg [ДНК (Gv + Av)].
Пациентки совершали 5 визитов к врачу-исследователю:
визит 1 (1-й день): подписание информированного согласия, сбор анамнеза, комплексное микробиологическое исследование;
визит 2 (3–4-й день): оценка результатов исследований, верификация диагноза БВ, рандомизация, назначение лечения;
визит 3 (7–8-й день после окончания терапии): оценка эффективности и комплаентности лечения (жалобы, осмотр, бактериоскопия отделяемого из цервикального канала и влагалища с окраской по Граму, pH вагинального содержимого);
визиты 4 и 5 (1 и 6 мес. после окончания лечения): оценка эффективности терапии.
Оценка клинической эффективности проводилась через 1 и 6 мес. после окончания лечения. Критерии эффективности терапии: отсутствие специфических жалоб; клинико-лабораторные критерии (pH, Ньюджента); ПЦР-критерии (оценка КС).
Комплаенс лечения оценивался по клинико-психологическим тестовым методикам — шкала Мориски — Грин и модифицированная Шкала медикаментозного комплаенса, разработанная в НИПНИ им. В.М. Бехтерева (29–35 баллов — полный комплаенс, 28–21 балл — частичный, менее 21 балла — отсутствие комплаенса) [27, 28].
С целью оценки безопасности определялось наличие нежелательных явлений (НЯ).
Статистические процедуры
Полученные результаты были подвергнуты статистической обработке с вычислением средней арифметической величины (М) и стандартного отклонения (s) в формате М±s с учетом достоверной вероятности по критерию Пирсона (χ2) с помощью программного обеспечения (R, версия 3.1.1 для Windows, R Foundation, http://www.r-project.org/) (величина p<0,05 признана статистически значимой). Объем выборки для уровня значимости (0,05) и мощности критерия (0,80) рассчитывался по формуле: N=2* (Zα/2+Zβ)2/(d/SD)2),
где N — рассчитываемый объем выборки,
Zα/2 и Zβ — значения нормального распределения при вероятности α/2 и β соответственно (Zα/2+Zβ=1,96+0,84=2,8),
d — клинически значимая разность групповых средних значений.
Величина вариабельности (d/SD) в исследовании составила 0,65.
Результаты и обсуждение
Клиническая характеристика пациенток
Основные жалобы пациенток с верифицированным диагнозом «N76.8 или N89.8 БВ» были: специфический неприятный запах из влагалища (79/96 (82,3%)), патологические бели (81/96 (84,4%)), зуд в области наружных половых органов (11/96 (11,4%)), рези при мочеиспускании (6/96 (6,2%)), диспареуния (33/96 (34,4%)) (рис. 1).
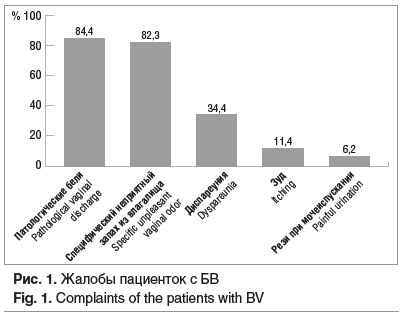
При гинекологическом осмотре (в зеркалах) выявили наличие гомогенных беловато-серых вагинальных выделений, равномерно распределенных по слизистой оболочке влагалища, и отсутствие воспалительных изменений слизистых вульвы и влагалища у 96/96 (100,0%).
Значения pH вагинального секрета у наших пациенток были смещены в сторону щелочной среды — в среднем 5,2±0,4 (95% ДИ 4,9; 5,6) (рис. 2).
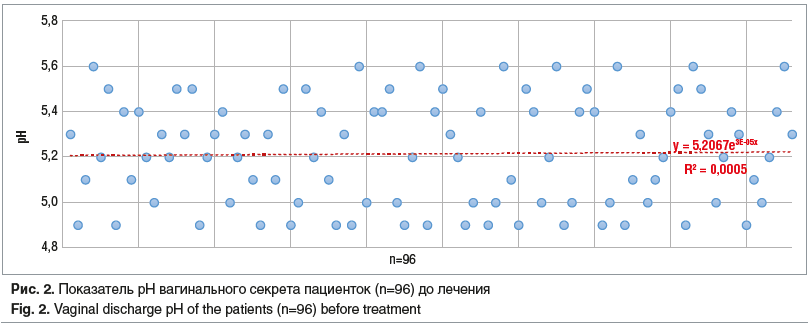
Микроскопия влагалищных мазков, окрашенных по Граму, показала наличие «ключевых клеток» ( 96/96 (100,0%)), клеток Mobiluncus (35/96 (36,5%)), кокковой флоры (Г+/-) ( 40/96 (41,7%)) с низким (менее 5 в поле зрения) количеством Lactobacillus (88/96 (91,7%)). Количество лейкоцитов в вагинальных мазках в среднем было 4,8±2,2 в поле зрения (95% ДИ 3; 9). Оценка признаков вагинального микробиоценоза по критериям Ньюджента показала вторую (4–6 баллов) степень (промежуточный вариант) у 11,5% (11/96) женщин и третью (7–10 баллов) степень (БВ) у остальных 85/96 (88,5%) пациенток.
Результаты ПЦР-детекции с определением ДНК G. vaginalis, A. vaginae, Lactobacillus spp. и общего количества бактерий (Bacteria) показали преобладание условно-патогенной анаэробной вагинальной микрофлоры у наших респонденток, что и подтвердилось при расчете КС концентраций Lactobacillus spp. и анаэробных микроорганизмов G. vaginalis и A. vaginae (рис. 3).
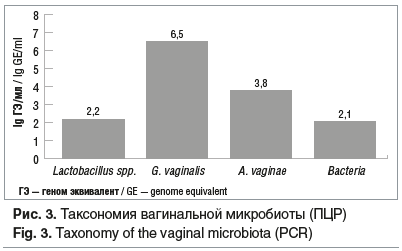
Среднее значение КС в группе было 0,3±0,15 (95% ДИ 0,2; 0,5) (КС<0,5 — соотношения концентраций ДНК микроорганизмов соответствуют БВ).
Клиническая эффективность
Через 1 мес. у всех пациенток было отмечено статистически значимое (p<0,05) по сравнению с исходным снижение частоты выявления симптоматики БВ: зуд в области наружных половых органов и преддверия влагалища отмечался только у 3/96 (3,1%) пациенток; патологические бели — у 6/96 (6,3%), у всех пациенток отсутствовали дизурические явления. Такой относительно субъективный признак, как «неприятный запах» из влагалища через 1 мес. после лечения отмечали 10/96 (10,4%) пациенток.
Доли пациенток с признаками БВ в группах I и II через 1 и 6 мес. после лечения представлены в таблице 1. Межгрупповые различия через 1 мес. после начала лечения были статистически незначимыми (p>0,05).
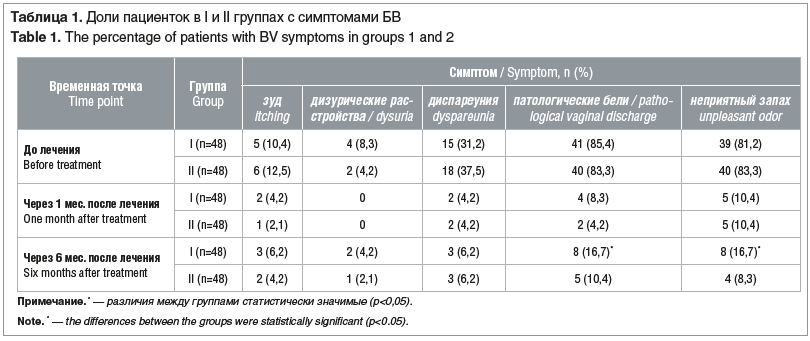
Через 6 мес. после окончания терапии зарегистрировано увеличение числа пациенток I группы с патологическими выделениями из влагалища со специфическим запахом до 16,7%; во II группе данный показатель снизился до 8,3% (межгрупповые различия статистически значимы, p<0,05). По показателям зуда, дизурических расстройств, диспареунии статистически значимых межгрупповых различий не выявили.
Установили, что pH вагинального секрета через 1 мес. после лечения в обеих группах снизился в среднем до 4,2±0,3 (95% ДИ 4,0; 4,6) (в I группе pH выше 4,5 зарегистрирован в 3/48 (6,2%) случаев, во II группе — в 2/48 (4,2%)). Через 6 мес. средняя величина pH в группах составила 4,3±0,4 (95% ДИ 4,0; 4,8): в I группе pH выше 4,5 отмечен у 9/48 (18,7%), во II — у 6/48 (12,5%) (различия между группами не были статистически значимыми, p>0,05).
Вышеперечисленные изменения в субъективной/объективной симптоматике показывают высокую клиническую эффективность комплексной деконтаминационной (5-нитроимидазолы) и контаминационной терапии БВ, при этом отмечается некоторая более высокая эффективность терапии препаратом, содержащим секнидазол (Секнидокс®).
Микробиологическая эффективность
При оценке микробиологической эффективности через 1 мес. после окончания терапии установили физиологический микробиоценоз у 82/96 (85,4%) пациенток двух групп, промежуточный вариант микробиоценоза у 8/96 (8,3%) и БВ у 6/96 (6,3%).
Через полгода после лечения количество нормоценозов бактериоскопически отмечено у 61/96 (63,5%), промежуточный вариант выявили у 17/96 (17,7%), при этом БВ выявили у 18/96 (18,8%) пациенток.
Динамика бактериоскопических признаков БВ (критерии Ньюджента) в группах представлена на рисунке 4.
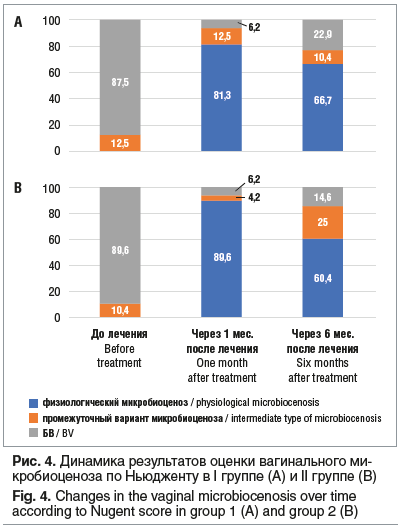
Микробиологическая оценка (ПЦР) комплексной терапии БВ в двух группах показала высокую антибактериальную эффективность 5-нитроимидазолов в течение первого месяца наблюдения: эрадикация G. vaginalis — у 79/96 (82,2%) (I группа — 79,2%, II группа — 85,4%) и A. vaginae — у 89/96 (92,7%) (I группа — 87,5%, II группа — 97,9%), а также уменьшение количества Г+ и Г- микрофлоры (Bacteria), при этом у большинства женщин — 91/96 (94,8%) (I группа — 91,7%, II группа — 97,9%) — определялось адекватное количество лактофлоры.
При межгрупповых сравнениях статистически значимой разницы между группами не выявлено (p>0,05).
Наблюдение в течение 6 мес. после окончания лечения показало некоторое увеличение средней концентрации во влагалище условно-патогенной микрофлоры и увеличение количества женщин с ПЦР-детекцией G. vaginalis — 13/48 (27,1%) и A. vaginae — 6/48 (12,5%) в I группе и 8/481 (6,7%) и 4/48 (8,3%) во II группе.
В таблице 2 представлена динамика состава микробиоты влагалища у пациенток обеих групп.
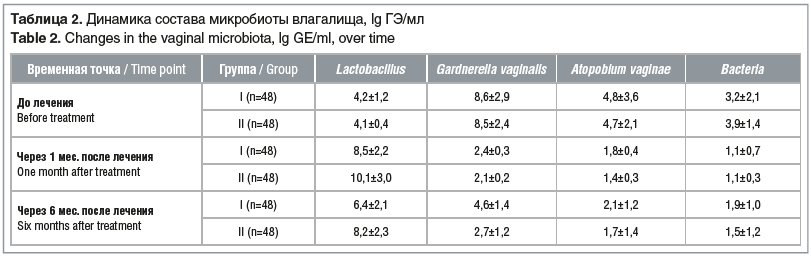
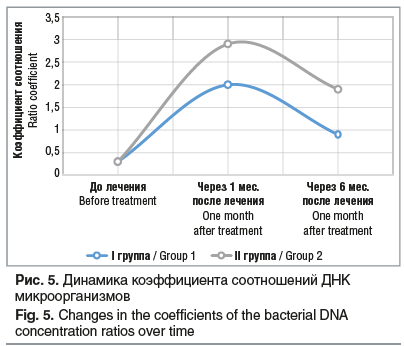
Коэффициент соотношений лактобактерий и факультативных анаэробов (G. vaginalis и A. vaginae), который в обеих группах исходно был равен 0,3±0,2 (КС<0,5 — соотношения концентраций ДНК микроорганизмов соответствуют БВ), в процессе терапии в течение месяца вырос до 2,0±1,3 в I группе и до 2,9±1,1 во II группе (КС>1 — БВ не установлен), при наблюдении в течение 6 мес., несмотря на некоторое снижение КС (0,9±1,2 и 1,9±1,3 в I и II группах соответственно), в большинстве случаев его значения не снижались ниже 0,5, что может свидетельствовать об эффективности терапии в обеих группах (рис. 5). При этом статистически значимой разницы ввиду малой выборки в группах установить не удалось (p>0,05).
Таким образом, в результате проведенного шестимесячного сравнительного исследования выявлено, что у пациенток с верифицированным диагнозом БВ пероральное применение двух 5-нитроимидазолов (метронидазол и секнидазол) с последующей контаминационной терапией показало их высокую эффективность, с отсутствием существенных различий между группами (при применении секнидазола клиническая эффективность составила 89,6% против 83,3% (метронидазол), микробиологическая (критерии Ньюджента и ПЦР) — 85,4% против 77,1%.
Клиническая безопасность и комплаенс
Из системных НЯ, зарегистрированных при применении 5-нитроимидазолов, наиболее значимыми были НЯ со стороны пищеварительной системы: 13/48 (27,1%) респондентов из I группы (пероральное применение препарата метронидазола) отмечали тошноту (11/48; 22,9%), однократную рвоту (2/48; 41,7%), металлический привкус во рту (5/48; 10,4%); во II группе таких пациенток, жаловавшихся на дискомфорт со стороны пищеварительной системы (тошноту) при применении препарата секнидазола, было в 3 раза меньше — 4/48 (8,3%) (табл. 3).
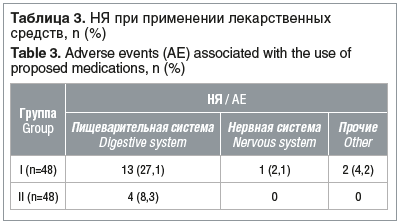
Аллергические реакции при применении метронидазола и секнидазола не отмечались. У 2/48 (4,2%) пациенток на фоне приема метронидазола была отмечена однократная субфебрильная гипертермия, купировавшаяся без применения дополнительных лекарственных препаратов, а одна женщина (2,1%) предъявляла жалобы на головокружение и легкую парестезию (онемение) в области ладоней. Все вышеперечисленные носили преходящий характер и не препятствовали дальнейшему применению предлагаемой медикаментозной терапии.
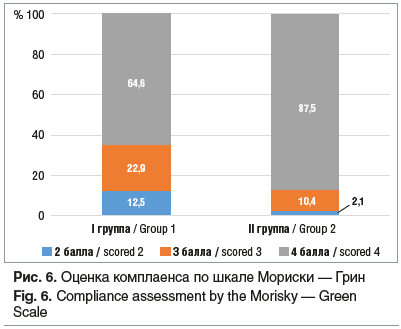
Удовлетворительный комплаенс предлагаемой в исследовании терапии (4 балла по шкале Мориски — Грин) выявлен у пациенток I группы — 31/48 (64,6%) и пациенток II группы — 42/48 (87,5%) (рис. 6). Среди критериев, определивших оценку комплаенса, кроме вышеперечисленных НЯ, отмечены длительность лечения, кратность применения лекарственных препаратов, время исчезновения симптомов заболевания после начала лечения.
Оценка по модернизированной для наших целей Шкале медикаментозного комплаенса, разработанной в НИПНИ им. В.М. Бехтерева, показала полный комплаенс у большинства пациенток исследуемых групп — 30,1±3,5 балла (95% ДИ 28; 33) в I группе и 32,6±2,8 балла (95% ДИ 30; 35) во II группе, что свидетельствует о приемлемости предложенной терапии.
Таким образом, полный комплаенс (4 балла по шкале Мориски — Грин и 30 баллов по Шкале медикаментозного комплаенса) определен у 76,2±2,8% пациенток I группы и у 93,75±3,25% (среднее по двум шкалам) пациенток II группы.
Обсуждение
Несмотря на то, что БВ является одним из наиболее распространенных инфекционных заболеваний влагалища во всем мире, до сих пор ведутся дискуссии о его основных этиологических агентах, а также наиболее приемлемой терапии этой инфекции у женщин [1, 3, 29]. На сегодняшний день основным препаратом для лечения БВ признан метронидазол, который имеет эффективность 70–90%, но при этом большинством исследователей признается высокая частота рецидивов БВ после его применения [30]. Причины рецидивов также достаточно дискутабельны: считается, что возобновлению симптомов БВ способствует сохранение остаточной инфекции, резистентность микроорганизмов, связанная как с длительностью приема антибактериальных препаратов, так и с наличием биопленки, которая защищает БВ-ассоциированную микрофлору от антимикробной терапии. Прошлые исследования клиндамицина и тинидазола при лечении рецидивирующего БВ были сосредоточены на пациентках с признаками резистентности к метронидазолу. Исследования по препаратам, направленным на разрушение биопленки, с дальнейшим использованием пробиотиков являются достаточно перспективными, но все же требуют дополнительного анализа. При этом, несмотря на ограничения, связанные в первую очередь с побочными эффектами и возможным развитием резистентности, антибактериальная терапия останется основной при БВ в обозримом будущем, что стимулирует поиск новых лекарственных средств, отличающихся высокой эффективностью, полным комплаенсом и низкой антибиотикорезистентностью.
Секнидазол представляет собой новое поколение 5-нитроимидазола, который более 10 лет назад был одобрен в США (FDA), Европе и Азии в качестве однократной дозы 2 г для лечения БВ [31]. Длительный период полувыведения (17–28,8 ч) позволяет секнидазолу быть эффективным при однократном применении, что подтверждено несколькими рандомизированными контролируемыми испытаниями [32].
Мы нашли только 2 исследования, в которых сравнивали эффект 2 г секнидазола с метронидазолом в дозе 500 мг при лечении БВ в течение 5–7 сут. Результаты не выявили существенных различий в скорости клинического излечения при применении обоих методов (критерии Амселя). При этом ни в одном исследовании не зарегистрировано длительного (более 1 мес.) наблюдения за пациентками, что не позволяет оценить количество последующих рецидивов заболевания [33, 34]. В нашем исследовании мы проводили наблюдение в течение более длительного срока, что позволило в динамике оценить возвращение симптомов БВ и изменения микробиоценоза влагалища после проведенного лечения. Кроме того, была дана оценка приверженности лечению при применении двух методов терапии, что также немаловажно при назначении лечения.
Заключение
Таким образом, проведенное исследование показало высокую сравнительную клиническую и микробиологическую эффективность терапии пациенток с диагнозом БВ препаратами 5-нитроимидазолов (метронидазол и секнидазол) с последующей вагинальной контаминацией лактобактериями. При этом на фоне полугодового мониторинга, хоть и статистически недостоверная ввиду небольшой выборки пациенток, но более высокая эффективность (клиническая и микробиологическая) была зарегистрирована при применении секнидазола (Секнидокс® 2 г однократно) со статистически значимым (p<0,05) более высоким комплаенсом.
Сведения об авторах:
Куценко Ирина Игоревна — д.м.н., профессор, заведующая кафедрой акушерства, гинекологии и перинатологии ФГБОУ ВО КубГМУ Минздрава России; 350063, Россия, г. Краснодар, ул. им. Митрофана Седина, д. 4; ORCID iD 0000-0003-0938-8286.
Боровиков Игорь Олегович — д.м.н., доцент, доцент кафедры акушерства, гинекологии и перинатологии ФГБОУ ВО КубГМУ Минздрава России; 350063, Россия, г. Краснодар, ул. им. Митрофана Седина, д. 4; ORCID iD 0000-0001-8576-1359.
Кравцова Елена Иосифовна — к.м.н., доцент кафедры акушерства, гинекологии и перинатологии ФГБОУ ВО КубГМУ Минздрава России; 350063, Россия, г. Краснодар, ул. им. Митрофана Седина, д. 4; ORCID iD 0000-0001-8987-7375.
Батмен Саида Казбековна — к.м.н., доцент кафедры акушерства, гинекологии и перинатологии ФГБОУ ВО КубГМУ Минздрава России; 350063, Россия, г. Краснодар, ул. им. Митрофана Седина, д. 4; ORCID iD 0000-0002-1790-444X.
Магай Антон Сергеевич — аспирант кафедры акушерства, гинекологии и перинатологии ФГБОУ ВО КубГМУ Минздрава России; 350063, Россия, г. Краснодар, ул. им. Митрофана Седина, д. 4; ORCID iD 0000-0003-2910-8798.
Боровикова Ольга Игоревна — аспирант кафедры акушерства, гинекологии и перинатологии ФГБОУ ВО КубГМУ Минздрава России; 350063, Россия, г. Краснодар, ул. им. Митрофана Седина, д. 4; ORCID iD 0000-0002-7275-9388.
Авакимян Вероника Артемовна — к.м.н., ассистент кафедры акушерства, гинекологии и перинатологии ФГБОУ ВО КубГМУ Минздрава России; 350063, Россия, г. Краснодар, ул. им. Митрофана Седина, д. 4; ORCID iD 0000-0002-4946-6640.
Андреева Анастасия Александровна — аспирант кафедры акушерства, гинекологии и перинатологии ФГБОУ ВО КубГМУ Минздрава России; 350063, Россия, г. Краснодар, ул. им. Митрофана Седина, д. 4; ORCID iD 0000-0001-5749-4193.
Контактная информация: Боровиков Игорь Олегович, e-mail: bio2302@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 13.03.2023.
Поступила после рецензирования 05.04.2023.
Принята в печать 28.04.2023.
About the authors:
Irina I. Kutsenko — Dr. Sc. (Med.), Professor, Head of the Department of Obstetrics, Gynecology and Perinatology, Kuban State Medical University; 4, Mitrofan Sedin str., Krasnodar, 350063, Russian Federation; ORCID iD 0000-0003-0938-8286.
Igor O. Borovikov — Dr. Sc. (Med.), associate professor of the Department of Obstetrics, Gynecology and Perinatology, Kuban State Medical University; 4, Mitrofan Sedin str., Krasnodar, 350063, Russian Federation; ORCID iD 0000-0001-8576-1359.
Elena I. Kravtsova — C. Sc. (Med.), associate professor of the Department of Obstetrics, Gynecology and Perinatology, Kuban State Medical University; 4, Mitrofan Sedin str., Krasnodar, 350063, Russian Federation; ORCID iD 0000-0001-8987-7375.
Saida K. Batmen — C. Sc. (Med.), associate professor of the Department of Obstetrics, Gynecology and Perinatology, Kuban State Medical University; 4, Mitrofan Sedin str., Krasnodar, 350063, Russian Federation; ORCID iD 0000-0002-1790-444X.
Anton S. Magay — postgraduate student of the Department of Obstetrics, Gynecology and Perinatology, Kuban State Medical University; 4, Mitrofan Sedin str., Krasnodar, 350063, Russian Federation; ORCID iD 0000-0003-2910-8798.
Olga I. Borovikova — postgraduate student of the Department of Obstetrics, Gynecology and Perinatology, Kuban State Medical University; 4, Mitrofan Sedin str., Krasnodar, 350063, Russian Federation; ORCID iD 0000-0002-7275-9388.
Veronika A. Avakimyan — C. Sc. (Med.), assistant of the Department of Obstetrics, Gynecology and Perinatology, Kuban State Medical University; 4, Mitrofan Sedin str., Krasnodar, 350063, Russian Federation; ORCID iD 0000-0002-4946-6640.
Anastasiya A. Andreeva — postgraduate student of the Department of Obstetrics, Gynecology and Perinatology, Kuban State Medical University; 4, Mitrofan Sedin str., Krasnodar, 350063, Russian Federation; ORCID iD 0000-0001-5749-4193.
Contact information: Igor O. Borovikov, e-mail: bio2302@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 13.03.2023.
Revised 05.04.2023.
Accepted 28.04.2023.
Информация с rmj.ru




