Ацетил-L-карнитин при болевой форме периферической нейропатии: систематический обзор (реферат)
Содержание статьи
- 1 Введение
- 2 Материал и методы
- 3 Статистический анализ
- 4 Результаты
- 5 Обзор клинических испытаний
- 6 Ацетил-L-карнитин при диабетической нейропатии
- 7 Ацетил-L-карнитин при антиретровирусной токсической нейропатии
- 8 Ацетил-L-карнитин при нейропатии, вызванной химиотерапией
- 9 Ацетил-L-карнитин у пациентов с синдромом запястного канала
- 10 Влияние АЛК на функцию нервов
- 11 Обсуждение
- 12 Заключение
Введение
Улучшение понимания патофизиологического механизма невропатической боли привело к использованию ранее неисследовавшихся методов лечения с обнадеживающими результатами. Применение ацетил-L-карнитина (АЛК) — ацетилового эфира L-карнитина, продуцируемого человеческим мозгом, печенью и почками, представляет собой один из таких новых терапевтических подходов. Молекула АЛК является донором ацетильной группы и играет важную роль в энергетическом балансе и процессе детоксикации митохондрий [1, 2]. Помимо усиления эффектов фактора роста нервов (Nerve Growth Factor, NGF) [3–5] и стимуляции регенерации периферических нервов [6, 7], у АЛК выявили нейропротективные свойства in vitro [2, 8], in vivo [9] и на моделях животных с диабетической нейропатией [10]. Установлено, что на моделях периферической мононейропатии АЛК оказывал антиапоптотическое действие [11], обладал антиоксидантной активностью [12] и увеличивал выработку ацетилхолина. Исследования с применением методики микродиализа продемонстрировали повышенное высвобождение ацетилхолина как в стриатуме, так и в гиппокампе крыс после введения АЛК [13].
Благодаря анальгетическому эффекту АЛК возрастает клинический интерес к его применению при различных формах хронической болевой нейропатии, причем не только для лечения, но и для профилактики возникновения боли [14, 15]. Антиноцицептивный эффект АЛК был подтвержден на нескольких экспериментальных моделях невропатической боли, например, при нейропатии, вызванной введением стрептозотоцина и химиотерапией, а также при хроническом компрессионном повреждении седалищного нерва [6, 16]. Кроме того, АЛК оказывал значительное антиноцицептивное действие при уже имеющейся невропатической боли.
Эти анальгетические свойства являются результатом действия различных механизмов. АЛК является единственным лекарственным средством, анальгетический эффект которого обусловлен эпигенетическим механизмом, основанным на ацетилировании p65/RelA — транскрипционного фактора, принадлежащего семейству NFkB. Ацетилирование p65/RelA приводит к усиленной экспрессии метаботропных глутаматных рецепторов 2 типа (mGlu2) в ганглиях дорсального корешка и спинных рогах спинного мозга, тем самым снижая высвобождение глутамата из первичных афферентных сенсорных волокон [17, 18].
Анальгетический эффект, индуцированный АЛК, сохранялся не менее 14 дней после прекращения приема препарата. Долгосрочный анальгетический эффект также наблюдался у мышей после хронического компрессионного повреждения седалищного нерва [17].
Как показано в ряде исследований на животных, влияние АЛК на боль также модулируется никотиновыми и мускариновыми антагонистами, что позволяет предположить роль холинергического пути в антиноцицептивной активности этого препарата [19, 20]. АЛК может повышать поглощение ацетил-КоА в митохондриях и из-за его структурного сходства с ацетилхолином оказывать холиномиметическое действие.
Данный обзор и метаанализ выполнены с целью систематизации информации, основанной на доказательствах эффективности применения АЛК по сравнению с плацебо при лечении невропатической боли у пациентов с периферической нейропатией.
Материал и методы
Процесс поиска
Авторы осуществляли поиск в PubMed, Embase и Кокрановской базе данных систематических обзоров на предмет соответствующих работ, опубликованных вплоть до апреля 2018 г. Были использованы следующие поисковые термины: «ацетил-L-карнитин», «невропатическая боль» и «нейропатия». Были включены оригинальные статьи, написанные на английском языке. Процесс рецензирования проводился двумя рецензентами: были приняты во внимание только публикации, независимо одобренные двумя авторами. Критерии включения: испытания, включающие пациентов с диагнозом невропатической боли, связанной с периферической нейропатией, и минимальный размер выборки — 10 пациентов. Был проведен пересмотр выбранных клинических испытаний, чтобы обеспечить уровень доказательности в соответствии с руководящими принципами Американской академии неврологии (ААН) [22]. Был выполнен метаанализ рандомизированных контролируемых исследований (РКИ), оценивающих эффективность АЛК у пациентов с болевой формой периферической нейропатии. Для данного метаанализа авторы рассматривали только РКИ, оценивающие влияние АЛК на боль по сравнению с плацебо. Риск систематических ошибок включенных РКИ оценивался независимо двумя исследователями в соответствии с принципами, изложенными в Кокрановском справочнике по систематическим обзорам вмешательств 5.1.0.
Статистический анализ
Авторы оценивали среднее значение уменьшения интенсивности боли по сравнению с плацебо, измеренное с помощью 10 см визуально-аналоговой шкалы (ВАШ). Объединенный результат каждого исследования был представлен в виде средней разницы (MD) с 95% доверительным интервалом (ДИ). Статистический анализ проводился с применением критерия χ2 и индекса I2 [23]. Индекс I2 > 50% показывает статистически значимую гетерогенность среди исследований, в этом случае исследования были объединены с использованием модели случайных эффектов. Был проведен анализ подгрупп, выделенных в зависимости от причин нейропатии; также оценивали гетерогенность между группами. С помощью GraphPad Prism 7.0 были рассчитаны графики показателей в рамках отдельных исследований и объединенное среднее.
Результаты
Обзор клинических испытаний
Из 44 полнотекстовых статей в работу были включены 14 клинических исследований, среди них были как РКИ, так и открытые исследования. Каждому из этих исследований был присвоен определенный класс в соответствии с классификацией ААН [22]. Среди них только 4 РКИ были включены в метаанализ.
Ацетил-L-карнитин при диабетической нейропатии
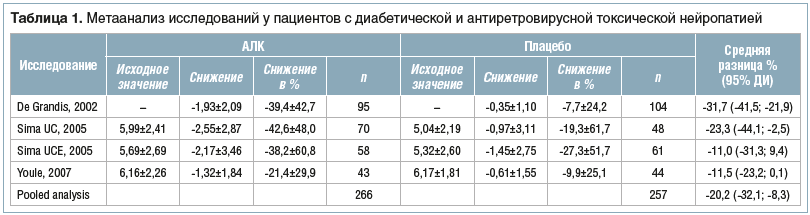
Три РКИ класса II сравнивали АЛК с плацебо у 1590 пациентов с диабетической периферической нейропатией [24, 25]. Эффективность лечения боли оценивали с использованием ВАШ.
Sima et al. провели 2 РКИ с одинаковым дизайном. АЛК вводили в дозах 500 или 1000 мг 3 р./сут в течение 1 года. У пациентов, получавших 1000 мг АЛК 3 р./сут, отмечалось значительное улучшение как на 26-й, так и на 52-й нед.
Сахарный диабет (СД) 2 типа, адекватная приверженность лечению и HbA1c > 8,5% коррелировали с большей эффективностью в снижении интенсивности боли. Облегчение боли было связано с улучшением показателей клинических симптомов и морфометрических параметров икроножного нерва при биопсии, т. е. с увеличением числа волокон и скоплений регенерирующих волокон. Существенных различий в показателях нервной проводимости и частоты нежелательных явлений между 2 группами пациентов не наблюдалось [24].
В РКИ De Grandis et al. 1000 мг/сут АЛК вводили внутримышечно в течение 10 дней, затем пациента переводили на пероральный прием АЛК 2000 мг/сут до конца исследования (355 дней) [25]. После 12 мес. лечения у пациентов, получавших АЛК, наблюдалось значительное снижение средних показателей интенсивности боли по ВАШ в сравнении с группой плацебо. Также у пролеченных пациентов отмечали значительное улучшение показателей нервной проводимости. О серьезных побочных эффектах не сообщалось.
В многоцентровом двойном слепом РКИ оценивали эффективность и безопасность применения АЛК по сравнению с метилкобаламином при диабетической периферической нейропатии [26]. В исследование включили 232 пациента, рандомизированных для получения перорального АЛК 500 мг/сут или метилкобаламина в дозе 500 мг 2 р./сут в течение 24 нед. В конце периода лечения у пациентов из обеих групп было показано значительное улучшение показателей, оцениваемых как по шкале симптомов нейропатии, так и по шкале инвалидности (нетрудоспособности), без существенной разницы между 2 группами. Нейрофизиоологические показатели также улучшились в обеих группах.
Ацетил-L-карнитин при антиретровирусной токсической нейропатии
Одно РКИ класса II было проведено у пациентов с антиретровирусной токсической нейропатией [27]. Это двойное слепое плацебо-контролируемое исследование, оценивающее безопасность и эффективность АЛК по сравнению с плацебо при лечении боли у ВИЧ-положительных пациентов с дистальной симметричной полинейропатией, связанной с приемом антиретровирусных препаратов [28]. В исследование были включены 90 пациентов, рандомизированных для получения АЛК 1000 мг/сут (500 мг внутримышечно 2 р./сут) в течение 14 дней в период двойной слепой фазы. В течение 42 дней открытой фазы лечения пациенты принимали АЛК перорально в дозе 1000 мг 2 р./сут.
Эффективность лечения боли оценивали с использованием ВАШ, общего показателя симптомов (Total Symptom Score, TSS), Шкалы общей клинической оценки изменений, опросника боли McGill (McGill Pain Questionnaire, MPQ) и с учетом потребности в анальгетиках. В группе пациентов, получавших АЛК, наблюдалось значительно большее снижение интенсивности боли по сравнению с таковым в группе плацебо. Во время открытой фазы с помощью ВАШ, TSS и MPQ выявили облегчение боли. Внутримышечное и пероральное применение препарата было в целом безопасным и хорошо переносилось пациентами; вирусная нагрузка, соотношение CD4/CD8 и количество CD4 и CD8 оставались стабильными, что свидетельствует о том, что лечение АЛК не приводит к прогрессированию ВИЧ-инфекции.
Было проведено несколько открытых исследований, в которых участвовали пациенты с антиретровирусной токсической нейропатией. В одном исследовании, в котором участвовал 21 ВИЧ-положительный пациент с установленной нейропатией, оценивалось влияние АЛК (перорально 1500 мг 2 р./сут) на кожную и интраэпидермальную иннервацию [29]. После 6-месячного лечения средняя площадь иммунного окрашивания для небольших чувствительных волокон увеличилась у всех типов волокон, включая симпатические: иннервация эпидермальных, дермальных и потовых желез достигла 92%, 80% и 69% соответственно по сравнению с таковой в контрольной группе. Интенсивность невропатической боли уменьшилась у 76% пациентов, и только у 19% она осталась неизменной. Никакой связи между лечением АЛК и прогрессированием ВИЧ-инфекции не наблюдалось. Открытое пилотное исследование, в котором участвовал 21 пациент, оценивало влияние 3000 мг/сут АЛК на плотность интраэпидермальных нервных волокон (intra-epidermal nerve fiber, IENF) и число копий митохондриальной ДНК (мтДНК) в клетках [30]. При этом плотность IENF и число копий мтДНК в клетках не изменились после терапии, наблюдалось уменьшение выраженности невропатической боли, парестезий и симптомов онемения. В открытом исследовании, в котором приняли участие 20 пациентов с болевой антиретровирусной токсической нейропатией, изучалась эффективность перорального приема АЛК в дозе 2000 мг/сут в течение 4-недельного периода [31]. Средний балл интенсивности боли, оцененной с использованием модифицированной короткой формы опросника MPQ, был значительно снижен во время исследования, тогда как электрофизиологические параметры не показали значительных изменений. В 2 других открытых исследованиях, в которых приняли участие 26 пациентов, был выявлен положительный эффект АЛК в снижении интенсивности невропатической боли [32, 33].
Ацетил-L-карнитин при нейропатии, вызванной химиотерапией
Описаны клинические исследования, оценивавшие нейропротективный эффект АЛК при нейропатии, вызванной химиотерапией, но данные о снижении невропатической боли отсутствуют. В проспективном двойном слепом РКИ класса II, в котором приняли участие 239 пациентов с периферической нейропатией, вызванной химиотерапией, была оценена эффективность перорального приема АЛК в дозе 3 г/сут [34].
В качестве первичной конечной точки в данном исследовании было принято улучшение периферической нейропатии по крайней мере на одну ступень согласно версии 3.0 Общих критериев токсичности Национального института рака. Состояние пациентов оценивалось на 4-й, 8-й и 12-й нед. с момента включения в исследование. На 8-й нед. 51,6% пациентов, получавших АЛК, достигли первичной конечной точки, в то время как в группе плацебо — 23,1% пациентов. Вторичные конечные точки, такие как скорость проведения нервного импульса по икроножному нерву и оценка по шкале Karnofsky, также показали значительное улучшение у пациентов, получавших АЛК, по сравнению с группой плацебо. Не было выявлено существенных различий в частоте возникновения нежелательных явлений между 2 группами.
В 2 открытых исследованиях определяли эффективность АЛК у пациентов с нейропатией, вызванной паклитакселом и цисплатином [35, 36]. Maestri et al. оценивали эффективность в/в инфузий АЛК (1 г/сут в течение 1–2 ч) в течение не менее 10 дней у 27 пациентов; проявления периферической нейропатии уменьшились у 73% из них. Bianchi et al. назначали АЛК в дозе 1 г/сут per os в течение 8 нед. у 25 пациентов. Общий показатель нейропатии, включая нейрофизиологические показатели, улучшился у 92% из них.
Ацетил-L-карнитин у пациентов с синдромом запястного канала
Невропатическая боль является распространенным симптомом у пациентов с синдромом запястного канала (СЗК) [37]. Недавнее многоцентровое слепое клиническое и нейрофизиологическое исследование оценило эффективность АЛК в отношении нейропротекции, боли и функции при СЗК [15].
В исследование были включены 82 пациента с СЗК легкой и средней степени тяжести. Состояние пациентов оценивалось в начале исследования и через 10, 60 и 120 дней лечения. После первого 10-дневного периода внутримышечных инъекций АЛК 500 мг 2 р./сут пациенты были переведены на таблетированную форму АЛК в дозе 500 мг 2 р./сут в течение 110 дней. У каждого пациента исследовали проводимость нервного импульса по срединному нерву, проводили оценку тяжести заболевания по Бостонскому опроснику при синдроме запястного канала (Boston Carpal Tunnel Questionnaire, BCTQ) и Опроснику по симптомам невропатической боли (Neuropathic Pain Symptom Inventory, NPSI). Показатели по BCTQ значительно улучшились. Отмечалось значительное снижение болевых ощущений сжимающе-давящего характера в покое и при надавливании. Эти улучшения симптомов отмечались после первых 10 дней инъекций и сохранялись в течение 4-месячного периода лечения. Результаты всех сенсорных нейрофизиологических измерений показали значительное улучшение показателей.
Метаанализ РКИ при диабетической нейропатии и связанной с ВИЧ болевой форме периферической нейропатии
В 4 РКИ была оценена эффективность АЛК по сравнению с плацебо у пациентов с диабетической и антиретровирусной токсической нейропатией (табл. 1). Для анализа использовали модель случайных эффектов, учитывая, что индексы неоднородности приблизились к статистической значимости (τ2=88,58; χ2=8,06, df=3, P=0,045; I2=62,8%). По сравнению с применением плацебо прием АЛК приводил к уменьшению интенсивности боли, составляющему 20,2% (95% ДИ: 8,3–32,1%, p<0,0001) относительно исходного уровня. На рисунке 1 представлены результаты отдельных исследований, а также объединенный результат. Был проведен анализ подгруппы, учитывающий результаты только 3 исследований, проведенных при диабетической периферической нейропатии. В этом случае также использовалась модель случайных эффектов (τ2=50,28; χ2=3,40, df=2, p=0,18; I2=41,2%).
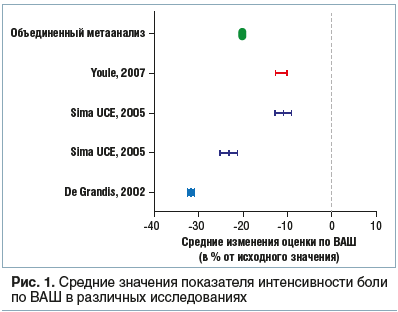
Средняя разница в уменьшении интенсивности боли относительно исходного значения составила 24,6% (95% ДИ: 12,4–36,8%, p<0,0001): эти результаты совпадают с данными, опубликованными Li et al. [14].
Влияние АЛК на функцию нервов
В контролируемых исследованиях на больших группах пациентов с периферической нейропатией различной этиологии оценивалось влияние АЛК на нейрофизиологические показатели. В двойном слепом РКИ, проведенном De Grandis et al., участвовали 333 пациента с диабетической нейропатией. Результаты исследования показали, что средняя скорость и амплитуда нервной проводимости значительно улучшились при приеме АЛК по сравнению с плацебо [25]. В 2 плацебо-контролируемых РКИ, включавших 1257 пациентов с диабетической нейропатией, Sima et al. не смогли обнаружить каких-либо существенных электрофизиологических изменений у пациентов, получавших АЛК в дозе 500 мг или 1000 мг, хотя сообщалось о значительном снижении порога восприятия вибрации [24]. Краткосрочное двойное слепое клиническое исследование с участием 426 пациентов с периферической нейропатией различной этиологии показало статистически значимые различия между группами АЛК и плацебо в отношении улучшения средней скорости проводимости нервного импульса [38].
В двойном слепом плацебо-контролируемом РКИ, в котором приняли участие 239 пациентов с периферической нейропатией, вызванной химиотерапией, было показано значительное увеличение скорости проводимости по икроножному нерву после лечения АЛК [34].
Нейропротективный эффект АЛК при СЗК изучался в многоцентровом слепом клиническом и нейрофизиологическом исследовании, в котором участвовало 82 пациента. Первичный результат, т. е. скорость сенсорной проводимости срединного нерва, значительно улучшился после 4 мес. лечения. Такое улучшение, выявленное после первых 60 дней терапии, сохранялось в течение всего ее периода, продолжавшегося 4 мес. Амплитуда потенциалов сенсорного действия срединного нерва до конца исследования повышалась по сравнению с исходным уровнем [15]. Кроме того, значительно снизились выраженность симптомов и функциональные показатели BCTQ.
Обсуждение
Согласно результатам доклинических и клинических исследований АЛК можно рассматривать как этиологическое и симптоматическое лекарственное средство с хорошим профилем безопасности, применяемое у пациентов с периферической нейропатией. АЛК действует посредством нескольких механизмов, способствуя регенерации поврежденных нервных волокон, уменьшая окислительный стресс, стимулируя синтез ДНК в митохондриях и увеличивая концентрацию NGF в нейронах, что приводит к удлинению аксонов [3, 7]. Недостаток карнитина снижает синтез энергии, нарушая процесс расщепления жирных кислот: эти данные были получены в исследованиях с участием пациентов с сахарным диабетом и его осложнениями [39, 40]. Поперечное исследование, проведенное у пациентов с ВИЧ, получавших антиретровирусные аналоги нуклеозидов, показало, что у пациентов с аксональной периферической нейропатией уровни АЛК значительно ниже по сравнению с контрольными группами [41]. При определенных условиях потребность в АЛК может превышать способность синтезировать это важное для организма вещество [25]. Кроме того, синтез АЛК может быть нарушен вследствие генетических дефектов.
Было показано, что АЛК обладает анальгетическими свойствами и способен уменьшать острую и хроническую боль. В нескольких клинических исследованиях сообщалось об улучшении симптомов после приема АЛК у пациентов с периферической нейропатией различной этиологии [31, 36, 42]. Несколько работ, описывающих различные модели невропатической боли, подтвердили антиноцицептивный эффект АЛК. Такой эффект обусловлен различными механизмами, в т. ч. активацией мускариновых холинергических рецепторов и повышенной экспрессией рецепторов mGlu2 в нейронах ганглиев дорсальных корешков посредством механизма ацетилирования, включающего факторы транскрипции семейства NF-κB [17, 20].
Следует отметить, что, как показано на моделях хронической воспалительной и невропатической боли, обезболивающий эффект АЛК длится в течение нескольких дней или даже недель после окончания лечения. Это усиливает важность применения АЛК в качестве анальгетического препарата и доказывает значимость эпигенетических механизмов в лечении хронической боли [17].
Впервые был проведен систематический обзор литературы, представивший классификацию доступных клинических испытаний и уровень доказательств в отношении диабетической нейропатии, антиретровирусной токсической нейропатии, невропатии, вызванной химиотерапией, и СЗК.
Согласно классификации ААН считается, что АЛК эффективен при диабетической нейропатии. Возможный эффект АЛК при антиретровирусной токсической нейропатии и при нейропатии, вызванной химиотерапией, подтверждается наличием 1 исследования класса II для каждого из этих типов. У пациентов с СЗК не проводилось РКИ, но результаты, полученные в ходе недавнего многоцентрового слепого клинического и нейрофизиологического исследования, являются многообещающими.
Обобщенные результаты настоящего метаанализа, включая 4 РКИ у пациентов с диабетической и антиретровирусной токсической нейропатией, показали эффективность АЛК по сравнению с плацебо в снижении интенсивности боли. У пациентов с диабетической нейропатией отмечалось большее уменьшение интенсивности боли по сравнению с пациентами с периферической нейропатией, связанной с ВИЧ.
Согласно недавнему систематическому обзору и метаанализу влияние АЛК на интенсивность боли по ВАШ у пациентов с болевой нейропатией было сходным для разных путей введения (внутримышечное и пероральное последовательное введение или только пероральное введение) [14].
В недавнем многоцентровом слепом клиническом и нейрофизиологическом исследовании оценивали эффекты АЛК у пациентов с СЗК от легкой до умеренной степени [15]. Благодаря своему нейропротективному действию и центральным антиноцицептивным свойствам АЛК обеспечил значительное уменьшение боли, измеренное с помощью опросника NPSI.
Отмечалось значительное снижение болевых ощущений сжимающе-давящего характера в покое и при надавливании. Уменьшение боли было выявлено после первых 10 дней инъекций. Внутримышечное введение позволяет достичь высоких концентраций АЛК в центральной нервной системе, что является необходимым условием для активации и усиления эпигенетических механизмов, лежащих в основе обезболивающего действия препарата. Однако после запуска эпигенетического механизма различий между внутримышечным и пероральным введением не ожидается.
Необходимо дальнейшее проведение исследований у пациентов с болевой формой периферической нейропатии различной этиологии.
Заключение
АЛК — эффективный и безопасный препарат, используемый при болевой форме периферической нейропатии, особенно у пациентов с сахарным диабетом. Необходимы дальнейшие исследования, направленные на оценку продолжительности терапевтической эффективности и поиск оптимальной дозы в больших популяциях, возможно, с более длительными периодами наблюдения.
Уменьшение боли, вызванное АЛК, может быть опосредовано как нейропротективным, так и центральным антиноцицептивным механизмом. Проведение дальнейших исследований необходимо для изучения роли этих двух механизмов.
Реферат подготовлен редакцией «РМЖ» по материалам статьи: Di Stefano G., Di Lionardo A., Galosi E. et al. Acetyl-L-carnitine in painful peripheral neuropathy: a systematic review. J Pain Res. 2019;12:1341-1351. DOI: 10.2147/JPR.S190231.
Информация с rmj.ru



