Рассмотрены вопросы антибиотикотерапии и ее влияния на кишечную микробиоту. Показано, что пробиотики являются агентами, способными модулировать и улучшать кишечную микрофлору при применении антибиотиков.
Распространенность ожирения в мире достигла масштабов эпидемии за последние несколько десятилетий. В 2013 г. 36,9% взрослых мужчин и 29,8% женщин (в возрасте ≥20 лет) имеют избыточный вес (индекс массы тела (ИМТ) — 25–29,9 кг/м
) [1], а недавние анализы тенденций показывают, что число пациентов с избыточным весом или ожирением продолжает расти во всем мире [2]. Из-за многогранной природы ожирения нет единого или простого решения для борьбы с этой растущей эпидемией. Таким образом, необходимы новые, наиболее результативные индивидуальные методы для эффективной профилактики и лечения избыточного веса и ожирения.
Исследования на животных и человеке показывают, что триллионы бактерий в кишечнике связаны с энергетическим гомеостазом [3, 4]. Кишечные бактерии ферментируют неперевариваемые углеводы, синтезируют из них короткоцепочечные жирные кислоты (КЖК) и аминокислоты и могут тем самым вносить энергетический вклад в метаболизм хозяина [5, 6]. Побочные продукты процесса бактериальной ферментации могут влиять на аппетит и чувство насыщения [7], также путем модуляции метаболизма желчных кислот [8] микробиота может управлять алиментарным ожирением, «увеличивая» калорийность потребляемой пищи [9, 10]. Кроме того, бактерии кишечника могут манипулировать вкусом индивидуума и его диетическими предпочтениями [11].
Бактерии освоили нашу планету около 3 млрд лет назад. Доктор Martin J. Blaser очень интересно описывает это в своей книге «Удаленные микробы: как чрезмерное использование антибиотиков помогает развитию наших современных эпидемий», которая вышла в 2014 г. и стала бестселлером: «Они (бактерии) сделали кислород, которым мы дышим, почву, поддерживают наши океаны. Медленно, неумолимо, посредством проб и ошибок на протяжении всего времени они изобрели сложные и надежные системы обратной связи, которые по сей день поддерживают всю жизнь на Земле. Древние, но не примитивные бактериальные клетки — самодостаточные существа, достигают различных форм и размеров и адаптируются практически к каждой экосистеме на Земле» [12]. 99% уникальных генов в наших телах являются бактериальными. Эта популяция из более чем 100 трлн микроорганизмов составляет наш микробиом: совокупность микробных сообществ, которая развилась вместе с
, чтобы помочь организовать основные жизненные процессы, начиная с момента рождения.
Метаболические изменения могут быть вызваны первичным нарушением микробиоты [13], что связано с современными изменениями в физиологии человека [14, 15], которые инициируются внешними факторами. Эпидемиологические исследования показали, что лечение антибиотиками в течение первых 6 мес. жизни [16] или рождение ребенка путем кесарева сечения [17, 18] может увеличить риск накопления избыточного веса в старшем возрасте, не воздействуя напрямую на потребление калорий или метаболизм хозяина [19], но оказывая большое влияние на микробиом [14, 20]. На взаимовыгодные отношения человека с собственными микробами влияют многие аспекты современного образа жизни, включая урбанизацию, международные путешествия и диетические изменения [21], а также антибиотики [22].
Микробиом играет важную роль в поддержании здоровья, особенно иммунитета и обмена веществ. Не исключено и то, что нарушение этого равновесия может иметь серьезные последствия. Но об этом вряд ли задумывались в 1940-х гг., когда в нашу жизнь вошли антибиотики, уничтожающие бактерии или замедляющие их рост. Смертельные ранее болезни стало возможно предотвратить или вылечить, намного безопаснее стали хирургические операции. Побочные эффекты у антибиотиков казались немногочисленными и незначительными. Сегодня антибиотики — бесценное средство лечения многих серьезных инфекций, продолжающее спасать бесчисленные жизни. Побочные влияния от лечения антибиотиками на кишечную микрофлору варьируются от быстропроходящей самостоятельно «функциональной» диареи до опасного для жизни псевдомембранозного колита [23, 24]. Долгосрочные последствия изменений кишечного микробного пейзажа человека сложно выявить, но хронические состояния, такие как астма и атопические заболевания, зачастую связаны с использованием антибиотиков в детстве и изменениями вследствие этого микробиоты кишечника [25–27]. Многие химические процессы в кишечнике опосредованы специфическими микробными популяциями [28], что может провоцировать развитие рака [29, 30] и ожирения [31, 32], изменения в составе кишечной микрофлоры могут иметь и другие отсроченные серьезные последствия для здоровья [33]. Последствия приема даже одного курса антибиотиков в специфических микробных популяциях в естественных условиях могут сохраняться в течение многих лет [34–36].
Содержание статьи
Последствия применения антибиотиков у беременных женщин и младенцев
Исследование когорты датских женщин выявило, что более 40% из них получали антибиотик хотя бы 1 раз во время беременности [42]. Было показано, что в дополнение к нарушению передачи микробиоты от матери к ребенку воздействие пренатального антибиотика влияло на весовые коэффициенты новорожденных, повышало риск ожирения и связанных с ним метаболических нарушений позже в жизни ребенка [43, 44].
Анализ базы данных уровня антибиотикорезистентности в США в 2010 г., содержащей информацию о более чем 70% американских рецептов [45], продемонстрировал широкое использование антибиотиков, особенно в младенчестве и детстве, которые существенно варьировали в зависимости от региона. Экстраполяция данных показывает, что в возрасте 2 лет в среднем 1 американский ребенок получил почти 3 курса антибиотиков (в основном для лечения острых инфекций ушей и верхних дыхательных путей), около 10 курсов в возрасте до 10 лет и 17 курсов в возрасте до 20 лет. Хотя эти показатели поразительно высоки, они согласуются с предшествующими национальными обследованиями [46, 47]. Взаимосвязь между количеством назначаемых антибиотиков и уровнем ожирения в США представлена на рисунке 1 [48]. Выявлено, что в тех штатах, где чаще всего назначаются курсы антибиотикотерапии, проживают самые тучные люди.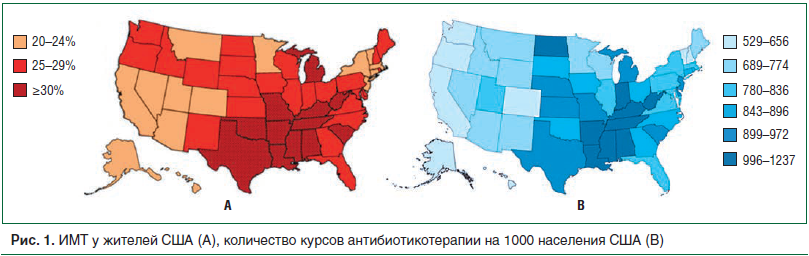
В отличие от этого, в Швеции использование антибиотиков у младенцев и взрослых пациентов составляет примерно 40% от того количества, которое назначается в США [49]. Тот факт, что большая часть предписанного использования антибиотиков у детей в США не нужна, признан профессиональными органами, включая Американскую педиатрическую академию [50] и Центр по контролю и профилактике заболеваний [51]. Тем не менее темпы использования антибиотиков в педиатрии в США в период с 2000 до 2010 г. увеличились [52]. Даже в пределах одного региона существует значительная вариабельность назначения врачами лекарств, о чем свидетельствует недавний большой обзор, проведенный крупным медицинским академическим центром [53].
Новые эпидемиологические исследования подтвердили гипотезу о том, что воздействие антибиотиков в раннем детстве (от 1 года до 3-х лет) связано с повышенным риском развития ожирения. При исследовании более 28 тыс. пар мать — ребенок в датской национальной когорте новорожденных [54] было установлено, что воздействие антибиотика у детей в течение первых 6 мес. связано с повышенным риском избыточного веса в возрасте 7 лет, причем данный эффект у мальчиков был более выраженным, чем у девочек. Эти результаты были подтверждены в лонгитюдном когортном исследовании родителей и детей (ALSPAC), в котором участвовало более 10 тыс. детей. В когорте новорожденных ALSPAC использование антибиотиков в течение первых 6 мес. жизни было связано с увеличением ИМТ в возрасте 10, 20 и 38 мес. Исследование ALSPAC также определило, что материнский ИМТ является вторым фактором, способствующим развитию ожирения, после воздействия антибиотиков в раннем возрасте, причем с возрастом наблюдается усиление этого эффекта у детей от матерей с нормальным весом по сравнению с матерями с избыточным весом. В другом большом исследовании наблюдались около 11 500 детей, родившихся в Соединенном Королевстве в 1991–1992 гг., которые получали антибиотики до 6 мес. Установлено, что они имели больший риск развития ожирения в возрасте 38 мес. (отношение шансов 1,22) [16].
В исследованиях с канадскими младенцами антибиотики, вводимые в первый год жизни, увеличивали вероятность того, что ребенок будет иметь избыточный вес в возрасте 9 и 12 лет, а также высокое центральное ожирение (маркер метаболического синдрома) [55]. Эти эффекты наблюдались после коррекции других факторов, которые влияют на вес тела, таких как диета, физическая активность и курение матерей во время беременности. Проявился выраженный половой диморфизм, эффект был сильнее у детей мужского пола. Продольное исследование в США с 2001 по 2009 г. с участием 65 480 детей из Филадельфии также показало связь между антибиотиками, применяемыми в первый год жизни, и ожирением в детском возрасте, которое было выражено значительно сильнее, если пациент получил несколько курсов антибиотикотерапии в период с 0 до 23 мес. Поскольку распространенные детские инфекции были наиболее частыми диагнозами, связанными с назначением антибиотиков широкого спектра действия, сужение выбора антибиотиков потенциально может быть управляемым фактором риска формирования ожирения у детей [56]. Примечательно, что эти эффекты имели сильную корреляцию с использованием антибиотиков широкого спектра, но не с антибиотиками с узким спектром.
В глобальном кросс-секционном исследовании выявлено, что применение антибиотиков в течение первого года жизни влияет на массу тела у детей, а изменения в обоих направлениях (увеличение или уменьшение) зависят от места проживания, которое ассоциировалось с повышенным риском избыточного веса в возрасте 5–8 лет у мальчиков [57]. В том же исследовании увеличение массы тела или снижение веса у девочек зависело от места проживания, однако в целом у этих участников не наблюдалось статистически значимых эффектов. Все эти эпидемиологические исследования свидетельствуют о том, что воздействие антибиотиков в течение первого года жизни может увеличить риск формирования ожирения в будущем. Гендерная специфика этих эффектов пока изучается [58].
Формирование нормальной кишечной микрофлоры
младенца зависит от вертикальной передачи бактерий от матери во время родов; таким образом, применение антибиотиков матерью во время беременности или нарушения в родах также могут повлиять на формирование нормального микробного пейзажа у ребенка и последующее увеличение его веса. Изучение 436 пар мать — ребенок обнаружило повышение риска ожирения на 84% (33–154%) в возрасте 7 лет, если мать получала антибиотики во II или III триместре беременности [59]. В нескольких независимых исследованиях было выявлено, что повышенный риск ожирения или избыточного веса был связан с родоразрешением путем кесарева сечения [17, 18]. Независимо от пренатального применения матерью антибиотиков и других факторов у детей, рожденных путем кесарева сечения, риск ожирения был на 46% выше, чем у детей, рожденных естественным путем [60]. Эти исследования свидетельствуют о том, что передача материнской нормальной микрофлоры, вероятно, является значимым фактором, который формирует метаболическое развитие у детей.
Влияние антибиотиков на микробиоту взрослых
По результатам 10-месячного проспективного экспериментального исследования 3 взрослых пациентов, получивших два курса ципрофлоксацина, установлено, что микробиота кишечника быстро изменялась на фоне воздействия антимикробного препарата. Состав микробиоты стабилизировался через 10 мес., но в измененном состоянии [61].
Французские исследователи наблюдали 48 взрослых пациентов с диагнозом «бактериальный эндокардит» (БЭ), получавших антибиотики, которых сравнивали с 48 людьми сопоставимого пола и возраста без БЭ. Их ИМТ определялся за 1 мес. до первых симптомов БЭ и через 1 год после выписки из больницы. ИМТ значительно увеличился у пациентов, получавших ванкомицин + гентамицин (В+Г) (p=0,03), но не в контрольной группе или у пациентов, получавших другие антибиотики. У 17 пациентов отмечали увеличение ИМТ ≥10%, а у 5 из группы антибиотиков В+Г развилось ожирение. Лечение В+Г было независимым предиктором увеличения ИМТ ≥10% (p=0,02). Увеличение веса было особенно выраженным после 6-недельного внутривенного лечения В+Г БЭ у мужчин старше 65 лет, которые не подверглись кардиохирургическому вмешательству [62].
Механизм, с помощью которого антибактериальные агенты увеличивают показатели роста и веса, недостаточно известен, но было предложено несколько гипотез [63]:
питательные вещества эффективнее усваиваются из-за более тонкого кишечного эпителия и нарушения его проницаемости;
питательные вещества сохраняются из-за сокращения конкурирующих микроорганизмов;
уменьшаются или устраняются микроорганизмы, ответственные за субклинические инфекции;
снижается количество бактерий, стимулирующих рост токсинов и метаболитов;
изменяется активность бактериальных ферментов, которые улучшают эффективность метаболизма продуктов питания.
Таким образом, появляется все больше доказательств роли микроорганизмов кишечника в отношении преобразования энергии питательных веществ [64] и их последствий для ожирения.
Антибиотики в сельском хозяйстве
Нарушения микрофлоры кишечника происходят не только из-за лечения антибиотиками. Препараты накапливаются в мясе животных и птицы, которое мы употребляем в пищу. Антибиотики широко используются в качестве стимуляторов роста в сельском хозяйстве. В 1940-х гг. использование Streptomyces aureofaciens способствовало увеличению веса у животных, что привело к открытию хлортетрациклина. Тетрациклины, макролиды, авопарцин и пенициллины обычно используются в животноводстве для ускорения роста за счет увеличения потребления пищи, увеличения веса и улучшения состояния здоровья стада [65]. Авопарцин, гликопептид, структурно связанный с ванкомицином, широко использовался в Европе в качестве стимулятора роста с начала 1970-х гг. до недавнего запрета из-за появления резистентных к ванкомицину энтерококков [66]. Было показано, что этот антибиотик улучшает эффективность корма и увеличивает вес у животных [67]. Как следствие, в мясе обнаруживаются ванкомицинрезистентные энтерококки, которые стали выделяться при инфекциях у людей. В связи с этим в настоящее время Всемирная организация здравоохранения (ВОЗ) рекомендует максимально снизить применение антибиотиков в животноводстве. Однако только в Евросоюзе прислушались к ее советам. США, Китай и Россия продолжают активно скармливать их животным, а заодно и конечным потребителям. Только с 2005 по 2009 г. российский рынок антибиотиков вырос в 2,3 раза [68]. В результате мы можем получить мясо, молоко и другие продукты с наличием в них антибиотиков в количестве, превышающем допустимые санитарные нормы. Наличие их в продуктах маркируется как пищевые добавки Е700–Е800. Например, молоко и мясо могут содержать, согласно нормам, до 100 мкг на 1 кг продукта тетрациклина — антибиотика широкого спектра действия. Это означает, что человек, выпивающий 2 стакана молока в день, употребляет около 50 мкг тетрациклина ежедневно. Это немного, но необходимо учитывать, что многие пьют молоко каждый день на протяжении всей жизни.
Особенно опасно использование одних и тех же антибиотиков в животноводстве и в медицине, т. к. это способствует возникновению устойчивых к антибиотикам бактериальных штаммов, которые отрицательно влияют на здоровье человека, что является давней проблемой во многих странах. В США 80% от всего количества выпускаемых антибиотиков шло на нужды животноводства, причем около 60% из них — это те же наименования, которые используются и в медицине. Их применение запрещено с 1 января 2017 г. [69]. Кроме того, в новых исследованиях изучался вопрос о том, существуют ли прямые метаболические эффекты в результате потребления человеком загрязненных продуктов [70–72]. Примерно 70 лет назад ученые-ветеринары показали, что добавление низких (субтерапевтических) доз антибиотиков к корму или воде для домашнего скота привело к стимулированию его роста [73]. Этот эффект впоследствии был продемонстрирован у основных видов домашних млекопитающих (коров, свиней и овец) и домашней птицы [74]. Данный эффект наблюдался у различных антимикробных агентов, независимо от класса лекарственных средств (антибиотик или антисептик), химической структуры, способа действия и спектра активности [75, 76].
Больше всего антибиотиков накапливается в свинине, несколько меньше — в курятине и еще меньше — в говядине. Кроме того, в фермерских креветках и рыбе, в частности в лососе, отмечается высокий уровень антибиотиков, потому что они необходимы для профилактики заболеваний. Даже органические овощи содержат в себе антибиотики, потому что в них концентрируется около 75% антибиотиков, получаемых домашними животными, — их навоз используется для удобрения земли [77]. Важно отметить, что животных кормят антибиотиками на ранней стадии жизни, потому что в этот период стимулирование роста и эффективность корма (способность превращать калории пищи в массу тела) выше, чем при применении антибиотиков в старшем возрасте [75, 78]. Эффекты, связанные с возрастом, согласуются с концепцией критического периода формирования метаболизма хозяина, причем в раннем возрасте способность подвергаться изменениям выше, чем в старшем. По оценкам специалистов, использование антибиотиков для домашних животных увеличится на 67% к 2030 г., т. к. спрос на белок растет во всем мире. В Китае, Индии, Бразилии и России ожидается, что использование антибиотиков увеличится на 99% — намного больше, чем прирост населения этих стран. Многие из этих продуктов будут экспортироваться [77].
Коррекция дисбиоза
Как же профилактировать и корректировать нарушения метаболизма, ассоциированные с воздействием антибиотиков на организм человека на разных этапах его жизни? Ожирение у людей связано с дисбиотическим сдвигом в фекальной микробиоте, а также с низким содержанием бифидобактерий [79]. С другой стороны, ограничение энергии и потеря веса связаны с повышенным содержанием бактерий [80]. Измененная микробиота в кишечнике субъектов с ожирением, по-видимому, эффективнее «усваивает» энергию из рациона и может способствовать дальнейшему увеличению веса [81]. Следовательно, микробиота кишечника является потенциально изменяемой мишенью для профилактики и/или лечения ожирения.
Пробиотики (в основном бифидобактерии и лактобациллы) попадают в толстую кишку человека, где они участвуют в таких процессах, как модулирование микрофлоры толстой кишки, иммуногенные реакции и метаболические процессы. Пробиотики могут профилактировать инфекционные заболевания, снижать уровень холестерина, стимулировать синтез витаминов и цитокинов, ингибировать канцерогенез. Безопасность и эффективность определенных штаммов в контексте этих свойств должны быть научно доказаны для того, чтобы считать их пробиотиком. Сочетание пребиотиков и пробиотических бактерий образует синбиотики, которые могут обладать еще большими преимуществами, чем пробиотики или пребиотики в отдельности [82].
Введение жизнеспособных штаммов бактерий (пробиотиков) в качестве способа влияния на экосистему кишечника в целях снижения веса сегодня достаточно серьезно изучается [83]. Ряд исследований показывают, что пробиотики могут влиять на функцию различных видов бактерий в кишечнике [84, 85], в нескольких недавних исследованиях было обнаружено, что пробиотические добавки могут способствовать снижению веса [86].
Влияние пробиотиков на динамику массы телаQ
. Zhang et al. опубликовали метаанализ 19 исследований, который показал снижение ИМТ на 0,49 кг/м2 (p
H. Borgeraas et al. провели еще один метаанализ 15 последних исследований по оценке результатов применения пробиотиков пациентами с избыточным весом и ожирением. Две трети (n=10) исследований включали один вид пробиотика, а остальные исследования (n=5) — два или несколько видов пробиотиков. Суточная доза пробиотиков варьировала от 1,0×109 до 4,8×1011 КОЕ, а длительность испытаний составляла от 3 до 12 нед. (медиана — 8 нед.). Установлено, что пробиотические добавки уменьшают массу тела (масса тела [95% ДИ], -0,60 [-1,19, -0,01] кг), ИМТ (-0,27 [-0,45, -0,08] кг/м2) и процентное содержание жира (-0,60 [-1,20, -0,01] %), но несущественно. Пробиотические добавки также уменьшали массу жировых отложений, хотя и незначительно (масса тела -0,42 [-1,08, 0,23] кг) [88].
В многоцентровом двойном слепом рандомизированном плацебо-контролируемом клиническом интервенционном исследовании 87 пациентов с высоким ИМТ (24,2–30,7 кг/м2) и увеличением области брюшного висцерального жира (81,2–178,5 см2) были рандомизированы для приема либо ферментированного молока (FM), содержащего LG2055 (активный FM, n=43), либо FM без LG2055 (контроль FM; n=44). Испытуемые потребляли 200 г/сут FM в течение 12 нед. В активной группе FM область брюшного висцерального и подкожного жира значительно (р
Таким образом, антибиотики уменьшают разнообразие кишечной микрофлоры. Они снижают популяцию основных бактерий, живущих в кишечнике, что способствует разрастанию условно-патогенных, патогенных бактерий и грибов. Также использование антибиотиков может индуцировать у людей избыточный вес и ожирение. Пробиотики являются «противоядием» антибиотикотерапии, и это утверждение имеет под собой научную и практическую основу.
В России зарегистрировано большое количество пробиотических продуктов в разных формах — лекарственных препаратов, БАДов, продуктов питания. Для терапии различных описанных выше заболеваний можно рекомендовать Максилак®.
Синбиотик Максилак®
Максилак® (Genexo Sp. z.o.o., Польша) — синбиотик, который содержит 9 культур кишечных бактерий в концентрации 4,5×109 КОЕ. Сегодня это самый высокодозированный пробиотический продукт в России. Содержащиеся в его составе лактобактерии подавляют рост патогенной микрофлоры, перерабатывают лактозу до простых сахаров, что полезно для лиц с лактазной ферментной недостаточностью, непереносимостью молока и молочных продуктов. Бифидобактерии, которые также входят в состав синбиотика Максилак®, поддерживают нормальные процессы пристеночного пищеварения, подавляют рост патогенной микрофлоры, способствуют стимулированию иммунитета, снижению рН пищевой массы. Пребиотик олигофруктоза стимулирует быстрое размножение полезных бактерий и тормозит развитие болезнетворных бактерий внешнего происхождения, уменьшает загрязнение кишечника токсинами и улучшает его работу, стимулирует перистальтику, служит для профилактики запоров и диареи.
Благодаря применению инновационной технологии производства MURE® (Multi Resistant Encapsulation) бактерии, присутствующие в синбиотике Максилак®, защищены от кислого содержимого желудочного сока, солей желчи и пищеварительных ферментов. Такая защита позволяет им адаптироваться и прижиться в просвете кишечника, сохранив высокую биологическую активность. Более того, благодаря данной технологии большая часть пробиотических бактерий попадает в кишечник, а не инактивируется в желудке, что положительно сказывается на восстановлении кишечной микрофлоры, т. к. концентрация колоний микроорганизмов возрастает на пути от желудка к толстой кишке, достигая там своего максимума. Таким образом, лакто- и бифидобактерии попадают к очагу заболевания, где и начинают проявлять свое действие.
Авторы статьи провели микробиологическое исследование содержимого капсул Максилак®. Содержимое капсулы было посеяно на тиогликолевую среду. После культивирования при 37 °С в течение 24 ч отмечали бурный рост микроорганизмов, который характеризовался диффузным помутнением и образованием придонного осадка. Из среды был сделан мазок, окрашен по Граму. При микроскопическом изучении мазка по Граму установлено наличие 3 морфотипов грамположительных бактерий: крупных, толстых плейоморфных палочек с закругленными концами, расположенных в виде «иероглифов», V-образно и короткими цепочками (предположительно род Bifidobacterium); тонких слегка изогнутых палочек, расположенных одиночно или короткими цепочками (предположительно род Lactobacillus); а также правильной шаровидной формы кокков, расположенных короткими цепочками и скоплениями (предположительно род Streptococcus). Посторонних морфотипов бактерий в составе препарата выявлено не было.
При бактериологическом контроле контаминации препарата установлено отсутствие роста на среде Эндо, питательном агаре с 9% хлоридом натрия и на среде Сабуро,
т. е. препарат характеризовался отсутствием посторонней микрофлоры (кишечных палочек, грибов, стафилококков). Для определения содержания количества микроорганизмов в каждой капсуле использовали метод разведений. В 1 дозе препарата содержится 20×1010 КОЕ бактерий, т. е. не меньше заявляемого производителем количества. При этом высокая концентрация бактерий in vitro (в 6 раз выше, чем указано в документации), вероятно, обусловлена стимулирующим действием олигофруктозы. В целом адгезивная способность была хорошей, т. к. индекс адгезии равен 3,61.
Далее было проведено определение чувствительности к антибиотикам всего консорциума бактерий, без выделения чистых культур. Установлено, что бактерии были резистентны к следующим антибиотикам: имипенему, цефтазидиму, цефазолину, амоксициллину, офлоксацину. Консорциум бактерий был чувствителен к ципрофлоксацину, левофлоксацину, спарфлоксацину, рокситромицину, меропенему, гентамицину, амикацину.
Таким образом, Максилак® характеризуется следующими микробиологическими признаками: содержание бактерий в 1 дозе препарата составило не менее 20×109 КОЕ/г, консорциум включает микроорганизмы родов Bifidobacterium, Lactobacillus, Streptococcus. Консорциум бактерий обладал устойчивостью к антибиотикам группы β-лактамов (имипенему, цефтазидиму, цефазолину, амоксициллину) и офлоксацину, что позволяет назначать Максилак® во время приема соответствующих антибиотиков.
Заключение
Если антибиотики делают людей тучными, то пробиотики могут помочь избежать этого. Антибиотики являются нужными и потенциально жизненно важными лекарствами, которые значительно снижают смертность и заболеваемость людей. Сегодня мы получаем четкое представление о том, как эти бактериомодулирующие агенты могут способствовать ожирению. С учетом затрат на устранение осложнений и связанных с этим методов лечения необходимо разумное использование антибиотиков. А все курсы антибиотикотерапии — у беременных женщин, новорожденных младенцев, детей разного возраста и взрослых пациентов — необходимо сопровождать приемом пробиотиков. В настоящее время в этой области ведется множество исследований, и особенно важно определить конкретные виды и штаммы пробиотиков, которые являются наиболее эффективными в каждой конкретной ситуации.
Пробиотики не только профилактируют и лечат антибиотик-ассоциированную диарею, но и способствуют снижению веса и уменьшают ИМТ, они могут помочь улучшить иммунитет, предотвратить простудные и атопические заболевания, уменьшить стресс и тревогу, улучшить когнитивные возможности у пациентов с болезнью Альцгеймера, способствовать восстановлению после травмы, минимизировать осложнения заболеваний печени, регулировать артериальное давление, снизить уровень гликемии при диабете и многих других заболеваниях. Максилак® может быть препаратом выбора при всех вышеописанных заболеваниях — как для их профилактики, так и для лечения.
Информация с rmj.ru

