Возможности применения протеината серебра в комплексной терапии риносинуситов
Проблема инфекционного ринита остается актуальной во всем мире, особенно в странах, где не менее половины календарного года продолжается холодный период. Согласно статистической информации Минздрава России патология органов дыхания взрослого и детского населения не имеет тенденции к снижению [1]. Из 50 млн случаев инфекционных заболеваний, ежегодно регистрируемых в Российской Федерации, до 90% — острые респираторные вирусные инфекции (ОРВИ) [1]. При этом отмечается высокая изменчивость вирусов и тропность их к зонам поражения респираторного тракта: риновирусы (РВ), которых около 100 штаммов, — наиболее частая причина острых инфекционных ринитов [2]. Для РВ-инфекции характерна меньшая инвазивность, в связи с чем значительная часть реснитчатого эпителия остается относительно интактной, в отличие от вирусов гриппа и аденовирусов, вызывающих обширное поражение и десквамацию мерцательного эпителия.
В клинической картине острого катарального ринита выделяют три стадии, последовательно переходящие одна в другую:
стадия сухого раздражения;
стадия серозных выделений;
стадия гнойных выделений (разрешения).
Пациенты предъявляют жалобы на назальные симптомы: заложенность носа, ринорею, чихание, которые преобладают на второй-третий день и уменьшаются к пятому дню заболевания.
Важно отметить, что симптомы ринита снижают качество жизни пациентов: отмечаются расстройства сна, снижение работоспособности и успеваемости в школе, психологические нарушения [3–5].
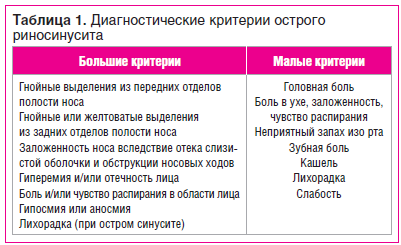
Практически при любой ОРВИ в процесс вовлекаются околоносовые пазухи (ОНП) [6]. В таблице 1 приведены диагностические критерии острого риносинусита (ОРС). Диагноз устанавливается при наличии по крайней мере 2 больших или 1 малого или более 2 малых критериев. Иногда к ОРС присоединяется вторичная бактериальная инфекция [7]. Некоторые заболевания, включая попадание инородного тела в носовые ходы или прободение перегородки носа, перелом носа, предрасполагают к длительному течению инфекционного ринита.
Наряду с противовирусными и иммуностимулирующими лекарственными средствами, составляющими основу современной стратегии лечения гриппа и ОРВИ, при симптоматическом лечении ОРС широко используются адреномиметики (деконгестанты), антигистаминные препараты, имеющие ряд нежелательных побочных эффектов [8].
Нарушение рекомендуемого режима дозирования местных деконгестантов зачастую приводит к местным нежелательным явлениям (атрофический ринит), к появлению таких общих симптомов передозировки, как беспокойство, тремор, бессонница, головная боль, тахикардия и артериальная гипертензия [9].
Системная антибиотикотерапия используется при ОРС необоснованно часто. Так, в США антибиотики получают 84,8% больных ОРС, причем чаще других врачи назначают макролиды [10]. Поскольку дополнительные методы исследования, такие как рентгенография, компьютерная томография, УЗИ, не позволяют дифференцировать вирусное и бактериальное поражение ОНП и не являются критериями степени тяжести заболевания, основными ориентирами при решении вопроса о назначении антибиотика становятся общее состояние и жалобы больного, анамнез и наличие гнойного отделяемого в носовых ходах. Назначение системной антибиотикотерапии рекомендуется при отсутствии улучшения к 7-му дню заболевания или в любые сроки в случае ухудшения состояния [11].
Широкое, и, в части случаев, нерациональное использование антибактериальных средств (системных, местных) при лечении этой и иных воспалительных патологий, кроме того, самолечение, так же как и массовое применение антибиотиков в ветеринарии, пищевой промышленности и других отраслях, привело к появлению и распространению антибиотикорезистентных штаммов микроорганизмов, возникновению у них различных приспособительных факторов, способствующих передаче генов резистентности. Кроме того, произошла эволюция микроорганизмов: сапрофиты приобрели патогенные свойства, условно-патогенные повысили свою вирулентность, появились адаптированные к больничным условиям госпитальные штаммы, устойчивые к антисептикам и антибиотикам, традиционно применяемым для лечения бактериальных инфекций [12, 13].
Увеличение числа случаев необоснованного назначения препаратов, приводящих к росту полипрагмазии, антибиотикорезистентности, аллергизации населения, заставляет врачей настойчивее искать новые возможности эффективной и безопасной терапии. В связи с этим одним из путей решения данной проблемы является применение методов и средств, лечебное воздействие которых не связано с преодолением антибиотикорезистентности микропатогенов, при этом обладающих значительным бактерицидным, фунгицидным, вирулицидным эффектом.
Примером может служить объединение двух или нескольких эффективных способов лечения, когда их совместное использование существенно превосходит эффект каждого отдельного компонента. К таким способам относится сочетанное применение водного раствора протеината серебра на слизистые оболочки полости носа,
озон/NO-насыщенного физиологического раствора на слизистые оболочки полости носа и верхнечелюстных синусов и низкочастотного ультразвука (НчУЗ) на слизистые оболочки верхнечелюстных синусов у пациентов, оперированных по поводу хронического гнойного риносинусита (гайморита).
Протеинат серебра (лат. Argentum proteinate) — коллоидное серебро, антисептическое и дезинфицирующее средство для местного применения, обладает вяжущим, антисептическим и противовоспалительным действием, диссоциирует с образованием ионов серебра, которые препятствуют размножению бактерий на слизистых, блокируя ферментативные системы. В основе противовоспалительного механизма действия протеината серебра на поврежденные слизистые оболочки или поверхность кожи лежит образование защитной пленки, возникающей за счет осаждения серебром белков, которая способствует уменьшению чувствительности слизистых оболочек, кожи и активирует сужение сосудов, что приводит к торможению воспалительных реакций [14]. Кроме того, такая пленка препятствует проникновению микроорганизмов в слизистые и кожу, а также усиливает регенеративные свойства мерцательного эпителия [15].
Протеинат серебра проявляет активность в отношении грамположительных бактерий, а именно стафилококков (S. aureus) и стрептококков (Str. pneumoniae), Moraxella catarrhalis, грамотрицательных бактерий, в частности гонококка, менингококка, гемофильной палочки, синегнойной палочки, а также грибов. При этом применение протеината серебра не вызывает дисбиоз [12]. Бактериостатический и бактерицидный эффект протеината серебра (в зависимости от концентрации) был подтвержден данными исследований in vitro в отношении клинических штаммов Staphylococcus spp. (S. aureus, S. haemolyticus, S. epidermidis, S. cohnii), Streptococcus spp. (Str. pneumoniaе, Str. pyogenes), H. influenzaе, M. catarrhalis, Pseudomonas aeruginosa, Neisseria spp. (Neisseria subflava), Burkholderia cenocepacia при количественном содержании указанных возбудителей 103, 104, 105, 106, 107 КОЕ/мл, с определением минимальной бактериостатической концентрации, минимальной бактерицидной концентрации, устойчивости микроорганизмов к препарату, проведенных на базе НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи [16]. Было установлено, что патогенная микрофлора более чувствительна к ионам серебра, чем непатогенная, что позволяет протеинату серебра воздействовать избирательно и не вызывать нарушения баланса нормальной микрофлоры [17].
В аптечные прописи протеинат серебра входит с 1964 г. в форме 2% раствора под названием «протаргол». Из порошка в аптеках готовят 2% растворы, которые используют для наружного применения [15]. В 2013 г. российскими учеными создана и запатентована форма выпуска промышленного протеината серебра (Сиалор®) — таблетки для приготовления 2% раствора. Эта форма имеет длительный срок хранения (препарат в виде таблеток в герметичной упаковке хранится 2 года). Форма выпуска препарата включает таблетку (200 мг протеината серебра) в блистере, растворитель (10 мл очищенной воды), флакон из темного стекла с крышкой-пипеткой или насадкой-распылителем. Раствор готовят согласно инструкции по применению, процесс приготовления занимает ~15 мин. После каждого использования плотно закрытый флакон можно хранить при комнатной температуре до 30 сут. Курс лечения — 5–7 дней [18].
После местного применения препарата его действующий компонент практически не поступает в системный кровоток со слизистой оболочки носа.
К настоящему времени накоплен большой положительный опыт применения протеината серебра с учетом его хорошей эффективности, высокого профиля безопасности при лечении ряда воспалительных заболеваний верхних дыхательных путей, в частности вирусных, бактериальных ринитов, в т. ч. при наличии бактериально-грибковых ассоциаций [19], гнойных ринитов [12], острых риносинуситов [20, 21], ринофарингитов, инфекционно-воспалительных заболеваний носоглотки и придаточных пазух носа при осложнениях ОРЗ [15], в комплексном лечении хронических риносинуситов, гипертрофии аденоидов, хронических фарингитов, наружных отитов [17, 21], хронических аденоидитов, вызванных грибково-бактериальными ассоциациями [18], в составе комплексной терапии у детей после аденотомии [22].
С учетом вышеперечисленных свойств протеината серебра, его высокой эффективности в отношении ряда микроорганизмов, как правило, вегетирующих на слизистых оболочках при гнойных риносинуситах [23], в клинике ЛОР-болезней АГМУ мы применили данный антисептик в составе комплексной терапии у больных, оперированных по поводу хронического гнойного риносинусита (гайморита). Другим компонентом предлагаемого лечения является сочетание НчУЗ, озона и оксида азота (метод озон/NO-ультразвуковой терапии), т. к. эти средства обладают бактерицидным действием, способствуют регенерации тканей, не имеют побочных эффектов, позволяют ускорить процессы заживления и восстановления нормальных функций оперированного органа.
Патогенетический эффект озонотерапии определяется высоким окислительно-восстановительным потенциалом озона, что обеспечивает двойной механизм действия: во‑первых, локальный, с дезинфицирующей активностью в отношении бактерий, вирусов и грибов, во‑вторых, системный, метаболический в отношении белково-липидных комплексов плазмы и мембран клеток, ведущий к повышению РО2, преобразованию и синтезу биологически активных веществ, усилению активности иммунокомпетентных клеток, улучшению реологии и кислородтранспортной функции крови [24]. Оксид азота (NO) наряду с другими биологическими медиаторами участвует в процессах мукоцилиарного транспорта, воспаления и антимикробной защиты. Оксид азота останавливает рост множества микроорганизмов и обеспечивает активацию иммунной защиты в инфицированном организме [24–27]. Вводимые экзогенно в биотропных дозах в очаг инфекции озон и оксид азота позволяют эффективно воздействовать на фазы раневого процесса, обеспечивая сокращение сроков лечения гнойно-воспалительных заболеваний [24, 28].
В последние годы появилось больше возможностей использовать в лечении заболеваний физические методы, одним из которых является НчУЗ. НчУЗ, воздействуя на биоткани, оказывает бактерицидное действие, способствует нормализации обменных процессов и устранению нарушений в системе микроциркуляторного русла, активации макрофагальной реакции, усилению пролиферативной и синтетической активности фибробластов. Для организма человека НчУЗ практически безвреден [29–32].
С целью доказательства эффективного бактерицидного воздействия НчУЗ в сочетании с озон/NO-газовой смесью на патогенную микрофлору нами был поставлен эксперимент. При этом использовали следующее оборудование: аппарат низкочастотный ультразвуковой хирургический «Кавитон» (Россия), аппарат физиотерапевтический для газовой озонотерапии «Озотрон» (Россия), газоанализатор озонометр «Медозон-254/5» (Россия). Используемые материалы: чистые культуры микроорганизмов E. coli, Р. aeruginosa, S. aureus. Суспензию каждого микроорганизма готовили согласно стандарту мутности 10 ед., что соответствовало 109 микробных клеток на мл. Затем полученные суспензии микроорганизмов в объеме 15 мл подвергали обработке только НчУЗ (в пробирку погружали волновод с амплитудой колебаний 60–80 мкм и частотой 26 кГц, воздействие проводили в течение 10, 20, 30 и 60 с). Далее суспензии в объеме 15 мл подвергали обработке только озон/NO-содержащей газовой смесью с концентрацией озона 3,5–4 мг/л при такой же временной экспозиции. После этого на суспензии микроорганизмов в объеме 15 мл воздействовали НчУЗ в сочетании с вышеуказанной газовой смесью с теми же физическими, физико-химическими и временными параметрами. Для подсчета выросших колоний, определения культуральных свойств и способности к гемолизу был подготовлен ряд серийных разведений, высев которых производили из пробирок с концентрацией микроорганизмов 105 и 103 клеток/мл по 0,1 мл на 5% кровяной агар в чашки Петри с последующим термостатированием при 37 °C в течение 24–48 ч.
Полученные результаты свидетельствовали о том, что при воздействии только НчУЗ на E. coli отмечался частичный бактерицидный эффект, проявившийся в уменьшении числа выросших колоний в 100 раз, с увеличением времени воздействия результат не менялся, рост колоний сохранялся типичным. При воздействии на Р. aeruginosa возник частичный бактерицидный эффект с уменьшением числа колоний в 100 раз через 10 с, который усиливался при увеличении времени воздействия, рост сохранялся типичным. Действие НчУЗ на S. aureus выразилось в меньшей степени, рост колоний уменьшился в 20 раз, при увеличении времени экспозиции результат не менялся, рост колоний сохранялся типичным.
При воздействии только озон/NO-содержащей газовой смеси получены более выраженные изменения. Уменьшение роста колоний E. coli в 100 раз наблюдали через 10 с, при увеличении времени воздействия, соответственно, увеличился и бактерицидный эффект до 1000 раз через 60 с, появились колонии с атипичным ростом, произошла утрата гемолитических свойств. Подобную картину наблюдали при воздействии и на Р. aeruginosa. При этом наблюдался частичный бактерицидный эффект, выразившийся в уменьшении числа колоний в 25 раз при воздействии в течение 10 с и усилившийся в 1000 раз через 60 с. Отмечался атипичный рост колоний, произошла утрата гемолитических свойств. При воздействии на S. aureus выявлен полный бактерицидный эффект (роста нет) через 60 с.
Самым эффективным было применение НчУЗ и озон/NO-газовой смеси. Результаты свидетельствовали о развитии синергизма в отношении подавления роста и жизнедеятельности патогенных микроорганизмов. Так, воздействие на E. coli вызвало уменьшение роста колоний в 1000 раз при 10 с, далее был достигнут полный бактерицидный эффект (роста нет). При воздействии на Р. aeruginosa были получены результаты, которые совпадали с результатами применения отдельно озон/NO-газовой смеси. Частичный бактерицидный эффект с уменьшением числа колоний в 30 раз появился при воздействии в течение 10 с, усилился при увеличении времени до 60 с в 100 раз, отмечался атипичный рост колоний, произошла утрата гемолитических свойств. При воздействии на S. aureus получен более быстрый бактерицидный и фунгицидный эффект, при котором роста колоний не наблюдали.
Все вышесказанное позволяло ожидать выраженного клинического эффекта в результате сочетанного применения у больных 2% раствора протеината серебра и озон/NO-ультразвукового метода.
В группу пролеченных были включены пациенты, оперированные по поводу хронического гнойного риносинусита (гайморита) (60 человек). Протеинат серебра (3 капли 2% раствора, приготовленного согласно инструкции) применяли всем пациентам путем распыления на слизистые оболочки полости носа через 8 ч 3 раза в течение
2 сут до оперативного вмешательства и в 16 и 24 ч в течение 2–7 сут после операции. Озон/NO-содержащий физиологический раствор применяли у пациентов, которым выполняли эндоскопические операции. Первый этап: после расширения естественного соустья верхнечелюстной пазухи и удаления патологического содержимого пазуху заполняли вышеуказанным раствором, через 120 с удаляли его из пазухи электроотсосом. Второй этап: ежедневно с 3-х по 6-е сут промывали пазуху данным раствором через соустье с помощью металлической канюли. Количество раствора составляло 150–200 мл. Промывание проводили до чистой промывной жидкости. Воздействие НчУЗ выполняли путем кавитации через указанный раствор у пациентов с наиболее тяжелым течением патологического процесса, которым выполняли операции с трепанацией передней стенки верхнечелюстной пазухи. Первый этап: после вскрытия верхнечелюстной пазухи и удаления патологического содержимого пазуху заполняли указанным раствором, вводили ультразвуковой волновод (аппарат «Тонзиллор-3ММ») и воздействовали в течение 90 с, затем удаляли раствор из пазухи электроотсосом. Второй этап: ежедневно с 3-х по 7-е сут промывали пазуху данным раствором через расширенное соустье с помощью металлической канюли. Количество раствора составило 150–200 мл. Промывание проводили до чистой жидкости.
Для оценки эффективности воздействия такой терапии мы выполнили (до оперативного вмешательства и на 7-е, 30-е сут после него): анализ клинических проявлений в послеоперационном периоде, анализ данных бактериологического исследования, оценку состояния базального кровотока слизистой полости носа, оценку показателей мукоцилиарного транспорта верхнечелюстного синуса.
Анализ результатов показал, что предложенный способ терапии является эффективным и безопасным способом ведения больных в послеоперационном периоде, который уже с первых суток после операции позволил уменьшить болевой синдром, отек в области оперированной пазухи, отек слизистой оболочки полости носа; улучшить показатели мукоцилиарного транспорта, повысить показатель, отражающий улучшение микроциркуляции как на 7-е сут, так и через 1 мес. после операции. У всех больных до операции в отделяемом из верхнечелюстных синусов и полости носа были высеяны микробные возбудители: S. aureus, S. saprophyticus, S. epidermidis, S. pneumoniaе, H. influenzaе, P. aeruginosa, E. coli при количественном содержании указанных возбудителей КОЕ/мл не ниже 104. Микробиологическое исследование, проведенное после лечения, выявило практически полную элиминацию данных микропатогенов, за исключением 2 случаев, где был высеян S. aureus 103.
Таким образом, приведенные данные позволяют сделать вывод о том, что сочетанное применение раствора протеината серебра (препарата Сиалор®) в комплексе с озон/NO-ультразвуковым методом в ходе хирургического лечения и в послеоперационном периоде у больных с гнойными формами синусита является эффективным, хорошо переносится пациентами и позволяет добиться не только эрадикации микробов в оперированных полостях, но и быстрой положительной клинической динамики заболевания, что дает основания рекомендовать такой подход к применению в лечебной практике.
В клинической картине острого катарального ринита выделяют три стадии, последовательно переходящие одна в другую:
стадия сухого раздражения;
стадия серозных выделений;
стадия гнойных выделений (разрешения).
Пациенты предъявляют жалобы на назальные симптомы: заложенность носа, ринорею, чихание, которые преобладают на второй-третий день и уменьшаются к пятому дню заболевания.
Важно отметить, что симптомы ринита снижают качество жизни пациентов: отмечаются расстройства сна, снижение работоспособности и успеваемости в школе, психологические нарушения [3–5].
Практически при любой ОРВИ в процесс вовлекаются околоносовые пазухи (ОНП) [6]. В таблице 1 приведены диагностические критерии острого риносинусита (ОРС). Диагноз устанавливается при наличии по крайней мере 2 больших или 1 малого или более 2 малых критериев. Иногда к ОРС присоединяется вторичная бактериальная инфекция [7]. Некоторые заболевания, включая попадание инородного тела в носовые ходы или прободение перегородки носа, перелом носа, предрасполагают к длительному течению инфекционного ринита.

Наряду с противовирусными и иммуностимулирующими лекарственными средствами, составляющими основу современной стратегии лечения гриппа и ОРВИ, при симптоматическом лечении ОРС широко используются адреномиметики (деконгестанты), антигистаминные препараты, имеющие ряд нежелательных побочных эффектов [8].
Нарушение рекомендуемого режима дозирования местных деконгестантов зачастую приводит к местным нежелательным явлениям (атрофический ринит), к появлению таких общих симптомов передозировки, как беспокойство, тремор, бессонница, головная боль, тахикардия и артериальная гипертензия [9].
Системная антибиотикотерапия используется при ОРС необоснованно часто. Так, в США антибиотики получают 84,8% больных ОРС, причем чаще других врачи назначают макролиды [10]. Поскольку дополнительные методы исследования, такие как рентгенография, компьютерная томография, УЗИ, не позволяют дифференцировать вирусное и бактериальное поражение ОНП и не являются критериями степени тяжести заболевания, основными ориентирами при решении вопроса о назначении антибиотика становятся общее состояние и жалобы больного, анамнез и наличие гнойного отделяемого в носовых ходах. Назначение системной антибиотикотерапии рекомендуется при отсутствии улучшения к 7-му дню заболевания или в любые сроки в случае ухудшения состояния [11].
Широкое, и, в части случаев, нерациональное использование антибактериальных средств (системных, местных) при лечении этой и иных воспалительных патологий, кроме того, самолечение, так же как и массовое применение антибиотиков в ветеринарии, пищевой промышленности и других отраслях, привело к появлению и распространению антибиотикорезистентных штаммов микроорганизмов, возникновению у них различных приспособительных факторов, способствующих передаче генов резистентности. Кроме того, произошла эволюция микроорганизмов: сапрофиты приобрели патогенные свойства, условно-патогенные повысили свою вирулентность, появились адаптированные к больничным условиям госпитальные штаммы, устойчивые к антисептикам и антибиотикам, традиционно применяемым для лечения бактериальных инфекций [12, 13].
Увеличение числа случаев необоснованного назначения препаратов, приводящих к росту полипрагмазии, антибиотикорезистентности, аллергизации населения, заставляет врачей настойчивее искать новые возможности эффективной и безопасной терапии. В связи с этим одним из путей решения данной проблемы является применение методов и средств, лечебное воздействие которых не связано с преодолением антибиотикорезистентности микропатогенов, при этом обладающих значительным бактерицидным, фунгицидным, вирулицидным эффектом.
Примером может служить объединение двух или нескольких эффективных способов лечения, когда их совместное использование существенно превосходит эффект каждого отдельного компонента. К таким способам относится сочетанное применение водного раствора протеината серебра на слизистые оболочки полости носа,
озон/NO-насыщенного физиологического раствора на слизистые оболочки полости носа и верхнечелюстных синусов и низкочастотного ультразвука (НчУЗ) на слизистые оболочки верхнечелюстных синусов у пациентов, оперированных по поводу хронического гнойного риносинусита (гайморита).
Протеинат серебра (лат. Argentum proteinate) — коллоидное серебро, антисептическое и дезинфицирующее средство для местного применения, обладает вяжущим, антисептическим и противовоспалительным действием, диссоциирует с образованием ионов серебра, которые препятствуют размножению бактерий на слизистых, блокируя ферментативные системы. В основе противовоспалительного механизма действия протеината серебра на поврежденные слизистые оболочки или поверхность кожи лежит образование защитной пленки, возникающей за счет осаждения серебром белков, которая способствует уменьшению чувствительности слизистых оболочек, кожи и активирует сужение сосудов, что приводит к торможению воспалительных реакций [14]. Кроме того, такая пленка препятствует проникновению микроорганизмов в слизистые и кожу, а также усиливает регенеративные свойства мерцательного эпителия [15].
Протеинат серебра проявляет активность в отношении грамположительных бактерий, а именно стафилококков (S. aureus) и стрептококков (Str. pneumoniae), Moraxella catarrhalis, грамотрицательных бактерий, в частности гонококка, менингококка, гемофильной палочки, синегнойной палочки, а также грибов. При этом применение протеината серебра не вызывает дисбиоз [12]. Бактериостатический и бактерицидный эффект протеината серебра (в зависимости от концентрации) был подтвержден данными исследований in vitro в отношении клинических штаммов Staphylococcus spp. (S. aureus, S. haemolyticus, S. epidermidis, S. cohnii), Streptococcus spp. (Str. pneumoniaе, Str. pyogenes), H. influenzaе, M. catarrhalis, Pseudomonas aeruginosa, Neisseria spp. (Neisseria subflava), Burkholderia cenocepacia при количественном содержании указанных возбудителей 103, 104, 105, 106, 107 КОЕ/мл, с определением минимальной бактериостатической концентрации, минимальной бактерицидной концентрации, устойчивости микроорганизмов к препарату, проведенных на базе НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи [16]. Было установлено, что патогенная микрофлора более чувствительна к ионам серебра, чем непатогенная, что позволяет протеинату серебра воздействовать избирательно и не вызывать нарушения баланса нормальной микрофлоры [17].
В аптечные прописи протеинат серебра входит с 1964 г. в форме 2% раствора под названием «протаргол». Из порошка в аптеках готовят 2% растворы, которые используют для наружного применения [15]. В 2013 г. российскими учеными создана и запатентована форма выпуска промышленного протеината серебра (Сиалор®) — таблетки для приготовления 2% раствора. Эта форма имеет длительный срок хранения (препарат в виде таблеток в герметичной упаковке хранится 2 года). Форма выпуска препарата включает таблетку (200 мг протеината серебра) в блистере, растворитель (10 мл очищенной воды), флакон из темного стекла с крышкой-пипеткой или насадкой-распылителем. Раствор готовят согласно инструкции по применению, процесс приготовления занимает ~15 мин. После каждого использования плотно закрытый флакон можно хранить при комнатной температуре до 30 сут. Курс лечения — 5–7 дней [18].
После местного применения препарата его действующий компонент практически не поступает в системный кровоток со слизистой оболочки носа.
К настоящему времени накоплен большой положительный опыт применения протеината серебра с учетом его хорошей эффективности, высокого профиля безопасности при лечении ряда воспалительных заболеваний верхних дыхательных путей, в частности вирусных, бактериальных ринитов, в т. ч. при наличии бактериально-грибковых ассоциаций [19], гнойных ринитов [12], острых риносинуситов [20, 21], ринофарингитов, инфекционно-воспалительных заболеваний носоглотки и придаточных пазух носа при осложнениях ОРЗ [15], в комплексном лечении хронических риносинуситов, гипертрофии аденоидов, хронических фарингитов, наружных отитов [17, 21], хронических аденоидитов, вызванных грибково-бактериальными ассоциациями [18], в составе комплексной терапии у детей после аденотомии [22].
С учетом вышеперечисленных свойств протеината серебра, его высокой эффективности в отношении ряда микроорганизмов, как правило, вегетирующих на слизистых оболочках при гнойных риносинуситах [23], в клинике ЛОР-болезней АГМУ мы применили данный антисептик в составе комплексной терапии у больных, оперированных по поводу хронического гнойного риносинусита (гайморита). Другим компонентом предлагаемого лечения является сочетание НчУЗ, озона и оксида азота (метод озон/NO-ультразвуковой терапии), т. к. эти средства обладают бактерицидным действием, способствуют регенерации тканей, не имеют побочных эффектов, позволяют ускорить процессы заживления и восстановления нормальных функций оперированного органа.
Патогенетический эффект озонотерапии определяется высоким окислительно-восстановительным потенциалом озона, что обеспечивает двойной механизм действия: во‑первых, локальный, с дезинфицирующей активностью в отношении бактерий, вирусов и грибов, во‑вторых, системный, метаболический в отношении белково-липидных комплексов плазмы и мембран клеток, ведущий к повышению РО2, преобразованию и синтезу биологически активных веществ, усилению активности иммунокомпетентных клеток, улучшению реологии и кислородтранспортной функции крови [24]. Оксид азота (NO) наряду с другими биологическими медиаторами участвует в процессах мукоцилиарного транспорта, воспаления и антимикробной защиты. Оксид азота останавливает рост множества микроорганизмов и обеспечивает активацию иммунной защиты в инфицированном организме [24–27]. Вводимые экзогенно в биотропных дозах в очаг инфекции озон и оксид азота позволяют эффективно воздействовать на фазы раневого процесса, обеспечивая сокращение сроков лечения гнойно-воспалительных заболеваний [24, 28].
В последние годы появилось больше возможностей использовать в лечении заболеваний физические методы, одним из которых является НчУЗ. НчУЗ, воздействуя на биоткани, оказывает бактерицидное действие, способствует нормализации обменных процессов и устранению нарушений в системе микроциркуляторного русла, активации макрофагальной реакции, усилению пролиферативной и синтетической активности фибробластов. Для организма человека НчУЗ практически безвреден [29–32].
С целью доказательства эффективного бактерицидного воздействия НчУЗ в сочетании с озон/NO-газовой смесью на патогенную микрофлору нами был поставлен эксперимент. При этом использовали следующее оборудование: аппарат низкочастотный ультразвуковой хирургический «Кавитон» (Россия), аппарат физиотерапевтический для газовой озонотерапии «Озотрон» (Россия), газоанализатор озонометр «Медозон-254/5» (Россия). Используемые материалы: чистые культуры микроорганизмов E. coli, Р. aeruginosa, S. aureus. Суспензию каждого микроорганизма готовили согласно стандарту мутности 10 ед., что соответствовало 109 микробных клеток на мл. Затем полученные суспензии микроорганизмов в объеме 15 мл подвергали обработке только НчУЗ (в пробирку погружали волновод с амплитудой колебаний 60–80 мкм и частотой 26 кГц, воздействие проводили в течение 10, 20, 30 и 60 с). Далее суспензии в объеме 15 мл подвергали обработке только озон/NO-содержащей газовой смесью с концентрацией озона 3,5–4 мг/л при такой же временной экспозиции. После этого на суспензии микроорганизмов в объеме 15 мл воздействовали НчУЗ в сочетании с вышеуказанной газовой смесью с теми же физическими, физико-химическими и временными параметрами. Для подсчета выросших колоний, определения культуральных свойств и способности к гемолизу был подготовлен ряд серийных разведений, высев которых производили из пробирок с концентрацией микроорганизмов 105 и 103 клеток/мл по 0,1 мл на 5% кровяной агар в чашки Петри с последующим термостатированием при 37 °C в течение 24–48 ч.
Полученные результаты свидетельствовали о том, что при воздействии только НчУЗ на E. coli отмечался частичный бактерицидный эффект, проявившийся в уменьшении числа выросших колоний в 100 раз, с увеличением времени воздействия результат не менялся, рост колоний сохранялся типичным. При воздействии на Р. aeruginosa возник частичный бактерицидный эффект с уменьшением числа колоний в 100 раз через 10 с, который усиливался при увеличении времени воздействия, рост сохранялся типичным. Действие НчУЗ на S. aureus выразилось в меньшей степени, рост колоний уменьшился в 20 раз, при увеличении времени экспозиции результат не менялся, рост колоний сохранялся типичным.
При воздействии только озон/NO-содержащей газовой смеси получены более выраженные изменения. Уменьшение роста колоний E. coli в 100 раз наблюдали через 10 с, при увеличении времени воздействия, соответственно, увеличился и бактерицидный эффект до 1000 раз через 60 с, появились колонии с атипичным ростом, произошла утрата гемолитических свойств. Подобную картину наблюдали при воздействии и на Р. aeruginosa. При этом наблюдался частичный бактерицидный эффект, выразившийся в уменьшении числа колоний в 25 раз при воздействии в течение 10 с и усилившийся в 1000 раз через 60 с. Отмечался атипичный рост колоний, произошла утрата гемолитических свойств. При воздействии на S. aureus выявлен полный бактерицидный эффект (роста нет) через 60 с.
Самым эффективным было применение НчУЗ и озон/NO-газовой смеси. Результаты свидетельствовали о развитии синергизма в отношении подавления роста и жизнедеятельности патогенных микроорганизмов. Так, воздействие на E. coli вызвало уменьшение роста колоний в 1000 раз при 10 с, далее был достигнут полный бактерицидный эффект (роста нет). При воздействии на Р. aeruginosa были получены результаты, которые совпадали с результатами применения отдельно озон/NO-газовой смеси. Частичный бактерицидный эффект с уменьшением числа колоний в 30 раз появился при воздействии в течение 10 с, усилился при увеличении времени до 60 с в 100 раз, отмечался атипичный рост колоний, произошла утрата гемолитических свойств. При воздействии на S. aureus получен более быстрый бактерицидный и фунгицидный эффект, при котором роста колоний не наблюдали.
Все вышесказанное позволяло ожидать выраженного клинического эффекта в результате сочетанного применения у больных 2% раствора протеината серебра и озон/NO-ультразвукового метода.
В группу пролеченных были включены пациенты, оперированные по поводу хронического гнойного риносинусита (гайморита) (60 человек). Протеинат серебра (3 капли 2% раствора, приготовленного согласно инструкции) применяли всем пациентам путем распыления на слизистые оболочки полости носа через 8 ч 3 раза в течение
2 сут до оперативного вмешательства и в 16 и 24 ч в течение 2–7 сут после операции. Озон/NO-содержащий физиологический раствор применяли у пациентов, которым выполняли эндоскопические операции. Первый этап: после расширения естественного соустья верхнечелюстной пазухи и удаления патологического содержимого пазуху заполняли вышеуказанным раствором, через 120 с удаляли его из пазухи электроотсосом. Второй этап: ежедневно с 3-х по 6-е сут промывали пазуху данным раствором через соустье с помощью металлической канюли. Количество раствора составляло 150–200 мл. Промывание проводили до чистой промывной жидкости. Воздействие НчУЗ выполняли путем кавитации через указанный раствор у пациентов с наиболее тяжелым течением патологического процесса, которым выполняли операции с трепанацией передней стенки верхнечелюстной пазухи. Первый этап: после вскрытия верхнечелюстной пазухи и удаления патологического содержимого пазуху заполняли указанным раствором, вводили ультразвуковой волновод (аппарат «Тонзиллор-3ММ») и воздействовали в течение 90 с, затем удаляли раствор из пазухи электроотсосом. Второй этап: ежедневно с 3-х по 7-е сут промывали пазуху данным раствором через расширенное соустье с помощью металлической канюли. Количество раствора составило 150–200 мл. Промывание проводили до чистой жидкости.
Для оценки эффективности воздействия такой терапии мы выполнили (до оперативного вмешательства и на 7-е, 30-е сут после него): анализ клинических проявлений в послеоперационном периоде, анализ данных бактериологического исследования, оценку состояния базального кровотока слизистой полости носа, оценку показателей мукоцилиарного транспорта верхнечелюстного синуса.
Анализ результатов показал, что предложенный способ терапии является эффективным и безопасным способом ведения больных в послеоперационном периоде, который уже с первых суток после операции позволил уменьшить болевой синдром, отек в области оперированной пазухи, отек слизистой оболочки полости носа; улучшить показатели мукоцилиарного транспорта, повысить показатель, отражающий улучшение микроциркуляции как на 7-е сут, так и через 1 мес. после операции. У всех больных до операции в отделяемом из верхнечелюстных синусов и полости носа были высеяны микробные возбудители: S. aureus, S. saprophyticus, S. epidermidis, S. pneumoniaе, H. influenzaе, P. aeruginosa, E. coli при количественном содержании указанных возбудителей КОЕ/мл не ниже 104. Микробиологическое исследование, проведенное после лечения, выявило практически полную элиминацию данных микропатогенов, за исключением 2 случаев, где был высеян S. aureus 103.
Таким образом, приведенные данные позволяют сделать вывод о том, что сочетанное применение раствора протеината серебра (препарата Сиалор®) в комплексе с озон/NO-ультразвуковым методом в ходе хирургического лечения и в послеоперационном периоде у больных с гнойными формами синусита является эффективным, хорошо переносится пациентами и позволяет добиться не только эрадикации микробов в оперированных полостях, но и быстрой положительной клинической динамики заболевания, что дает основания рекомендовать такой подход к применению в лечебной практике.
материал rmj.ru
