Содержание статьи
Энтеральное питание в коррекции стрессовой гипергликемии у
больных, оперированных по поводу новообразований поджелудочной железы
В. А. Зырьянов*
Н. Г. Панова*, кандидат медицинских наук
М. Д. Любимов*
А. Е. Шестопалов**, доктор медицинских наук, профессор
* ФГКУ ГВКГ им. ак. Н. Н. Бурденко, Москва
** ГБОУ ДПО РМАПО МЗ РФ, Москва
В соответствии с современными представлениями, обязательным компонентом
послеоперационного лечения пациентов хирургического профиля является
нутритивно-метаболическая поддержка (НП), направленная на полноценное
обеспечение энергетических и пластических потребностей организма, а также
введение нутриентов как фармакологического средства коррекции метаболического
ответа организма на стресс, в том числе «метаболическую терапию» синдрома
кишечной недостаточности [1–5].
Такой подход обусловлен несколькими причинами. Согласно данным многочисленных
исследований до 50% пациентов, поступающих в стационары на лечение, имеют
признаки питательной недостаточности [1, 2, 4, 6, 7]. Наряду с питательной
недостаточностью при поступлении, существенное значение в течении
послеоперационного периода и результатах хирургического лечения, интенсивной
терапии критических состояний имеет метаболический ответ на стресс (травма,
оперативное вмешательство, инфекция, ишемия и др.) [1–3, 6, 8–10].
Хирургическое вмешательство, независимо от вида анестезиологического пособия,
является мощным стрессовым фактором, особенно в современной абдоминальной
хирургии, при выполнении расширенных комбинированных вмешательств, которые
отличаются значительной травматичностью. К основным проявлениям метаболического
ответа на стресс в послеоперационном периоде относятся синдром
гиперметаболизма-гиперкатаболизма и нарушения функций желудочно-кишечного тракта
(ЖКТ) [1–5, 9, 11, 12].
Принципиально важную роль в патогенезе гиперметаболизма и органных
расстройств при критических состояниях играют постагрессивные нарушения функций
ЖКТ — синдром кишечной недостаточности (СКН). СКН возникает как при первичном
поражении ЖКТ (оперативное вмешательство, перитонит, панкреатит и др.), так и
вторичном, без органической патологии ЖКТ (ожоги, черепно-мозговая травма,
пневмония, гнойно-воспалительные поражения мягких тканей и др.) [1–3, 9, 10, 12,
13].
При синдроме гиперметаболизма-гиперкатаболизма на 30–80% возрастают
потребности организма в энергии, наблюдаются чрезмерные протеолиз, гликогенолиз,
глюконеогенез, что сопровождается большими потерями азота и высоким темпом
истощения больных. Ведущим показателем гиперметаболизма-гиперкатаболизма
является увеличение скорости обмена веществ. Потребности больного в энергии
резко возрастают по отношению к базальному энергообмену в покое. К ключевым
показателям относятся снижение концентрации сывороточных белков, потери белка,
гипергликемия, гиперлактатемия, гипербилирубинемия, повышение содержания в
плазме крови креатинина, изменение состава тела. В печени на фоне активного
синтеза острофазовых белков нарушается продукция висцеральных белков.
Развивается стресс-индуцированная гипергликемия [1–4, 6, 8, 12, 14].
Стрессовую гипергликемию определяют как повышение уровня глюкозы крови более
7,8 ммоль/л у пациентов без очевидных признаков сахарного диабета [7, 10, 14].
Стрессовая гипергликемия является проявлением синдрома гиперкатаболизма
критического состояния любой этиологии и представляет одну из наиболее
актуальных проблем современной интенсивной медицины. По данным различных
авторов, частота развития стрессовой гипергликемии у пациентов, находящихся в
критическом состоянии (в т. ч. после обширных оперативных вмешательств),
превышает 90%. У 31% пациентов отделений реанимации и интенсивной терапии (ОРИТ)
при однократном измерении обнаруживается гипергликемия > 11,1 ммоль/л [1, 11,
15, 16]. Гипергликемию, хотя бы однократно, обнаруживают у 97,5% пациентов в
ОРИТ, 70% больных с сепсисом, 60% больных с инфарктом миокарда, 50% больных с
острым нарушением мозгового кровообращения (ОНМК) [2, 3, 10, 17, 18].
Гипоксия любой природы, нарушения кровообращения, острое заболевание,
хирургические вмешательства или травма приводят к нарушению синтеза и транспорта
инсулина и одновременно к повышению уровня контринсулярных гормонов —
адреналина, кортизола, глюкагона и гормона роста. Контррегуляторный ответ
организма на стресс (выброс стресс-гормонов и системная воспалительная реакция
на операционную травму) приводит к нарушению углеводного обмена, включая
инсулинорезистентность, повышение продукции глюкозы печенью, нарушение
утилизации глюкозы на периферии и относительной инсулиновой недостаточности.
Адреналин стимулирует выброс глюкагона и подавляет выработку инсулина β-клетками
поджелудочной железы. Высокий уровень кортизола увеличивает продукцию глюкозы
печенью и стимулирует распад белков, вследствие чего повышается уровень
циркулирующих аминокислот, что приводит к глюконеогенезу. В дополнение к этому
стресс приводит к продукции цитокинов, таких как фактор некроза опухолей (ФНО-α),
интерлейкинов (ИЛ-6 и ИЛ-1), которые повышают инсулинорезистентность, понижая
чувствительность рецепторов инсулина к последнему. Инсулинорезистентность — одна
из основных причин гипергликемии, развивается в течение нескольких минут и
сохраняется от нескольких дней до недель, один из факторов, определяющих
длительность пребывания в стационаре [16, 18–22].
Результаты многочисленных исследований последних лет показали взаимосвязь
между гипергликемией и исходами лечения, смертностью, длительностью пребывания в
стационаре, инфекционными и другими осложнениями после хирургического
вмешательства [7, 22, 23].
Методы нутритивной поддержки в лечении синдрома
гиперметаболизма-гиперкатаболизма при критических состояниях и полиорганной
недостаточности применяются и разрабатываются более двух десятков лет. Сегодня
уже достаточно очевидны те принципиальные подходы, без применения которых нельзя
говорить о проведении адекватной метаболической коррекции расстройств в системе
гомеостаза и обмена веществ при критических состояниях. Прежде всего, это
касается подходов к метаболически ориентированной нутритивной поддержке,
позволяющей активно вмешиваться в патогенетические звенья системной
воспалительной реакции и адекватно корригировать белково-энергетическую и
питательную недостаточность, энтерального компонента нутритивно-метаболической
поддержки и энтеральной терапии синдрома кишечной недостаточности, применения
новых технологий парентерального питания [1–3, 6, 10, 11, 14, 17, 24].
В этой связи при проведении нутритивно-метаболической поддержки у больных со
стрессовой гипергликемией, как правило, применяют специализированные смеси,
предназначенные для больных сахарным диабетом. Общим для них является
полноценность и сбалансированность химического состава, низкий гликемический
индекс (относительно пониженный уровень углеводов, которые должны быть
представлены цельным крахмалом и крупномолекулярным мальтодекстрином),
отсутствие моно- или дисахаридов с инсулинозависимым типом метаболизма, высокий
уровень белка и растительных жиров, повышенное содержание мононенасыщенных
жирных кислот, содержание антиоксидантов, наличие пищевых волокон [4, 5, 10, 13,
14].
С целью предотвращения ошибок и осложнений парентерального питания, которое
может вызвать гипергликемию, вместо флаконной методики применяют технологию «три
в одном» [23].
В связи с этим большой научный и практический интерес представляет решение
проблемы адекватной нутритивно-метаболической поддержки больных хирургического
профиля в послеоперационном периоде со стрессовой гипергликемией с применением
специальных смесей энтерального питания.
Цель работы: оценить эффективность послеоперационного энтерального питания
низкоуглеводной гиперкалорийной смесью с высоким содержанием белка в коррекции
стрессовой гипергликемии и нутритивного статуса у больных, оперированных по
поводу новообразований поджелудочной железы.
Материалы и методы исследования
Одноцентровое проспективное рандомизированное контролируемое исследование в
двух группах сравнения выполнено в Главном военном клиническом госпитале имени
академика Н. Н. Бурденко в период с апреля 2015 г. по март 2016 г.
Обследовано 45 пациентов мужского пола. Средний возраст составил 61,5 ± 13,8
года. Диагноз рака головки поджелудочной железы был установлен на основании
инструментальных и гистологических методов исследований. Всем пациентам
выполнена расширенная гастропанкреатодоуденальная резекция в условиях
комбинированной анестезии: эпидуральной (уровень пункции Th7-Th9) +
ингаляционной с искусственной вентиляцией легких (ингаляционный анестетик
Севоран). Операцию заканчивали интубацией тонкой кишки двухканальным зондом (ЗКС
№ 21) дистальнее анастомоза.
Характеристика смесей энтерального питания, использованных в исследовании:
- стандартная жидкая смесь Изосурс Стандарт, содержащая в 100 мл: белок —
3,9 г, жиры — 3,4 г, углеводы — 13,5 г, калорийность — 100 ккал; - жидкая смесь Новасурс Диабет Плюс. Энергетическая ценность: 1,23 ккал/мл
продукта, содержащего: а) углеводы (39%) — 60 г/500 мл, декстрин из тапиоки,
гликемический индекс (ГИ) — 27; б) белки (20%) — 29,6 г/500 мл, казеинаты и
концентрат сывороточного белка; в) жиры (39%) — мононенасыщенные жирные
кислоты (МНЖК) (26%); ненасыщенные жирные кислоты (НЖК) (6,6%); трансжиры < 0,2%, эйкозапентаеновая кислота (ЭПК)/докозагексаеновая кислота (ДГК): 0,57 г на 1500 ккал, источник: подсолнечное масло с высоким содержанием олеиновой кислоты, масло канолы и рыбий жир; г) пищевые волокна (2%) — 7,5 г на 500 мл; источник: ЧГГК, ФОС, АК, инулин; д) осмолярность: 236 мосм/л.
В соответствии с задачами работы и в зависимости от выбранной программы НП
все больные были распределены на две рандомизированые группы методом закрытых
конвертов.
В 1-ю группу (группу сравнения) вошли 22 пациента, которые получали
стандарную НП. Начиная со вторых по третьи сутки послеоперационного периода
парентеральное питание (ПП) осуществляли по общепринятым схемам с использованием
системы «три в одном» «Кабивен центральный» в объеме 2000 мл (азот 10,8 г, жиры
80 г, глюкоза безводная 200 г, энергетическая ценность 1900 ккал). На 4–5 сутки
в объеме 1500 мл (1400 ккал/сут), на 5–6 сутки — ПП прекращали. С первых часов
послеоперационного периода через назоинтестинальный зонд проводили кишечный
лаваж глюкозоэлектролитным раствором (ГЭР). По мере восстановления
всасывательной и переваривающей функции тонкой кишки переходили на
внутрикишечное введение ГЭР, в первые сутки — декомпрессия кишки и кишечный
лаваж ГЭР, во вторые сутки — вводили 800 мл ГЭР. С четвертых суток начинали
энтеральное питание (ЭП) стандартной смесью нарастающей нутритивной ценности: от
0,5 ккал/мл (500 мл) до 1 ккал/мл (2000 мл = 2000 ккал: белки 78 г, жиры 68 г,
углеводы 270 г) на 5–6 сутки.
У 23 больных 2-й группы (основной) изучали эффективность послеоперационного
ЭП смесью Новасурс Диабет Плюс в коррекции метаболических нарушений,
нутритивного статуса и стрессовой гипергликемии. Отличием 2-й группы было
внутрикишечное введение смеси Новасурс Диабет Плюс, которая производилась по
следующей схеме: кишечный лаваж и энтеральное введение ГЭР, далее, по мере
восстановления функций ЖКТ, поэтапно с третьих суток проводили энтеральное
питание нарастающего объема и нутритивной ценности — от 0,5 ккал/мл (500 мл) до
1,23 ккал/мл (1500 мл = 1850 ккал/сут: белки 90 г, жиры 79,5 г, углеводы 180 г,
пищевые волокна 22,5 г) на 5–6 сутки. Соответственно ПП полностью прекращали.
Методы исследования
При поступлении больного в отделение реанимации и на первые, третьи, пятые,
седьмые сутки после оперативного вмешательства помимо общеклинических
исследований были использованы специальные методы исследования, позволяющие
оценить эффективность проводимой НП в коррекции основных показателей гомеостаза.
Функциональное состояние ЖКТ оценивали по клиническим признакам и данным
рентгеноконтрастного исследования — зондовой энтерографии водорастворимым
контрастом. Измерение внутрибрюшного давления (ВБД) производили непрямым методом
трансвезикально путем использования мочевого катетера.
Критерии включения в исследование: возраст старше 18 лет; предполагаемое
обширное оперативное вмешательство на органах брюшной полости; отсутствие
сахарного диабета, независимо от типов; поступление в стационар не менее чем за
семь суток до предполагаемого оперативного вмешательства.
Критерии исключения: возраст старше 80 лет; невозможность выполнения
хирургического вмешательства (например, ввиду распространенности ракового
процесса и т. п.), отказ от оперативного вмешательства; лимфомы вне зависимости
от типов.
Статистическая обработка данных
Статистическая обработка материала выполнена с использованием методов
вариационной статистики (программа SPSS). Определяли значение среднего
арифметического (М), стандартного отклонения (SD), стандарной ошибки среднего (SE),
медианы, 25-го и 75-го процентилей. Для проверки нормальности распределения
использовался критерий Колмогорова–Смирнова. Сравнения проводили с
использованием непараметрического критерия Краскела–Уоллиса, непараметрического
критерия Манна–Уитни, параметрического критерия Стьюдента, критерия хи-квадрат
или точного критерия Фишера, критерия Уилкоксона. При исследовании
корреляционной зависимости использовали метод Спирмена.
Результаты и их обсуждение
При изучении основных показателей метаболизма в первые сутки после операции у
больных как 1-й, так и 2-й группы обнаруживали выраженные проявления
гиперметаболизма-гиперкатаболизма с нарушениями белкового, углеводного и
липидного обмена, увеличение потерь азота и расхода энергии. Вместе с тем уже с
третьих суток послеоперационного периода между группами выявлена существенная
разница как в тяжести метаболических нарушений, так и сроках их разрешения на
фоне проводимой НП.
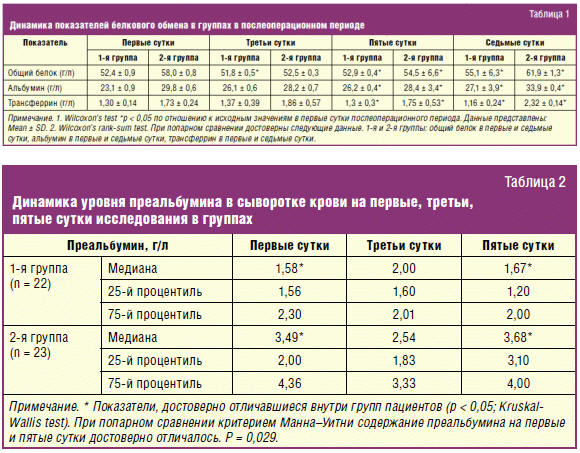
У больных 1-й группы на катаболическую реакцию организма, снижение
белковообразующей функции печени и увеличение потерь белка указывала гипо- и
диспротеинемия: уровень общего белка: 52,4 ± 1,9 г/л; альбумина: 23,1 ± 0,9 г/л;
трансферрина: 1,30 ± 0,14 г/л, преальбумина 1,58 г/л (табл. 1, 2). Интенсивность
катаболизма отражает значительное повышение суточной экскреции азота с мочой —
18,2 ± 1,7 г/сут и отрицательный баланс азота -25,7 ± 1,8 г/сут. Отрицательный
азотистый баланс был обусловлен не только усилением катаболизма белков, но и
нарушением их синтеза, что является проявлением стрессового нарушения обмена
белков.
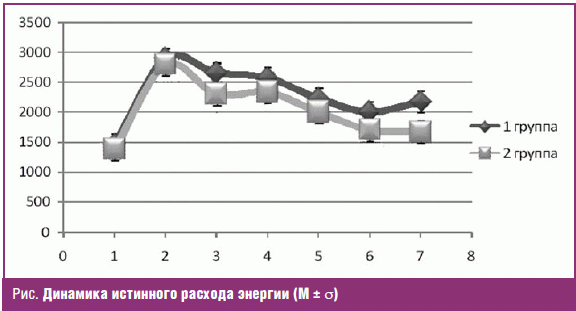
Характерным проявлением гиперметаболической реакции организма было увеличение
энергопотребности. Истинный расход энергии (ИРЭ) по данным непрямой калориметрии
от первых к третьим суткам возрастал с 1687,7 ± 110,4 до 2875,3 ± 206,1 ккал/сут.
К 5–6 суткам в 1-й группе потребности в энергии снижались до 2040,9 ± 185 ккал/сут
(p ≤ 0,05), а во 2-й до 1754,3 ± 200,3 ккал/сут (p ≤ 0,05). Это свидетельствует
о положительной динамике в разрешении реакции гиперметаболизма на фоне
адекватной корригирующей терапии за счет применения смеси с повышенным
содержанием белка и калоража по сравнению со стандартной смесью (рис.).
О развитии синдрома гиперметаболизма и стрессовой гипергликемии
свидетельствовало повышение в крови глюкозы (13,3 ± 1,9 ммоль/л), креатинина
(177,8 ± 7,3 ммоль/л) и азота мочевины (14,0 ± 0,4 ммоль/л). В биохимических
анализах мочи повышенным было содержание креатинина — 3,1 ± 0,1 г/сут и мочевины
— 44,5 ± 3,1 г/сут (р < 0,05).
На фоне раннего энтерального питания специализированной метаболически
ориентированной гиперкалорической, гипернитрогенной питательной смесью с
пищевыми волокнами для больных диабетом и стрессовой гипергликемией (Новасурс
Диабет Плюс) выявлена стабилизация показателей белкового обмена у больных 2-й
группы, которая происходила в более короткие сроки, чем у больных 1-й группы.
С первых по седьмые сутки отмечено достоверное по сравнению с первыми сутками
повышение уровня общего белка с 58,0 ± 2,7 г/л до 61,9 ± 1,3 г/л, альбумина — с
29,8 ± 4,6 г/л до 33,9 ± 0,4 г/л, трансферрина — с 1,70 ± 0,24 г/л до 2,32 ±
0,14 г/л, преальбумина — с 3,49 ± 0,81 г/л до 3,68 ± 046 (р < 0,05, Wilcoxon’s
test).
Выделение с мочой белка уменьшилось до 40–44 г/24 ч. Положительный баланс
азота по сравнению с первыми сутками (-22,0 ± 1,4 г/24 ч) к 7–8 суткам составил
+0,81 ± 0,07 г/24 ч (р < 0,05). В 1-й группе также наблюдается положительная
тенденция, но на седьмые сутки азотистый баланс все еще остается отрицательным
(-1,93 ± 0,33 г/сут, р ≤ 0,05). Следует отметить, что уже к третьим суткам
наблюдения уровень трансферрина во 2-й группе (1,86 ± 0,57 г/л) значимо
превышает таковой в группе сравнения (1,37 ± 0,39 г/л) (р ≤ 0,05). При попарном
сравнении критерием Манна–Уитни было выявлено, что именно во 2-й группе
трансферрин был достоверно выше в первые и седьмые сутки, чем в 1-й группе.
Подтверждением более ранней стабилизации белкового обмена во 2-й группе также
могут служить результаты исследования уровня преальбумина в сыворотке крови: с
первых по пятые сутки этот показатель остается стабильно высоким (табл. 1, 2).
Подтверждением более ранней стабилизации белкового обмена во 2-й группе также
могут служить результаты исследования уровня преальбумина в сыворотке крови: с
первых по пятые сутки этот показатель остается стабильно высоким (табл. 2).
Короткий период полураспада, незначительность пула этого белка во внесосудистом
пространстве и быстрота синтеза в печени позволили определить его в литературе
как маркер ранней диагностики белковой недостаточности [13, 19].
Сравнение полученных результатов показало, что среднесуточное поступление
азота и энергии в группах на фоне полного парентерального питания было
сопоставимо. Включение энтерального питания специальной смесью во 2-й группе
существенно увеличило суточное поступление белка и энергии. Можно полагать, что
в связи с этим коррекция гипо- и диспротеинемии, а также восстановление баланса
азота во 2-й группе происходили в более короткие сроки и эффективнее, чем в 1-й
группе больных.
Не менее важным фактом, установленным по результатам исследования, является
разрешение стрессовой гипергликемии на фоне энтерального питания специальной
смесью Новасурс Диабет Плюс.
Расстройства углеводного обмена, проявляющиеся в послеоперационном периоде в
виде постагрессивной гипергликемии (13,3 ± 1,9 ммоль/л), в совокупности с
характером оперативного вмешательства, установлены у всех больных, что требовало
повышения количества вводимого экзогенного инсулина. Это укладывается в
сложившуюся концепцию нарушения углеводного обмена, сопровождающегося спонтанной
гипергликемией и повышением окисления глюкозы в тканях. Отсутствие сахарного
диабета и нарушения толерантности к глюкозе в анамнезе у всех включенных в
исследование пациентов позволили определить тяжесть нарушения углеводного обмена
в послеоперационном периоде.
Следует отметить, что стресс приводит к продукции цитокинов (ФНО-α) и
интерлейкинов (ИЛ-6 и ИЛ-1), которые повышают инсулинорезистентность, понижая
чувствительность рецепторов инсулина к последнему.
Если рассматривать общую тенденцию в группах, то к пятому дню наблюдения
уровень ИЛ-6 падает почти в 3 раза. В первые сутки послеоперационного периода в
сыворотке крови было определено повышение ИЛ-6 во всех группах. Данное повышение
явилось результатом ответа на обширную хирургическую травму, но уже на третьи
сутки послеоперационного периода анализ ИЛ-6 как показателя провоспалительной
цитокиновой системы показал существенные различия в исследуемых группах: на
первые сутки в 1-й группе — 175,6 ± 23,24 пг/мл, во 2-й группе — 55,3 ± 12,9 пг/мл
(р ≤ 0,05). На пятые сутки уровень ИЛ-6 в 1-й группе превышал таковой во 2-й
группе на 50% и составил 63,7 ± 12,7 пг/мл. В группе сравнения этот показатель
был равен 154,9 ± 51,3 пг/мл, однако в динамике определялась тенденция к
снижению этого показателя от исходного (р = 0,025).
На этапах исследования у больных 2-й группы от первых к пятым суткам уровень
глюкозы снижается с 13,5 ± 0,9 ммоль/л до 6,1 ± 0,2 ммоль/л (р < 0,05). При этом
выявлена достоверная разница между группами (р < 0,05). Одновременно следует
отметить, что в 1-й группе количество инсулина, вводимого за сутки, достигало
137,8 ± 13,1 ЕД, а во 2-й — 90,1 ± 19,8 ЕД (табл. 3).
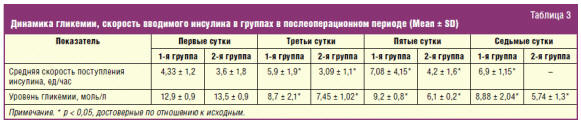
Полученные данные свидетельствуют о том, что послеоперационное энтеральное
питание корригирует стрессовую гипергликемию. Влияние энтерального питания на
углеводный обмен имеет большое практическое значение в лечении послеоперационной
стресс-индуцированной гипергликемии и инсулинорезистентности у больных с
обширными оперативными вмешательствами на желудке и поджелудочной железе.
В целом анализ полученных результатов показал, что менее выраженные
метаболические нарушения и их коррекция в короткие сроки послеоперационного
периода у больных 2-й группы обусловлены особенностями состава периоперационной
нутритивной поддержки, включавшей смесь с повышенным содержанием белка, пищевых
волокон и энергии.
Таким образом, у больных хирургического профиля в послеоперационном периоде
показано проведение своевременной нутритивно-метаболической терапии,
направленной на коррекцию метаболических нарушений и полноценное обеспечение
энергопластических потребностей организма. Проведение энтерального питания
низкоуглеводной гиперкалорийной смесью с повышенным содержанием белка имеет
преимущества по сравнению с традиционным методом коррекции нутритивной
недостаточности и стрессовой гипергликемии, позволяет сократить расход инсулина.
Литература
-
Руднов В. А. Клиническая значимость и возможные пути коррекции
гипергликемии при критических состояниях // Consilium Medicum. 2006; 8 (7):
54–61. -
Шестопалов А. Е. Глава 3. Метаболический ответ организма на
агрессивное воздействие. С. 85–105. Руководство по клиническому питанию / Под
ред. В. М. Луфт, С. В. Багненко. СПб, 2013. 449 с. -
Шестопалов А. Е., Лейдерман И. Н., Свиридов С. В. Метаболический
ответ организма на стресс Глава 8. С. 142–160. Национальное руководство
«Парентеральное и энтеральное питание» / Под ред. М. Ш. Хубутия, Т. С.
Поповой, А. И. Салтанова. М.: ГЭОТАР-Медиа, 2014. - A.S.P.E.N. Clinical Guidelines: Nutrition Support of Adult Patients With
Hyperglycemia // Journal of Parenteral and Enteral Nutrition. 2013, № 1, vol.
37, 23–36. -
Elia M., Ceriello A., Laube H., Sinclair A. J., Engfer M. Enteral
Nutritional Support and Use of Diabetes-Specific Formulas for Patients With
Diabetes. A systematic review and meta-analysis // Diabetes Care. 2005, № 9,
vol. 28, р. 2267–2279. -
Van den Berghe G., Wouters P., Weekers F., Verwaest C., Bruyninckx F.,
Schetz M., Vlasselaers D., Ferdinande P., Lauwers P., Bouillon R.
Intensive insulin therapy in critically ill patients // N. Engl. J. Med. 2001;
345 (19): 1359–1367. -
Клыпа Т. В., Орехова М. С., Забросаева Л. И. Гипергликемия
критических состояний // Сахарный диабет. 2015; (1): 33–41. - Эндокринология: национальное руководство / Под ред. И. И. Дедова М.:
ГЭОТАР-Медиа, 2013. -
Losser M.-R. et al. Bench-to-bedside review: Glucose and stress
conditions in the intensive care unit // Critical Care. 2010, 14: 231. -
Preiser J. C. Glucose control // World review of nutrition and
dietetics. 2013; 105: 82–89. DOI: 10.1159/000341275. -
Николенко А. В., Прелоус И. Н., Лейдерман И. Н. Коррекция
стрессовой гипергликемии у больных с острой хирургической патологией органов
брюшной полости // Общая реаниматология. 2013, IX; 2. С29–34. -
Jeon C. Y., Furuya E. Y., Berman M. F., Larson E. L. The role of
pre-operative and post-operative glucose control in surgical-site infections
and mortality // PloSone. 2012; 7 (9): e45616. DOI: 10.1371. - ESPEN Guidelines on Enteral Nutrition: Surgery including Organ
Transplantation // Clinical Nutrition. 2006, 25, 224–244. - ESPEN Guidelines on Enteral Nutrition: Intensive care // Clinical
Nutrition. 2006, 25, 210–223. -
Обухова О. А., Кашия Ш. Р., Курмуков И. А., Салтанов А. И.
Гипергликемия при критических состояниях: возможные пути решения проблемы //
Вестн. интенс. терапии. 2008; 3: 39–44. -
Farrokhi F., Smiley D., Umpierrez G. E. Glycemic control in
non-diabetic critically ill patients. Best practice and research // Clinical
endocrinology and metabolism. 2011; 25 (5): 813–824. -
Krinsley J. S. et al. Diabetic status and the relation of the
three domains of glycemic control to mortality in critically ill patients: an
international multicenter cohort study // Critical Care. 2013, 17: R37. -
Van Ackerbroeck et al. Incidence and predisposing factors for the
development of disturbed glucose metabolism and DIabetes mellitus AFter
Intensive Care admission: the DIAFIC study // Critical Care. 2015, 19: 355. -
Badawi O., Waite M. D., Fuhrman S. A., Zuckerman I. H.
Association between intensive care unit-acquired dysglycemia and in-hospital
mortality // Critical care medicine. 2012; 40 (12): 3180–3188. -
Gosmanov A. R. et al. Medical Nutrition Therapy in Hospitalized
Patients with Diabetes // Curr Diab Rep. 2012; 12 (1): 93–100. -
Preiser J.-C. et al. Metabolic and nutritional support of
critically ill patients: consensus and controversies // Critical Care. 2015,
19: 35. -
Krinsley J. S., Preiser J.-C. Time in blood glucose range 70 to
140 mg/dl > 80% is strongly associated with increased survival in non-diabetic
critically ill adults // Critical Care. 2015, 19: 179. -
Gosmanov A. R. et al. Management of Hyperglycemia During Enteral
and Parenteral Nutrition Therapy // Curr Diab Rep. 2013; 13 (1): 155–162. -
De Betue С. et al. Does a reduced glucose intake prevent
hyperglycemia in children early after cardiac surgery? a randomized controlled
crossover study // Critical Care. 2012, 16: R176.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru