Введение
Значительные успехи в раннем выявлении (скрининге, генетическом тестировании) и лечении рака привели к значительному увеличению выживаемости: более 85% женщин, у которых был диагностирован рак в возрасте до 45 лет, превысили 5-летнюю выживаемость [1–3]. Для достижения таких впечатляющих результатов лечение рака включает в себя системную химиотерапию, лучевую терапию, гормональную терапию и/или хирургические методы. Несмотря на то, что эти методы лечения продлевают жизнь, они также могут стать причиной нарушения репродуктивной функции [4–6]. Использование современных методов лечения рака сопровождается преждевременным истощением пула фолликулов, что приводит к нарушению репродуктивной, гормональной функции и бесплодию.
Химиотерапия оказывает гонадотоксическое действие, вызывая повреждение ДНК с последующим апоптозом клеток гранулезы и/или яйцеклеток, уязвимых к воздействию цитотоксических агентов. Индуцированные химиотерапией двухцепочечные разрывы ДНК в клетках ооцитов и гранулезных клетках запускают клеточный апоптоз, следствием которого, если не происходит репарации, является истощение овариального резерва. Ткань стромы яичников также восприимчива к повреждениям цитотоксическими агентами за счет нарушения кровоснабжения и фиброза. Общим эффектом является частичная или полная потеря овариального резерва в зависимости от типа химиотерапевтического препарата, дозы, продолжительности терапии и возраста пациентки [7].
Лучевая терапия является важным компонентом многих методов лечения рака. В то же время лучевая терапия весьма токсична для половых клеток: доза 5–10 Гр достаточна, чтобы вызвать дисфункцию яичников и снижение овариального резерва [8]. Радиационно-индуцированное повреждение тканей опосредовано активными формами кислорода, образующимися в результате радиолиза воды. Свободные радикалы способны повреждать многие клеточные элементы, такие как липиды, белки и ДНК в различных тканях организма [7]. Важными факторами, связанными с нарушениями фертильности при лучевой терапии, являются доза и область облучения. Облучения брюшной полости или малого таза в дозе, превышающей 6, 10 и 15 Гр, связаны с повышенным риском развития бесплодия и снижением способности выносить беременность доношенного срока, а облучения в дозе 20 Гр и более или общее облучение тела в дозе 15 Гр может вызвать необратимые последствия — бесплодие [9].
Уменьшение размеров матки, а также снижение частоты наступления беременности, низкая масса плода и преждевременные роды — осложнения, регистрируемые после химиотерапии и лучевой терапии [10].
По оценкам, более 100 млн женщин во всем мире подвержены риску нарушений функции яичников, связанных с лечением рака [11]. Примерно 51,7% выздоровевших людей сообщили о том, что желали бы реализовать репродуктивную функцию после завершения лечения [12]. Эти обстоятельства лежат в основе рекомендации: как можно раньше, до начала противоопухолевого лечения, направлять онкологических больных при наличии показаний на консультацию к врачу-репродуктологу [13–15].
В то же время практические вопросы организации помощи по направлению онкофертильности недостаточно разработаны. Международные опросы показывают недостаточную осведомленность больных о программах по сохранению фертильности и лечению бесплодия [12, 16]. Также существуют проблемы междисциплинарного взаимодействия врачей различных специальностей: онкологов, акушеров-гинекологов, репродуктологов, связанные с различием подходов. Для разработки механизма взаимодействия по сохранению фертильности целесообразно создать междисциплинарный проект, который позволит взаимодействовать друг с другом специалистам из разных областей медицины [17].
Цель исследования: изучение возможности сохранения репродуктивной функции у онкологических и онкогематологических больных до проведения противоопухолевого лечения в рамках междисциплинарного проекта.
Содержание статьи
Материал и методы
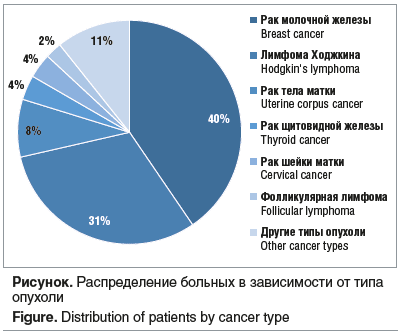
В исследование включено 84 пациентки репродуктивного возраста c морфологически верифицированными онкологическими и онкогематологическими заболеваниями: раком молочной железы (41%), лимфопролиферативными заболеваниями (41%), онкогинекологическими заболеваниями (14%) и раком щитовидной железы (4%). Пациентки проходили обследование, лечение и находились под наблюдением на базе ГБУЗ «ГКБ им. С.С. Юдина ДЗМ». Во всех случаях, в соответствии с нормативными требованиями [18], был проведен онкологический консилиум с определением тактики ведения с учетом стадии заболевания и морфологического типа опухоли. На онкологических консилиумах со всеми пациентками обсуждался риск снижения репродуктивной функции и развития бесплодия в результате химио- или лучевой терапии. С целью дообследования и определения гормонального статуса и репродуктивного потенциала для решения вопроса о возможности сохранения фертильности во всех случаях была предложена консультация врача акушера-гинеколога.
Критериями направления больных на консультацию врача акушера-гинеколога явились: установленный диагноз онкологического заболевания, необходимость проведения химио/химиолучевой терапии, возраст больных от 18–40 лет, благоприятный прогноз заболевания, ECOG 0–1 статус, нереализованная репродуктивная функция, желание сохранить фертильность. Кроме того, в рамках обследования мультидисциплинарной командой была рекомендована консультация специалиста по репродуктивному здоровью на базе ООО «Институт репродуктивной медицины» REMEDI с целью оценки овариального резерва и выбора метода сохранения фертильности. На основе коллегиального решения мультидисциплинарной команды было дано заключение о возможности сохранения репродуктивной функции.
Результаты исследования
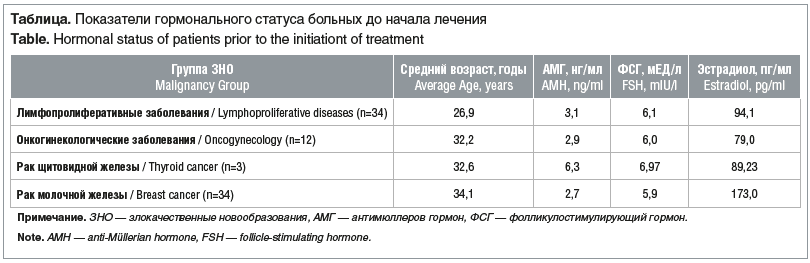
Проанализированы данные 84 пациенток с различными онкологическими и лимфопролиферативными заболеваниями (см. рисунок). Средний возраст больных, включенных в исследование, составил 31 год. Во всех случаях была проведена оценка гормонального статуса (см. таблицу). Со всеми пациентками были обсуждены различные варианты сохранения фертильности. У 55 (65,4%) пациенток удалось осуществить забор биологического материала. У остальных 29 (34,5%) пациенток по причине отказа и медицинским противопоказаниям не был реализован забор материала. Наиболее используемым и эффективным способом забора материала явилась трансвагинальная пункция фолликулов после контролируемой овариальной стимуляции (КОС) — 46 (83,6%) случаев, в 9 (16,3%) случаях была выполнена лапароскопия, резекция яичника / овариоэктомия. При проведении КОС использовали гонадотропины, фоллитропин α или фоллитропин β, в ежедневной дозировке150–225 МЕ подкожно; также в качестве триггера финального созревания ооцитов использовали агонисты гонадотропин-рилизинг-гормона (ГнРГ). КОС проводили по протоколу с антагонистами ГнРГ, старт стимуляции — в день обращения пациентки, независимо от дня цикла. У больных раком молочной железы совместно с гонадотропинами использовали ингибитор ароматазы. Данная комбинация, согласно данным литературы, обеспечивают высокий уровень безопасности КОС. Через 35–36 ч после введения триггера финального созревания ооцитов проводили трансвагинальную пункцию фолликулов с целью получения ооцитов, через 37–38 ч эмбриологи проводили витрификацию зрелых ооцитов (на стадии MII).
При планируемой витрификации эмбрионов выполняли оплодотворение ооцитов сперматозоидами супруга, культивирование эмбрионов до 5–6 сут развития по стандартному протоколу, принятому в ООО «Институт репродуктивной медицины».
При невозможности проведения КОС в связи с особенностью вида и течения онкологического заболевания, при наличии у пациентки желания проводили криоконсервацию овариальной ткани. Для повышения эффективности данного вида сохранения фертильности предпринимали попытки выделения ооцит-кумулюсных комплексов, дозревание ооцитов, витрификацию зрелых ооцитов или оплодотворение зрелых ооцитов сперматозоидами супруга с целью витрификации эмбрионов. Забор яичниковой ткани реализовали лапароскопическим доступом с использованием стандартного эндоскопического оборудования. Часть материала направляли на гистологическое и иммуногистохимическое исследование для исключения забора и криоконсервации опухолевых клеток. Далее яичник транспортировали в контейнере с забуференной средой при температуре 37 °С до 1 ч в эмбриологическую лабораторию клиники репродуктивной медицины для выделения незрелых ооцитов и криоконсервации ткани яичника.
Проводилась витрификация зрелых ооцитов или оплодотворение зрелых ооцитов сперматозоидами супруга с целью витрификации эмбрионов по стандартному протоколу, принятому в ООО «Институт репродуктивной медицины» [19].
В целом в целях сохранения фертильности в 64% случаев была проведена криоконсервация ооцитов, в 10% — криоконсервация эмбрионов, в 17% — криоконсервация овариальной ткани, в 9% — криоконсервация ооцитов и эмбрионов.
Осложнений после применения программ ВРТ отмечено не было.
После реализации программ по сохранению репродуктивной функции все пациентки приступили к противоопухолевому лечению согласно плану, прописанному в онкологическом консилиуме.
Каждые 3 мес. оценивали онкологический и гинекологический статус пациенток. Согласно контрольным исследованиям, проводимым врачами-гинекологами, на фоне гонадотоксической терапии у больных отмечались признаки климактерического синдрома, а также резкое снижение уровня АМГ, отсутствие фолликулов по данным УЗИ.
К настоящему времени более 60% (n=53) больных продолжают лечение согласно плану, прописанному в консилиуме (II клиническая группа). Более 30% (n=28) женщин завершили лечение и находятся под наблюдением (III клиническая группа). Прогрессирование основного заболевания было выявлено у 2 больных гинекологического профиля через 1 год после завершения лечения. Одна пациентка гематологического профиля умерла вследствие прогрессирования основного заболевания.
Обсуждение
Согласно международным рекомендациям консультирование пациенток по вопросам сохранения репродуктивной функции должно быть неотъемлемым этапом при формировании плана противоопухолевого лечения и стандартной процедурой. Однако на пути соблюдения стандартов специалисты сталкиваются с рядом барьеров. Во-первых, многие пациентки не осведомлены о рисках развития бесплодия в процессе лечения, что не дает им возможность инициировать обсуждение о планировании семьи после завершения лечения. Кроме того, как показано в проведенном исследовании и во многих других, пациентки могут быть сосредоточены только на лечении основного заболевания в силу боязни отсрочки лечения, неблагоприятных исходов и побочных эффектов КОС, что влечет за собой отказ от предложенных методов сохранения фертильности [20, 21]. Во-вторых, несмотря на существующие стандарты, нарушена коммуникация между врачами-онкологами и репродуктологами, в том числе и по причине отсутствия специалиста по репродуктивному здоровью в онкологических клиниках. В-третьих, отсутствие страхового покрытия не дает возможность включить методы сохранения фертильности в план ведения пациентки[1]. Большинство технологий по сохранению фертильности осуществляется в частных центрах, что связано с необходимостью финансовых вложений [17, 20]. В связи с этим нашей командой положено начало формирования региональной сети по сохранению фертильности у онкологических больных в рамках научно-практической работы с созданием единого регистра больных.
Заключение
Сформированная нами мультидисциплинарная команда позволила обеспечить онкологических больных необходимой медицинской помощью, обеспечивающей сохранение фертильности без снижения эффективности терапии основного заболевания. Основой взаимодействия стала четкая маршрутизация пациентов в соответствии с приоритетом противоопухолевого лечения, а также поэтапное участие специалистов репродуктологов и акушеров-гинекологов. Благодаря мультидисциплинарному подходу пациентки получали исчерпывающую информацию о рисках развития бесплодия после специального лечения и методах сохранения репродуктивной функции. Также удалось реализовать персонализированный подход: каждой пациентке был предложен оптимальный в конкретной клинической ситуации метод сохранения фертильности.
Полученные в ходе исследования данные показали, что у пациенток с различными онкологическими заболеваниями имеет место снижение овариального резерва после завершения специального лечения. Это еще раз подтверждает важность оценки гормонального статуса и необходимость проведения консультации врача-репродуктолога еще до начала противоопухолевого лечения у всех пациенток с онкологическими и гематологическими заболеваниями.
Сведения об авторах:
Кишкина Анастасия Юрьевна — к.м.н., заведующая отделением диагностики и лечения опухолей молочной железы и репродуктивной системы № 3 ГБУЗ «ГКБ им. С.С. Юдина ДЗМ»; 115446, Россия, г. Москва, Коломенский пр-д, д. 4; ORCID iD 0000-0003-2560-0996
Шевченко Николай Алексеевич — к.м.н., доцент кафедры акушерства и гинекологии лечебного факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117513, Россия, г. Москва, ул. Островитянова, д. 1; заведующий гинекологическим отделением ГБУЗ «МКНИЦ Больница № 52 ДЗМ»; 123182, Россия, г. Москва, ул. Пехотная, д. 3; ORCID iD 0000-0002-1216-5721
Младова Елена Сергеевна — врач акушер-гинеколог, репродуктолог, главный врач ООО «Институт репродуктивной медицины»; 123100, Россия, г. Москва, Шмитовский пр-д, д. 3, стр. 1; ORCID iD 0000-0002-6103-3100
Поликарпова Ольга Валентиновна — врач акушер-гинеколог гинекологического отделения ГБУЗ «МКНИЦ Больница № 52 ДЗМ»; 123182, Россия, г. Москва, ул. Пехотная, д. 3; ORCID iD 0000-0001-9060-3005
Гращенко Ирина Михайловна — врач акушер-гинеколог гинекологического отделения, ГБУЗ «МКНИЦ Больница № 52 ДЗМ»; 123182, Россия, г. Москва, ул. Пехотная, д. 3; ORCID iD 0009-0002-5595-148X
Диденко Вера Владимировна — врач-онколог, заведующая отделением диагностики и лечения опухолей молочной железы и репродуктивной системы № 2 ГБУЗ «ГКБ им. С.С. Юдина ДЗМ»; 115446, Россия, г. Москва, Коломенский пр-д, д. 4; ORCID iD 0000-0001-9068-1273
Бричкалевич Юлия Константиновна — врач акушер-гинеколог, репродуктолог ООО «Институт репродуктивной медицины»; 123100, Россия, г. Москва, Шмитовский пр-д, д. 3, стр. 1; ORCID iD 0009-0009-9798-9743
Поварова Анна Андреевна — врач акушер-гинеколог, репродуктолог ООО «Институт репродуктивной медицины»; 123100, Россия, г. Москва, Шмитовский пр-д, д. 3, стр. 1; ORCID iD 0000-0002-2117-155
Барях Елена Александровна — д.м.н., заведующая отделением гематологии и химиотерапии ГБУЗ «МКНИЦ Больница № 52 ДЗМ»; 123182, Россия, г. Москва, ул. Пехотная, д. 3; ORCID iD 0000-0001-6880-9269
Иванова Диана Давидовна — врач-гематолог отделения гематологии и химиотерапии ГБУЗ «МКНИЦ Больница № 52 ДЗМ»; 123182, Россия, г. Москва, ул. Пехотная, д. 3; ORCID iD 0009-0004-3632-9198
Партс Сергей Адольфович — к.м.н., заместитель главного врача по онкологии ГБУЗ «ГКБ им. С.С. Юдина ДЗМ»; 115446, Россия, г. Москва, Коломенский пр-д, д. 4; доцент кафедры онкологии и пластической хирургии Академии постдипломного образования ФГБУ ФНКЦ ФМБА России; 125371, Россия, г. Москва, Волоколамское ш., д. 91; ORCID iD 0009-0003-9954-4584
Галкин Всеволод Николаевич — д.м.н., профессор, главный врач ГБУЗ «ГКБ им. С.С. Юдина ДЗМ»; 115446, Россия, г. Москва, Коломенский пр-д, д. 4; ORCID iD 0000-0002-6619-6179
Лысенко Марьяна Анатольевна — д.м.н., директор ГБУЗ «МКНИЦ Больница № 52 ДЗМ»; 123182, Россия, г. Москва, ул. Пехотная, д. 3; профессор кафедры общей терапии факультета дополнительного профессионального образования ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117513, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0001-6010-7975
Доброхотова Юлия Эдуардовна — д.м.н., профессор, заведующая кафедрой акушерства и гинекологии Института хирургии ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России (Пироговский Университет); 117513, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-7830-2290
Грабовский Василий Михайлович — заместитель главного врача по акушерско-гинекологической помощи ГБУЗ «МКНИЦ Больница № 52 ДЗМ»; 123182, Россия, г. Москва, ул. Пехотная, д. 3; ORCID iD 0000-0002-7512-2470
Контактная информация: Кишкина Анастасия Юрьевна, e-mail: dr.kishkina@mail.ru
Источник финансирования: исследование и публикация выполнены при поддержке АНО «Московский центр инновационных технологий в здравоохранении» (грант № 1603-45/23 «Исследование возможности сохранения репродуктивной и менструальной функции у онкологических, в частности онкогематологических, пациенток с использованием методов криоконсервации ооцитов, эмбрионов и овариальной ткани с последующей аутотрансплантацией»).
Конфликт интересов отсутствует.
Статья поступила 18.06.2025.
Поступила после рецензирования 08.07.2025.
Принята в печать 29.07.2025.
About the authors:
Anastasia Yu. Kishkina — C. Sc. (Med.), Head of the Department of Diagnosis and Treatment of Breast and Reproductive System Tumors No. 3, S.S. Yudin City Clinical Hospital; 4, Kolomenskiy Ave., Moscow, 115446, Russian Federation; ORCID iD 0000-0003-2560-0996
Nikolay A. Shevchenko — C. Sc. (Med.), Associate Professor of the Department of Obstetrics and Gynecology of the Institute of Surgery, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117513, Russian Federation; Head of the Department of Obstetrics; City Clinical Hospital No. 52; 3, Pekhotnaya str., Moscow, 123182, Russian Federation; ORCID iD 0000-0002-1216-5721
Elena S. Mladova — obstetrician-gynecologist, reproductologist, Chief Medical Officer of the Institute of Reproductive Medicine LLC; 3 build. 1, Shmitovsky Lane, Moscow, 123100, Russian Federation; ORCID iD 0000-0002-6103-3100
Olga V. Polikarpova — obstetrician-gynecologist of the Department of Obstetrics, City Clinical Hospital No. 52; 3, Pekhotnaya str., Moscow, 123182, Russian Federation; ORCID iD 0000-0001-9060-3005
Irina M. Grashchenko — obstetrician-gynecologist of the Department of Obstetrics, City Clinical Hospital No. 52; 3, Pekhotnaya str., Moscow, 123182, Russian Federation; ORCID iD 0009-0002-5595-148X
Vera V. Didenko — oncologist, Head of the Department of Diagnosis and Treatment of Breast and Reproductive System Tumors No. 3, S.S. Yudin City Clinical Hospital; 4, Kolomenskiy Ave., Moscow, 115446, Russian Federation; ORCID iD 0000-0001-9068-1273
Yulia K. Brichkalevich — obstetrician-gynecologist, reproductologist, Institute of Reproductive Medicine LLC; 3 build. 1, Shmitovsky Lane, Moscow, 123100, Russian Federation; ORCID iD 0009-0009-9798-9743
Anna A. Povarova — obstetrician-gynecologist, reproductologist, Institute of Reproductive Medicine LLC; 3 build. 1, Shmitovsky Lane, Moscow, 123100, Russian Federation; ORCID iD 0000-0002-2117-155
Elena A. Baryakh — Dr. Sc. (Med.), Head of the Department of Hematology and Chemotherapy, City Clinical Hospital No. 52; 3, Pekhotnaya str., Moscow, 123182, Russian Federation; ORCID iD 0000-0001-6880-9269
Diana D. Ivanova — hematologist of the Department of Hematology and Chemotherapy, City Clinical Hospital No. 52; 3, Pekhotnaya str., Moscow, 123182, Russian Federation; ORCID iD 0009-0004-3632-9198
Sergey A. Parts — C. Sc. (Med.), Deputy Chief Medical Officer for Oncology, S.S. Yudin City Clinical Hospital; 4, Kolomenskiy Ave., Moscow, 115446, Russian Federation; Associate Professor of the Department of Oncology and Plastic Surgery, Academy of Postgraduate Education of the Federal Scientific and Clinical Center of the Federal Medical Biological Agency of Russian Federation; 91, Volokolamskoe road, Moscow, 125371, Russian Federation; ORCID iD 0009-0003-9954-4584
Vsevolod N. Galkin — Dr. Sc. (Med.), Professor, Chief Medical Officer of the S.S. Yudin City Clinical Hospital; 4, Kolomenskiy Ave., Moscow, 115446, Russian Federation; ORCID iD 0000-0002-6619-6179
Mariana A. Lysenko — Dr. Sc. (Med.), Chief Medical Officer of the City Clinical Hospital No. 52; 3, Pekhotnaya str., Moscow, 123182, Russian Federation; Professor of the Department of General Therapy of the Faculty of Continuous Professional Education, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117513, Russian Federation; ORCID iD 0000-0001-6010-7975
Yulia E. Dobrokhotova — Dr. Sc. (Med.), Professor, Head of the Department of Obstetrics and Gynecology of the Institute of Surgery, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117513, Russian Federation; ORCID iD 0000-0002-7830-2290
Vasily M. Grabovsky — Deputy Chief Medical Officer of Obstetric and Gynecological Care, City Clinical Hospital No. 52; 3, Pekhotnaya str., Moscow, 123182, Russian Federation; ORCID iD 0000-0002-7512-2470
Contact information: Anastasia Yu. Kishkina, e-mail: dr.kishkina@mail.ru
Financial Disclosure: the research and publication were carried out with the support of the ANO «Moscow Center for Innovative Technologies in Healthcare» (grant No. 1603-45/23 «Study on the possibility of preserving reproductive and menstrual function in oncological, in particular oncohematological, patients using cryopreservation of oocytes, embryos and ovarian tissue with subsequent autotransplantation»).
There is no conflict of interest.
Received 18.06.2025.
Revised 08.07.2025.
Accepted 29.07.2025.
[1] Федеральный закон от 21 ноября 2011 г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации» (Собрание законодательства Российской Федерации, 2011, № 48, ст. 6724). (Электронный ресурс.) URL: https://minzdrav.gov.ru/documents/7025 (дата обращения: 20.05.2025).
Информация с rmj.ru



