Введение
Бронхиальная астма (БА) является гетерогенным заболеванием, характеризующимся хроническим воспалением дыхательных путей, наличием респираторных симптомов, таких как приступы затруднения дыхания, удушья, свистящие хрипы, одышка, заложенность в груди и кашель, которые варьируют по времени и интенсивности и проявляются вместе с вариабельной обструкцией дыхательных путей1. Гетерогенность БА проявляется различными фенотипами заболевания, многие из которых возможно выделить в обычной клинической практике. Согласно исследованию НИКА-2 одним из наиболее распространенных фенотипов в России является эозинофильная БА с поздним дебютом [1]. Термин «астма с поздним дебютом» обозначает состояние, при котором симптомы, схожие с БА, впервые проявляются у человека старше 40 лет. Важно отметить, что строгих возрастных критериев для определения позднего дебюта не существует: некоторые исследования рассматривают границы от 12 до 65 лет [2]. Однако в большинстве случаев акцент делается на пациентах, у которых симптомы заболевания впервые появились после 40 лет [3].
Содержание статьи
- 1 Эпидемиология и этиология БА с поздним дебютом
- 2 Фенотипы БА
- 3 Патофизиология БА с поздним дебютом
- 4 Структурные изменения легких
- 5 Диагностика БА с поздним началом
- 6 Различия БА с поздним началом и ХОБЛ
- 7 Сопутствующие заболевания у пациентов с БА с поздним началом
- 8 Ожирение
- 9 Гастроэзофагеальная рефлюксная болезнь
- 10 Заболевания ЛОР-органов
- 11 Особенности лечения БА с поздним дебютом
- 12 Заключение
Эпидемиология и этиология БА с поздним дебютом
Являясь одним из самых распространенных хронических заболеваний в мире, БА затрагивает около 300 млн человек [4]. Около 30–40% взрослых пациентов с БА испытывают первые симптомы после 40 лет. Кроме того, до 52% пациентов с БА имеют первый астматический приступ после достижения 40 лет [5]. По оценкам, только один из 4 человек с детской астмой продолжает страдать БА во взрослом возрасте, тогда как у одного из каждых 10, не имеющих детской БА, она развивается впервые во взрослом возрасте [6].
Мужчинам с длительным стажем курения, у которых развиваются симптомы кашля, свиста и одышки, с большей вероятностью диагностируют хроническую обструктивную болезнь легких (ХОБЛ), в то время как женщинам с аналогичной историей чаще выставляют диагноз БА [7]. Тем не менее даже среди популяции некурящих, где такая гендерная предвзятость может ожидаться в меньшей степени, некоторые исследования показывают, что БА с поздним дебютом является более распространенным диагнозом среди взрослых женщин. Возможные объяснения гендерных различий в частоте возникновении БА с поздним дебютом могут включать эндогенные и экзогенные гормональные факторы [8].
Кроме того, среди некоторых пациентов с БА с поздним дебютом в качестве основных проблем начинают признаваться пожилой возраст, коморбидность, полипрагмазия и нарушения техники использования ингалятора, малоподвижный и одинокий образ жизни, а также психологический статус (депрессия, деменция и т. д.) [9]. По крайней мере около 9–15% случаев БА с поздним дебютом могут быть связаны с профессиональным воздействием и стрессом, связанным с работой. Тревога и депрессия также являются факторами, способствующими развитию поздней БА [10]. Кроме того, сообщается, что облитерирующий бронхиолит после трансплантации органов, трансплантации стволовых/прогениторных гемопоэтических стволовых клеток и иммунная дисрегуляция могут способствовать патогенезу БА с поздним дебютом [11].
Фенотипы БА
В зависимости от возраста начала заболевания, типа воспаления дыхательных путей (эозинофильное, неэозинофильное), наличия атопии, степени ограничения воздушного потока выделяют различные фенотипы, которые предполагают существование нескольких патобиологически обусловленных кластеров заболевания [12]. Основные идентифицированные фенотипы (рис. 1):
![Рис. 1. Фенотипы БА в зависимости от возраста начала заболевания, эндотипа, наличия аллергии и степени ограничения скорости воздушного потока [12] Fig. 1. Phenotypes of asthma depending on the age of the disease onset, endotype, presence of allergy, and d Рис. 1. Фенотипы БА в зависимости от возраста начала заболевания, эндотипа, наличия аллергии и степени ограничения скорости воздушного потока [12] Fig. 1. Phenotypes of asthma depending on the age of the disease onset, endotype, presence of allergy, and d](https://medblog.su/wp-content/uploads/2025/10/Bronhialnaya-astma-s-pozdnim-debyutom-Gajnitdinova-VV-Bogatyreva-TU.png)
-
легкая БА с ранним началом, связанная с аллергией;
-
БА средней и тяжелой степени, связанная с аллергией и возникающая в раннем возрасте, с изменениями в строении бронхов;
-
неаллергическая эозинофильная БА, возникающая в позднем возрасте;
-
неаллергическая неэозинофильная БА с поздним дебютом.
Кластерный анализ одного из крупных многоцентровых исследований (программа исследования тяжелой астмы (Severe Asthma Research Program, SARP)), проведенного в США, позволил выявить 5 фенотипов: (1) легкая ранняя аллергическая БА, (2) средняя ранняя аллергическая БА, (3) поздняя эозинофильная неаллергическая БА, (4) тяжелая ранняя эозинофильная аллергическая БА и (5) поздно возникшая неаллергическая нейтрофильная тяжелая БА с фиксированной обструкцией [13].
В данном исследовании оценивался анализ мокроты, который показал высокое содержание эозинофилов при кластерах 3, 4 и 5, при этом кластер 3 характеризовался наибольшим процентом эозинофилов, а кластер 5 — смешанной популяцией с высоким содержанием эозинофилов и нейтрофилов, что свидетельствует о смешанной воспалительной реакции. Для кластеров 1 и 2 характерно наличие менее 1% эозинофилов.
Эти результаты предполагают, что пациенты с тяжелой БА делятся на 3 клинически различимые группы: (1) пациенты с ранним аллергическим началом, (2) пациенты с поздним неаллергическим преобладанием эозинофилов, (3) пациенты с преобладанием нейтрофилов в мокроте. Кластеры 1, 2 и 4 входят в спектр заболеваний, вызванных аллергическим воспалением, в то время как кластеры 3 и 5, похоже, обусловлены биологическими процессами, не связанными с аллергией, и наиболее явно проявляются у взрослых [13].
В исследовании J.L. Simpson et al. [14] была проведена оценка воспалительных клеток в мокроте для фенотипирования и разделения пациентов на группы. Были идентифицированы 4 кластера БА: (1) эозинофильный (порог эозинофилов в мокроте >1,01%), (2) нейтрофильный (порог нейтрофилов в мокроте >61%), (3) смешанный гранулоцитарный (высокие уровни эозинофилов и нейтрофилов) и (4) малогранулоцитарный (низкие уровни эозинофилов и нейтрофилов). Четыре подтипа были клинически схожи, за исключением того, что пациенты с преобладанием нейтрофилов имели значительно более поздний возраст начала БА. Интересно, что эта подгруппа также была идентифицирована в исследовании SARP, что подтверждает существование неэозинофильной неаллергической подгруппы пациентов с более поздним возрастом начала БА.
Патофизиология БА с поздним дебютом
Увеличение уровня фракционного выдыхаемого оксида азота (FENO), который служит неинвазивным индикатором воспаления дыхательных путей, наблюдается по мере увеличения возраста. Это повышение может свидетельствовать об изменении распределения воспалительных клеток или их активности в дыхательных путях. Такие изменения могут объяснять различия в клинических фенотипах БА между молодыми и пожилыми пациентами с поздним дебютом заболевания [15].
Возрастные изменения функции иммунной системы оказывают влияние на воспаление дыхательных путей при астме с поздним дебютом. Эти изменения наблюдаются в клетках как врожденного, так и адаптивного иммунитета. T2-астма с поздним дебютом часто связана с активацией врожденных лимфоидных клеток 2-го типа (ILC2), которые играют ключевую роль врожденного иммунного ответа, усиливающего аллергическое воспаление [16, 17].
В частности, ILC2 тесно связаны с появлением новых полипов в носу у пациентов с хроническим синуситом [18]. Эти клетки могут активироваться под воздействием интерлейкина (ИЛ) 25, ИЛ-33 и тимусного стромального лимфопоэтина (Thymic Stromal Lymphopoietin, TSLP), выделяемых бронхиальными эпителиальными клетками при воздействии загрязняющих веществ, бактерий и вирусов [18]. Исследования показывают, что ILC2 оказывают более значительное влияние на астму позднего начала по сравнению с астмой раннего возраста [19].
Возрастные изменения иммунной системы, известные как иммуносенесценция, также играют важную роль в развитии аллергической астмы. Этот процесс усугубляется окислительным стрессом и ускоренным укорочением теломер из-за повреждения ДНК. Сосуществование иммуносенесценции и вирусных инфекций способствует хроническому воспалению, которое связано со снижением функции В-клеток [20, 21]. В результате этого процесса сохраняемость антигена увеличивается, особенно у пожилых людей, а возрастное воспаление легких усиливается через цитокины или Toll-подобные рецепторы даже без инфекции [22]. Кроме того, аутоиммунные реакции могут повышать аффинность Т-клеток к собственным антигенам или латентным вирусам, способствуя развитию аутоиммунных процессов [23]. С возрастом наблюдается снижение количества наивных Т-лимфоцитов как в тимусе, так и на периферии из-за атрофии тимуса и потери функции костного мозга [24]. Напротив, количество Т-лимфоцитов памяти с возрастом увеличивается [25, 26]. Эти изменения снижают эффективность активации Т-клеток [25].
Однако при увеличении уровня аутоантител у пожилых людей из-за повышенного повреждения тканей и апоптоза Т-регуляторные клетки (Tregs) становятся более активными [27]. В результате снижается активность CD4+ и CD8+ Т-клеток, что увеличивает восприимчивость к инфекциям. Рецидивирующие инфекции стимулируют выработку провоспалительных цитокинов, что приводит к активации Tregs и усилению продукции Т-хелперов (Th) 17, что в свою очередь способствует хроническому воспалению.
С возрастом общий уровень IgE в сыворотке крови обычно снижается из-за нарушенной продукции антител В-клетками и их специфичности [28]. Однако исследования показывают, что уровень сенсибилизации к аллергенам у пожилых пациентов с астмой выше по сравнению с контрольной группой того же возраста [29]. Различия в активации В-клеток, приведшие к возникновению данного состояния, могут играть значительную роль в развитии аутоиммунных процессов [30]. Генетическая вариация, например, на хромосоме 17q21 или хемокине C-C, и нормальные Т-клетки, экспрессируемые и секретируемые, могут играть роль в развитии астмы с поздним дебютом [31]. Сообщается, что около 38% пациентов страдают БА малогранулоцитарного типа. Предполагается, что этот механизм обусловлен нарушением или дисфункцией структурных клеток (гладкомышечных клеток и нервных клеток дыхательных путей) [30].
Замечено, что у взрослых женщин БА с поздним дебютом развивается чаще, чем у мужчин в таком же возрасте. Это позволяет предположить, что половые гормоны играют не последнюю роль в патогенезе БА с поздним началом [23]. Многие клетки (эозинофилы, тучные клетки и Т-клетки) и ткани имеют на своей поверхности рецепторы эстрогена и тестостерона. Считается, что эстрогены стимулируют иммунные реакции, в то время как тестостерон, наоборот, подавляет их. Было отмечено, что прием контрацептивов может улучшить контроль астмы, а применение заместительной гормональной терапии в менопаузе, наоборот, ухудшает течение астмы. Можно предположить, что данная терапия усиливает Т2-воспаление [32]. Безусловно, необходимы дальнейшие исследования, чтобы четко понимать роль гормонов в развитии астмы с поздним началом.
Структурные изменения легких
В исследовании R.J. Hopp et al. [33], включавшем 148 участников в возрасте от 5 до 76 лет, было установлено, что возраст имеет независимую связь с бронхиальной гиперреактивностью, измеренной с помощью метахолинового теста. В этом же исследовании показано, что БА с поздним дебютом характеризуется более высоким ежегодным снижением ОФВ1, особенно среди пожилых людей, или курильщиков со стажем курения более 10 лет [33]. В другом исследовании была выявлена связь между бронхиальной гиперреактивностью, гистаминовым тестом и увеличением количества эозинофилов, а также аллергической сенсибилизацией [34]. Однако более старший возраст сохранял независимую связь с бронхиальной гиперреактивностью, которая была более выраженной у лиц с респираторными симптомами [34].
Кроме возраста, значительное влияние на бронхиальную гиперреактивность оказывают курение и исходный ОФВ1 [35, 36]. В дополнение к этим факторам дыхание с возрастом становится более затрудненным из-за воздушных ловушек и снижения податливости грудной стенки [37].
Диагностика БА с поздним началом
Известно, что БА диагностируется на основе симптомов и объективной оценки обратимой обструкции воздушного потока, независимо от возраста пациента. Однако диагностика БА с поздним дебютом остается сложной задачей, так как до половины пациентов, особенно старше 65 лет, с астмой не имеют установленного диагноза [38, 39].
Одной из ключевых проблем, связанных с БА с поздним началом, является неправильное распознавание заболевания. В связи с этим возникает вопрос о применимости традиционного диагностического алгоритма для лиц с поздним началом симптомов БА. Вероятно, что точность диагностики БА у таких пациентов могла бы повыситься при более широком использовании объективных и инструментальных методов оценки, включая спирометрию [40].
Неправильная диагностика БА возможна в случаях, когда у пожилых пациентов с впервые возникшими одышкой и хрипами не проводится адекватная дифференциальная диагностика альтернативных причин симптомов. Опыт центра по лечению кардиомиопатий выявил потенциальную возможность гипердиагностики БА: около 20% пациентов с кардиомиопатией ошибочно начинали принимать ингаляционные β-агонисты в течение 5 лет до постановки диагноза заболевания сердца [41].
Стеноз трахеи или его компрессия (например, вследствие предыдущей интубации или увеличенной щитовидной железы) могут приводить к обструкции верхних дыхательных путей и проявляться локальными хрипами, что является важным аспектом дифференциальной диагностики. Аспирация может вызывать кашель и хрипы, факторами риска являются снижение уровня сознания и неврологические нарушения, затрудняющие глотание. Другие заболевания, имитирующие БА по клинической картине, включают бронхогенную карциному или другие опухоли дыхательных путей, медикаментозные причины (например, кашель при приеме ингибиторов ангиотензинпревращающего фермента (иАПФ)), гастроэзофагеальную рефлюксную болезнь (ГЭРБ) и тромбоэмболию легочной артерии (ТЭЛА). С учетом риска ошибочной диагностики особое значение приобретает тщательный сбор анамнеза и физикальное обследование. В анамнезе необходимо выявлять признаки или сведения, указывающие на альтернативные причины симптомов. Таким образом, перечень заболеваний или клинических состояний, которые необходимо дифференцировать с БА у взрослых пациентов, включает [42]:
-
заболевания органов дыхания: эмфизема, облитерирующий бронхиолит, бронхоэктатическая болезнь, саркоидоз;
-
сердечно-сосудистые заболевания: декомпенсация хронической сердечной недостаточности, ТЭЛА;
-
злокачественные новообразования: рак легких, лимфома, аденома бронха;
-
другие причины: аспирация, синдром дисфункции голосовых связок, стеноз трахеи, герпетический трахеобронхит, хронический кашель (обусловленный ГЭРБ, постназальным затеком или приемом иАПФ).
Структурные изменения в стареющих легких могут приводить к постоянному ограничению воздушного потока, что усложняет интерпретацию спирометрических кривых у возрастных пациентов, особенно в пограничных случаях. Эти изменения также могут объяснять потерю обратимости, что делает бронходилатационный тест на обратимость менее полезным для диагностики БА с поздним началом [43].
Фракция выдыхаемого оксида азота служит маркером эозинофильного воспаления дыхательных путей. Измерения FENO могут быть полезны для диагностики БА с поздним началом [44]. Однако рутинное использование этого показателя может не иметь клинической ценности у пациентов с БА с поздним началом, поскольку некоторые из них могут демонстрировать нейтрофильное воспаление дыхательных путей в результате курения или ожирения [45–47].
В качестве альтернативы, возможно, лучше использовать имидж-диагностику грудной клетки. В исследованиях показано, что с помощью биомаркеров визуализации грудной клетки БА с поздним дебютом можно идентифицировать как фенотип, основанный на визуализации [48]. Было высказано предположение, что характерными КТ-признаками БА с поздним дебютом являются сужение просвета дыхательных путей, уменьшение объема легких и гиперинфляция. Биомаркеры T2-воспаления (эозинофилы крови, FENO и периостин) широко используются для дифференциальной диагностики T2- и не-T2-астмы с поздним дебютом [49].
Различия БА с поздним началом и ХОБЛ
К сожалению, анамнез курения не позволяет однозначно дифференцировать БА и ХОБЛ, поскольку значительная часть пациентов с БА являются как текущими, так и бывшими курильщиками [50, 51].
Разграничение между БА и ХОБЛ не должно основываться на результатах бронхолитического теста. У некоторых пациентов с БА, особенно с поздним началом заболевания, возможно отсутствие обратимого ограничения воздушного потока, что может быть связано с возрастными структурными изменениями. В то же время у некоторых пациентов с ХОБЛ, несмотря на фиксированное ограничение воздушного потока, наблюдается определенная степень обратимости [52, 53].
Оценка атопии также вряд ли будет полезной для различения этих двух заболеваний, особенно учитывая, что отсутствие атопии явно не исключает диагноз БА [54].
Клиническое значение этих соображений заключается в том, что пожилой пациент с характерными признаками БА должен классифицироваться как больной БА, независимо от наличия необратимой обструкции воздушного потока.
Сопутствующие заболевания у пациентов с БА с поздним началом
Пациент с БА, проявляющейся в позднем возрасте, характеризуется наличием сопутствующих заболеваний, количество которых, как правило, возрастает с годами. Исследования показывают, что более 50% людей старше 65 лет страдают как минимум от трех различных заболеваний [55].
У пациентов с БА, проявляющейся в позднем возрасте, необходимо уделять внимание лечению сопутствующих состояний, таких как ринит, ГЭРБ, ишемическая болезнь сердца, аритмии, сахарный диабет (СД), ожирение и остеопороз, следуя установленным рекомендациям. Избыточное количество назначаемых медикаментов может затруднять приверженность лечению и увеличить риск нежелательных лекарственных взаимодействий. Роль сопутствующих заболеваний БА в патофизиологии БА с поздним дебютом схематически представлена на рисунке 2.
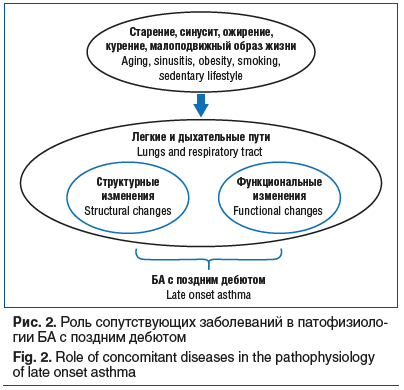
Ожирение
Ожирение является важным фактором, отягощающим течение БА с поздним началом. Ожирение характеризуется хроническим воспалением, окислительным стрессом и повышением активности врожденного иммунитета [56]. При ожирении происходит патологическое ремоделирование бронхиального дерева — нарушение адипогенеза способствует гипертрофии адипоцитов, которые в свою очередь вырабатывают провоспалительные цитокины, такие как фактор некроза опухоли α (ФНО-α), ИЛ-6, ИЛ-8, моноцитарный хемоаттрактантный протеин 1 (monocyte chemoattractant protein 1, МСР-1) и др. [56]. Ожирение с СД 2 типа и без него связано с повышением экспрессии ИЛ-4 — гомолога лимфотоксина, который индуцирует экспрессию матриксной металлопротеиназы (ММП) 9 и хемокинового рецептора CC (CCR) 2 [57]. Кроме того, у пациентов с ожирением и астмой с поздним началом, по данным многих исследований, был выявлен низкий уровень L-аргинина и более высокие концентрации асимметричного диметиларгинина (Asymmetric dimethylarginine, ADMA). Данное явление может способствовать разобщению NO-синтетазы и приводить к образованию активных форм кислорода и развитию окислительного стресса [58]. Таким образом, при астме с поздним дебютом соотношение L-аргинина и ADMA в плазме крови может объяснить обратную зависимость между индексом массы тела (ИМТ) и FENO (снижение FENO при ожирении). Считается, что это происходит потому, что ADMA может быть эндогенным ингибитором изоформ NO-синтазы (NOS) [59]. На самом деле, эти более низкие соотношения L-аргинина/ADMA связаны со снижением функции легких и усилением респираторных симптомов и могут играть роль в патобиологии астмы с поздним дебютом [60].
Еще одним механизмом cнижения FENO при ожирении и астме является чрезмерный окислительный стресс при ожирении, который вступает в реакцию с FENO. Хотя подобные случаи имели место среди пациентов с ХОБЛ, чрезмерный нитрозативный стресс вследствие увеличения концентрации NO генерируется в периферических дыхательных путях [61]. То же самое можно сказать и о патофизиологии астмы с поздним дебютом. Было высказано предположение, что стойкое повышение выдыхаемого NO в дистальных дыхательных путях пациента с БА может быть терапевтической мишенью. Однако в реальных клинических условиях терапия ингаляционными глюкокортикостероидами (ИГКС) не может полностью подавить повышение остаточного нитрозативного стресса в дистальных отделах дыхательных путей. Предполагается, что нитрозативный стресс в дыхательных путях может быть связан с фактическими механизмами резистентности к стероидам при некоторых фенотипах БА с поздним дебютом [62]. Изменение диеты, а именно употребление пищи, бедной витамином D, может способствовать патогенезу БА при ожирении [63]. Кроме того, ожирение из-за сдавления грудной клетки мягкими тканями способствует уменьшению объема легких, что проявляется снижением резервного объема выдоха и функциональной остаточной емкости [64]. Ожирение часто сочетается с такими заболеваниями, как ГЭРБ, апноэ сна, что в свою очередь также ухудшает прогноз БА.
Гастроэзофагеальная рефлюксная болезнь
Наличие ГЭРБ у пациентов также оказывает существенное влияние на течение БА. У пациентов с БА легкой и средней степени тяжести распространенность ГЭРБ составляет 21%, а у пациентов с тяжелой БА — от 46 до 63% [65]. Прямая аспирация желудочного сока в дыхательные пути приводит к повреждению эпителия, выбросу цитокинов и хроническому воспалению, что обусловливает развитие гиперчувствительности дыхательных путей и обструкции. Пищевод и бронхиальное дерево иннервируются блуждающим нервом, поэтому если имеется дисбаланс рН на фоне рефлюкса, то это вызывает стимуляцию рецепторов в дистальном отделе пищевода, что приводит к бронхоспазму как вагусному рефлексу [66]. Сама по себе дыхательная обструкция при БА может вызывать отрицательное плевральное давление, которое повышает давление между грудной клеткой и брюшной полостью, тем самым способствуя рефлюксу [65].
Заболевания ЛОР-органов
Заболевания верхних дыхательных путей, такие как ринит, синусит и риносинусит, по данным некоторых исследований, в 95% случаев сопровождают БА [67]. По данным проведенного исследования, эозинофильная БА с ранним началом была ассоциирована с ринитом больше по сравнению с БА с поздним началом (75,3% против 53% соответственно). При этом сопутствующий ринит был у большего количества пациентов именно с неконтролируемой БА. В то время как при астме с поздним началом ринит, наоборот, обеспечивал лучший контроль БА, и уровень общего IgE в крови и распространенность аллергий были ниже у взрослых пациентов, чем у пациентов с эозинофильной БА.
Особенности лечения БА с поздним дебютом
Обычно медикаментозное и немедикаментозное лечение (например, обучение пациентов) назначаются в зависимости от фенотипа. Немедикаментозные методы лечения, такие как отказ от табакокурения и снижение массы тела, следует применять всегда, при любом фенотипе. Что касается фармакологических методов лечения, то ИГКС необходимы для лечения T2-астмы с поздним дебютом [68].
Если же ИГКС действительно неэффективны, следует рассматривать возможность применения генно-инженерной биологической терапии. В сравнении с плацебо реслизумаб — моноклональное антитело против ИЛ-5 — вызывает более значительное снижение частоты обострений астмы и улучшение функции легких у пациентов с поздним началом БА по сравнению с ранним началом астмы. Омализумаб улучшает все показатели при астме независимо от возраста, хотя эффект у пожилых кажется менее выраженным по сравнению с другими возрастными группами [69–71]. Терапия анти-ИЛ-5 и анти-ИЛ-13, по-видимому, демонстрирует еще более выраженный эффект в качестве таргетной терапии при позднем дебюте заболевания и у пациентов с астмой 65 лет и старше, но доказательств этого недостаточно [72]. Тезепелумаб рекомендован и включен в схемы лечения тяжелой БА экспертами GINA в 2024 г. По данным исследований, тезепелумаб снижал частоту обострений и улучшал показатели ОФВ1, контроль симптомов БА независимо от типа воспаления (эозинофильного или нейтрофильного). Таким образом, он может быть эффективен и при тяжелой астме с поздним дебютом, ассоциированной с нейтрофильным воспалением.
Добавление тиотропия бромида к терапии ИГКС/длительно действующими β2-агонистами показало свою эффективность при плохом контроле астмы и может быть использовано у пожилых пациентов с поздним началом, несмотря на отсутствие прямых клинических данных [73]. Исследования показывают, что эффект тиотропия бромида не зависит от возраста или возраста начала заболевания [74]. Более того, крупное исследование TIOSPIR подтвердило безопасность длительно действующих антихолинергических средств у пациентов старше 40 лет, из которых около половины были старше 65 [75].
Еще одним приемлемым вариантом лечения БА с поздним дебютом может рассматриваться терапия макролидами. Макролиды выполняют различные функции в дополнение к их действию в качестве антибиотиков. Эффективность азитромицина показана при персистирующей неконтролируемой астме: в 43% случаев — при эозинофильной, в 11% — при нейтрофильной, в 30% — при малогранулоцитарной, в 4% — при смешанной гранулоцитарной (данные получены на основе фенотипирования мокроты) [76]. Пока для лечения неэозинофильной астмы у пожилых людей отсутствуют доказательства эффективности таргетной терапии, но использование макролидов представляется альтернативным вариантом [76].
Бронхиальная термопластика (БТ) — это эндоскопическая процедура, которая направлена в первую очередь на ремоделирование дыхательных путей и улучшает качество жизни или снижает риск обостренией у больных, хотя функция легких не улучшается [77]. Один из механизмов, лежащих в основе клинического улучшения, связан с изменениями в различных структурах бронхов, таких как гладкие мышцы дыхательных путей и нейроэндокринные клетки, без какого-либо влияния на эозинофильное воспаление [78]. БТ может быть вариантом лечения при малогранулоцитарном типе тяжелой астмы с поздним дебютом.
Таким образом, лечение БА с поздним дебютом имеет свои особенности и требует индивидуального подхода. Прогноз заболевания зависит от лечения (рис. 3).
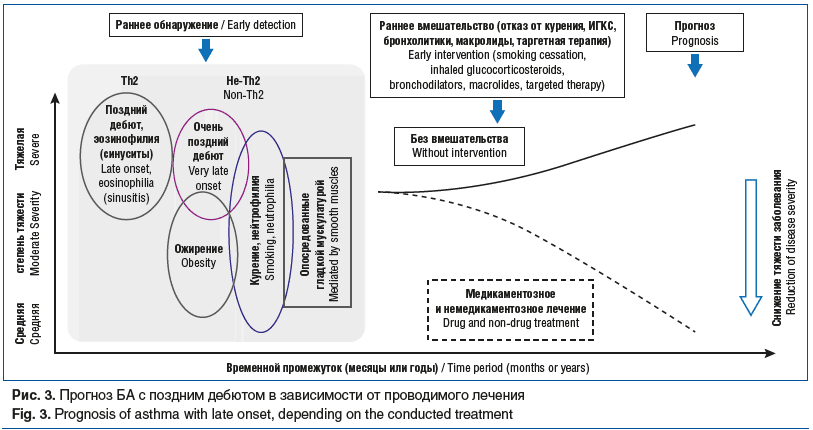
Заключение
Бронхиальная астма с поздним дебютом представляет собой клинически значимый и сложный фенотип, который впервые проявляется у лиц старше 40 лет. Для него характерны уникальные патобиологические механизмы, включая неаллергическое эозинофильное или неэозинофильное воспаление, а также влияние возрастных изменений иммунной системы — иммуносенесценции. Высокая распространенность коморбидных состояний, таких как ожирение, ГЭРБ и сердечно-сосудистые заболевания, существенно осложняет диагностику и лечение. Дифференциальная диагностика часто затруднена из-за схожести симптомов с ХОБЛ и возрастного ремоделирования дыхательных путей. Медикаментозное лечение включает ИГКС, таргетную биологическую терапию (анти-ИЛ-5, анти-ИЛ-4/13), длительно действующие бронходилататоры, а в случаях неэозинофильного воспаления — макролиды. Немедикаментозные методы, такие как отказ от курения, коррекция массы тела и лечение сопутствующей патологии, играют критически важную роль в достижении контроля над заболеванием. Особое внимание стоит уделять сопутствующим заболеваниям и их лечению у пациентов с БА в позднем возрасте, так как это является критически важным. Дальнейшие исследования должны быть направлены на оптимизацию стратегий лечения и улучшение долгосрочных исходов у этой категории пациентов.
Сведения об авторах:
Гайнитдинова Вилия Вилевна — д.м.н., профессор кафедры пульмонологии Института клинической медицины им. Н.В. Склифосовского ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119048, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0001-9928-926Х
Богатырева Тамара Умаровна — аспирант кафедры пульмонологии Института клинической медицины ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119048, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0009-0005-0348-1772
Авдеев Сергей Николаевич — д.м.н., профессор, академик РАН, заведующий кафедрой пульмонологии Института клинической медицины им. Н.В. Склифосовского, директор НМИЦ пульмонологии ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава России (Сеченовский Университет); 119048, Россия, г. Москва, ул. Трубецкая, д. 8, стр. 2; ORCID iD 0000-0002-5999-2150
Контактная информация: Богатырева Тамара Умаровна, e-mail: bogatireva001@mail.ru
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 03.07.2025.
Поступила после рецензирования 28.07.2025.
Принята в печать 20.08.2025.
About the authors:
Viliya V. Gaynitdinova — Dr. Sc. (Med.), Professor at the Pulmonology Department of the Institute of Clinical Medicine of the N.V. Sklifosovskiy, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8, build. 2, Trubetskaya str., Moscow, 119048, Russian Federation; ORCID iD 0000-0001-9928-926Х
Tamara U. Bogatyreva — postgraduate student at the Pulmonology Department of the Institute of Clinical Medicine, I.M. Sechenov First Moscow State Medical University (Sechenov University); 8, build. 2, Trubetskaya str., Moscow, 119048, Russian Federation; ORCID iD 0009-0005-0348-1772
Sergey N. Avdeev — Dr. Sc. (Med.), Professor, Academician of the Russian Academy of Sciences, Head of the Department of Pulmonology at the Institute of Clinical Medicine of the N.V. Sklifosovskiy, Director of the Scientific Research Institute of Pulmonology of the I.M. Sechenov First Moscow State Medical University (Sechenov University); 8, build. 2, Trubetskaya str., Moscow, 119048, Russian Federation; ORCID iD 0000-0002-5999-2150
Contact information: Tamara U. Bogatyreva, e-mail: bogatireva001@mail.ru
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 03.07.2025.
Revised 28.07.2025.
Accepted 20.08.2025.
1Global Initiative for Asthma (GINA). 2024. (Electronic resource.) URL: http://www. ginasthma.org (access date: 28.05.2025).
Информация с rmj.ru

