Введение
Рак нижней губы является наиболее частой формой рака губы (90%) и составляет примерно 30% всех злокачественных опухолей полости рта [1, 2]. По гистологическому строению рак нижней губы в подавляющем большинстве случаев представлен плоскоклеточной карциномой [2].
Рак нижней губы в первую очередь распространяется в подбородочные или подчелюстные лимфатические узлы [5, 6]. Хотя хирургическая резекция в настоящее время является методом лечения при ранней стадии (Т1-2) плоскоклеточного рака нижней губы, практика профилактической шейной диссекции у пациентов с высоким риском метастазирования или случаев, классифицированных клинически как N0 в соответствии с системой определения стадии Американского объединенного комитета по онкологическим заболеваниям (American Joint Commission on Cancer, AYCC), все еще остается спорным вопросом [7]. Одни авторы считают, что профилактическая шейная диссекция является необходимым вариантом лечения при клинически не определяемых (cN0) шейных метастазах [6, 8, 9]. В то время как в других случаях при отсутствии клинических данных о поражении лимфатических узлов шеи в результате физикального и радиологического обследования применение профилактической шейной диссекции считают чрезмерным [10, 11].
Цель исследования: определение эффективности профилактической шейной диссекции при клинически (cN0) не определяемых метастазах плоскоклеточного рака нижней губы.
Содержание статьи
Материал и методы
В ретроспективном исследовании были проанализированы данные о 85 пациентах с плоскоклеточным раком нижней губы Т1-4N0, которые лечились и находились под наблюдением в Онкологической клинике Азербайджанского Медицинского Университета с 2008 по 2023 г. Исследование проводилось в соответствии с принципами Хельсинкской декларации. Критерии включения: в исследование вошли первичные больные раком нижней губы. Критерии исключения: пациенты, которые были направлены в клинику после широкого иссечения опухоли, а также пациенты с рецидивами опухоли. Пациенты были классифицированы по возрасту, полу, распространенности опухолевого процесса, по морфологическому типу опухоли и вариантам шейной диссекции. Среди 85 пациентов 69 были мужчины, 16 — женщины. Самому молодому пациенту было 39 лет, самому старшему — 85 лет, средний возраст составил 58 лет.
Диагноз во всех случаях был подтвержден морфологически по результатам оценки биоптатов, полученных в ходе предоперационной пункционной или инцизионной биопсии. По распространенности опухолевого процесса пациенты были распределены согласно классификации TNM AYCC [12]. Статус регионарного лимфатического узла или отдаленных метастазов оценивали с помощью ультра-звукового исследования (УЗИ), компьютерной томографии (КТ) или магнитно-резонансной томографии (МРТ) в зависимости от стадии опухоли.
При хирургическом лечении первичного очага после широкого иссечения опухоли дефекты менее 1/3 нижней губы восстановлены первично. При дефектах более 1/3 нижней губы были использованы локальные и регионарные лоскуты. Описание реконструкции дефекта не будет представлено в данной статье.
Подход к лимфатическим узлам. Показаниями к профилактической шейной диссекции являлись наличие одного или более факторов высокого риска метастазирования, среди которых: диаметр опухоли >2 см, глубина инвазии >2 мм, наличие периневральной инвазии, плохой дифференциации, иммуносупрессии. Надподъязычная шейная диссекция (I–III уровня лимфатических узлов шеи) проводилась на стадиях Т1–2 с клинически и радиологически подтвержденным отсутствием метастазов в регионарных лимфатических узлах (cN0). Передне-боковая шейная диссекция (I–IV) выполнена при опухолях на стадиях Т3-4N0. Диссекция была двусторонняя при центральной (в средней линии) локализации опухоли на нижней губе. Пациенты с обнаруженными регионарными метастазами после шейной диссекции при морфологическом исследовании были направлены в радиологическое отделение в связи с потенциальной потребностью в адъювантной радиотерапии. Пациенты наблюдались каждые 3 мес. в течение 2 лет, затем каждые 6 мес. в следующем году и ежегодно после четвертого года.
Результаты исследования
В общей сложности из 85 пациентов с диагнозом «рак нижней губы Т1-4N0M0» мы выполнили профилактическую шейную диссекцию 51 пациенту. Группу динамического наблюдения составили остальные 34 пациента, которым не была проведена шейная диссекция.
Профилактическая надподъязычная шейная диссекция проведена у 39 пациентов, передне-боковая шейная диссекция — у 12 (табл. 1).
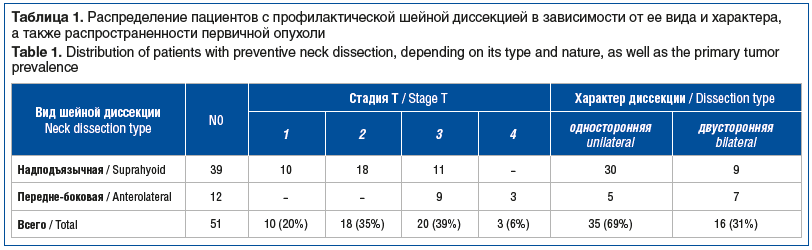
Непосредственные результаты шейных диссекций приведены в таблице 2.
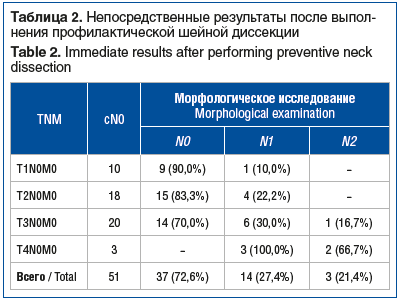
Как видно из таблицы 2, при послеоперационном морфологическом исследовании удаленных лимфатических шейных узлов микрометастазы были обнаружены у 14 пациентов. Анализ частоты микрометастазов в зависимости от статуса первичной опухоли показал, что среди 10 пациентов со стадией Т1 они выявлены у одного, среди 18 пациентов в стадии Т2 — у четырех. Из 20 пациентов в стадии Т3, подвергнутых профилактической шейной диссекции, микрометастазы выявлены в 6 случаях. После профилактической шейной диссекции у 3 пациентов в стадии Т4 микрометастазы были диагностированы во всех случаях. Микрометастазы были выявлены при односторонней шейной диссекции у 14 пациентов, при двусторонней шейной диссекции — у 3. Двусторонние шейные метастазы были диагностированы у 1 пациента с опухолью стадии Т3N0M0, и у 2 — Т4N0M0. При анализе частоты встречаемости микрометастазов в зависимости от варианта профилактической шейной диссекции различий между ними выявлено не было: в 28,2% (у 11 пациентов из 39) случаев при надподъязычной и в 25,0% (у 3 пациентов из 12) при передне-боковой шейной диссекции.
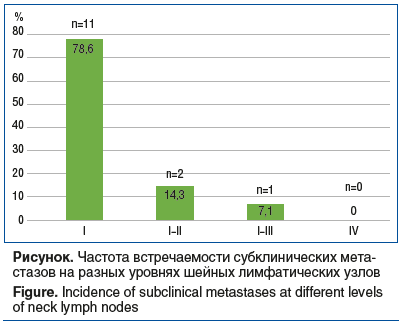
Субклинические метастазы среди 14 пациентов диагностированы у 11 пациентов на I, у 2 пациентов на I–II, у 1 пациента на I–III и ни у одного пациента на IV уровне шейных лимфатических узлов (см. рисунок).
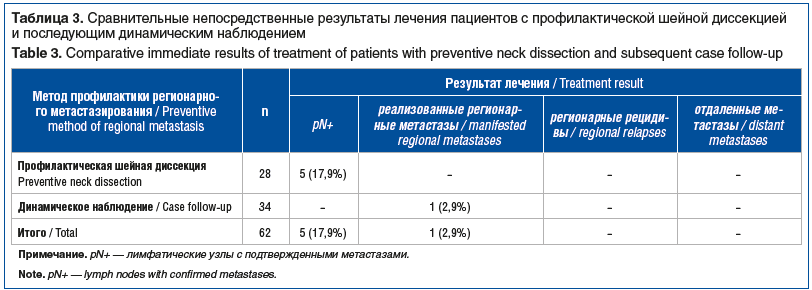
Сравнительные результаты лечения 62 больных раком нижней губы T2N0M0, у которых была проведена профилактическая шейная диссекция (28 пациентов) в связи с высоким прогностическим риском метастазирования и которые находились под динамическим наблюдением (34 пациента), приведены в таблице 3.
Как видно из таблицы 3, после профилактической шейной диссекции, при послеоперационном морфологическом исследовании субклинические метастазы выявлены в 17,9% случаев. В группе контроля (пациенты динамического наблюдения) с низким прогностическим риском регионарные метастазы реализовались лишь в 2,9% случаев.
Обсуждение
Плоскоклеточный рак нижней губы, как известно, имеет относительно хороший прогноз. Однако в ряде случаев рак этой локализации может быть более инвазивным и метастатическим по сравнению с другими плоскоклеточными раками кожи головы и шеи [13, 14].
Метастазы в лимфатические узлы шеи при раке нижней губы часто диагностируются рано из-за анатомической локализации, но при этом выживаемость по сравнению с пациентами без метастазов ниже почти вдвое [6]. В руководящих указаниях Национальной комплексной сети рака (National Comprehensive Cancer Network, NCCN) существует консенсус (общее мнение) в отношении необходимости функциональной или модифицированной радикальной шейной диссекции при клинически подтвержденных метастазах в лимфатические узлы шеи (cN+) независимо от стадии Т [15]. Однако такой объем неприменим при клинически не определяемых метастазах (cN0). В том же исследовании при проведении профилактической шейной диссекции было показано, что частота встречаемости скрытых метастазов составляет примерно 20% [6]. В нашем исследовании она составила 27,4%.
Ряд исследователей, например N. Ciloglu et. al. [16], не предлагали проведение профилактической шейной диссекции у больных с cN0 при высокой дифференцировке опухоли (Grade I). В нашем исследовании профилактическая шейная диссекция проводилась независимо от N статуса у 28 пациентов Т1-Т2, и так как у 5 были диагностированы метастазы, это, по нашему мнению, доказывает целесообразность профилактической шейной диссекции у больных раком на стадии Т1-Т2 с высоким риском.
Многие исследователи считают, что профилактическую шейную диссекцию при раке головы и шеи необходимо выполнять при риске регионарных метастазов выше 15–20% [17–19].
L. Califano et al. [20] утверждают, что размер первичной опухоли и эстракапсулярное распространение являются наиболее важными параметрами в отношении развития метастазов на шее. Известно, что опухоли, окруженные большой полосой лимфоцитов, и высокодифференцированные опухоли реже дают метастазы в лимфатические узлы шеи [18, 21]. Другими важными прогностическими факторами являются глубина инвазии опухолей (>2 мм), периневральная инвазия и иммуносупрессия [12, 22]. Было показано, что опухолевые поражения в этой группе высокого риска имеют тенденцию к развитию рецидивов и метастазов.
Селективная шейная диссекция характеризуется меньшим сопутствующим поражением (меньшим объемом удаляемых тканей), чем модифицированная радикальная диссекция в плане эстетических и функциональных результатов, при этом основными преимуществами являются сохранение объема шеи и функциональность плеча [23].
Сообщалось, что среди пациентов с плоскоклеточным раком нижней губы со статусом cN0, получавших только резекцию первичной опухоли, при дальнейшем динамическом наблюдении регионарные метастазы наблюдались в 5–15% случаев [24, 25].
В исследовании, проведенном А. Кос et al. [26], профилактическая шейная диссекция была выполнена всем больным раком нижней губы без клинически не определяемых шейных метастазов (cN0). В результате анализа полученных результатов авторы пришли к выводу, что ее следует выполнять, чтобы снизить последующий риск метастазирования в шейные лимфоузлы.
В литературе нет ни одного мнения относительно подхода, который следует использовать при клинически отрицательных шейных лимфатических узлах у пациентов с плоскоклеточным раком нижней губы, и сообщаемая частота регионарных метастазов варьировала от 0 до 15% для опухолей Т1 и от 11 по 35% при опухолях Т2 [20, 27].
Скрытые метастазы в субклинической стадии часто являются причиной позднего выявления клинически определяемых метастазов в лимфатические узлы шеи. J. De Visscher et al. [28] и I.N. Hosal et al. [29] подтвердили, что поздно выявленные клинически определяемые регионарные метастазы трудно поддаются лечению и зачастую становятся причиной смерти пациентов в течение первого года наблюдения. Кроме того, в исследовании показано, что биопсия сторожевого лимфатического узла в настоящее время является стандартной процедурой для определения стадии рака молочной железы и меланомы, тогда как ее роль для плоскоклеточного рака головы и шеи, в том числе для рака нижней губы, полностью не определена.
Потенциальная польза от биопсии сторожевого лимфатического узла при плоскоклеточном раке нижней губы изучается во многих центрах. При сравнении эффективности для выявления скрытых метастазов на шее было установлено, что биопсия сторожевого лимфатического узла является более информативной, чем радиологические исследования, но менее информативной, чем селективная шейная диссекция [28–31].
Заключение
Результаты настоящего исследования показали, что плоскоклеточный рак нижней губы имеет хороший прогноз по сравнению с другими видами рака головы и шеи при своевременном хирургическом лечении. Однако реализация регионарных метастазов не редка и значительно снижает выживаемость. Таким образом, наши результаты подтверждают необходимость выполнения профилактической шейной диссекции в избирательных случаях при плоскоклеточном раке нижней губы стадии T1-2N0 и во всех случаях рака нижней губы стадии Т3-4N0M0 для профилактики регионарного метастазирования. Также нужно отметить, что биопсия сторожевого лимфатического узла является эффективным и менее инвазивным способом оценки состояния лимфатических узлов шеи и может быть хорошим вариантом для пациентов, которые отказываются от селективной диссекции. Основываясь на результате этого исследования, можно сделать вывод, что наличие высокого прогностического риска (размер, глубина, гистологическая градация опухоли) является одним из важных параметров для решения вопроса о проведении профилактической шейной диссекции в случаях плоскоклеточного рака нижней губы на ранней стадии. Мы считаем целесообразным проведение надподъязычной шейной диссекции (I-III) при cN0 при раке нижней губы у пациентов высокого риска.
Сведения об авторах:
Рустамзаде Мехрибан Ализамин — докторант кафедры онкологии лечебного факультета Азербайджанского Медицинского Университета; Азербайджан, г. Баку, ул. С. Вургуна, д. 108; ORCID iD 0009-0000-1956-8403
Амиралиев Намик Майис — д.м.н., профессор кафедры онкологии лечебного факультета Азербайджанского Медицинского Университета; Азербайджан, г. Баку, ул. С. Вургуна, д. 108; ORCID iD 0009-0001-3960-8393
Контактная информация: Рустамзаде Мехрибан Ализамин, e-mail: dr.abdullayeva.nco@gmail.com
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 30.09.2024.
Поступила после рецензирования 23.10.2024.
Принята в печать 15.11.2024.
About the authors:
Mehriban A. Rustamzade — Doctoral Candidate of the Department of Oncology, Faculty of Medicine, Azerbaijan Medical University; 108, S. Vurgun str., Baku, Azerbaijan; ORCID iD 0009-0000-1956-8403
Namik M. Amiraliev — Dr. Sc. (Med.), Professor, Department of Oncology, Faculty of Medicine, Azerbaijan Medical University; 108, S. Vurgun str., Baku, Azerbaijan; ORCID iD 0009-0001-3960-8393
Contact information: Mehriban A. Rustamzade, e-mail: dr.abdullayeva.nco@gmail.com
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 30.09.2024.
Revised 23.10.2024.
Accepted 15.11.2024.
Информация с rmj.ru
