Введение
Криптогенная организующаяся пневмония (КОП) — заболевание из группы идиопатических интерстициальных пневмоний. Морфологическим субстратом КОП является поражение бронхиол с вовлечением в воспалительный процесс альвеол и наличием в их просвете организованного экссудата [1].
В настоящее время отсутствуют данные рандомизированных контролируемых исследований по терапии КОП, поэтому выбор тактики лечения зачастую опирается на результаты серии клинических наблюдений или мнения отдельных экспертов. Стандартной терапией КОП являются системные глюкокортикостероиды (СГКС), при их недостаточной эффективности применяются цитостатики, однако доказательств их эффективности недостаточно [2–4].
Несмотря на то, что на терапию СГКС у пациентов с КОП обычно наблюдается хороший ответ, примерно у 70% пациентов может развиваться рецидив заболевания, а множественные и поздние рецидивы возникают примерно у одной трети пациентов [5].
Представляем клиническое наблюдение пациента с морфологически подтвержденной КОП, с недостаточной эффективностью терапии СГКС и плохой переносимостью микофенолата мофетила, что потребовало поиска альтернативного подхода к лечению (от пациента было получено письменное добровольное информированное согласие на публикацию результатов обследования и лечения).
Клиническое наблюдение
Пациент П., 58 лет, обратился в медицинский центр ФГБУ «НИИ пульмонологии» ФМБА России в июне 2019 г. с жалобами на выраженную одышку при минимальных (самообслуживание) физических нагрузках, сухой приступообразный кашель, утомляемость.
Анамнез жизни: рос и развивался нормально. Хронические заболевания органов дыхания отрицает. Во время службы в Вооруженных силах СССР и РФ имел продолжительный контакт с пороховыми газами.
Сопутствующие заболевания: гипертоническая болезнь I стадии, 1-я степень артериальной гипертензии (достигнута нормотония), риск сердечно-сосудистых осложнений 2. Регулярно принимает бисопролол 5 мг 1 р/сут, ривароксабан 20 мг, аторвастатин 10 мг.
Анамнез болезни: в марте 2017 г. на фоне затянувшейся острой респираторной вирусной инфекции диагностирована интерстициальная пневмония, выполнена фибробронхоскопия с трансбронхиальной биопсией легкого, морфологически описан паттерн КОП (рис. 1).
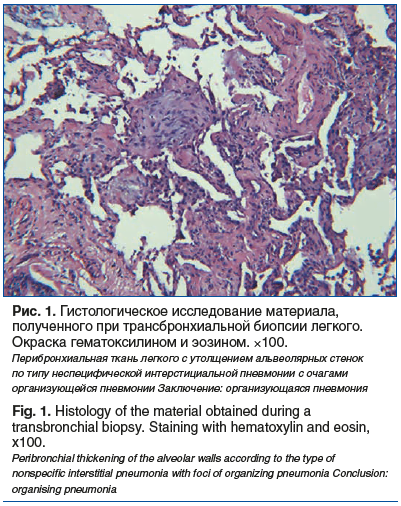
Проводилась пульс-терапия СГКС (метилпреднизолон 250 мг в/в № 1) с последующим переходом на пероральный прием преднизолона в дозе 25 мг/сут с положительным эффектом.
На фоне отмены СГКС в декабре 2017 г. зарегистрирован рецидив процесса, отмечалось прогрессирование одышки, усиление кашля, регистрировалась отрицательная рентгенологическая динамика в виде увеличения объема поражения легочной ткани, что потребовало возо-бновления терапии преднизолоном в дозе 15 мг/сут, которую пациент получал в течение 2 мес. На фоне лечения состояние без динамики, рентгенологические проявления оставались в прежнем объеме. При функциональном исследовании от 12.02.2018 выявлено снижение диффузионной способности легких (DLCO) до 44% от должного. Проведена пульс-терапия метилпреднизолоном 250 мг 1 р/сут в/в № 2, доза перорального преднизолона увеличена до 20 мг/сут.
К октябрю 2018 г. доза перорального преднизолона составляла 10 мг/сут, на фоне чего самочувствие пациента вновь стало прогрессивно ухудшаться: нарастала одышка, регистрировалась отрицательная рентгенологическая динамика, в связи с чем пациент был госпитализирован. Выполнен скрининг на наличие системных заболеваний соединительной ткани (СЗСТ), данных за наличие СЗСТ не получено. Проведена пульс-терапия метилпреднизолоном 250 мг 1 р/сут в/в № 2, доза перорального преднизолона увеличена до 20 мг/сут на 3 мес. без рекомендации к снижению дозы.
В январе 2019 г. DLCO составляла 27,2% от должной. К лечению добавлен микофенолата мофетил (500 мг 2 р/сут с увеличением дозы до 1000 мг 2 р/сут через 1 нед. терапии). На этом фоне к концу 1-й недели приема у пациента развились выраженные диспептические расстройства (тошнота, рвота, диарея), в связи с чем прием препарата был самостоятельно отменен.
В апреле 2019 г. отмечалось очередное ухудшение, в связи с чем доза преднизолона увеличена до 25 мг/сут, ее пациент принимал в течение 1 мес. с последующим постепенным снижением до 10 мг/сут. В мае 2019 г. уровень DLCO составлял 35% от должного.
В связи с ухудшением состояния в начале июня 2019 г. пациент госпитализирован в стационар. По данным компьютерной томографии органов грудной клетки (КТ ОГК) от 17.06.2019 зарегистрировано нарастание интенсивности изменений в нижних отделах обоих легких (рис. 2, А–С). Проведена пульс-терапия (метилпреднизолон 500 мг в/в 1 р/сут № 2), доза перорального преднизолона увеличена до 25 мг/сут, планировалось добавление к терапии азатиоприна, однако от приема системных цитостатических препаратов пациент категорически отказался.
После выписки из стационара обратился в ФГБУ «НИИ пульмонологии» ФМБА России. На основании имеющихся данных об эффективности ингаляционного применения ультранизких доз алкилирующих препаратов при воспалительных заболеваниях [6–10], 24.06.2019 решением консилиума специалистов и после получения от пациента письменного согласия начат курс лечения препаратом мелфалан (МФ) в дозе 0,1 мг 1 р/сут ингаляционно на протяжении 5 последовательных дней. Было рекомендовано продолжить прием преднизолона 25 мг/сут до 1 мес. с последующим постепенным снижением на 1,25 мг 1 раз в 2 нед. вплоть до полной отмены. Курс ингаляций пациент перенес удовлетворительно, в ходе лечения МФ нежелательных явлений (НЯ) зарегистрировано не было.
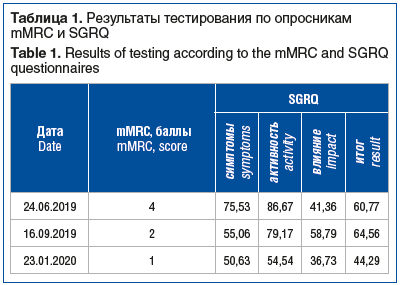
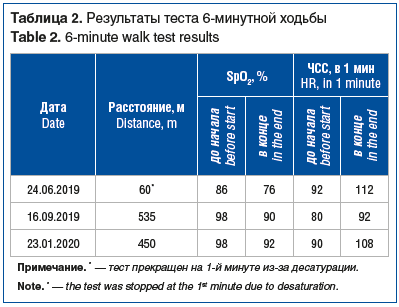
В ходе последующего наблюдения, продлившегося 7 мес., отмечалась положительная клинико-рентгенологическая динамика в виде уменьшения одышки по шкале Modified Medical Research Council (mMRC) и улучшения показателей качества жизни по данным респираторного опросника госпиталя Святого Георгия (St. George’s Respiratory Questionnaire, SGRQ) (табл. 1), увеличения толерантности к физической нагрузке по данным теста 6-минутной ходьбы (табл. 2), увеличения функциональных показателей дыхательной системы (табл. 3), существенного улучшения рентгенологической картины по данным КТ ОГК на 12-й (рис. 2, D–F) и 30-й (рис. 2, G–I) неделях наблюдения.
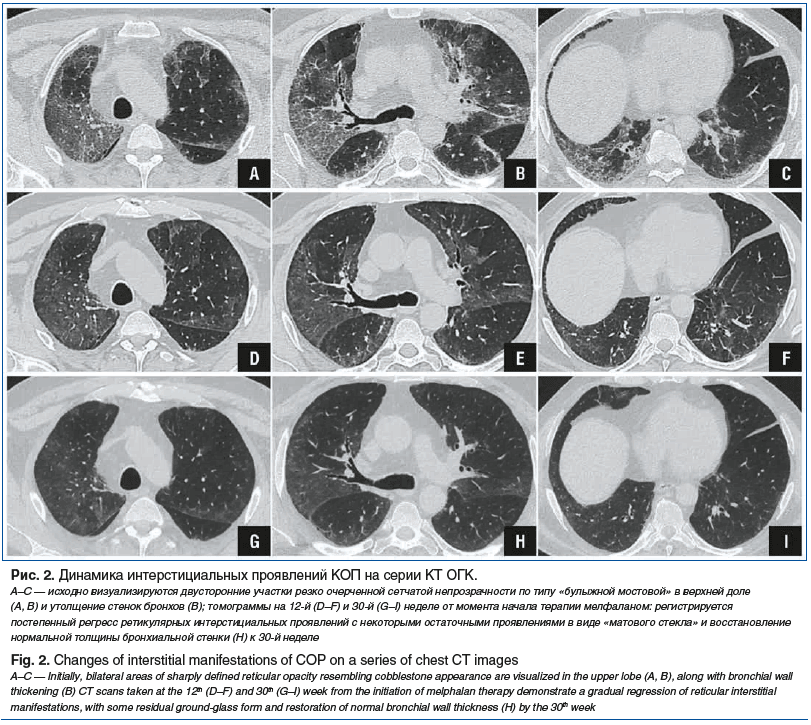
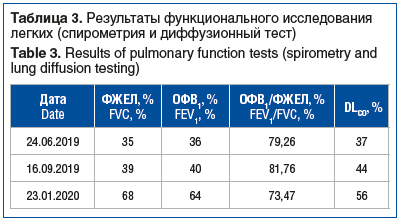
В мае 2020 г. был прекращен прием СГКС, рецидивов КОП не зарегистрировано, пациент находился в стабильном состоянии под наблюдением пульмонолога. К моменту прекращения приема пациентом СГКС проведение контрольного обследования стало невозможным по причине разгара пандемии новой коронавирусной инфекции.
Обсуждение
Стандартная терапия СГКС у пациентов с КОП не обладает достаточной эффективностью, о чем свидетельствует большой процент рецидивов заболевания. Кроме того, терапия СГКС имеет серьезные побочные эффекты, обусловленные их длительным использованием (иммуносупрессия и вторичные инфекционные осложнения, нарушение толерантности к глюкозе и сахарный диабет, остеопороз, поражение желудочно-кишечного тракта (ЖКТ), в том числе развитие «стероидной» язвы желудка и двенадцатиперстной кишки и др.).
Добавление к терапии системных цитостатических препаратов остается недостаточно изученным. Так, по данным ряда авторов, назначение системных цитостатиков более эффективно при интерстициальных заболеваниях легких, ассоциированных с СЗСТ, в то время как при ряде других состояний, в том числе КОП, было продемонстрировано снижение выживаемости пациентов [11]. Важнейшим ограничением применения системных цитостатиков являются побочные эффекты, обусловленные как цитостатическим, так и общетоксическим действием данной группы препаратов. Наиболее характерными НЯ для большинства цитостатиков являются угнетение гемопоэза (лейкопения, нейтропения, тромбоцитопения, анемия), токсические явления со стороны ЖКТ (тошнота, рвота, стоматит, диарея и др.) и кожи (сыпь, кожный зуд и др.). Также они могут обладать кардио-, нефро- и гепатотоксичностью, вызвать угнетение иммунной системы.
Таким образом, остается актуальным поиск новых эффективных и безопасных методов терапии КОП, обладающих противовоспалительным действием и не вызывающих цитотоксические реакции.
Одним из успешных примеров возможного решения этой проблемы может стать применение ингаляций ультранизких доз алкилирующего препарата МФ в дозе в 100 раз ниже обычной терапевтической, при которой реализуется противовоспалительное, а не цитотоксическое действие за счет блокады поверхностных клеточных цитокиновых рецепторов [12]. Имеются данные об успешном применении в клинической практике ингаляций ультранизких доз МФ у пациентов с тяжелой бронхиальной астмой, на фоне применения которых были зарегистрированы достоверное уменьшение одышки и кашля, увеличение толерантности к физической нагрузке, снижение частоты обострений и уменьшение потребности в использовании ингаляционных короткодействующих β2-агонистов по сравнению с контрольной группой. Также у пациентов исследуемой группы наблюдалось достоверное улучшение показателей спирометрии, при проведении фибробронхоскопии — существенное уменьшение гиперемии, отека слизистой, количества и вязкости секрета, а по данным электронной микроскопии — положительная динамика морфологических изменений слизистой оболочки бронхиального дерева с восстановлением в ряде случаев его структурной целостности как пласта, что является доказательством выраженного противовоспалительного действия предлагаемой методики лечения. Важным выводом данного исследования явилось отсутствие местнораздражающего действия и отрицательного влияния ультранизких доз МФ на лабораторные показатели [13, 14].
Также эффективность и безопасность ингаляций ультранизких доз МФ оценивали в ходе одноцентрового проспективного открытого сравнительного исследования с ретроспективным контролем, слепого для центрального эксперта, у 120 взрослых госпитализированных пациентов с COVID-19-ассоциированным поражением легких. Эффективность лечения МФ характеризовалась лучшими показателями шкалы клинического улучшения Всемирной организации здравоохранения, более быстрым снижением выраженности одышки по модифицированной шкале Борга и уменьшением объема поражения легочной ткани по данным КТ ОГК. Кроме того, у пациентов исследуемой группы скорость снижения уровня С-реактивного белка была выше, чем в группе контроля, что свидетельствует о противовоспалительном действии препарата. Безопасность ингаляций ультранизких доз МФ была подтверждена отсутствием НЯ, характерных для терапевтических доз алкилирующих препаратов, и НЯ, непосредственно связанных с приемом препарата, а также отсутствием различий в динамике лабораторных показателей (клинического и биохимического анализов крови) между группами [15].
В представленном клиническом наблюдении выбор предлагаемого метода лечения был обусловлен недостаточной эффективностью назначения СГКС при КОП, характеризующейся повторными рецидивами заболевания. Включение в схему лечения терапевтических доз цитостатических препаратов повлекло за собой развитие НЯ (выраженные диспептические явления) и, как следствие, категорический отказ пациента принимать препараты этой группы. Курс противовоспалительного лечения ингаляциями МФ в сочетании со стандартной терапией рецидива КОП СГКС обеспечил стабилизацию состояния пациента, уменьшение степени одышки, улучшение рентгенологической картины и функциональных показателей дыхательной системы, а также качества жизни пациента, позволил со временем полностью отменить прием СГКС без развития очередного рецидива заболевания.
Заключение
Представленное наблюдение указывает на потенциальную возможность ингаляционного использования ультранизких доз алкилирующих препаратов при КОП, при этом применение в широкой практике такого подхода требует проведения дополнительных исследований.
Сведения об авторах:
Синицын Евгений Александрович — к.м.н., старший научный сотрудник лаборатории клинической пульмонологии ФГБУ «НИИ пульмонологии» ФМБА России; 115682, Россия, г. Москва, Ореховый б-р, д. 28; ассистент кафедры факультетской терапии и профболезней ФГБОУ ВО «Российский университет медицины» Минздрава России; 127006, Россия, г. Москва, ул. Долгоруковская, д. 4; ORCID iD 0000-0002-8813-5932.
Ларченко Юлия Александровна — врач-пульмонолог, научный сотрудник лаборатории клинической пульмонологии ФГБУ «НИИ пульмонологии» ФМБА России; 115682, Россия, г. Москва, Ореховый б-р, д. 28; старший лаборант кафедры факультетской терапии и профболезней ФГБОУ ВО «Российский университет медицины» Минздрава России; 127006, Россия, г. Москва, ул. Долгоруковская, д. 4; ORCID iD 0000-0002-5047-6395.
Самсонова Мария Викторовна — д.м.н., заведующая лабораторией патологической анатомии ФГБУ «НИИ пульмонологии» ФМБА России; 115682, Россия, г. Москва, Ореховый б-р, д. 28; ORCID iD 0000-0001-8170-1260.
Петров Кирилл Сергеевич — к.м.н., врач-рентгенолог ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России; 115478, Россия, г. Москва, Каширское ш., д. 23; ORCID iD 0000-0002-0997-7825.
Зыков Кирилл Алексеевич — д.м.н., член-корреспондент РАН, профессор РАН, заместитель директора по научной и инновационной работе ФГБУ «НИИ пульмонологии» ФМБА России; 115682, Россия, г. Москва, Ореховый б-р, д. 28; заведующий кафедрой факультетской терапии и профболезней ФГБОУ ВО «Российский университет медицины» Минздрава России; 127006, Россия, г. Москва, ул. Долгоруковская, д. 4; ORCID iD 0000-0003-3385-2632.
Контактная информация: Синицын Евгений Александрович, e-mail: sinymlad@list.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 04.07.2024.
Поступила после рецензирования 24.07.2024.
Принята в печать 15.08.2024.
About the authors:
Evgeny A. Sinitsyn — C. Sc. (Med.), Senior Researcher at the Laboratory of Clinical Pulmonology, Research Institute of Pulmonology of the Russian Federal Medical Biological Agency; 28, Orekhovyy blvrd., Moscow, 115682, Russian Federation; Assistant Professor of the Department of Faculty Therapy and Occupational Diseases, Russian University of Medicine; 4, Dolgorukovskaya str., Moscow, 127006, Russian Federation; ORCID iD 0000-0002-8813-5932.
Yulia A. Larchenko — pulmonologist, Researcher at the Laboratory of Clinical Pulmonology, Research Institute of Pulmonology of the Russian Federal Medical Biological Agency; 28, Orekhovyy blvrd., Moscow, 115682, Russian Federation; Senior Laboratory Assistant of the Department of Faculty Therapy and Occupational Diseases, Russian University of Medicine; 4, Dolgorukovskaya str., Moscow, 127006, Russian Federation; ORCID iD 0000-0002-5047-6395.
Maria V. Samsonova — Dr. Sc. (Med.), Head of the Laboratory of Pathological Anatomy, Research Institute of Pulmonology of the Russian Federal Medical Biological Agency; 28, Orekhovyy blvrd., Moscow, 115682, Russian Federation; ORCID iD 0000-0001-8170-1260.
Kirill S. Petrov — C. Sc. (Med.), radiologist of the N.N. Blokhin National Medical Research Center of Oncology; 23, Kashirskoye road, Moscow, 115478, Russian Federation; ORCID iD 0000-0002-0997-7825.
Kirill A. Zykov — Dr. Sc. (Med.), Corresponding Member of the Russian Academy of Sciences, Professor of the Russian Academy of Sciences, Deputy Director for Scientific and Innovative Work, Research Institute of Pulmonology of the Russian Federal Medical Biological Agency; 28, Orekhovyy blvrd., Moscow, 115682, Russian Federation; Head of the Department of Faculty Therapy and Occupational Diseases, Russian University of Medicine; 4, Dolgorukovskaya str., Moscow, 127006, Russian Federation; ORCID iD 0000-0003-3385-2632.
Contact information: Evgeny A. Sinitsyn, e-mail: sinymlad@list.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 04.07.2024.
Revised 24.07.2024.
Accepted 15.08.2024.
Информация с rmj.ru

