Введение
Возраст-ассоциированные изменения кожи являются важной эстетической и социально значимой проблемой, требующей современных подходов к терапии проявлений старения [1]. Большинство исследователей выделяют хронологическое старение и фотоиндуцированное старение [2]. В стареющей ткани происходит снижение синтеза, а также ускоренная биодеградация основных «игроков», отвечающих за поддержание структуры кожи: коллагена, эластина и гиалуроновой кислоты (ГК) [3, 4]. Подобные возрастные изменения кожного покрова и их коррекция являются важной проблемой современной дерматологии и косметологии [5].
Термином «биоревитализация» обозначают метод восстановления и улучшения качественных эстетических характеристик кожи непосредственно в области введения композиций биополимеров на основе ГК [6]. Многолетний опыт применения нативной ГК сделал ее «золотым стандартом» терапии инволютивных изменений кожи [7]. Эффект от биоревитализации с применением ГК обусловлен, с одной стороны, ответной реакцией организма на механохимический стресс (инвазивное действие), а с другой — специфическим воздействием введенного препарата. Эффективность напрямую зависит от состава гидрогелевого материала на основе ГК [8]. Современные протоколы коррекции в эстетической косметологии подразумевают комбинированный подход, который призван значительно повысить удовлетворенность пациента и врача за счет взаимодополняемых техник [9]. Одной из перспективных терапевтических стратегий в клинической практике является комбинирование ГК, модифицированной магнием (ГК-Мg), с полидезоксирибонуклеотидами (ПДРН) [10].
Интрадермальные инъекции имплантатов на основе гиалуронана в рамках терапии возрастных изменений кожи
Гиалуроновая кислота представляет собой природный биополимер, высокомолекулярный гликозаминогликан, состоящий из остатков D-глюкуроновой кислоты и D-N-ацетилглюкозамина. На сегодняшний день в области косметологии и эстетической медицины используют ГК разной молекулярной массы и концентрации. Молекулы гиалуронана, как высокомолекулярного, среднемолекулярного, так и низкомолекулярного, воздействуют на разные клеточные регуляторные механизмы и реализуют различный по выраженности эстетический эффект [11]. Наиболее целесообразна в отношении использования в рамках биоревитализации высокомолекулярная ГК [12]. В работе В.Н. Хабарова [13] отмечено, что 1% (10 мг/мл) раствор ГК является предельным по концентрации для препарата, используемого в целях биоревитализации. Связь фибробласта с гиалуронаном осуществляется через большое количество клеточных рецепторов, специфично реагирующих на определенные последовательности элементов межклеточного матрикса. Интегральный гликопротеин CD44 является наиболее распространенным рецептором ГК. Таким образом, интрадермальное введение ГК позволяет воздействовать на морфогенез ткани, способствует тканевой гидратации, ангиогенезу, клеточной дифференцировке, пролиферации и усилению миграционной подвижности [14, 15].
Содержание статьи
Комбинация препаратов на основе ГК и ПДРН как перспективный инструмент терапии инволютивных изменений кожи
Полидезоксирибонуклеотиды — биополимерные цепи, состоящие из дезоксирибонуклеотидных мономеров, которые, в свою очередь, состоят из азотистого основания, углеводного остатка и фосфатной группы. ПДРН для применения в косметологии в основном экстрагируют из зародышевых клеток рыб семейства лососевых, что минимизирует риск аллергической реакции [16]. Реализация роли ПДРН также зависит от молекулярной массы полимера. Среди исследованных образцов эффективнее всего себя проявила среднемолекулярная фракция ПДРН (50–1500 кДа) [17]. Область применения ПДРН довольно широка и связана с их ранозаживляющим и противовоспалительном действием [18–22]. Добавление ГК даже в низкой концентрации (1 мг/мл) повышает эффективность ПДРН до 20% [23]. Комбинация ГК с ПДРН активно применяется в ревматологии [24], стоматологии [25], гинекологии [26] и косметологии [27, 28].
Сочетанное применение ГК-Мg и ПДРН для более стойкого терапевтического эффекта
Совокупная комбинированная терапия в рамках антивозрастной коррекции демонстрирует более выраженный результат, чем простая сумма одиночных манипуляций [29, 30]. Наиболее актуально включение в курс процедур макро- и микроэлементов, жизненно необходимых для организма человека. Магний является кофактором более 600 ферментов, активно участвует в обмене белка и нуклеиновых кислот, регулирует продукцию ГК [31, 32]. ДНК-полимеразу считают холоферментом, поскольку для оптимального функционирования ей необходимо присутствие ионов магния в качестве кофактора [33]. Положительная регуляция стабильности клеток во всех фазах клеточного цикла осуществляется благодаря адекватному уровню внутриклеточного магния [34], при этом эффективнее проходит регенерация и обновление клеток тканей [35]. Тяжелый дефицит магния (гипомагниемия) встречается редко, но хронический латентный дефицит, по-видимому, широко распространен среди населения. Ряд авторов связывают хронический латентный дефицит магния с ускоренным прогрессированием всех ключевых процессов, связанных со старением [36]. Хотя нынешнее ежедневное потребление магния с пищей кажется относительно достаточным, чтобы избежать явных признаков гипомагниемии, у большинства населения его может не хватить для обеспечения оптимального состояния здоровья [37]. По данным исследования, проведенного на базе Научного центра здоровья детей, наличие низкой концентрации магния верифицировалось у 42,5% из 4300 пациентов [38]. Проведенные в РФ многоцентровые скрининговые исследования на базе многопрофильных больниц продемонстрировали, что из 2000 пациентов в возрасте 13 лет и старше 47,8% имели недостаток магния (ниже нормы) в организме, что показывает высокую распространенность дефицита этого макроэлемента [39]. В США латентный дефицит магния выявляется едва ли не у 75% населения либо его уровень соответствует нижней границе нормы [40].
С целью профилактики и лечения выраженных магний-дефицитных состояний (гипомагниемия) стандартно используют препараты на основе органических солей магния — магния цитрат, магния оротат, магния глюконат, магния лактат. Данные соединения используются как биологически активные добавки или входят в состав лекарственных препаратов. Однако их использование в антивозрастной терапии в косметологии и эстетической медицине с целью локальной регенерации и обновления клеток дермально-эпидермальной зоны не представляется возможным [41] в связи с системным действием. Внутрикожное введение магния является альтернативным способом его доставки к тканям-мишеням. Широко используемый на рынке косметологии сульфат магния имеет относительно низкую биодоступность при интрадермальном введении, так как основной областью приложения данного соединения является внеклеточный матрикс, а преобладающая роль принадлежит именно внутриклеточной фракции катиона [42]. К тому же действие сульфата магния в межклеточном матриксе может носить негативный характер [43, 44], тем больший, чем большая доза используется.
В настоящее время рынок косметологии предлагает множество препаратов и методов для борьбы с признаками старения кожи. Однако, несмотря на разнообразие предложений, существует потребность в новых эффективных и безопасных решениях. В 2023 г. на рынке косметологии появился гибридный препарат для биоревитализации — Магнидерм® (РУ РЗН 2022/17237), имеющий в составе, помимо высокомолекулярной ГК, хелатный комплекс ГК и хлорида магния. В данном решении была реализована система с относительно высокой биодоступностью двухвалентного катиона по сравнению с существующими на рынке препаратами [8]. C учетом ведущей роли магния в синтезе и распаде нуклеиновых кислот, синтезе белков, жирных кислот и липидов данная разработка логично привела к выработке новых протоколов с сочетанным использованием гидрогелевых систем на основе ГК-Мg и ПДРН для применения в антивозрастной терапии. Однако, несмотря на потенциальную эффективность и более стойкий терапевтический эффект, мы сочли необходимым провести пилотное исследование для подтверждения безопасности и эффективности препарата, так как вопросы изучения сочетанной методики применения ГК-Мg и ПДРН остаются недостаточно изученными в рамках косметологии.
Цель пилотной фазы исследования: оценить эффективность коррекции возрастных изменений кожи гидрогелем на основе ГК-Мg и препаратом на основе ПДРН по разработанной методике.
Пилотное исследование направлено на выявление тенденций влияния предложенной терапии на синтез коллагена и, следовательно, на улучшение состояния дермального слоя кожи. В более широком контексте это может привести к созданию более эффективных и персонализированных стратегий терапии возрастных изменений кожи.
Материал и методы
Под наблюдением находилось 20 женщин в возрасте 42–54 года c целью оценки уровня репарационных способностей кожи в рамках подготовки к последующей пластической операции — блефаропластике. Все пациентки были европеоидной расы с I–III фототипом кожи по Фитцпатрику и G2–G3 типом фотостарения по Глогау. Включение в исследование проводили после подписания информированного добровольного согласия пациента. Другим критерием включения являлось отсутствие процедур биоревитализации периорбитальной области в последние два года.
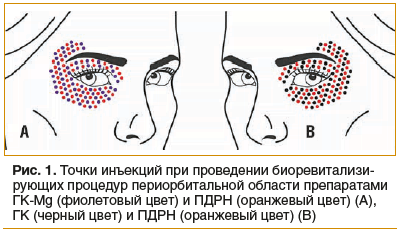
До проведения забора биоптатов 10 пациенток не проходили инъекционную терапию препаратами (контрольная группа). Во второй, экспериментальной, группе (n=10, средний возраст 48 лет) применяли предложенные протоколы работы: в периорбитальную зону по заранее отмеченным участкам (в шахматном порядке) c одной стороны (рис. 1А) вводили гиалуронановый гидрогель Магнидерм® 061 (ГК-Мg) и ПДРН (Плинест Фаст2, СЗ 2011/10659), с другой (рис. 1B) — гиалуронановый гидрогель (ГК, Контургель-ХПМ3, ФСР 2007/00256) и ПДРН. Введение осуществляли в четыре сеанса (один раз с интервалом 10–14 дней) согласно стандартному протоколу в соответствии с инструкцией по применению препаратов. Инъекции проводили в поверхностной микропапульной технике интрадермально на глубину среза иглы (33G) срезом вверх (угол введения ≈15°). Объем папулы не более ≈1–2 мм, шаг между вколами ≈2–3 мм. Общий объем вводимых препаратов на периорбитальную область с двух сторон — не более 0,6–0,8 мл.
Через 65 дней после завершения курса биоревитализации пациенткам была выполнена плановая пластическая операция по иссечению излишков кожи нижних и верхних век (блефаропластика) с забором биоптатов кожи, которые были изучены на предмет изменения активности белковых молекул, составляющих основу межклеточного матрикса дермы — коллагена I, III, IV типа.
Общая характеристика: строение кожи пациенток укладывалось в варианты возрастной нормы. Наблюдались возраст-ассоциированные изменения гистоархитектоники коллагеново-эластического каркаса дермального слоя и снижение его прорегенераторного потенциала. Для иммуногистохимического окрашивания были приготовлены депарафинизированные и дегидратированные гистологические серийные срезы толщиной 4–6 мкм с помощью авидин-биотинового иммунопероксидазного метода, которые помещались на предметные полилизиновые стекла (Menzel, Германия). С целью верификации экспрессии использовали первичные антитела Anti-Collagen I antibody, Anti-Collagen III antibody, Anti-Collagen IV antibody в разведении 1:300 (Abcam, Великобритания).
Для оценки показателей экспрессии биомолекулярных маркеров коллагена I, III, IV типа использовали оценку реакции на 1 мм2 по средней интенсивности окрашивания (в процентах), а также оценку содержания в гистологических структурах дермального слоя.
Статистический анализ результатов проводили в программах Microsoft Excel 2007 и Statistica 13.3. Для проверки соответствия распределения показателей нормальному применяли критерий Шапиро — Уилка (W-тест). В качестве непараметрического теста для проверки статистической однородности нескольких выборок использовали однофакторный дисперсионный анализ (критерий Краскела — Уоллиса). Для выборок с выраженным разбросом параметров применяли U-критерий Манна — Уитни. Критический уровень достоверности нулевой гипотезы (об отсутствии значимых межгрупповых различий или факторных влияний) принимали равным 0,05.
Результаты и обсуждение
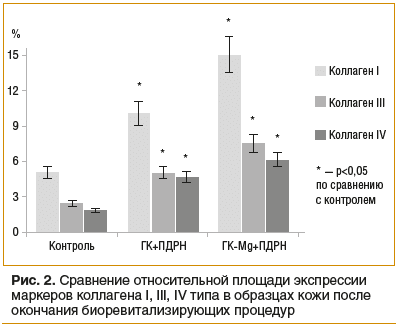
Уменьшение упругости отражает ухудшение функционального состояния кожи и является одним из самых объективных маркеров биологического старения. В косметологии при физиологическом потенцировании увеличения упругости ткани среднестатистический процесс обновления волокон коллагена занимает 40–60 дней [45]. Результаты терапии спустя 65 дней показали, что площадь экспрессии коллагена I, III, IV типа в интактной коже была в ≈3 раза ниже, чем в образцах кожи после окончания биоревитализирующих процедур препаратами ГК-Мg и ПДРН, что согласуется с данными литературы [36, 46–48]. Рисунок 2 наглядно отражает изменение экспрессии генов коллагена I, III, IV типа в экспериментальной группе по сравнению с контрольной группой. Полученные данные свидетельствуют о том, что исследуемый протокол сочетанного применения препаратов активирует синтез основных белков (коллаген I, III, IV типа) в пределах дермально-эпидермальной зоны и предположительно ведет к последующей регенерации межклеточного матрикса за счет активации способности синтезировать фибробластами компоненты экстрацеллюлярного матрикса в оптимальном количестве.
В соединительнотканных структурах кожи взрослого человека основу составляет интерстициальный фибриллярный коллаген I типа, располагающийся в сетчатом слое дермы. Коллаген III типа локализован в сосочковом слое, отличается меньшим диаметром, а также оплетает волокна коллагена I типа и активно синтезируется при регенерации. Коллаген IV типа участвует в формировании базальных мембран, где его макромолекулы формируют сетчатые структуры. Базальные мембраны участвуют в клеточной адгезии, обеспечивают взаимодействие клеток с микроокружением, а также дермально-эпидермальный контакт [45, 49, 50]. Из этого можно заключить, насколько важна биосинтетическая активность дермальных фибробластов человека для эстетически здорового вида кожных покровов.
Внеклеточный матрикс служит окружением для клеток, поддерживая их, что необходимо для формирования нормальной архитектуры ткани. В зависимости от биологической активности каждого компонента, внеклеточный матрикс может регулировать клеточную адгезию, выживание, пролиферацию, миграцию и дифференцировку [51]. В этом свете применение предложенного сочетанного протокола с добавлением хелатной формы магния в качестве поддержания качественных характеристик экстрацеллюлярного матрикса имеет ряд преимуществ по сравнению с известными протоколами комбинированных интрадермальных инъекций гелей на основе нативной ГК в сочетании с ПДРН.
Заключение
Таким образом, с возрастом происходят структурные изменения кожи, которые являются следствием изменений синтеза и/или распределения коллагена I, III, IV типа. Данные изменения на поверхности кожи выражаются в формах, характерных для стареющей кожи, а именно: нарушения микрорельефа, появление поверхностных складок и/или морщин. Результаты иммуногистохимического исследования, представленные в данной работе, подтвердили наше предположение об увеличении эффективности восстановления экспрессии ключевых белковых компонентов внеклеточного матрикса. Было показано, что предложенный протокол с использованием комбинированной терапии ГК-Мg и ПДРН активирует в фибробластах выработку коллагена I, III, IV типа — основных белков дермально-эпидермальной зоны. Результаты данного пилотного исследования продемонстрировали эффективность применения предложенного протокола коррекции для омоложения кожи, однако эти результаты требуют дальнейшего изучения.
Благодарность
Авторы выражают благодарность директору научно-исследовательского центра АНО «НИЦГК» к.х.н. Хабарову Владимиру Николаевичу за оказанную помощь при проведении данного исследования и написании настоящей статьи.
1Натриевая соль гиалуроновой кислоты — 6 мг/мл, натрия хлорид — 8,5 мг/мл, натрия гидрофосфат дигидрат — 3,5 мг/мл, натрия дигидрофосфат дигидрат — 0,4 мг/мл, магния хлорид гексагидрат — 0,015 мг/мл, вода для инъекций — до 1000 мг/мл.
2Полинуклеотиды 7,5 мг/мл, вода для инъекций, хлорид натрия, одноосновной дигидрат фосфата натрия, двухосновной додекагидрат фосфата натрия.
3Натриевая соль гиалуроновой кислоты — 6 мг/мл, в качестве вспомогательных веществ присутствуют: натрия хлорид — 8,5 мг/мл, натрия гидрофосфат дигидрат — 3,5 мг/мл, натрия дигидрофосфат дигидрат — 0,4 мг/мл, вода для инъекций — до 1000 мг/мл.
Информация с rmj.ru