Введение
Аортальный стеноз (АС) — одно из наиболее частых сердечно-сосудистых заболеваний в мире [1]. Хотя факторы риска АС схожи с факторами риска атеросклероза, проведенные ранее рандомизированные клинические исследования показали спорное влияние статинов и ингибиторов ренин-ангиотензин-альдостероновой системы на прогрессирование АС [2–4]. Таким образом, современное лечение сводится к выжидательному подходу, пока развитие тяжелого АС не станет поводом для хирургического или транскатетерного протезирования клапана [5]. С увеличением продолжительности жизни и старением населения АС стал одним из самых распространенных пороков сердца. Ранняя диагностика и лечение АС имеют первостепенное значение, поскольку симптоматическая тяжелая форма порока без лечения заболевания в большинстве случаев приводит к летальному исходу.
Появление технологий транскатетерной замены аортального клапана (АК) открывает возможности для оказания помощи пожилым пациентам с этим заболеванием, у которых традиционные хирургические процедуры не могут быть выполнены или связаны с высоким риском летального исхода.
Обновление клинических рекомендаций происходит каждые 3 года. Что это дает? Во-первых, за это время могут появиться обновленные данные по эпидемиологии заболевания; во-вторых, анализируются медикаментозный и хирургический подходы к ведению пациента, место малоинвазивных вмешательств при лечении АС; в-третьих, освещается роль высокотехнологичных методик (трехмерная эхокардиография (ЭхоКГ), компьютерная томография (КТ) и магнитно-резонансная томография (МРТ) сердца) в диагностике АС; в-четвертых, получены новые рекомендации по антитромботической терапии при АС после хирургических вмешательств, в том числе малоинвазивных, а также по бридж-терапии в периоперационном периоде и в долгосрочной перспективе; в-пятых, проводится стратификация рисков для определения сроков вмешательства и, собственно, сам выбор лечения: традиционная хирургическая коррекция или транскатетерная методика.
Содержание статьи
Эпидемиология АС
На сегодняшний день, к сожалению, нет полноценных сведений о распространенности АС в мире. Точные эпидемиологические данные о распространенности АС в Российской Федерации в настоящее время также отсутствуют. По данным J.J. Thaden et al. [6], в 2010 г. насчитывалось около 40 млн человек в возрасте 65 лет и старше с АС, ожидается, что в 2030 г. это число составит 72 млн. В США в той или иной форме клинически значимое заболевание клапанов имеют от 4,2 до 5,6 млн взрослых [7]. Хельсинкское скрининговое ЭхоКГ-исследование представило дополнительные доказательства увеличения кальцификации и дегенерации АК с возрастом [8]. Различная степень кальцификации АК была выявлена у 75% людей в возрасте 85–86 лет. Распространенность критического стеноза АК увеличивалась с возрастом — от 1–2% у лиц в возрасте 75–76 лет до 6% в возрасте 85–86 лет. По результатам 11 911 ЭхоКГ-исследований АС был диагностирован у 0,4% пациентов [7].
Классификация заболевания
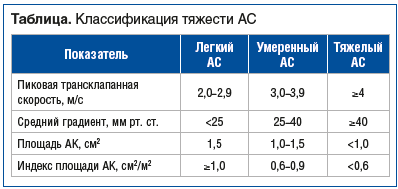
В таблице представлена классификация тяжести АС на основе данных внутрисердечной гемодинамики и осмотра [9, 10]. В российских клинических рекомендациях 2023 г.1 подчеркивается, что тактика ведения пациентов с АС, а это в первую очередь показания к хирургической коррекции, базируется на присутствии или отсутствии клинико-инструментальных симптомов. Стоит иметь в виду, что даже при умеренном стенозе, когда максимальная скорость кровотока не превышает 3,0 м/с, ежегодно отмечается увеличение максимальной скорости кровотока на 0,3 м/с, среднего градиента давления на 7 мм рт. ст. и уменьшение площади отверстия АК на 0,1 см2.
Клиническая картина АС
Длительное время заболевание может протекать бессимптомно и часто обнаруживается при проведении ЭхоКГ случайно. Поскольку нет патогномоничных симптомов, ранняя диагностика затруднена. Характерными симптомами, отражающими тяжесть порока, являются стенокардия и обмороки, нередко одышка, нарушения ритма сердца по типу желудочковой экстрасистолии и фибрилляции предсердий (ФП). Продолжительность жизни после появления вышеуказанных симптомов составляет 2–3 года [9, 11]. Известно, что внезапная смерть случается у пациентов с тяжелым АС. У бессимптомных пациентов согласно данным исследований внезапная смерть случается редко: менее чем у 1% пациентов с диагностируемым АС в год.
Согласно клиническим рекомендациям 2023 г.[1]
физикальное исследование должно включать пальпацию артерий шеи (выявление усиленного пульса на сонных артериях), измерение артериального давления (АД), аускультацию сердца и сосудов шеи (обнаружение патологических шумов и верификация диагноза).
К критериям АС, выявляемым при аускультации, относят следующие:
грубый систолический шум изгнания нарастающе-убывающий (типа крещендо-декрещендо);
громкий поздний систолический шум, распространяющийся на сонные артерии;
раздвоение (в том числе парадоксальное) второго тона;
медленный и малый пульс на сонной артерии;
одновременное уменьшение интенсивности II тона сердца.
Лабораторная диагностика АС
В клинических рекомендациях 2023 г. (в отличие от редакции 2020 г.) уделяется внимание лабораторной диагностике АС, которая включает в себя как рутинные исследования (клинический анализ крови, общий анализ мочи, биохимический анализ крови с оценкой липидограммы и коагулограммы), так и исследование уровня N-терминального мозгового натрийуретического пропептида (NT-proBNP) в крови с целью стратификации рисков летальности.
Инструментальная диагностика АС
Согласно клиническим рекомендациям 2023 г. выделяют неинвазивные и инвазивные методы диагностики.
К неинвазивным методам, используемым у всех пациентов с установленным диагнозом АС или подозрением на него, относятся: Электрокардиография (ЭКГ) (с целью выявления нарушений ритма и проводимости сердца, оценки признаков гипертрофии миокарда левого желудочка (ЛЖ)).
ЭхоКГ (с целью диагностики АС; оценки тяжести АС, толщины стенки ЛЖ, функции ЛЖ; динамического наблюдения за асимптомными пациентами с ранее диагностированным АС (без изменений с 2020 г.): каждый год для тяжелого АС, каждые 1–2 года для умеренного АС, каждые 3 года — 5 лет для легкого АС; определение сроков оперативного лечения).
Оценка АС проводится комплексно и включает:
измерение трансклапанного потока;
определение среднего трансклапанного градиента давления;
расчет эффективной площади клапана.
Точность измерения давления и потока особенно важна при сниженном сердечном выбросе и/или сниженном трансклапанном градиенте давления. Стресс-ЭхоКГ с добутамином (для оценки тяжести АС и «сократительной возможности миокарда» при низком градиенте / низкой скорости кровотока при наличии дисфункции ЛЖ (фракция выброса (ФВ) ЛЖ менее 50%). Чреспищеводная ЭхоКГ — новый метод исследования, прописанный в клинических рекомендациях 2023 г. (для оценки механизмов и тяжести АС при недостаточно информативной визуализации трансторакальной ЭхоКГ и интраоперационно — для оценки результатов реконструктивной операции на клапане). Холтеровское мониторирование ЭКГ — исследование, рекомендованное к проведению в клинических рекомендациях 2023 г. с целью диагностики сопутствующих нарушений ритма и/или проводимости при АС, а также в периоперационном периоде. Рентгенография органов грудной клетки (всем пациентам с подозрением на АС или при динамическом наблюдении с ранее установленным АС, для исключения других заболеваний сердца и крупных сосудов, а также внесердечной патологии). Нагрузочные тесты (проводятся только при асимптомном АС для выявления спровоцированных нагрузкой симптомов и неадекватной реакции АД). Магнитно-резонансная томография сердца (выполняется при подозрении на АС и при неадекватном качестве и/или спорных результатах ЭхоКГ). Компьютерная томография (выполняется при подозрении на АС для оценки выраженности стеноза, степени тяжести кальциноза и планиметрических измерений, важный метод диагностики при проведении транскатетерной имплантации АК). Позитронно-эмиссионная томография сердца и магистральных сосудов — исследование, которое впервые прописано в клинических рекомендациях 2023 г. Его рекомендовано проводить при АС с целью получения информации о структуре и функции сердца, когда результаты ЭхоКГ и МРТ неубедительны.
Ультразвуковое исследование органов брюшной полости перед операцией на АК с целью дообследования и получения информации о сопутствующей патологии.
К инвазивным методам диагностики АС относятся: МСКТ-ангиография коронарных артерий (альтернатива коронароангиографии перед оперативным вмешательством на АК при тяжелом пороке клапана и низкой вероятности ишемической болезни сердца (ИБС), а также при невозможности выполнения стандартной коронароангиографии). Коронароангиография (всем пациентам с АС для выявления гемодинамически значимых стенозов коронарных артерий перед протезированием АК (стандартным, транскатетерным или гибридным), если возраст пациентов старше 40 лет, имеют место ИБС, признаки ишемии миокарда, снижение ФВ ЛЖ). Катетеризация правых камер сердца (индивидуально в тех случаях, когда результаты данного исследования могут повлиять на тактику лечения).
Лечение
Основным методом лечения АС является хирургический. В то же время тщательная оценка факторов риска развития атеросклероза и влияние на них важны для профилактики сопутствующей ИБС.
Медикаментозное лечение
антибиотикопрофилактика при АС ревматического генеза; профилактика инфекционного эндокардита; лечение артериальной гипертензии (АГ) (при АС умеренной степени тяжести или у асимптомных пациентов терапия подбирается в соответствии с действующими рекомендациями по лечению АГ с медленной титрацией дозы под контролем АД. Препараты выбора — ингибиторы АПФ / сартаны);
гиполипидемическая терапия (с целью первичной и вторичной профилактики атеросклероза, основываясь на стандартных шкалах риска);
лечение сердечной недостаточности (диуретики, β-адреноблокаторы, ингибиторы АПФ, сердечные гликозиды).
Что нового в лечении пациентов АС, согласно клиническим рекомендациям 2023 г.?
В разделе медикаментозного лечения выделены следующие группы препаратов: дапаглифлозин/эмпаглифлозин (рекомендуются всем пациентам с симптомной сердечной недостаточностью и сниженной ФВ ЛЖ независимо от наличия или отсутствия сахарного диабета).
Также добавлены данные о применении антикоагулянтов у пациентов с АС при различных ситуациях. В частности, антикоагулянтная терапия показана всем пациентам с имплантированными биопротезами, а также после транскатетерной имплантации АК (ТИАК) при наличии дополнительных показаний к антикоагулянтной терапии, таких как ФП, венозные тромбозы, гиперкоагуляция и хроническая сердечная недостаточность с низкой (<35%) ФВ ЛЖ. С целью профилактики тромботических осложнений в сочетании с ФП рекомендован прием прямых оральных антикоагулянтов (ПОАК), а не антагонистов витамина К (АВК). ПОАК также рекомендованы пациентам с ФП через 3 мес. после пластики АК биологическим протезом.
Пациентам, перенесшим имплантацию механического клапана, показана пожизненная антикоагулянтная терапия АВК — варфарином. В этой ситуации варфарин назначается под строгим контролем МНО (целевые значения: от 2 до 3 без факторов риска тромбоэмболических осложнений и 2,5–3,5 при наличии >1 фактора риска).
Ацетилсалициловая кислота (АСК) в дозе 75–100 мг/сут или варфарин в качестве антикоагулянтов рекомендованы также пациентам, не имеющим показаний к антикоагулянтной терапии, в первые 3 мес. после протезирования АК. Кроме того, АСК может быть добавлена к варфарину при развитии тромбоэмболических осложнений, несмотря на поддержание необходимых значений МНО или при наличии сопутствующего атеросклероза при условии низких рисков кровотечений.
Пациентам с механическим протезом АК рекомендуется добавление низких доз АСК (75–100 мг/сут) к варфарину после аортокоронарного шунтирования в течение 12 мес. начиная от даты операции. Если после пластики АК или ТИАК у пациента нет показаний к антикоагулянтной терапии, рекомендуется назначить низкие дозы АСК (75–100 мг).
Тройная антитромботическая терапия (АСК в дозе 75–100 мг/сут, клопидогрел в дозе 75 мг/сут и варфарин) должна проводиться в течение 1 нед. у пациентов с имплантированными коронарными стентами и механическим протезом АК и высоким геморрагическим риском. При высоком ишемическом риске такая терапия должна быть продлена от 14 до 30 дней. После этого проводится отмена АСК и далее продолжается комбинированное лечение (клопидогрел и варфарин) в течение 6 мес. при высоких и 12 мес. при низких геморрагических рисках с последующим переходом на монотерапию варфарином пожизненно.
Хирургическое лечение
В целом хирургическая коррекция порока АК является основным способом лечения данной патологии. В отличие от клинических рекомендаций 2020 г., в редакции 2023 г. проведено разделение пациентов для протезирования на симптомных и асимптомных.
Согласно предлагаемым клиническим рекомендациям 2023 г. у симптомных пациентов показаниями к хирургическому лечению являются:
тяжелый, высокоградиентный АС (средний градиент более 40 мм рт. ст., скорость на АК более 4 м/с и площадь АК менее 1 см2 или расчетная площадь АК менее 0,6 см2/м2);
тяжелый низкопотоковый (Svi менее 35 мл/м2), низкоградиентный (менее 40 мм рт. ст.) АС со сниженной ФВ ЛЖ (менее 50%) и признаками сохраненного сократительного резерва миокарда.
Если предполагается, что такое лечение не улучшит качество жизни или не увеличит ожидаемую продолжительность жизни более чем на 1 год у пациентов с тяжелой сопутствующей патологией, то хирургическое вмешательство не рекомендуется.
Согласно предлагаемым клиническим рекомендациям 2023 г. у асимптомных пациентов выделяют следующие показания к хирургическому лечению:
тяжелый АС со сниженной ФВ ЛЖ (<55%);
тяжелый АС и положительный нагрузочный тест (появление симптомов при нагрузке или снижение АД >20 мм рт. ст. при нагрузке).
Вместе с тем оперативное лечение может быть рекомендовано и при сохраненной ФВ ЛЖ у асимптомных пациентов при соблюдении следующих условий:
критический АС (средний градиент более 60 мм рт. ст. или скорость потока на АК более 5 м/с);
тяжелый кальциноз АК или увеличение максимальной скорости на АК >0,3 м/с в год;
уровень BNP/NTproBNP более чем в 3 раза выше нормы.
Стратегия лечения и выбор способа вмешательства при тяжелом АС представлены на рисунках 1, 2.
![Рис. 1. Ведение пациентов с тяжелым АС [12] Рис. 1. Ведение пациентов с тяжелым АС [12]](https://medblog.su/wp-content/uploads/2024/04/1712833900_457_Vedenie-patsientov-s-aortalnym-stenozom-chto-novogo-v-klinicheskih-rekomendatsiyah.png)
![Рис. 2. Факторы, влияющие на способ вмешательства при АС [13] Рис. 2. Факторы, влияющие на способ вмешательства при АС [13]](https://medblog.su/wp-content/uploads/2024/04/1712833900_23_Vedenie-patsientov-s-aortalnym-stenozom-chto-novogo-v-klinicheskih-rekomendatsiyah.png)
Протезирование АК
У взрослых пациентов с тяжелым симптомным кальцинированным АС протезирование АК (ПАК) является единственным эффективным лечением. При этом молодым пациентам с врожденным или ревматическим АС допустимо выполнение вальвулотомии.
Согласно клиническим рекомендациям 2023 г. при выборе типа искусственного клапана сердца стоит учитывать: возможности продленной антикоагулянтной терапии, предполагаемую продолжительность жизни пациента, наличие сопутствующих заболеваний, планирование беременности.
Протезирование механическим протезом показано в следующих ситуациях:
отсутствуют противопоказания к длительной антикоагулянтной терапии либо пациенты уже получают антикоагулянты в связи с наличием рисков тромбоза (ФП, предшествующие тромбоэмболические осложнения, антифосфолипидный синдром);
у пациента уже имеется механический клапан с другой локализацией;
у пациентов старше 65 лет, когда продолжительность жизни предполагается больше срока службы биопротеза;
при сопутствующей патологии, способствующей быстрой деградации биологического протеза (гиперпаратиреоз, гемодиализ).
Протезирование биологическим протезом показано:
при наличии противопоказаний к длительной антикоагулянтной терапии либо когда нет уверенности в эффективной антикоагулянтной терапии или она противопоказана;
пациентам старше 70 лет или с ожидаемой продолжительностью жизни меньше, чем срок службы протеза;
при тромбозе механического протеза, несмотря на корректную длительную антикоагулянтную терапию;
при планировании беременности;
пациентам моложе 75 лет, которым не показана ТИАК или у которых низкий риск хирургического вмешательства (STS-31 PROM/EuroSCORE II менее 4%).
Катетерная баллонная аортальная вальвулопластика (КБАВ) в настоящее время рассматривается в основном при лечении пациентов молодого возраста (подростки, юноши). У возрастных пациентов этот вариант лечения стоит рассматривать как вариант этапной операции перед ПАК или ТИАК, а также как паллиативную помощь, когда хирургическое вмешательство противопоказано, либо как бридж-терапию перед ПАК или ТИАК в случаях, когда необходимо немедленное оказание помощи пациенту. Это обусловлено тем, что площадь клапана после КБАВ редко превышает 1 см2, а ранние осложнения встречаются с частотой более чем 10% [14], при этом у большинства пациентов рестеноз и клиническое ухудшение наблюдаются в течение 6–12 мес. после вмешательства.
Лечение стеноза АК претерпело радикальные изменения с появлением транскатетерной его замены. Однако применение данной методики тоже имеет свои ограничения. Выбор между стандартным кардиохирургическим и транскатетерным вмешательством рекомендуется проводить мультидисциплинарной командой, основываясь на оценке клинических, анатомических, хирургических факторов, учитывая риски и преимущества индивидуально у каждого конкретного пациента. ТИАК рекомендуется проводить в кардиохирургических отделениях мультидисциплинарной командой.
Согласно клиническим рекомендациям 2023 г. выделяют следующие показания к ТИАК:
пациенты старше 75 лет или с высоким риском вмешательства (STS-PROM/EuroSCORE II более 8%) либо не подходящие для выполнения открытого кардиохирургического лечения;
тяжелый АС и ожидаемая продолжительность жизни пациента больше одного года, при этом ожидается улучшение качества жизни пациента;
пациенты высокого риска с тяжелым симптомным АС, у которых, с учетом индивидуальных рисков, ТИАК признана методом выбора;
в случае, когда использование трансфеморального доступа для проведения ТИАК невозможно, рекомендуется использовать подключичный, сонный, транскавальный или трансапикальный доступ;
пациенты после ранее установленного биопротеза методом «клапан-в-клапан».
В клинических рекомендациях 2023 г. также прописано, когда не стоит применять ТИАК, а именно: если фиброзное кольцо АК не соответствует типу протеза, имеются активный инфекционный эндокардит, тромб в ЛЖ, повышенный риск обструкции коронарных артерий, выраженный атероматоз восходящей аорты с флотирующими тромбами и повышенный риск эмболии, если имеются анатомические особенности, которые препятствуют проведению ТИАК (например, патологическая извитость или тяжелый стеноз бедренных, подвздошных артерий, брюшной аорты), при двустворчатом АК, умеренном кальцинозе клапана, ИБС, которая требует реваскуляризации, ФВ ЛЖ <20%, при тяжелом заболевании легких, препятствующем выделению верхушки сердца, а также при наличии сопутствующей патологии, ставящей под сомнение ожидаемую пользу от хирургической коррекции порока.
Профилактика и диспансерное наблюдение
В клинических рекомендациях 2023 г. всем пациентам с АС, а также после протезирования АК рекомендуется пожизненное наблюдение у кардиолога, в случае отсутствия кардиолога — у врача-терапевта или врача общей практики.
У пациентов с выраженным/тяжелым приобретенным клапанным пороком сердца осмотр кардиологом (врачом-терапевтом в случае отсутствия кардиолога) и выполнение ЭхоКГ проводятся 2 раза в год, у остальных — ежегодно. После операции первый амбулаторный осмотр кардиологом должен быть осуществлен через 2–4 нед. после выписки из стационара с выполнением ЭхоКГ для ранней диагностики осложнений.
Заключение
Аортальный стеноз является распространенным заболеванием, и ожидается, что его распространенность будет увеличиваться по мере старения населения. У большинства пациентов моложе 70 лет основной причиной стеноза АК является двустворчатый АК, а у пациентов старше 70 лет — дегенеративные изменения трехстворчатого АК. Помимо старения, клинические факторы риска развития АС сходны с факторами риска развития атеросклероза и включают АГ, гиперлипидемию и сахарный диабет. Лекарственная терапия для коррекции основных сердечно-сосудистых факторов риска и симптомов не изменяет неблагоприятного прогноза тяжелого АС, и единственной эффективной терапией является ПАК. ТИАК появилась как альтернатива классической хирургической ПАК у пациентов со стенозом трехстворчатого АК и со средним, высоким или запредельным риском операции на открытом сердце. Транскатетерные сердечные клапаны служат до 5 лет, данные о более длительном сроке действия еще не получены.
Продолжаются исследования, изучающие эффективность ТИАК в группах низкого риска с тяжелым АС, у пациентов с умеренным АС и сниженной ФВ ЛЖ (<50%), а также с тяжелым АС вследствие стеноза двустворчатого клапана аорты. Возможно, что следующие клинические рекомендации будут опираться на результаты таких исследований. Список литературы Вы можете найти на сайте http://www.rmj.ru
Информация с rmj.ru
