Введение
Анемия беременных является повсеместной проблемой, не теряющей своей актуальности в настоящее время. Физиологические изменения, возникающие во время беременности, приводят к так называемой «дилюционной» анемии: объем плазмы увеличивается при доношенном сроке на 40–50%, однако масса эритроцитов увеличивается в меньшей степени — на 15–20% [1].
Одновременно с процессами гемодилюции во время беременности возрастает потребность в железе в прямой зависимости от срока гестации. В I триместре необходимо примерно 1–2 мг железа в день. Это количество аналогично нормальным потребностям вне беременности. Ко II триместру потребность увеличивается до 4–5 мг/сут из-за необходимости увеличения формирования эритроцитов у матери и плода, роста плаценты и плода. В III триместре потребность увеличивается примерно до 6 мг/сут [2]. Суммарная потребность в железе при одноплодной беременности составляет около 1000 мг, при этом 300 мг уходит на рост плода и плаценты, 500 мг необходимо для поддержания адекватного уровня материнского гемоглобина, 200 мг перераспределяется между пищеварительным трактом, мочевыделительной системой и кожными покровами. Это количество — 1000 мг — существенно превышает запасы железа у беременных (рис. 1). При сочетании увеличения объема циркулирующей крови и возрастающей потребности в железе во II триместре дефицит железа может проявляться снижением уровня гемоглобина. В III триместре увеличивается расход железа на нужды плода, при этом количество железа, транспортируемого плоду, при анемии матери остается нормальным [4].
![Рис. 1. Потребность в железе во время беременности (адаптировано по [3]) Fig. 1. Iron requirements in pregnancy (adapted from [3]) Рис. 1. Потребность в железе во время беременности (адаптировано по [3]) Fig. 1. Iron requirements in pregnancy (adapted from [3])](https://medblog.su/wp-content/uploads/2024/03/Novye-podhody-v-lechenii-i-profilaktike-anemii-beremennyh-Dobrohotova.png)
Второй, наиболее распространенной причиной анемии во время беременности после гемодилюции является дефицит железа. Железодефицитная анемия (ЖДА) занимает одно из ведущих мест в структуре экстрагенитальных заболеваний беременных. Несмотря на организацию профилактических программ в развитых странах, заболеваемость ЖДА не снижается, а, наоборот, имеет тенденцию к увеличению. Частота ЖДА у беременных в мире колеблется от 5,4% в развитых странах до более чем 80% в развивающихся странах. В Российской Федерации ЖДА наблюдается у 6–30% населения. Анемия беременных более чем в 90% случаев является железодефицитной, при этом частота выявления ЖДА зависит от уровня социально-экономического развития региона [5].
К факторам риска развития ЖДА во время беременности можно отнести: увеличение потребности в железе, недостаточное количество железа в рационе, кровопотери в результате предыдущих беременностей и/или менструаций, а также короткий интервал между родами; состояния, которые препятствуют адекватному потреблению железа или ухудшают его всасывание (тошнота и рвота во время беременности, воспалительные заболевания кишечника, бариатрическая хирургия и др.).
Другие причины анемии во время беременности встречаются гораздо реже, это различные гемоглобинопатии, такие как талассемия; серповидно-клеточная анемия, нарушения мембраны эритроцитов, приобретенные анемии (дефицит фолата, витамина В12, аутоиммунный гемолиз, гипотиреоз, хронические заболевания почек) и др. [5].
Во время беременности необходимо отличать ЖДА от физиологического снижения уровня железа, а также проводить дифференциальную диагностику с другими причинами анемии, которые могут потребовать терапии.
Анемия беременных как фактор риска развития акушерских и перинатальных осложнений
Неспособность поддерживать необходимый уровень железа во время беременности может приводить к неблагоприятным акушерским и перинатальным осложнениям. Исследование [6], проведенное в Китае, в котором было оценено более 18 млн беременностей, выявило, что анемия возникает из-за дефицита железа у 70% беременных, отмечается связь между анемией и неблагоприятными исходами для матери, такими как:
преждевременная отслойка плаценты (скорректированное отношение шансов (СОШ) 1,36 при легкой анемии, 1,98 — при умеренной анемии, 3,35 — при тяжелой анемии);
преждевременные роды (СОШ 1,08, 1,18 и 1,36 при легкой, умеренной и тяжелой анемии соответственно);
послеродовые кровотечения (СОШ 1,45, 3,53 и 15,65 при легкой, умеренной и тяжелой анемии соответственно);
развитие шока у матери (СОШ 1,50 при умеренной анемии, 14,98 — при тяжелой анемии);
поступление матерей в отделение интенсивной терапии (CОШ 1,08 при умеренной анемии, 2,88 — при тяжелой анемии).
Исследование ВОЗ [7] документально подтвердило, что тяжелая антенатальная или послеродовая анемия любого типа у матери была связана с повышенным риском материнской смертности (СОШ 2,36).
Была выявлена корреляция: новорожденные от матерей с дефицитом железа подвергаются высокому риску развития дефицита железа при рождении. Вместе с тем развитие отдаленных осложнений у детей показало когортное исследование [8], проведенное в Швеции: риск развития у детей расстройств психоневрологического спектра, таких как синдром дефицита внимания, гиперактивность и умственная отсталость, повышался тогда, когда анемия у беременных была выявлена в первые 30 нед. беременности, по сравнению с выявлением анемии после 30 нед. или отсутствием данной патологии (СОШ 1,4 и 2,2 соответственно).
Диагностика анемии во время беременности
Согласно клиническим рекомендациям «Нормальная беременность» всем беременным проводят скрининг на выявление анемии с помощью клинического анализа крови при первом визите пациентки, во II и III триместрах беременности1.
Нормальный уровень гемоглобина в I триместре составляет ≥110 г/л, в III триместре — ≥105 г/л. Для подтверждения латентного дефицита железа может быть рекомендовано определение уровня сывороточного ферритина как наиболее точного показателя содержания железа. При диагностике ЖДА у большинства беременных без сопутствующих заболеваний достаточно проверить уровень ферритина в сыворотке. Если уровень низкий (<30 нг/мл), этого достаточно для подтверждения диагноза дефицита железа. Пограничные уровни сывороточного ферритина могут находиться в диапазоне от 30 до 40 нг/мл при хронических заболеваниях, таких как сахарный диабет, или, наоборот, выше референтных значений — до 100 нг/мл при хронических заболеваниях почек или аутоиммунных заболеваниях, таких как системная красная волчанка или ревматоидный артрит. Это обусловлено тем, что ферритин является маркером воспалительной реакции. Таким образом, пограничные уровни ферритина должны требовать расширенного исследования, включая ферритин, сывороточное железо, общую железосвязывающую способность сыворотки и расчет коэффициента насыщения трансферрина железом. Коэффициент насыщения трансферрина железом ниже 20% свидетельствует о дефиците железа, независимо от того, низкий или нормальный уровень ферритина. Хотелось бы отметить, что у некоторых пациенток с дефицитом железа уровень ферритина в сыворотке может быть в пределах нормы и для диагностики дефицита железа может потребоваться исследование уровня трансферрина сыворотки крови [9]. Это особенно актуально, если есть заболевания воспалительного генеза, которые могут стать причиной повышения уровня ферритина, поскольку он является маркером воспалительной реакции.
Дискуссионным остается вопрос расширенного обследования на дефицит железа у беременных с нормальными показателями гемоглобина с помощью других клинико-лабораторных показателей. Однако можно рассмотреть необходимость проведения расширенного обследования у лиц высокого риска: с ЖДА в анамнезе, сахарным диабетом, курением, ВИЧ-инфекцией, воспалительным заболеванием кишечника, у повторнородящих (особенно с интервалом между беременностями менее 6 мес.), с маточными кровотечениями в анамнезе, индексом массы тела выше или ниже нормального диапазона, у вегетарианок. В пользу проведения скрининга на дефицит железа говорит выполненное в Канаде ретроспективное исследование [10] с участием 44 552 беременных, прошедших пренатальное тестирование. Ферритин проверяли у 59% женщин, в большинстве случаев в I триместре. Уровень ферритина был низким (<30 нг/мл) примерно у 53% обследованных, пограничным (от 30 до 44 нг/мл) у 25%, нормальным у 20% и выше референтных значений примерно у 4%. Тяжелый дефицит железа (ферритин <15 нг/мл) наблюдался у 24%. Базовый клинический анализ крови был проведен только у 75% пациенток. Из тех, кто сдал анализ на гемоглобин, у 8% была анемия (определяемая как снижение уровня гемоглобина <105 г/л), и только четверть из тех, кто страдал анемией, прошли тест на содержание ферритина.
Специальная группа профилактических служб США (USPSTF) отметила, что определение сывороточного ферритина может иметь ограниченное применение на поздних сроках беременности, так как его концентрация часто снижается с увеличением гестационного возраста, поскольку запасы железа матери используются для обеспечения железом плацентарного и внутриплодового кровообращения [11].
Наиболее полное клинико-лабораторное обследование отражено в клинических рекомендациях2: всем пациенткам с анемическим синдромом с целью диагностики ЖДА рекомендуется, кроме выполнения общего (клинического) анализа крови (с оценкой гематокрита, содержания эритроцитов, уровня ретикулоцитов, с определением размеров эритроцитов и среднего содержания и средней концентрации гемоглобина в эритроцитах), проводить исследование сывороточных показателей обмена железа — ферритина, трансферрина, железосвязывающей способности сыворотки, железа с определением коэффициента насыщения трансферрина железом для верификации абсолютного дефицита железа.
Содержание статьи
Дифференциальная диагностика
У беременных с анемией проводят диагностический поиск. Детали анализа зависят от анамнеза и данных клинико-лабораторного обследования (табл. 1). Например, в клиническом анализе крови может присутствовать микроцитоз, который, однако, является поздним проявлением дефицита железа и может быть вызван также талассемией. Таким образом, отсутствие микроцитоза не исключает, а наличие микроцитоза не подтверждает дефицита железа.
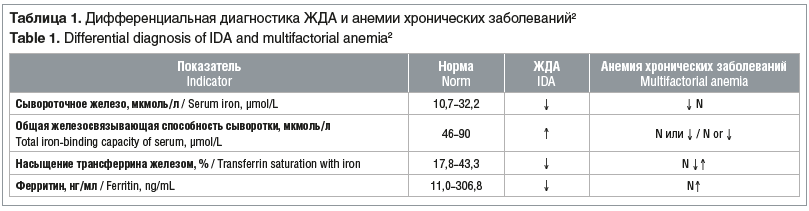
Примеры отличительных признаков, свидетельствующих не в пользу ЖДА, при проведении дифференциальной диагностики ЖДА:
-
выраженный микроцитоз (например, средний объем эритроцитов <80 фл), что указывает на талассемию;
-
макроцитоз (средний объем эритроцитов >100 фл), указывающий на дефицит витамина B12 или фолиевой кислоты либо ретикулоцитоз вследствие гемолиза;
-
другие цитопении, такие как тромбоцитопения или нейтропения;
-
аномально высокое количество лейкоцитов или тромбоцитов;
-
аномальная морфология эритроцитов или лейкоцитов;
-
неэффективная терапия анемии и др.
Физиологическая анемия беременности является диагнозом исключения, поэтому необходимо выявлять и устранять другие причины анемии.
Профилактика ЖДА беременных
В Российской Федерации согласно клиническим рекомендациям «Нормальная беременность»1 не рекомендовано рутинно назначать препараты железа беременным при нормальном уровне гемоглобина. При этом пациенткам группы риска развития латентного железодефицита и ЖДА (у которых невозможно устранить причину развития железодефицитного состояния, соблюдающим вегетарианскую или веганскую диету) рекомендовано назначать профилактические дозы лекарственных препаратов железа. В международной практике регламентируется дополнительное обеспечение беременных железом перорально в суточной дозе 27–30 мг на протяжении всей беременности, чтобы компенсировать повышенную потребность в железе во время беременности, — это считается профилактической дозой и соответствует количеству железа в большинстве железосодержащих витаминов для беременных [1]. Такая профилактика позволяет большинству беременных получать железо из железосодержащих пренатальных витаминов. Женщине с массой тела около 55 кг требуется примерно 1 г дополнительного железа в период от зачатия до родов, что включает 300–350 мг для плода и плаценты, 500 мг для увеличения массы материнских эритроцитов и 250 мг для физиологической кровопотери во время родов и в послеродовом периоде [12]. Добавки и препараты железа соответственно должны превышать эту потребность в 1 г, учитывая, что усваивается лишь некоторая часть поступающего железа. Кохрейновский обзор 2015 г., включающий в себя 61 исследование с участием 43 274 женщин, привел к выводам, что «добавки железа значительно снижают риск материнской анемии и дефицита железа во время беременности; положительное влияние данных добавок на другие исходы для матери и ребенка менее очевидно» [13].
Лечение ЖДА беременных
Препаратом первой линии у большинства беременных с дефицитом железа, особенно диагностированным в I триместре, служит пероральное железо. Стандартным лечением неосложненного дефицита железа (независимо от уровня гемоглобина) является введение железа в дозах, превышающих те, которые содержатся в витаминах и добавках железа для беременных. Лечение дефицита железа, начатое после постановки диагноза, может быть слишком запоздалым, чтобы предотвратить наступление некоторых неблагоприятных последствий. Лечение и коррекция дефицита железа до III триместра являются идеальным условием, поскольку железозависимый нейрогенез у плода максимален в III триместре и в раннем неонатальном периоде, а дефицит железа в этот период, как было отмечено выше, связан с нарушениями нейрокогнитивного развития [14].
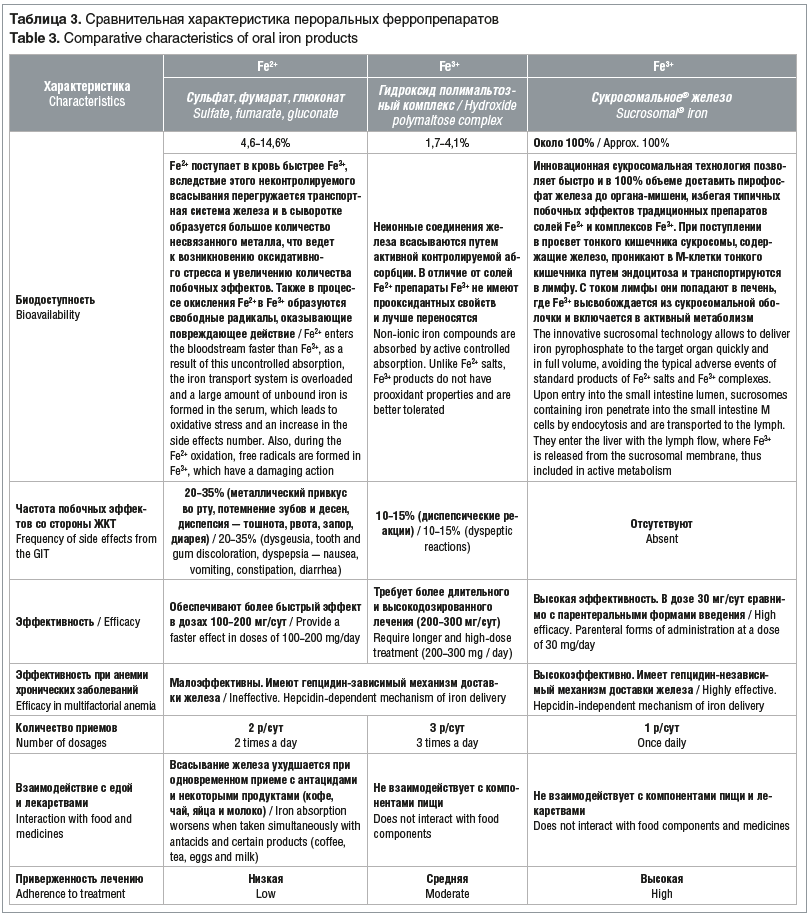
Пероральные ферропрепараты в зависимости от химического строения можно разделить на препараты двухвалентного железа (Fe2+; органические и неорганические соли железа) и трехвалентного железа (Fe3+; железосодержащие комплексы — хелаты, такие как протеин сукцинилат и гидроксид полимальтозный комплекс). На сегодняшний день в Российской Федерации представлены железосодержащие препараты, в которых железо содержится в составе разных композиций. Первая группа имеет ряд серьезных побочных эффектов, особенно это относится к сульфату железа, так как он является сильным раздражителем слизистой желудочно-кишечного тракта (ЖКТ) и до 70% тех, кому его назначают, сообщают о выраженных нарушениях в работе ЖКТ. Два масштабных метаанализа пероральной терапии железом во время беременности сообщают о высокой частоте побочных эффектов со стороны ЖКТ, таких как боли в эпигастральной области, запор, понос, тошнота, рвота, взаимодействие с другими лекарственными препаратами и пищей, выраженный металлический привкус, окрашивание эмали зубов и десен [15]. Fe2+ поступает в кровь быстрее, чем Fe3+, вследствие этого неконтролируемого всасывания перегружается транспортная система железа и в сыворотке появляется большое количество несвязанного железа, что обусловливает развитие оксидативного стресса и увеличение количества побочных эффектов. Также в процессе окисления Fe2+ в Fe3+ образуются свободные радикалы, обладающие повреждающим действием.
Более совершенны препараты второй группы, обладающие высокой усвояемостью и лучшей переносимостью. Неионные соединения железа всасываются путем активной контролируемой абсорбции. В отличие от солей Fe2+, препараты Fe3+ не имеют прооксидантных свойств и лучше переносятся. Современные препараты Fe3+ имеют следующие свойства и преимущества: высокая безопасность, отсутствие риска передозировки, интоксикации и отравлений; отсутствие потемнения десен и зубов; приятный вкус; лучшая переносимость; высокая комплаентность; отсутствие взаимодействия с другими лекарственными средствами и продуктами питания; наличие антиоксидантных свойств [4]. Однако ввиду низкой биодоступности эффективность препаратов Fe3+ также довольно низкая [4, 16].
Особое внимание следует уделить дозам элементарного железа в составе различных препаратов для лечения ЖДА. Поскольку транспорт железа в энтероцит — процесс насыщаемый, т. е. энтероцит не может принять больше железа, чем способна его ферментативная система, использование больших доз железа в препаратах неоправданно. Неконтролируемый прием железосодержащих препаратов может иметь неблагоприятные последствия, так как хроническая перегрузка железом не менее опасна, чем его дефицит. В связи с этим при выборе терапии железодефицита, особенно у беременных, необходимо оценивать дозу элементарного железа в составе препарата. В Российской Федерации принят диапазон доз от 80 до 300 мг элементарного железа. Представленные в настоящее время на отечественном рынке препараты содержат эти рекомендуемые дозы [4]. Существует тенденция к использованию доз нижнего предела этого диапазона, а также к приему через день в связи с признанием того, что более высокие и более частые дозы могут усиливать побочные эффекты без улучшения усвоения железа. В то же время есть доказательства того, что прием препарата через день приводит к увеличению всасывания перорального железа на фоне лучшей переносимости [17]. Таким образом, варианты улучшения переносимости включают увеличение интервала между приемами, переход на жидкие пероральные формы или внутривенное введение железа (во II или III триместре). Также всасывание железа можно улучшить, если избегать употребления кофе, чая и молока во время приема железосодержащих добавок и препаратов [18].
Вводить препараты железа внутривенно можно беременным, которые не переносят пероральные препараты железа, у кого тяжелая анемия (особенно на поздних сроках беременности) или недостаточно времени для восполнения запасов железа перорально, а также пациенткам с анатомическими особенностями (состояние после бариатрической хирургии или другие заболевания, которые мешают пероральной абсорбции железа — воспалительные заболевания кишечника, такие как болезнь Крона, язвенный колит), и тем, у кого пероральное железо не способствует эффективному повышению уровня гемоглобина и/или ферритина [12]. Внутривенное введение ферропрепаратов не проводится в I триместре. Некоторые эксперты используют внутривенное введение железа во второй половине беременности из-за опасений, что пероральное введение железа не обеспечит развивающийся плод достаточным количеством железа [12]. И наоборот, нежелание некоторых врачей использовать внутривенные препараты железа основано на опасениях возникновения выраженных аллергических реакций.
Все препараты железа для внутривенного введения обладают одинаковой безопасностью и эффективностью, о чем свидетельствуют различные исследования, включая исследования монопрепаратов и прямое сравнение различных препаратов у беременных и небеременных (табл. 2) [19–21].
![Таблица 2. Преимущества и недостатки перорального и внутривенного приема препаратов железа [22–25] Table 2. Benefits and drawbacks of taking iron orally versus intravenous administration [22–25] Таблица 2. Преимущества и недостатки перорального и внутривенного приема препаратов железа [22–25] Table 2. Benefits and drawbacks of taking iron orally versus intravenous administration [22–25]](https://medblog.su/wp-content/uploads/2024/03/1710456823_531_Novye-podhody-v-lechenii-i-profilaktike-anemii-beremennyh-Dobrohotova.png)
Эффективность терапии
Ожидаемым ответом на восполнение дефицита железа являются повышение выработки эритроцитов, которое обычно начинается с ретикулоцитоза примерно через 1 нед. после начала терапии, повышение уровня гемоглобина как минимум на 1 г/дл в течение 2–3 нед. и увеличение уровня сывороточного ферритина обычно в течение 3 нед. Реакция на терапию не зависит от пути введения (перорально или внутривенно) и в основном определяется временем, необходимым для включения железа в предшественники эритроцитов и их созревания до зрелых, циркулирующих эритроцитов. Потенциальными причинами отсутствия ответа могут быть несоблюдение режима лечения, снижение абсорбции, продолжающееся кровотечение или причина анемии, отличная от дефицита железа [1].
У беременных, получающих пероральные препараты железа, проверяют уровень гемоглобина и количество ретикулоцитов через 2–3 нед. после начала терапии. Если ожидаемый ответ наступил и пероральный препарат железа хорошо переносится, его прием можно продолжать на протяжении всей беременности и в послеродовом периоде [26].
Новые подходы к пероральной терапии железодефицитных состояний
Многие доступные в настоящее время пероральные препараты железа характеризуются низкой комплаентностью из-за непереносимости, наличия побочных эффектов и противопоказаний. Внутривенное введение препаратов железа инвазивно, может быть болезненно, требует наблюдения за пациентом и сопряжено с риском развития анафилаксии.
Идеальный пероральный препарат железа должен отвечать следующим требованиям:
-
обладать высокой биодоступностью, т. е. терапевтической эффективностью, быть удобным в применении;
-
не вступать во взаимодействие с пищей и лекарствами, минимально влиять на работу ЖКТ и не вызывать или иметь низкую частоту побочных эффектов.
В рамках поиска такого лекарственного средства большой клинический интерес представляет уникальный в своем роде СидерАЛ® Форте — специализированный продукт лечебно-профилактического питания при анемии, инновационный легкоусвояемый источник железа. В отличие от классических препаратов перорального железа он создан на основе сукросомального железа (СЖ). Инновационная сукросомальная технология позволяет быстро и в 100% объеме доставить пирофосфат железа в орган-мишень, избегая типичных побочных эффектов традиционных препаратов солей Fe2+ и комплексов Fe3+.
Сукросомы — микроскопические сферические частицы, пузырьки (диаметром 20–30 нм), заполненные жидкостью. Каждая сукросома состоит из трех слоев: внутреннего, среднего и наружного.
Внутренний слой представлен ядром, которое содержит активное вещество — пирофосфат железа (Fe3+), который, имея высокую тропность к трансферрину, обеспечивает полноценную доставку железа всем клеткам организма независимо от регулирующих патологических воспалительных процессов.
Средний слой — липосомальный — образован бислойной липидной мембраной (оболочкой), которая состоит из молекул тех же природных фосфолипидов, что и клеточные мембраны.
Сукрестор — оболочка из эфира сахарозы — покрывает липосомальную оболочку снаружи. Присутствие сукрестора позволяет СЖ быть устойчивым к кислой среде желудка и проходить через него в неизменной форме без побочных эффектов, вызванных взаимодействием железа со слизистой оболочкой желудка и кишечника.
Механизмы усвоения липосом были раскрыты в серии экспериментальных и клинических исследований, выполненных в 1970–1980-е годы. Липосомы состоят из природных липидов, поэтому нетоксичны и биодеградируемы. Это «транспортные средства» для доставки лечебных агентов в орган-мишень. До недавнего времени все уникальные свойства СидерАЛ® Форте объясняли липосомальной структурой, не придавая значения сукрестору. Однако в ходе научных исследований было выявлено, что сукрестор имеет большое значение в обеспечении устойчивости липосомы, защищая ее от действия желудочного сока. Тем самым обеспечивается высокая биодоступность наночастицы. Ученые предложили дать новое название липосоме, «обернутой» в сукрестор, — «сукросома». Технология производства СЖ и сам термин «сукросомальное железо» были запатентованы компанией-производителем СидерАЛ® Форте. Основной фармакологической особенностью и преимуществом этой формы является оригинальный механизм всасывания. При поступлении в ЖКТ СЖ не идентифицируется, так как находится в защитном окружении сукросомы. Преодолев желудочный барьер, наносфера достигает тонкого кишечника, где полностью абсорбируется через парацеллюлярные и трансклеточные пути с помощью М-клеток, которые контролируют поступление макромолекулярных комплексов, обладающих чужеродными для организма антигенными свойствами на всем протяжении тонкого кишечника. Они поглощают сукросому путем эндоцитоза, при этом оставляя содержимое наносферы без каких-либо изменений. Затем через базальную мембрану сукросома передается макрофагу, который с лимфой доставляет ее в печень. В клетках печени происходит биодеградация сукросом и высвобождение Fe3+, которое депонируется в составе ферритина и используется в дальнейшем для построения гема (в костном мозге). Железо в сукросоме становится более устойчивым в организме, так как изолировано от повреждающих воздействий внешних условий, в частности от разрушения в ЖКТ или взаимодействия с химическими веществами, и, в свою очередь, не оказывает общего токсического действия на организм [27–29].
Запатентованная сукросомальная технология позволяет избежать побочных эффектов, распространенных при приеме препаратов железа: изжоги, раздражения кишечника, расстройства стула (запор, понос), окрашивания слизистой оболочки ротовой полости и эмали зубов.
Сукросомальное® железо характеризуется высокой биодоступностью, меньшими побочными эффектами и хорошей переносимостью, что делает его предпочтительным для пациентов с непереносимостью традиционных (двух- и трехвалентных) пероральных или внутривенных форм железа. Так, в экспериментах in vitro показано, что введение СЖ увеличивало содержание ферритина в клетках CACO-2 в 3 и 3,5 раза по сравнению с сульфатом железа и фосфолипидами, содержащими пирофосфат железа (рис. 2А) [30], а также другими соединениями железа (рис. 2B) [31].
![Рис. 2. Биодоступность соединений железа при рабо- те с клеточной культурой CACO-2. Пояснения в тексте (адаптировано по [32]). Данные представлены как среднее ± SEM, * — p<0,001 при сравнении СЖ с другими соединениями железа Fig. 2. Bioavailability of iro Рис. 2. Биодоступность соединений железа при рабо- те с клеточной культурой CACO-2. Пояснения в тексте (адаптировано по [32]). Данные представлены как среднее ± SEM, * — p<0,001 при сравнении СЖ с другими соединениями железа Fig. 2. Bioavailability of iro](https://medblog.su/wp-content/uploads/2024/03/1710456823_442_Novye-podhody-v-lechenii-i-profilaktike-anemii-beremennyh-Dobrohotova.png)
Была доказана эффективность лечения СЖ по сравнению с внутривенным введением железа в популяции больных с хронической болезнью почек и анемией [33]. Также для пациентов с воспалительными заболеваниями кишечника пероральное введение СЖ эффективно в лечении анемии и улучшении качества жизни. Эти пилотные исследования [34–37] предоставляли фактические данные, подтверждающие терапевтическое применение СЖ для лечения ЖДА.
В исследовании [38] применения СЖ в гинекологической практике продемонстрирована высокая клиническая эффективность препарата у пациенток с обильными менструальными кровотечениями с минимумом побочных эффектов и высокой приверженностью терапии. Следует отметить, что в 2016 г. проведенное в Российской Федерации исследование [39] по применению СЖ в дозе 30 мг у беременных показало также высокую клиническую эффективность в нормализации феррокинетических показателей, улучшении качества жизни беременных и улучшении перинатальных исходов.
Анализ имеющихся данных подтверждает, что пероральный прием СЖ является эффективным вариантом лечения дефицита железа, который лучше переносится, чем пероральные соли железа; также была продемонстрирована эффективность с меньшими рисками у пациентов, обычно получающих препараты железа внутривенно (например, при хронической болезни почек, онкологических заболеваниях, после бариатрической хирургии). Таким образом, СЖ может рассматриваться как средство первой линии, особенно для пациентов с непереносимостью или неэффективностью лечения солями железа, а также как альтернатива внутривенному лечению железом для начальной и/или поддерживающей терапии у различных групп пациентов (табл. 3) [32].
Кроме того, присутствие в продукте линейки СидерАЛ® — СидерАЛ® Инт. витаминов С и В12 обеспечивает дополнительное положительное воздействие на организм. Доказано, что витамин В12 играет важную роль в гемопоэзе, являясь фактором активации фолиевой кислоты, которая в свою очередь участвует в синтезе ДНК в эритробластах. Витамин С обладает антиоксидантными свойствами, защищает клетки и ткани от повреждающего действия свободных радикалов, препятствует окислению жирных кислот, увеличивает усвоение железа.
Заключение
Анемия во время беременности увеличивает риск развития различных акушерских и перинатальных осложнений. Применение пероральных солей железа для терапии данной патологии связано с побочными эффектами со стороны ЖКТ, что ставит под угрозу соблюдение беременными режима лечения, а внутривенное введение железа, которое противопоказано в I триместре, является более дорогостоящей и логистически сложной альтернативой и небезопасно ввиду риска развития реакции гиперчувствительности. Назначение СидерАЛ® Форте, имеющего уникальные структурные, физико-химические и фармакокинетические характеристики, высокую клиническую эффективность и, что немаловажно, безопасность с позиции доказательной медицины, играет важную роль в достижении терапевтического эффекта, что позволяет рекомендовать его применение с профилактической и лечебной целью во время беременности и в послеродовом периоде [40]. Прием этого специализированного продукта для лечебно-профилактического питания в клинической практике во время и вне гестации показал хорошую комплаентность и переносимость.
1Клинические рекомендации. Нормальная беременность. 2023. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/recomend/669_1 (дата обращения: 15.02.2024).
2Клинические рекомендации. Железодефицитная анемия. 2021. (Электронный ресурс.) URL: https://cr.minzdrav.gov.ru/schema/669_1 (дата обращения: 21.01.2024).
Сведения об авторах:
Доброхотова Юлия Эдуардовна — д.м.н., профессор, заведующая кафедрой акушерства и гинекологии РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-7830-2290.
Романовская Валентина Валерьевна — к.м.н., ассистент кафедры акушерства и гинекологии лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-0413-5431.
Нариманова Метанат Рафиговна — к.м.н., доцент кафедры акушерства и гинекологии лечебного факультета РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-0677-2952.
Контактная информация: Романовская Валентина Валерьевна, e-mail: valentinaromano2005@yandex.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 30.11.2023.
Поступила после рецензирования 20.12.2023.
Принята в печать 15.01.2024.
About the authors:
Yulia E. Dobrokhotova — Dr. Sc. (Med.), Professor, Head of the Department of Obstetrics and Gynecology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-7830-2290.
Valentiva V. Romanovskaya — C. Sc. (Med.), assistant of the Department of Obstetrics and Gynecology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0003-0413-5431.
Metanat R. Narimanova — C. Sc. (Med.), associate professor of the Department of Obstetrics & Gynecology, Pirogov Russian National Research Medical University; 1, Ostrovityanov str., Moscow, 117437, Russian Federation; ORCID iD 0000-0003-0677-2952.
Contact information: Valentiva V. Romanovskaya, e-mail: valentinaromano2005@yandex.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interest.
Received 30.11.2023.
Revised 20.12.2023.
Accepted 15.01.2024.
Информация с rmj.ru
