«Алгоритмы терапии коморбидного пациента с ХИМ» (И.А. Щукин). Одной из наиболее значимых медицинских и социальных проблем неврологической практики в РФ является проблема острой и хронической цереброваскулярной патологии, а именно хроническая ишемия головного мозга (ХИМ) и церебральный инсульт.

Общемировая тенденция свидетельствует о том, что в большинстве стран мира отмечается рост средней продолжительности жизни. Так, по последним данным Росстата, средняя продолжительность жизни в РФ составила 72,2 года. Такая тенденция обусловлена целым рядом факторов, в первую очередь это определенный рост уровня жизни и совершенствование медицинских технологий. В то же время, по данным крупных эпидемиологических исследований, структура заболеваемости населения болезнями, связанными с возрастом, несколько различается, что напрямую зависит от уровня экономического развития страны. Так, в государствах с развивающейся экономикой заболеваемость населения болезнями, традиционно относящимися к заболеваниям, связанным с возрастом, отмечается в возрасте 60–70 лет, в то время как в государствах с высоким уровнем экономического развития эти же болезни выявляются в старшей возрастной группе (70–80 лет). В неврологии принять выделять 2 типа старения когнитивной функции:
нормальное старение, под которым понимают закономерные инволютивные изменения головного мозга в пожилом возрасте, не являющиеся основанием для постановки какого-либо диагноза (уменьшение массы головного мозга на 10% к 70–80 годам, уменьшение нейрональной пластичности, снижение активности нейротрансмиттерных систем);
патологическое старение, т. е. развитие ХИМ или нейродегенеративных заболеваний (НДЗ), кроме того, возможно совместное течение хронической цереброваскулярной патологии и нейродегенерации.
В развитии ХИМ важную роль играют сосудистые факторы риска: артериальная гипертензия (АГ), атеросклероз, сахарный диабет (СД), заболевания сердца (мерцательная аритмия, ишемическая болезнь сердца (ИБС)), метаболический синдром, венозная недостаточность и т. д. Все перечисленные сосудистые факторы риска наносят непоправимый урон и головному мозгу, и интеллекту каждого конкретного пациента. На формировании ХИМ, к сожалению, течение коморбидной патологии не останавливается. Ухудшая с каждым днем когнитивное и соматическое состояние пациента, комплекс заболеваний продолжает существовать вместе. Прогностическим, наиболее неблагоприятным в плане развития сосудистых когнитивных нарушений (КН) является сочетанное влияние АГ и других сосудистых факторов риска, в первую очередь СД.
Основной мишенью сосудистых факторов риска, в первую очередь АГ, является микроциркуляторное звено мозгового кровотока. Достаточно сложное устройство мозгового капилляра и обусловливает его главную барьерную функцию, а именно формирование гематоэнцефалического барьера (ГЭБ). Термин «церебральная микроангиопатия», встречающийся в отечественной медицинской литературе, или более поздний, традиционно используемый в мировой литературе — «болезнь малых сосудов» как раз и отражает те изменения, которые происходят в микроциркуляторном звене мозгового кровотока при ХИМ. Ключевым звеном патогенеза является разрушение связей между эндотелиоцитами, что приводит к значимому повышению проницаемости ГЭБ, проникновению внутрь мозга иммунокомпетентных клеток — Т- и В-лимфоцитов, которые экспрессируют большое количество провоспалительных медиаторов, повреждающих нейроны, глию и белое вещество. Кроме того, активированные лимфоциты, проникающие в мозг, активируют микроглию, резидентскую иммунную клетку мозга, что усугубляет повреждение. Также не стоит забывать, что через поврежденный ГЭБ происходит проникновение эритроцитов, различных плазменных белков. Данный процесс способствует усилению повреждающих внутримозговых воспалительных реакций, что обозначается термином «нейровоспаление», также угнетается нейрональная пластичность, нарастает эксайтотоксичность, окислительный стресс и реакции апоптоза. В итоге прогрессирует атрофия мозга, нарастает лейкоареоз, что клинически в первую очередь проявляется развитием синдрома сосудистых КН. Следует различать два последовательных ключевых патофизиологических механизма сосудистого церебрального повреждения — церебральную ишемию и гипоксию. Ишемия — это снижение мозгового кровотока, в то время как гипоксия является следствием ишемии, характеризующимся разнообразными механизмами повреждения мозга. Ишемия запускает нейровоспаление — процесс, сопровождающийся активацией клеток врожденного иммунитета и глиальных клеток. Биомаркеры нейровоспаления были найдены в плазме и цереброспинальной жидкости пациентов с сосудистыми КН.
Запуск процессов нейровоспаления характеризуется четырьмя основными механизмами: активацией микроглии, повышением уровня цитокинов и хемокинов, накоплением периферических иммунных клеток и локальным повреждением вещества головного мозга. Церебральное повреждение вызывает нарастание содержания в веществе головного мозга целого ряда провоспалительных субстанций (цитокинов и хемокинов, свободных радикалов, вторичных мессенджеров, компонентов поврежденных клеток), активирующих микроглию, которая сама начинает продуцировать провоспалительные цитокины и активные формы кислорода, тем самым усугубляя нейровоспаление и повреждение вещества головного мозга. Далее гипоксия способствует нарастанию нейровоспаления, что характеризуется увеличением зоны ишемического повреждения и снижением процессов нейропластичности.
Наряду со стандартными нейровизуализационными методами оценки структурных изменений при ХИМ, в клинической практике для определения прогноза и эффективности проводимой терапии с помощью таких методов, как КТ-перфузия, ОФЭКТ, ПЭТ и BOLD-МРТ, целесообразно определять возможности церебрального перфузионного резерва. Также следует оценивать степень патологической проницаемости ГЭБ с помощью контрастной МРТ. Влиять на сосудистые факторы риска развития ХИМ возможно с помощью немедикаментозных и медикаментозных подходов.
Немедикаментозные подходы включают ведение здорового образа жизни, физические тренировки и тренировки когнитивных функций, правильное питание, коррекцию нарушений слуха и зрения, коррекцию нарушений эмоций, социальную активность.
К медикаментозным подходам относятся: коррекция сосудистых факторов риска (АГ, дислипидемия, СД, кардиальная патология, венозные нарушения и т. д.), назначение препаратов, обладающих нейропротективным, антиокислительным и противогипоксическим механизмами действия.
В настоящее время изучается применение стратегий, направленных на коррекцию патофизиологических механизмов развития гипоксических повреждений головного мозга:
Восстановление поврежденного ГЭБ. В ряде экспериментальных и клинических исследований показана эффективность применения мелатонина, магния, витаминов, α-липоевой кислоты, ацетил-L-карнитина, цитиколина, антиоксидантов, блокада фактора роста эндотелия сосудов А (vascular endothelial growth factor A, VEGF-A), матриксных металлопротеиназ (matrix metalloproteinases, MMP) 2 и MMP-9, эндотелина-1, цитокинов, коррекция диеты.
Купирование нейровоспаления. Применение миноциклина, хлорохина, колхицина, подавление активного системного воспаления и активности провоспалительных цитокинов, MMP-2 и MMP-9, ингибирование сигнальных путей, подавление активности митоген-активируемой киназы p38 (МАРК).
Ингибирование процессов нейродегенерации и активация нейропластичности — процесса адаптации/репарации нервной ткани в неблагоприятных условиях, реализуемого за счет работы нейротрофических факторов и включающего в себя рост и созревание новых нейронов, миграцию нейронов в поврежденную зону, образование новых синаптических связей и процессы ангиогенеза. С целью ингибирования процессов нейродегенерации и активации нейропластичности применяют:
пептидные препараты (Ренобрейн®);
нейротрофические факторы.
В настоящее время ведется ряд исследований, изучающих возможность их прямой доставки в очаг церебрального повреждения, однако их клиническое использование в настоящее время по ряду причин ограничено.
Подавление окислительного стресса и процессов апоптоза, в частности, с использованием ключевого фермента дыхательной цепи митохондрий — цитохрома С. Он является главным метаболитом дыхательной цепи митохондрий. Без цитохрома С невозможны процессы тканевого дыхания и выработки АТФ. С одной стороны, в условиях тяжелой острой ишемии цитохром высвобождается из поврежденных митохондрий и запускает процессы апоптоза. С другой стороны, он является ключевым ферментом, ответственным за энергетический баланс клетки. Цитохром С образуется в виде предшественника в цитоплазме клетки и поступает в митохондрию извне; является универсальным внутриклеточным антигипоксантом и антиоксидантом, сочетая в себе возможности как донатора электронов, так и окислителя. В условиях ишемии клетки начинают активно «захватывать» цитохром С, что приводит к улучшению их выживаемости.
На настоящий момент выполнено значительное количество международных фундаментальных и клинических исследований, в которых было продемонстрировано антигипоксическое и антиоксидантное действие препарата Цитохром С при различной патологии, в том числе при церебральной ишемии.
При обращении к российской доказательной базе обращают на себя внимание результаты ряда исследований. В частности, было проведено сравнительное изучение нейропротективных и прокогнитивных свойств Цитохрома С и этилметилгидроксипиридина сукцината на модели церебральной ишемии у лабораторных животных (оценка неврологических нарушений и поведенческих реакций животных). Установлено, что Цитохром С повышал неврологический статус при ишемии головного мозга и, в отличие от препарата сравнения, улучшал клиническое состояние животных, причем эффект не был дозозависимым. Также Цитохром С способствовал существенному снижению уровня ключевого маркера церебральной ишемии и гибели головного белка S100b и обеспечивал снижение индекса апоптоза в 3 раза и увеличение индекса пролиферации в 2 раза.
В клинической практике было проведено исследование применения Цитохрома С у пациентов с острыми и хроническими нарушениями мозгового кровообращения. На фоне терапии Цитохромом С при ишемическом инсульте наблюдали выраженный регресс двигательных и чувствительных нарушений, при хронических нарушениях мозгового кровообращения — улучшение настроения, уменьшение головной боли и координаторных нарушений, улучшение субъективного состояния, наступавшее уже на 3–4-е сутки применения препарата.
Также патогенетически обоснованным является применение у пациентов с ХИМ полипептидов коры головного мозга скота (ПКГМС) — препарата Ренобрейн®, который обладает полимодальным действием: ноотропным, нейропротективным, антиоксидантным, тканеспецифическим, в том числе принимает участие в стимуляции нейропластичности. Доказанные эффекты препарата:
улучшает высшие функции головного мозга, процессы обучения и памяти, концентрацию внимания, устойчивость при различных стрессовых воздействиях;
защищает нейроны от поражения различными эндогенными нейротоксическими факторами (глутамат, ионы кальция, свободные радикалы), уменьшает токсические эффекты психотропных веществ;
ингибирует перекисное окисление липидов в нейронах, повышает выживаемость нейронов в условиях оксидативного стресса и гипоксии;
активирует метаболизм нейронов центральной и периферической нервной системы, репаративные процессы, способствует улучшению функций коры головного мозга и общего тонуса нервной системы.
Схема применения препарата при ХИМ: 10 мг внутримышечно 1 р/сут 10 дней, повтор курса через 3–6 мес. при необходимости.
Алгоритм рациональной терапии пациента с ХИМ формируется в зависимости от преобладающего симптомокомплекса у каждого конкретного пациента (рис. 1):
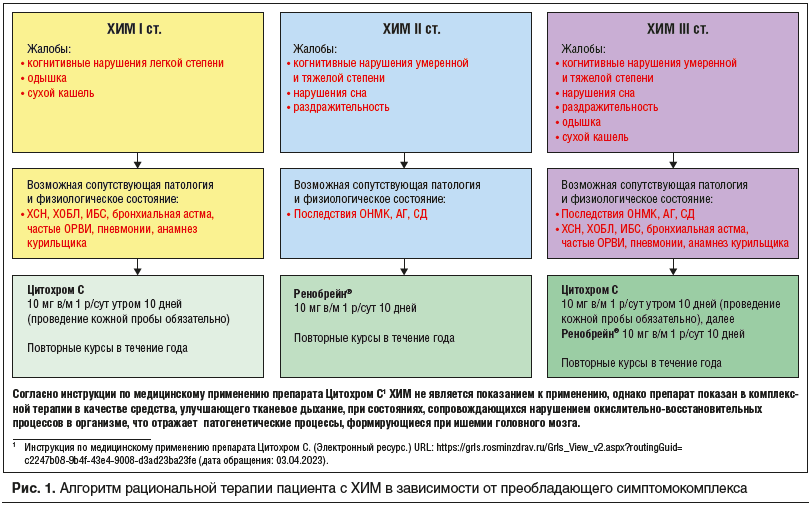
При ХИМ I стадии, которая сопровождается КН легкой степени, и наличии симптомов или заболеваний со стороны легочной системы предпочтение отдается Цитохрому С.
При ХИМ II стадии, умеренных и тяжелых КН и отсутствии бронхолегочной патологии (при этом у пациента дополнительно могут присутствовать другие коморбидные состояния со стороны сердечно-сосудистой системы (ССС) и/или СД) препаратом выбора является Ренобрейн®. При ХИМ III стадии, выраженных КН, появлении симптомов раздражительности и нарушения сна и наличии сопутствующих заболеваний со стороны ССС и дыхательной систем оптимальным будет сочетание препаратов Цитохром С и Ренобрейн® по схеме. «Рациональная фармакотерапия пациента с постковидным синдромом: взгляд клинического фармаколога» (М.В. Журавлева). Новая коронавирусная инфекция COVID-19 сохраняет актуальность: по состоянию на март 2023 г. прирост заболеваемости составил 33%, а это 60 тыс. новых пациентов с верифицированным SARS-CoV-2. До 20% людей, перенесших коронавирусную инфекцию, страдают от долгосрочных симптомов, длящихся до 12 нед. и дольше. Постковидный синдром (ПКС) является одной из актуальнейших проблем современной медицины. Пациентам с одним или более хроническими заболеваниями особенно сложно достичь быстрого и полного выздоровления от ПКС. Чаще всего у таких пациентов течение заболевания носит среднетяжелый или тяжелый характер, что ухудшает течение сопутствующих патологий и увеличивает количество симптомов ПКС. ПКС затрагивает ССС, нервную систему, в том числе вегетативную, и, безусловно, обеспечивает возможность развития КН.

В настоящее время существует несколько гипотез возникновения ПКС, которые включают в себя знания о патофизиологических процессах при возникновении COVID-19 (прямое повреждение органов, тромботические повреждения, вирус SARS-CoV-2 нейротропен и вызывает гиперактивацию иммунной системы).
Выделяют 2 категории ПКС:
подострый, или продолжающийся симптомный COVID-19 (long-COVID-19), который включает различные симптомы и отклонения от нормы, проявляющиеся в течение 4–12 нед. после острого COVID-19;
хронический, или ПКС, который включает симптомы и нарушения, сохраняющиеся более 12 нед. после возникновения острого COVID-19. Характеризуется симптомами, не связанными с альтернативными диагнозами, и выражается, как правило, полиорганными нарушениями, особенно важными для коморбидных пациентов (в особенности у пациентов с заболеваниями ССС, цереброваскулярной патологией, ожирением).
Постковидный синдром проявляет себя множеством патологических состояний. Одним из первых и важных маркеров церебральной патологии является нарушение когнитивных функций, которое может прогрессировать в то время, когда формальный неврологический статус (двигательные, координаторные и сенсорные функции) остается стабильным в течение длительного времени в постковидном периоде. Указанная особенность создает иллюзию стабилизации церебрального патологического процесса.
Согласно данным актуального исследования нервно-психических последствий среди пациентов, перенесших COVID-19, были выявлены:
КН — у 39%;
депрессия — у 36,4%;
обсессивно-судорожные расстройства — у 15,6%;
панические расстройства — у 15,6%.
По результатам обследования 1539 пациентов старше 60 лет были установлены факторы риска развития КН: тяжелая форма COVID-19, делирий, ХОБЛ, АГ и коморбидность, которая является важнейшей составляющей и коррелирует с тяжестью развития ПКС.
Говоря о патогенетическом подходе к лечению постковидного неврологического синдрома, необходимо установить механизмы повреждения ЦНС, задачи терапии и таргетные группы препаратов.
К повреждению ЦНС при ПКС приводят гипоксия, системное воспаление, нейродегенеративные процессы, нарушения микроциркуляции, дисбаланс цитокинов, прямые нейротоксические воздействия, оксидативный стресс и нарушения клеточного дыхания. Таким образом, задачами патогенетической терапии являются повышение устойчивости к гипоксии, уменьшение воспаления, восстановление биорегуляции ЦНС, уменьшение оксидативного стресса, предупреждение апоптоза, восстановление клеточного дыхания на уровне митохондрий. Для проведения таргетной терапии используются, в первую очередь, препараты нейропептидов (Ренобрейн®), препараты холина (холина альфосцерат, цитиколин), антиоксиданты (этилметилгидроксипиридина сукцинат/малат, кавинтон), энергопротекторы (Цитохром С).
Цитохром С и Ренобрейн® являются яркими представителями таргетной терапии пациентов с ПКС, особенно с коморбидной патологией.
ПКГМС в лечении ПКС оказывают патогенетическое и симптоматическое действие:
избирательно связывают нейропептиды и за счет этого улучшают множество нейрорегуляторных процессов;
оказывают системное и локальное противовоспалительное действие;
обладают нейротрофическим действием;
повышают устойчивость клеток ЦНС к гипоксии;
улучшают нейромедиаторные процессы;
снижают проницаемость ГЭБ;
оказывают антиоксидантное действие.
В клиническом исследовании на фоне применения ПКГМС у пациентов, перенесших COVID-19, отмечено достоверное уменьшение частоты утомляемости в 3 раза, нарушений памяти в 3,5 раза, головной боли и нарушений сна в 3,6 раза, общей слабости в 4,6 раза, нарушений концентрации внимания в 3,3 раза, раздражительности в 4 раза и тревоги в 4,5 раза. Логичным будет вывод о том, что ПКГМС обеспечивают выраженную положительную динамику, которая проявляется в действии на сложный с точки зрения этиопатогенеза комплекс постковидных симптомов.
Ренобрейн® как представитель ПКГМС обладает многофакторным механизмом действия: вызывает активацию пептидов нейронов и нейротрофических факторов мозга, оптимизирует баланс метаболизма возбуждающих и тормозных аминокислот, дофамина, серотонина, оказывает ГАМК-ергическое воздействие, снижает уровень пароксизмальной судорожной активности мозга, улучшает биоэлектрическую активность мозга и предотвращает образование продуктов перекисного окисления липидов.
По данным метаанализа (2021 г.), среди 55 симптомов, сохраняющихся у пациентов, перенесших COVID-19, наиболее часто встречаются: астения — у 58% (95% ДИ 42–73%), головная боль — у 44% (95% ДИ 13–78%), нарушение внимания — у 27% (95% ДИ 19–36%). Одним из наиболее частых симптомов, сохраняющихся у пациентов, перенесших COVID-19, является астения, которая может наблюдаться до 1 года после перенесенного заболевания.
Говоря о влиянии терапии на основной патогенетический процесс, сформированный коронавирусной инфекцией, отметим, что на первый план выходит действие на органеллы и митохондриальное дыхание, которое является основным компонентом жизни и функционирования любой клетки.
Вирус SARS-CoV-2 способствует развитию гипоксии и нейровоспаления с повреждением митохондрий, которые перестают быть акцепторами кислорода и субстратов. Нарушение энергообразующих процессов приводит к гибели клеток. На системном уровне в организме гипоксия провоцирует стресс и выработку гормонов стресса. Избыток серотонина приводит к ингибированию генерации потенциала действия и снижению двигательной активности, что служит одним из основных факторов развития симптомов усталости.
На сегодняшний день существуют клинические исследования по эффективности и безопасности препарата Цитохром С при постковидной астении, в том числе у пациентов с коморбидной патологией. После лечения препаратом Цитохром С быстро и значительно (на 35 баллов) уменьшились показатели выраженности астении (MFI-20) (до нормы, т. е. отсутствия астении), на 5 и 7 баллов снизились оценки по шкале психического статуса и шкале депрессии Бека, что свидетельствовало о нормализации психического статуса и отсутствии депрессии (рис. 2).
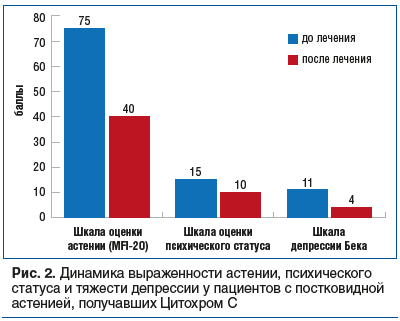
Применение Цитохрома С в целом способствовало существенному уменьшению количества пациентов с астенией, повышению уровня их социально-бытовой адаптации и качества жизни.
В основе постковидной астении лежат гипоксия и последующая митохондриальная дисфункция с нарушением тканевого дыхания. Цитохром С способствует решению всех задач при ведении пациента с ПКС. Цитохром С — мощный энергокорректор, действующий на уровне дыхательной цепи митохондрий. Он оказывает антигипоксическое и трофическое действие, являясь катализатором клеточного дыхания. Применение Цитохрома С в составе базисной терапии обладает синергизмом с другими лекарственными средствами, что обусловливает целесообразность назначения препарата в комплексной терапии. Цитохром С обладает благоприятным профилем безопасности и не оказывает влияния на артериальное давление, уровень глюкозы в крови, на активность выделительной системы, что крайне важно, особенно для коморбидных пациентов.
В фундаментальных исследованиях показано, что Цитохром С проходит через ГЭБ и обладает высокой тропностью к тканям ЦНС. После введения препарата Цитохром С начинает определяться в тканях мозга в течение 15 мин с определением максимума через 1 ч. Далее концентрация Цитохрома С начинает плавно снижаться и через 24 ч после введения определяется в тканях мозга в минимальных количествах.
С учетом приведенных ранее результатов клинических исследований и фармакотерапевтических показателей Цитохром С и ПКГМС являются препаратами выбора при полимодальном подходе к терапии пациентов с ПКС.
Таким образом, рациональная фармакотерапия пациента с ПКС основана на следующих принципах:
В связи с тропностью вируса SARS-CoV-2 к различным тканям человеческого организма необходим полимодальный подход к коррекции состояния пациентов после перенесенного COVID-19.
Рациональная фармакотерапия ПКС требует подключения препаратов различных фармакотерапевтических групп: нейропротекторов, антигипоксантов, энергокорректоров, иммуномодуляторов и т. д.
Для коррекции КН, нарушений сна, снижения раздражительности и тревоги обоснованным является назначение нейропептидов.
У пациентов с астенией Цитохром С продемонстрировал свою эффективность: достоверно снизил выраженность астении, повысил качество жизни.
«Как избежать полипрагмазии при назначении пептидных препаратов» (М.В. Путилина). В современной неврологии актуальна проблема полипрагмазии. После рассмотрения эффективности применения пептидных препаратов в предыдущих докладах закономерным будет вывод о том, что пептиды — это будущее мировой медицины. Как сделать терапию рациональной и избежать назначения многочисленных препаратов?

По данным международных исследований, на сегодняшний день в США, Европе и Японии одобрено более 60 пептидных препаратов; более 150 находятся в активной клинической разработке, а еще 260 прошли клинические испытания.
Понимание того, что пептиды — это белковые композиции, которые работают на определенном уровне, необходимо оставить в прошлом. Любой живой организм находится в социуме, под влиянием которого постоянно формируются различные патологические состояния. Даже проявления незначительного стресса под влиянием окружающей среды провоцируют дефицит пептидов. Если говорить об истинном проявлении болезни и тем более о коморбидности, то практически всегда происходят изменения пептидного состава нашего организма. Пептиды — это органические вещества, образованные аминокислотными цепочками. Большую часть организм человека синтезирует сам, меньшую — получает из пищи.
В неврологической практике на первый план выходят нейропептиды, однако пептиды — это не только компоненты нервной ткани, но и мощные регуляторы иммунной и гормональной систем. По биорегуляторному действию выделяют:
нейропептиды, которые вырабатываются в мозге и регулируют работу ЦНС (эндорфины, энкефалины);
пептидные регуляторы иммунитета, повышающие защитные функции (циклоспорин А, тафцин, тимозин);
пептидные гормоны (адренокортикотропный, меланотропины, статины, глюкагон, гастрин, вазопрессин, окситоцин);
пептидные антибиотики (грамицидин S, тироцидин, бацитрацины, актиномицины).
Из приведенной классификации следует, что пептиды — это универсальные регуляторы. Большинство пептидов синтезируются эндогенно и в условиях дефицита не способны восстанавливаться естественным образом, поэтому становится крайне важным поступление данных веществ экзогенным путем.
Экзогенные пептидные препараты можно разделить по типу действия:
органопрепараты:
с относительно специфическим типом действия (церебролизин, церебролизат, ПКГМС, румалон и др.);
препараты с неспецифическим (общим) типом действия (актовегин, солкосерил и др.);
полусинтетические пептидные препараты (семакс, коситропин и др.);
синтетические пептидные препараты (селанк, алптид, ноолепт, кортаген и др.).
Знание типов пептидных препаратов необходимо практикующему врачу для правильного выбора терапии, избежания полипрагмазии и создания рациональных комбинаций. Нейропептиды — препараты выбора в неврологической практике.
Нейропептидные препараты, особенно состоящие из небольших молекул, имеют способность к селективному связыванию с эндогенными белками. Пептиды проникают через ГЭБ, активируются в пораженных различными патогенами эндотелиальных клетках. Первичные эффекты того или иного пептида могут развиваться во времени в виде цепных и каскадных процессов. Пептидные препараты обладают выраженными нейротрофическими, медиаторными, эффекторными и противовоспалительными свойствами.
Особенностью структуры нейропептидов является наличие нескольких лигандных групп связывания, обладающих разным сродством к отдельным клеточным рецепторам и обусловливающих разнообразие вызываемых ими эффектов.
На настоящий момент через связь с лигандами доказана эффективность применения пептидных препаратов с целью:
регулирования боли;
модулирования воспалительного процесса;
коррекции тревожных расстройств;
влияния на работу желудочно-кишечного тракта;
терапии наркологической зависимости;
регуляции работы сердечно-сосудистой системы и др.
Также пептидные препараты классифицируются по структуре и, как следствие, по способу их применения:
Пептиды, синтезированные из L-аминокислот, образуют конформации, которые разрушаются под действием пептидаз и могут применяться только внутривенно или внутримышечно.
Пептиды, синтезированные из D-аминокислот, — синтетические пептиды, которые можно применять только перорально.
Нейропептидная терапия берет свое начало в 1973 г., когда В.Г. Морозов и В.Х. Хавинсон в Военно-медицинской академии им. С.М. Кирова совместно с заводом медицинских препаратов Ленинградского мясокомбината им. С.М. Кирова (впоследствии ООО «Самсон-Мед» (Санкт-Петербург, Россия)) начали разработку группы отечественных препаратов пептидной природы с целью повышения ресурса организма военнослужащих, находящихся в условиях воздействия неблагоприятных факторов.
В настоящее время в Российской Федерации наиболее часто используются ПКГМС (Ренобрейн®, Кортексин®), Церебролизин и синтетические пептиды.
Церебролизин представляет собой длинноцепочечный полипептид с большой молекулярной массой, при применении которого внутривенно может быть увеличена белковая нагрузка на организм. ПКГМС — это короткоцепочечные пептиды. За счет малой молекулярной массы ПКГМС демонстрируют эффективность при внутримышечном введении в меньшей дозе. Дополнительно малые пептиды способны связывать другие препараты непептидной природы и выступать в роли переносчиков, повышая эффективность сопутствующей терапии.
Существуют следующие стратегии по избежанию полипрагмазии при назначении пептидов:
Комбинации органоспецифических пептидов с неспецифическими: например, Цитохром С + ПКГМС. Цитохром С применяют в комплексной терапии в качестве средства, улучшающего тканевое дыхание, при состояниях, сопровождающихся нарушением окислительно-восстановительных процессов в организме, например, при хронической обструктивной болезни легких (ХОБЛ) и сердечной недостаточности (СН) (в том числе у курильщиков). Данная комбинация может назначаться пациентам с КН различной выраженности с соматическим коморбидным фоном (ХСН, ХОБЛ, ИБС, бронхиальная астма, частые ОРВИ, пневмонии, в том числе с последствиями COVID-19) и с поражением легких, пациентам с длительным кашлем, курильщикам, особенно пациентам, получающим статины и бета-адреноблокаторы, прием которых вызывает истощение коферментного статуса. Цитохром С назначают по 10 мг в/в или в/м (с обязательной кожной пробой). Биодоступность одинакова при в/в и в/м введении. Переход через 10 дней на Ренобрейн® в/м 10 мг 1 р/сут является оптимальным и патогенетически обоснованным.
Монотерапия нейропептидами. Применение данной стратегии возможно у пациентов молодого возраста (18–45 лет) без выраженной соматической патологии, после интенсивной физической или умственной работы, с жалобами на слабость, утомляемость, нарушения сна, тревожность. Препараты короткоцепочечных пептидов (Ренобрейн®) назначаются внутримышечно коротким курсом 10 мг 1 р/сут в течение 10 дней, при этом отмечается выраженный эффект последействия. Установлено, что повторный прием нейропептидов обоснован и возможен у различных групп пациентов через 3–6 мес. после окончания первого основного курса.
Комбинированная схема различных пептидов и других непептидных препаратов. Может применяться у пациентов различного возраста с ХИМ, в остром периоде ОНМК, после перенесенного ОНМК, травмы головы, нейроинфекции, при КН, НДЗ, в том числе у пациентов пожилого возраста.
Возможно одновременное применение нейропептидов с синтетическими пероральными пептидами (per os) и совместное назначение с препаратами непептидной структуры (Ренобрейн® + холина альфосцерат, Ренобрейн® + антиоксиданты, Ренобрейн® + антидепрессанты и т. д.).
В реальной клинической практике использование комбинации пептидов при любой неврологической патологии на начальных или более поздних стадиях позволит уменьшить риск развития полипрагмазии у коморбидных пациентов и повысит эффективность нейропротекции. В то же время необходимо дальнейшее изучение совместного применения препаратов этой группы для выработки оптимальных схем терапии. Предлагаемая комбинация пептидных препаратов Цитохром C и ПКГМС позволяет суммировать лечебные эффекты неселективных цитопротекторов с выраженными антигипоксическими свойствами и нейропротекторов, воздействующих на нейропластичность и нейротрофику, и, соответственно, добиться более значимого клинического результата.
Информация с rmj.ru






