Содержание статьи
Роль остеотропных минералов в профилактике и комплексном
лечении перелома берцовой кости
О. А. Громова*, доктор медицинских наук, профессор
И. Ю. Торшин*, кандидат химических наук
В. И. Демидов**, кандидат медицинских наук
Н. Ю. Жидоморов**, кандидат медицинских наук
Н. Ю. Сотникова***, доктор медицинских наук, профессор
А. Ю. Волков*
* РСЦ Международного института микроэлементов ЮНЕСКО, Москва
** ГБОУ ВПО ИвГМА МЗ РФ, Иваново
*** ФГБУ ИвНИИ МиД им. В. Н. Городкова МЗ РФ, Иваново
На сегодняшний день отмечается возрастание частоты повреждений органов
опорно-двигательного аппарата и тканей. Этому способствуют природные и
антропогенные катастрофы, бурное развитие всех видов транспорта, что
обусловливает высокий травматизм в мирное время. Во время вооруженных
конфликтов, террористических актов процент травматизма возрастает в разы. Данные
обстоятельства требуют от врачей надежных средств, методов и результатов
лечения.
Время протекания репаративного остеогистогенеза после травмы кости строго
детерминировано и зависит от обеспеченности остеогенными микронутриентами —
витамин D3, кальций, цинк, марганец, бор, медь, магний. Оптимальным
по времени является первичное костное сращение, однако оно происходит только при
благоприятных условиях. Обеспечение таких условий и есть элемент влияния на
скорость остеорепарации.
Магний и поддержка костной ткани
Одной из принципиально важных нутрициальных потребностей кости является
обеспеченность костей магнием — элементом, регулирующим минерализацию,
равномерный рост, гибкость и прочность костной ткани и увеличивающим
репаративный потенциал костей. И наоборот, дефицит магния в организме
препятствует успешной терапии и профилактике нарушений структуры кости. Среди
различных тканей организма основным депо магния являются именно костная ткань.
Помимо того, что кость является депо магния, магний также оказывает существенное
влияние на минерализацию и структуру костной ткани — низкие уровни магния
связаны с низкой костной массой и остеопорозом [5].
Важность роли магния в поддержании структуры кости связана и с тем, что при
хроническом дефиците магния нарушается важнейший аспект минерального обмена
костной ткани — отношение Mg:Ca. При снижении соотношения Mg:Ca в сторону
дефицита магния обменные процессы в кости замедлены, быстрее депонируются
токсичные металлы (прежде всего, кадмий и свинец). Вследствие накопления
токсичных элементов в суставе из-за нарушения пропорции Mg:Ca функция суставов
постепенно ухудшается: уменьшается объем движений, происходит деформация
суставов конечностей и позвоночника. Эпидемиологические исследования частоты
остеопороза в различных странах показали, что более высокое значение отношения
Mg:Ca в питании соответствует более низкой встречаемости остеопороза [7].
В эксперименте диета с очень низким содержанием магния (7% от нормального
уровня потребления) приводила к значительной гипомагниемии, гипокальциемии,
характерным для остеопороза изменениям костной ткани у цыплят. Дефицит магния
приводит к разрежению костной ткани, вплоть до образования полостей; компенсация
дефицита магния — к восстановлению структуры костной ткани [8]. Это может быть
связано с участием магния в синтезе коллагена в составе костного матрикса.
Более высокое диетарное потребление магния соответствует повышенной
минеральной плотности кости (МПК) у мужчин и женщин. В исследовании когорты из
2038 человек оценка диетарного потребления магния по опроснику коррелировала с
МПК после поправок на возраст, калорийность диеты, потребление кальция и
витамина D, индекс массы тела, курение, алкоголь, физическую активность,
использование тиазидных диуретиков и эстроген-содержащих препаратов (р = 0,05,
мужчины; p = 0,005, женщины) [9].
Материнское питание во время беременности значительно влияет на минеральную
плотность костной ткани у детей. Наблюдения за 173 парами мать–ребенок в течение
8 лет после родов показали, что МПК шейки бедра у детей повышалась с повышением
диетарной обеспеченности беременной магнием. МПК поясничного отдела позвоночника
зависела от обеспеченности беременной магнием. Дети, матери которых были
адекватно обеспечены магнием во время беременности, характеризовались значимо большими
значениями МПК (шейка бедра — +5,5%, поясничного отдела позвоночника — +12%,
всего тела — +7%) [10].
Медь
Медь участвует в модификации определенных лизиновых остатков коллагена и
эластина, что имеет важное значение для формирования коллагеновых и эластиновых
фибрилл. Одним из факторов, способствующих потере костной массы, являются
субклинические дефициты цинка и меди, возникающие вследствие уменьшенного
потребления или нарушений всасывания этих микроэлементов в организме. Недостаток
меди у человека и у животных связан с нарушениями роста, остеогенеза и
хрупкостью костей, что во многом обусловлено недостаточным количеством этих
поперечных сшивок [15]. В эксперименте дефицит меди приводил к нарушению
структуры коллагена и снижению таких механических свойств кости, как
устойчивость к скручиванию и угловой деформации (р < 0,05) [16, 17]. Дефицит
меди ухудшает формирование сшивок коллагена и приводит к тяжелой патологии
костей, легких и сердечно-сосудистой системы [18]. Медь, являясь кофактором
фермента лизилоксидазы (ген LOX), имеет важное значение для формирования внутри-
и межмолекулярных поперечных связей в коллагене [14]. Это указывает на важность
роли меди в синтезе коллагена.
Марганец
Марганец — эссенциальный микроэлемент и кофактор более 200 белков. К
клиническим симптомам марганцевого дефицита у беременных относится остеопения;
последствия дефицита марганца для плода включают аномалии развития скелета.
В эксперименте эффекты долгосрочного дефицита марганца и меди в диете
включают снижение минерализации в сочетании с увеличением резорбции кости [21].
Этот эффект осуществляется за счет падения активности Mn-зависимых ферментов,
принимающих участие в синтезе глюкозаминогликанов и других углеводных
компонентов протеогликанов. К этим ферментам относятся галактозилксилозил
глюкуронозилтрансферазы (в биосинтезе таких гликозаминогликанов соединительной
ткани, как хондроитин сульфат, дерматан сульфат, гепаран сульфат и гепарин),
бета-галактозилтрансферазы (участвуют в биохимических модификациях и
присоединении глюкозаминогликанов) и N-ацетилгалактозаминил-трансферазы
(необходимы для синтеза глюкозаминогликана хондроитин сульфата) [22].
Хронический сочетанный дефицит марганца и меди приводит к снижению активности
строящих кость остеобластов, увеличению резорбции костного матрикса и,
следовательно, снижению плотности и массы костей. Недостаточность потребления
меди и марганца приводит к значительному снижению содержания кальция в костях
(180 мг/г, дефицит Mn/Cu и 272 мг/г, контроль). Рентгенограммы плечевых костей
указали на присутствие многочисленных очагов повреждения кости как при
сочетанном дефиците Mn/Cu, так и при глубоком дефиците марганца [21].
В эксперименте диетарный дефицит марганца в течение 25 дней приводил к
снижению содержания марганца в кости до 2% от контрольной группы. При этом 88%
животных проявляли выраженные признаки остеопороза, причем значительно снижалось
поглощение сульфата для синтеза уроновых гликозаминогликанов соединительной
ткани вследствие снижения активности ряда марганец-зависимых гликозилтрансфераз.
Восстановление марганца в диете приводило к быстрому возрастанию его содержания
в кости и восстановлению нормальной структуры кости [21]. Научные данные
указывают на участие марганца на синтез коллагена 1-го и 3-го типа, находящихся
в костной ткани и на 90% составляющих структуру костного матрикса. Восполнение
дефицита марганца приводит к увеличению МПК.
Бор
Влияет на активность ряда ферментных каскадов, включая метаболизм стероидных
гормонов и гомеостаз кальция, магния и витамина D. Бораты могут образовывать
сложные эфиры с гидроксильными группами различных соединений, что является одним
из возможных механизмов осуществления их биологической активности [32].
Повышенное содержание бора в пище повышает экспрессию борат транспортера (NaBCl)
в тощей кишке и понижает — в ткани почек [33].
Хотя детали молекулярных механизмов воздействия бора на физиологические
процессы остаются неизвестными, бор оказывает существенное воздействие на
процессы роста клеток костной ткани. Так, бор повышает одонтогенную и
остеогенную дифференцировку клеток ростка стволовых клеток зубов. Прием
пентабората натрия оказывал дозозависимый эффект на активность щелочной
фосфатазы и экспрессию генов, связанных с одонтогенезом [34]. Поэтому дефицит
бора во время беременности, наряду с дефицитами кальция и других микронутриентов,
также будет способствовать нарушениям развития зубов и у беременной, и у
ребенка.
Бор дозозависимо влияет на процессы дифференцировки стромальных клеток
костного мозга. Концентрации бора в 1, 10 и 100 нг/мл повышали, а уровни более
1000 нг/мл ингибировали дифференцировку клеток (р < 0,05). При уровнях бора в
10…100 в питательной среде культуры клеток костного мозга также повышались
уровни белков остеогенеза — остеокальцина, коллагена I, белков морфогенеза
костей 4, 6 и 7 (р < 0,05) [35], а также остеопонтина, сиалопротеина кости (ген
BSP), белка Runx2 и других [36]. Таким образом, накопленные данные
свидетельствуют об огромном влиянии бора на синтез коллагена и костного
матрикса.
Цинк
Необходим для поддержания и дифференцировки остеобластов и синтеза коллагена.
Также он регулирует уровень инсулиноподобного фактора роста (ИФР-1). Дефицит
цинка приводит к нарушению синтеза ДНК и метаболизма белка, что ведет к
нарушению синтеза органического матрикса [37]. Более 400 ферментов содержат
цинк. Среди них ферменты, катализирующие гидролиз пептидов, белков и сложных
эфиров, образование альдегидов, полимеризацию дезоксирибонуклеиновой и
рибонуклеиновой кислот. Цинк и медь — принципиально важные кофакторы ферментов,
участвующих в синтезе различных молекулярных компонентов матрикса костной ткани
[14].
Целью данного исследования было изучение влияния средства Кальцемин Адванс на
регенерацию костной ткани. До начала эксперимента было получено разрешение на
проведение исследование Этического комитета ГБОУ ВПО ИвГМА.
Для достижения поставленной цели были выделены следующие задачи:
- формирование контрольных и опытных групп объектов исследования (капюшонные
крысы) по принципу однородности; - проведение операции;
- зондирование крыс Кальцемином Адванс (опытная группа) и водой (контрольная
группа); - отслеживание динамики регенерации;
- оценка уровня коллагена 1 в кости;
- оценка гистологической картины кости;
- обобщение результатов и выводы.
Материалы и методы исследования
1) Провели отбор крыс по следующим критериям: здоровые животные (блестящие
глаза; кожные покровы чистые, без видимых повреждений), активные, с хорошим
аппетитом, возрастом около 1 года, весом от 280 до 350 г.
2) Провели взвешивание крыс на электронных весах с поправкой на массу тары, в
которой взвешивалось животное. Каждое животное после взвешивания записывалось в
таблицу с указанием номера, веса, особенностей окраски.
3) Провели маркировку каждой крысы пикриновой кислотой следующим образом:
- 1 — бедро левой верхней лапы;
- 2 — левый бок;
- 4 — бедро левой нижней лапы;
- 8 — бедро правой верхней лапы;
- 16 — правый бок;
- 32 — бедро правой нижней лапы.
Маркировка осуществлялась путем сложения необходимых чисел.
4) Отсаживание экспериментальных крыс отдельно от других по мере вхождения в
исследование.
5) Операция. Перед операцией проводили контрольное взвешивание крыс. В
качестве наркотизирующего средства использовали хлоралгидрат из расчета 350
мг/кг внутрибрюшинно. После ввода в наркоз животному в области бедра правой
задней конечности удалялся волосяной покров. Далее крыса фиксировалась в станке.
На бедре рассекались ткани, обнажалась малоберцовая кость, после чего
производился перелом кости. Края раны стягивались непрерывным швом. Каждая крыса
помещалась в отдельную клетку. Всем крысам создавались одинаковые условия
(доступ к воде, одинаковая пища).
6) Зондирование и контроль регенерации. Проводится 5 раз в неделю в течение
30 дней.
7) С первого дня после операции проводились измерения площади перелома в
контрольной и опытной группах. Далее крысы зондировались. Контрольная группа 1
получала воду (3 мл), опытная группа 2 — средство Кальцемин Адванс из расчета
0,1 мл на килограмм массы тела.
8) На 31-й день животные из обеих групп 1 и 2 забивались, затем у каждого
животного иссекали область перелома. Проводили окрашивание костной ткани в месте
перелома специальными методиками с последующим приготовлением микросрезов кости
в месте перелома для гистологической оценки и изучали уровни коллагена в костной
ткани в месте перелома в группе 1 и 2.
Результаты и обсуждение
У крыс контрольной группы наблюдалась полная консолидация перелома берцовой
кости на 12–13 день эксперимента (табл.).

Для оценки влияния Кальцемин Адванс на биомеханические свойства кости
измерялись такие параметры, как удельная стрела прогиба, предел прочности,
модуль упругости, и вычислялась так называемая «работа разрушения» кости. На
30-й день значения удельной стрелы прогиба составили 3,20 ± 0,12 НмкМ (Кальцемин
Адванс) и 2,86 ± 0,10 НмкМ в контрольной группе.
Значения других показателей биомеханической прочности кости также были
повышены у животных в опытной группе. Прием препарата повышал предел прочности
(опыт — 218 ± 8 гПа, контроль — 198 ± 6 гПа, p < 0,05), модуль упругости (опыт —
6,12 ± 0,25 гПа, контроль — 5,12 ± 0,44, p < 0,01), работу разрушения (опыт —
182 ± 12 мДж, контроль — 141 ± 8 мДж, p < 0,05). Такие изменения биомеханических
параметров в основной группе следует интерпретировать как снижение хрупкости
кости на фоне увеличения прочности и эластичности.
Таким образом, внутрижелудочное введение подопытным животным средства
Кальцемин Адванс согласно нормам потребления, соответствующим утвержденным для
человека (исходя из суточной дозы на кг массы тела), проявляется в нивелировании
тенденции к снижению прочностных характеристик, происходящих в контрольной
группе, и даже в улучшении показателей. Вероятно, это связано с поступлением в
организм не только кальция и витамина D3, но и остеотропных
минералов, которые играют эссенциальную роль в метаболизме костной ткани. Анализ
изменения модуля упругости и удельной стрелы прогиба подтверждает наличие
тенденции к оптимизации структуры органического компонента в основной группе,
что проявляется в увеличении эластичности костной ткани и пластичности самой
кости. Причиной этого является поступление в организм меди, марганца, магния,
цинка и бора, которые участвуют в синтезе коллагена, в том числе 1-го и 3-го
типа, которые содержатся в костной ткани млекопитающих, включая человека.
Кроме того, в конце эксперимента проводилось гистологическое исследование
костной ткани всех подопытных животных. Проводилась окраска коллагена.
Результаты гистологического эксперимента коррелируют со всеми данными
эксперимента. Доказано, что применение средства Кальцемин Адванс стимулирует
синтез коллагена в костной ткани.
Костная ткань состоит из клеток и межклеточного вещества. Она выполняет
опорную, механическую (способность сопротивляться растяжению, сжатию), защитную
(для внутренних органов) и депо микро- и макронутриентов.
К костной ткани относят также дентин и цемент зуба.
Клетки костной ткани
Костные ткани содержат три вида костных клеток: остеобласты, остеоциты и
остеокласты.
Остеобласты (остеобластоциты) — это молодые клетки, создающие костную ткань.
Они образуются из стволовых клеток, затем проходят стадию полустволовых (преостеобластов),
которые превращаются в остеобласты, а из них дифференцируются остеоциты —
дефинитивные клетки костной ткани.
Остеобласты имеют размер 15–20 мкм. Форма кубическая, пирамидальная или
угловатая. В цитоплазме хорошо развиты гранулярная эндоплазматическая сеть,
комплекс Гольджи, митохондрии. Ядро округлой или овальной формы. Остеобласты
способны к делению и образованию межклеточного вещества костной ткани, а также
обеспечивают механизм его минерализации. В сформировавшейся кости остеобласты
встречаются в глубоких слоях надкостницы и в местах регенерации костной ткани
после травмы.
Остеоциты — это самые многочисленные клетки костной ткани, дефинитивные
формы, утратившие способность к делению и образованию межклеточного вещества.
Имеют многоотростчатую форму, лежат в костных полостях или лакунах. Они имеют
слабобазофильную цитоплазму, крупное овальное ядро. Органоиды развиты слабо,
центриоли отсутствуют. Обмен веществ между остеоцитами и кровью осуществляется
через тканевую жидкость, которая заполняет канальцы костных полостей.
Остеобласты и остеоциты образуют костный дифферон.
Второй дифферон клеток в костной ткани составляют остеокласты. Остеокласты
развиваются из стволовой кроветворной клетки и относятся к
моноцито-макрофагальной системе, т. е. они способны разрушать обызвествленный
хрящ и кость. Это крупные клетки (диаметром до 90 мкм), содержащие от 3 до
нескольких десятков ядер. Цитоплазма слабо базофильна, иногда оксифильна. Она
богата митохондриями и лизосомами. Располагаются остеокласты на поверхности
костных перекладин.
Межклеточное вещество
Состоит из основного вещества, пропитанного неорганическими солями, и пучков
коллагеновых волокон.
Основное вещество содержит много лимонной и других кислот, которые образуют
комплексы с кальцием.
Волокна межклеточного вещества содержат белок коллаген 1-го и 3-го типов. В
ретикулофиброзной костной ткани пучки волокон проходят в разных направлениях, в
пластинчатой — они имеют строго ориентированное направление.
На двух электронных микрофотографиях клеток костной ткани демонстрируется
структура коллагена (рис. 1 и 2).
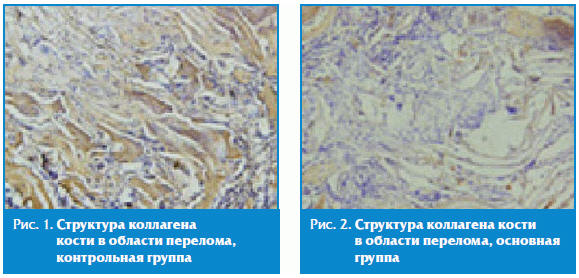
На рис. 1 видна бедная структура органического матрикса. Фибриллы коллагена
тонкие и неветвистые. Межклеточное вещество слабо минерализовано.
На рис. 2 в клетках хорошо развита гранулярная эндоплазматическая сеть.
Вокруг клеток расположены коллагеновые фибриллы. Межклеточное вещество
минерализовано. Фибриллы коллагена заметно толще, имеют ветвистую структуру.
Данные гистологического исследования еще раз подтверждают теорию об
эссенциальной роли остеотропных минералов: меди, магния, марганца, цинка и бора
в синтезе коллагена, который является основой костного матрикса.
Выводы
Применение комбинированного средства, содержащего кальций, витамин D3
и остеотропные минералы: медь, магний, марганец, цинк и бор (Кальцемин Адванс):
- способствует ускорению консолидации переломов в 1,6 раза;
- способствует синтезу коллагена 1-го и 3-го типов в составе костного
матрикса; - повышает прочность и эластичность костной ткани.
Заключение
Следует помнить, что костная ткань только на 70% состоит из кальциевых
соединений, а на 22% — из коллагена, и 8% составляет водная фракция. Возможности
полного восполнения дефицитов микроэлементов, необходимых для функционирования
костной ткани, для синтеза коллагена и, как следствие — костного матрикса,
существенно расширяются при использовании специальных микронутриентных
препаратов и средств. В настоящей работе показано, что поддержанию здоровья
костной системы способствуют такие микроэлементы, как магний, медь, марганец,
цинк и бор. Магний, марганец, медь, цинк и бор принято называть остеотропными
минералами. Они способствуют синтезу коллагена и, как следствие — синтезу
полноценного костного матрикса. Известно, что костный матрикс на 90% состоит из
коллагена [79]. Коллаген, в свою очередь, входит не только в состав костной
ткани, но и в состав всех соединительных тканей, включая суставные связки и
кожный покров. Двойное действие кальция и минералов в средстве Кальцемин Адванс
позволяет значимо улучшить качество костной ткани.
Литература
-
Zofkova I., Nemcikova P., Matucha P. Trace elements and bone
health // Clin Chem Lab Med. 2013; 51 (8): 1555–61 doi. -
Zittermann A., Schleithoff S. S., Koerfer R. Vitamin D and
vascular calcification // Curr Opin Lipidol. 2007; 18 (1): 41–46. -
Schaafsma A., de Vries P. J., Saris W. H. Delay of natural bone
loss by higher intakes of specific minerals and vitamins // Crit Rev Food Sci
Nutr. 2001; 41 (4): 225–249. -
Lakhkar N. J., Lee I. H., Kim H. W., Salih V., Wall I. B., Knowles J.
C. Bone formation controlled by biologically relevant inorganic ions:
role and controlled delivery from phosphate-based glasses // Adv Drug Deliv
Rev. 2013; 65 (4): 405–420 doi. -
De Francisco A. L., Rodriguez M. Magnesium — its role in CKD //
Nefrologia. 2013; 33 (3): 389–399 doi. -
Торшин И. Ю., Громова О. А. Молекулярные механизмы дефицита
магния в недифференцированной дисплазии соединительной ткани // Росс. мед.
журнал. 2008, № 2, с. 62–67. -
Swaminathan R. Nutritional factors in osteoporosis // Int J Clin
Pract. 1999; 53 (7): 540. -
Parlier R., Hioco D., Leblanc R. Metabolism of magnesium and its
relation to that of calcium. I. Apropos of a study of magnesium balance in the
normal man, in osteopathies and nephropathies // Rev Fr Endocrinol Clin. 1963;
4: 93–135. -
Ryder K. M., Shorr R. I., Bush A. J., Kritchevsky S. B., Harris T.,
Stone K., Cauley J., Tylavsky F. A. Magnesium intake from food and
supplements is associated with bone mineral density in healthy older white
subjects // J Am Geriatr Soc. 2005, 53: 1875–1880. -
Jones G., Riley M. D., Dwyer T. Maternal diet during pregnancy is
associated with bone mineral density in children: a longitudinal study // Eur
J Clin Nutr. 2000; 54 (10): 749–756. -
Smoliar V. I. Effect of iron-deficient diets on the formation of
bone tissue // Vopr Pitan. 1984; (5): 55–59. -
Diaz-Castro J., Lopez-Frias M. R., Campos M. S., Lopez-Frias M.,
Alferez M. J., Nestares T., Ojeda M. L., Lopez-Aliaga I. Severe
nutritional iron-deficiency anaemia has a negative effect on some bone
turnover biomarkers in rats // Eur J Nutr. 2012; 51 (2): 241–247. -
Jorgensen L., Skjelbakken T., Lochen M. L., Ahmed L., Bjornerem A.,
Joakimsen R., Jacobsen B. K. Anemia and the risk of non-vertebral
fractures: the Tromso Study // Osteoporos Int. 2010; 21 (10): 1761–1768 doi. -
Kaitila I. I., Peltonen L., Kuivaniemi H., Palotie A., Elo J.,
Kivirikko K. I. A skeletal and connective tissue disorder associated with
lysyl oxidase deficiency and abnormal copper metabolism // Prog Clin Biol Res.
1982; 104: 307–315. -
Smoliar V. I., Biniashevskii E. V. Effect of copper deficiency on
growth and bone tissue formation // Vopr Pitan. 1988; (6): 28–32. -
Jonas J., Burns J., Abel E. W., Cresswell M. J., Strain J. J.,
Paterson C. R. Impaired mechanical strength of bone in experimental
copper deficiency // Ann Nutr Metab. 1993; 37 (5): 245–252. -
Opsahl W., Zeronian H., Ellison M., Lewis D., Rucker R. B., Riggins R.
S. Role of copper in collagen cross-linking and its influence on selected
mechanical properties of chick bone and tendon // J Nutr. 1982; 112 (4):
708–716. -
O‘Dell B. L. Roles for iron and copper in connective tissue
biosynthesis // Philos Trans R Soc Lond B Biol Sci. 1981; 294 (1071): 91–104. -
Lowe N. M., Lowe N. M., Fraser W. D., Jackson M. J. Is there a
potential therapeutic value of copper and zinc for osteoporosis? // Proc Nutr
Soc. 2002; 61 (2): 181–185. -
Gallup W. D., Norris L. C. The essentialness of manganese for the
normal development of bone // Science. 1938; 87 (2245): 18–19. -
Strause L. G., Hegenauer J., Saltman P., Cone R., Resnick D.
Effects of long-term dietary manganese and copper deficiency on rat skeleton
// J Nutr. 1986; 116 (1): 135–141. -
Керимкулова Н. В., Торшин И. Ю., Громова О. А., Cеров В. Н.,
Никифорова Н. В. Систематический анализ молекулярно-физиологических
эффектов синергидного воздействия железа, марганца и меди на соединительную
ткань // Гинекология. 2012. № 6. С. 51–60. -
Jugdaohsingh R. Silicon and bone health // J Nutr Health Aging.
2007, 11: 99–110. -
Jugdaohsingh R., Tucker K. L., Qiao N., Cupples L. A., Kiel D. P.,
Powell J. J. Dietary silicon intake is positively associated with bone
mineral density in men and premenopausal women of the Framingham Offspring
cohort // J Bone Miner Res. 2004, 19: 297–307. -
Meunier P. J., Roux C., Seeman E. et al. The effects of strontium
ranelate on the risk of vertebral fracture in women with postmenopausal
osteoporosis // N Engl J Med. 2004. 350: 459–468. -
Reginster J. Y., Felsenberg D., Boonen S. et al. Effects of
long-term strontium ranelate treatment on the risk of nonvertebral and
vertebral fractures in postmenopausal osteoporosis: results of a five-year,
randomized, placebo-controlled trial // Arthritis Rheum. 200, 58: 1687–1695. -
Naghii M. R., Samman S. The role of boron in nutrition and
metabolism // Prog Food Nutr Sci. 1993; 17 (4): 331–349. -
Ребров В. Г., Громова О. А. Витамины, макро- и микроэлементы. М.:
Геотармед, 2008. 958 с. -
Newnham R. E. Essentiality of boron for healthy bones and joints
// Environ Health Perspect. 1994; 102 Suppl: 83–85. -
Devirian T. A., Volpe S. L. The physiological effects of dietary
boron // Crit Rev Food Sci Nutr. 2003; 43 (2): 219–231. -
Penland J. G. The importance of boron nutrition for brain and
psychological function // Biol Trace Elem Res. 1998; 66 (1–3): 299–317. -
Murray F. J. A comparative review of the pharmacokinetics of
boric acid in rodents and humans // Biol Trace Elem Res. 1998; 66 (1–3):
331–341. -
Liao S. F., Monegue J. S., Lindemann M. D., Cromwell G. L., Matthews
J. C. Dietary supplementation of boron differentially alters expression
of borate transporter (NaBCl) mRNA by jejunum and kidney of growing pigs //
Biol Trace Elem Res. 2011; 143 (2): 901–912. -
Tasli P. N., Dogan A., Demirci S., Sahin F. Boron enhances
odontogenic and osteogenic differentiation of human tooth germ stem cells (hTGSCs)
in vitro // Biol Trace Elem Res. 2013; 153 (1–3): 419–427 doi. -
Ying X., Cheng S., Wang W., Lin Z., Chen Q., Zhang W., Kou D., Shen
Y., Cheng X., Rompis F. A., Peng L., Zhu Lu C. Effect of boron on
osteogenic differentiation of human bone marrow stromal cells // Biol Trace
Elem Res. 2011; 144 (1–3): 306–315 doi. -
Hakki S. S., Bozkurt B. S., Hakki E. E. Boron regulates
mineralized tissue-associated proteins in osteoblasts (MC3 T3-E1) // J Trace
Elem Med Biol. 2010; 24 (4): 243–250 doi. -
Никитинская О. А., Торопцова Н. В. Роль макро- и микроэлементов в
профилактике первичного остеопороза. ГУ Институт ревматологии РАМН. -
Naghii M. R., Torkaman G., Mofid M. Effects of boron and calcium
supplementation on mechanical properties of bone in rats // Biofactors. 2006;
28 (3–4): 195–201. -
Lanoue L., Taubeneck M. W., Muniz J., Hanna L. A., Strong P. L.,
Murray F. J., Nielsen F. H., Hunt C. D., Keen C. L. Assessing the effects
of low boron diets on embryonic and fetal development in rodents using in
vitro and in vivo model systems // Biol Trace Elem Res. 1998; 66 (1–3):
271–298. -
Gorustovich A. A., Steimetz T., Nielsen F. H., Guglielmotti M. B.
A histomorphometric study of alveolar bone modelling and remodelling in mice
fed a boron-deficient diet // Arch Oral Biol. 2008; 53 (7): 677–682 doi. -
Gorustovich A. A., Steimetz T., Nielsen F. H., Guglielmotti M. B.
Histomorphometric study of alveolar bone healing in rats fed a boron-deficient
diet // Anat Rec (Hoboken). 2008; 291 (4): 441–447 doi. -
Nielsen F. H. Biochemical and physiologic consequences of boron
deprivation in humans // Environ Health Perspect. 1994; 102 Suppl: 59–63. -
Naghii M. R., Ebrahimpour Y., Darvishi P., Ghanizadeh G., Mofid M.,
Torkaman G., Asgari A. R., Hedayati M. Effect of consumption of fatty
acids, calcium, vitamin D and boron with regular physical activity on bone
mechanical properties and corresponding metabolic hormones in rats // Indian J
Exp Biol. 2012; 50 (3): 223–231. -
Hakki S. S., Dundar N., Kayis S. A., Hakki E. E., Hamurcu M.,
Kerimoglu U., Baspinar N., Basoglu A., Nielsen F. H. Boron enhances
strength and alters mineral composition of bone in rabbits fed a high energy
diet // J Trace Elem Med Biol. 2013; 27 (2): 148–153 doi. -
Ghanizadeh G., Babaei M., Naghii M. R., Mofid M., Torkaman G.,
Hedayati M. The effect of supplementation of calcium, vitamin D, boron,
and increased fluoride intake on bone mechanical properties and metabolic
hormones in rat // Toxicol Ind Health. 2014; 30 (3): 211–217 doi. -
Rico H., Crespo E., Hernandez E. R., Seco C., Crespo R. Influence
of boron supplementation on vertebral and femoral bone mass in rats on
strenuous treadmill exercise. A morphometric, densitometric, and
histomorphometric study // J Clin Densitom. 2002; 5 (2): 187–192. -
Sheng M. H., Taper L. J., Veit H., Qian H., Ritchey S. J., Lau K. H.
Dietary boron supplementation enhanced the action of estrogen, but not that of
parathyroid hormone, to improve trabecular bone quality in ovariectomized rats
// Biol Trace Elem Res. 2001; 82 (1–3): 109–123. -
Sheng M. H., Taper L. J., Veit H., Thomas E. A., Ritchey S. J., Lau K.
H. Dietary boron supplementation enhances the effects of estrogen on bone
mineral balance in ovariectomized rats // Biol Trace Elem Res. 2001; 81 (1):
29–45. -
Wilson J. H., Ruszler. L. Effects of boron on growing pullets //
Biol Trace Elem Res. 1997; 56 (3): 287–294. -
Qin X., Klandorf H. Effect of dietary boron supplementation on
egg production, shell quality, and calcium metabolism in aged broiler breeder
hens // Poult Sci. 1991; 70 (10): 2131–2138. -
King N., Odom T. W., Sampson H. W., Yersin A. G. The effect of in
ovo boron supplementation on bone mineralization of the vitamin D-deficient
chicken embryo // Biol Trace Elem Res. 1991; 31 (3): 223–233. -
Scorei I. D., Scorei R. I. Calcium fructoborate helps control
inflammation associated with diminished bone health // Biol Trace Elem Res.
2013; 155 (3): 315–321 doi.
Статья опубликована в журнале
Лечащий Врач
материал MedLinks.ru







