Введение
Высокая смертность при новой коронавирусной инфекции COVID-19, клиническим проявлением которой является двусторонняя пневмония, поставила перед специалистами здравоохранения задачи ранней диагностики, поиска эффективных методов профилактики и лечения осложнений, влияющих на исход заболевания. В период пандемии новой коронавирусной инфекции летальность в отделениях реанимации и интенсивной терапии (ОРИТ) достигала 45–55% [1, 2]. У 3–4% пациентов регистрировалось развитие острого респираторного дистресс-синдрома (ОРДС), который, по результатам метаанализа, включавшего 10 815 пациентов с тяжелой формой COVID-19 и ОРДС, являлся основной причиной смерти в 39% случаев (95% ДИ 23–56%) [1, 3, 4].
Важным звеном патогенеза развития ОРДС при COVID-19-ассоциированной пневмонии является снижение синтеза и функциональной активности легочного сурфактанта вследствие гибели альвеолоцитов 2-го типа, качественные изменения его фосфолипидного состава (увеличение содержания минорных компонентов и ненасыщенных жирных кислот) и протеиновых компонентов [5–7].
В ряде работ отечественных и зарубежных ученых была отмечена возможность использования препаратов экзогенного сурфактанта в комплексном лечении и профилактике развития ОРДС и острого повреждения легких, в том числе вирусной этиологии, в связи с демонстрируемыми им патогенетически обоснованными эффектами: восстановление содержания фосфолипидов, предотвращение коллапса альвеол и микроателектазирования; повышение активности альвеолярных макрофагов; стимуляция синтеза эндогенного сурфактанта альвеолоцитами 2-го типа; элиминация токсических веществ, вирусов, бактерий из альвеолярного пространства [8–12]. Однако результаты влияния сурфактант-терапии на показатели газообмена, тяжесть течения и исходы у взрослых пациентов с тяжелой пневмонией и ОРДС, представленные в научной литературе, неоднозначны [13, 14]. Большинство исследований носило ретроспективный характер, не отвечало на вопрос о преимуществах того или иного способа введения, длительности применения препарата, не включало оценку эффективности терапии сурфактантом на основании маркерного профиля патологического процесса.
В ряде работ в качестве потенциального маркера повреждения альвеолоцитов 2-го типа и структуры аэрогематического барьера предлагалось определять уровень сурфактантного протеина D (SP-D) в крови больных с ОРДС и интерстициальными заболеваниями легких [15–23].
Учитывая, что сурфактантные белки синтезируются в альвеолоцитах 2-го типа, которые экспрессируют рецептор АСЕ-2, являющийся целевым для SARS‑CoV‑2, можно предположить изменение уровня SP-D в зависимости от тяжести и прогноза пневмонии, ассоциированной с COVID-19, и возможности его использования для оценки эффективности сурфактант-терапии. В ряде отечественных и зарубежных работ SP-D рассматривается как потенциальный биомаркер и регулятор локального и системного воспаления при заболеваниях легких. Контроль его уровня в сыворотке при внебольничной пневмонии может отражать не только тяжесть заболевания, но и адекватность комбинированной терапии [1, 15, 24, 25].
Цель исследования: оценить влияние ингаляционной сурфактант-терапии в комплексном лечении тяжелой внебольничной пневмонии, вызванной вирусом SARS-CoV-2, на течение и исход заболевания и определить возможность использования уровня SP-D в сыворотке крови в качестве критерия эффективности лечения.
Материал и методы
Было выполнено проспективное рандомизированное исследование, которое проводилось в условиях палат интенсивной терапии и ОРИТ СПБ ГБУЗ «ГМПБ № 2» и СПб ГБУЗ «Городская Покровская больница», Санкт-Петербург.
В исследование включали пациентов старше 18 лет с тяжелой и крайне тяжелой пневмонией, вызванной SARS-СoV-2 (подтверждено результатами ПЦР-диагностики), вирусным двусторонним полисегментарным поражением легких не менее 3–4-й степени по данным КТ, с нарушениями оксигенации (SpO2 менее 92%), при ингаляции кислорода через лицевую маску с потоком более 6 л/мин. Исследование было одобрено этическим комитетом СПБ ГБУЗ «ГМПБ № 2». Письменное информированное согласие получено от всех пациентов.
Критериями невключения являлись: возраст до 18 лет; нарушения методики ингаляционного введения препарата Сурфактант-БЛ и проведение инвазивной механической вентиляции легких; продолжающиеся на момент скринингового обследования или имеющиеся в анамнезе сопутствующие заболевания, которые повышали риск перевода пациента на искусственную вентиляцию легких (ИВЛ) или могли привести к летальному исходу в течение 3 мес.; наличие в анамнезе состояний, потребовавших проведения ИВЛ; индивидуальная непереносимость компонентов исследуемого препарата; беременность, период грудного вскармливания.
Методом случайной выборки были сформированы 2 группы (n=60), сопоставимые по полу, возрасту, клинически значимым сопутствующим заболеваниям и тяжести их течения, исходным параметрам газообмена, проценту поражения легочной ткани по данным мультиспиральной компьютерной томографии, степени активности воспалительного процесса (по данным лабораторных исследований: лейкоциты, лимфоциты, С-реактивный белок (СРБ)) (табл. 1). Критерием исключения стала необходимость в инвазивной вентиляции легких при поступлении.
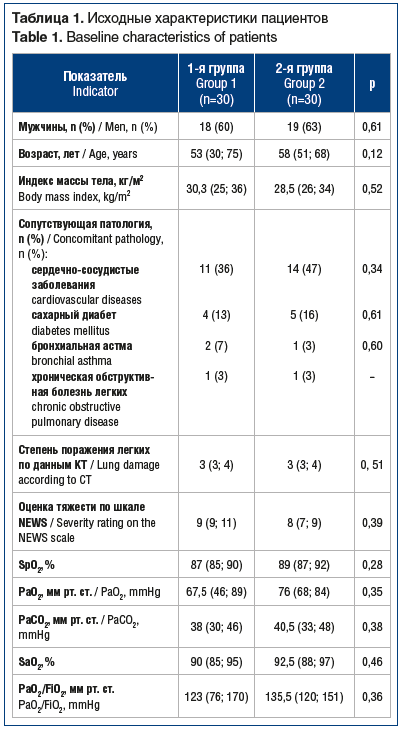
Пациенты 1-й группы (n=30) получали ингаляции эмульсии препарата Сурфактант-БЛ («Биосурф», Россия) в дополнение к стандартной терапии и респираторной поддержке. Пациенты 2-й группы (сравнения) (n=30) получали только стандартную терапию.
Пациентам обеих групп проводили лечение в соответствии с временными методическими рекомендациями по диагностике, лечению и профилактике COVID-19, версии 13, 13.1, 2021 г.; методическими рекомендациями Общероссийской общественной организации «Федерация анестезиологов и реаниматологов», версия 2021 г., которое включало противовирусную, патогенетическую, антитромботическую, инфузионную, симптоматическую и антибактериальную терапию [4, 26]. С целью коррекции гипоксии проводилась респираторная поддержка, включающая высокопоточную кислородотерапию через носовые канюли; СРАР-терапию в сочетании с прон-позицией; неинвазивную вентиляцию легких (НИВЛ, опция аппарата Puritan Bennett 980, Covidien/Medtronic, США; «Авента-М», Россия) в режимах c заданным уровнем инспираторного давления (Pressure Support, BIPAP) 14–24 см вод. ст. (минимальный уровень при сохранении комфорта пациента) и минимальной инспираторной фракцией кислорода для поддержания целевого значения SpO2 (60–100%).
Дополнительную терапию пациентам 1-й группы проводили сурфактантом-БЛ, который вводили ингаляционно через компрессорный или mesh-небулайзер Aerogen Solo (Aerogen, Ирландия) по следующей схеме: в дозе 1–1,5 мг/кг (в среднем 75 мг на 1 введение) 2 р/сут. Продолжительность терапии составляла от 3 до 5 сут (n=20) и 7–10 сут (n=10). Пациентам 1-й группы, получавшим сурфактант, в обязательном порядке проводилась персональная подготовка к ингаляции.
У пациентов при поступлении и через 10 дней лечения наряду с клиническими показателями анализировали следующие показатели: лейкоциты и лимфоциты крови (абсолютное число), СРБ (мг/л), D-димер (мг/мл), SpO2 методом пульсоксиметрии, газы артериальной крови с определением SаO2 (%), PaO2, PaCO2, РaO2/FiO2 (мм рт. ст.). Тяжесть состояния исходно оценивали по шкале NEWS. Регистрировали частоту перевода больных на ИВЛ, число пациентов, которым потребовалась НИВЛ, длительность госпитализации (дни), исход заболевания, летальные исходы, наступившие в течение 4 нед. Благоприятным исходом считалось выздоровление пациента.
Контроль уровня SP-D в сыворотке крови осуществлялся дважды в обеих группах: при поступлении и на 10-е сутки с момента госпитализации. Уровень SP-D определяли методом твердофазного ИФА (ELISA). Для его количественного определения в сыворотке крови использовался набор Human SPD (Pulmonary Surfactant Associated Protein D) ELISA Kit, Wuhan Fine Biotech Co., Ltd. Диапазон определения — 1,563–100 нг/мл, чувствительность — 0,938 нг/мл.
Статистический анализ проведен с помощью пакета Statistica 7.0 (StatSoft Inc., США). Данные представлены в абсолютных значениях (%), в виде медианы (25-й; 75-й процентиль), или средней арифметической и ошибки средней (М±SEM) в зависимости от нормальности распределения. Для сравнительного анализа и выявления различий использовали методы непараметрической статистики: дисперсионный анализ методом Краскела — Уоллиса с последующей оценкой U-критерием Манна — Уитни. Анализ категориальных переменных проводили с помощью трансформации Z Фишера с последующим применением двустороннего t-теста. Критическим уровнем значимости считали р=0,05.
Результаты исследования
У всех пациентов, включенных в исследование, имели место начальные проявления ОРДС. Зарегистрированные показатели, отражающие газообменную функцию (параметры оксигенации артериальной крови и их динамика), частоту перевода пациентов на ИВЛ, длительность пребывания в стационаре и исход заболевания, представлены в таблице 2.
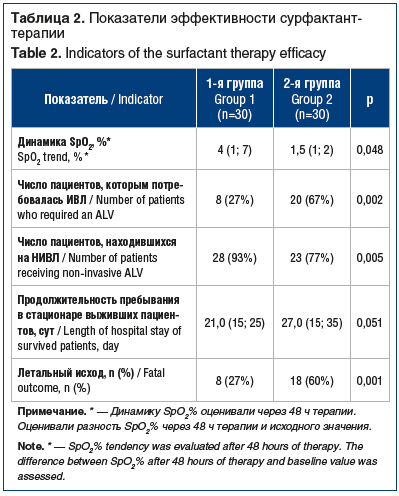
Несмотря на то, что при поступлении большему числу пациентов 1-й группы потребовалось проведение НИВЛ, на фоне лечения сурфактантом отмечалось более быстрое восстановление параметров оксигенации, меньшему числу пациентов потребовалась ИВЛ, летальность в группе сурфактанта была достоверно ниже. Следует отметить, что среди пациентов 1-й группы, имевших благоприятный исход заболевания, в 84% случаев сурфактант-терапия назначалась в более короткие сроки от начала заболевания по сравнению с больными, лечение которых было неэффективным (3±1,5 дня против 7±2,0 дня).
К 10-му дню терапии более чем у 70% пациентов 1-й группы наблюдалось восстановление параметров оксигенации, оцениваемое по газам артериальной крови.
Анализ газового состава крови выживших пациентов в 1-й и 2-й группах через 10 дней лечения показал достоверную положительную динамику показателей: РаO2, SаO2, РаO2 /FiO2 (p<0,005) (табл. 3).
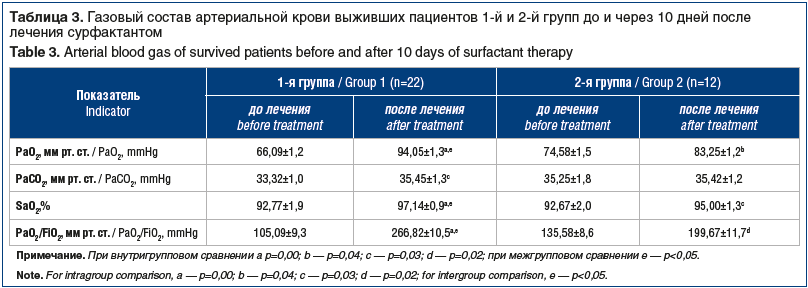
При межгрупповом сравнении с использованием однофакторного дисперсионного анализа у пациентов 1-й группы на 10-й день лечения зарегистрировано статистически достоверное (p<0,005) улучшение показателей газообмена, чему, вероятно, способствовали стабилизация и восстановление аэрогематического барьера, уменьшение нагрузки на респираторную систему вследствие введения сурфактанта.
С динамикой показателей газового состава крови коррелировали положительные изменения маркеров воспаления выживших пациентов 1-й и 2-й групп (табл. 4). Отмечалось достоверное увеличение числа лимфоцитов в крови при исходно выраженной лимфопении. Показатели СРБ, ферритина, D-димера снижались, но не достигали референтных значений.
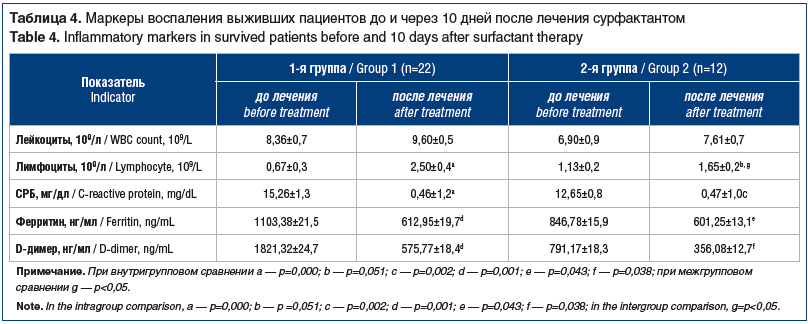
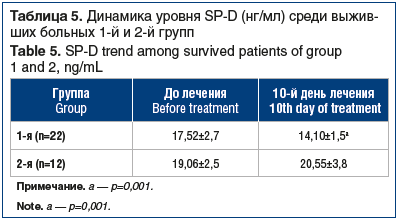
Анализ маркеров воспаления крови в 1-й и 2-й группах через 10 дней лечения с использованием однофакторного дисперсионного анализа демонстрировал достоверные различия по показателю абсолютного числа лимфоцитов (p<0,05), что указывало на активацию лимфопоэза, возможно, за счет комплексной стабилизации иммунного ответа и уменьшения степени выраженности системного воспаления на фоне сурфактант-терапии. По D-димеру межгрупповые различия тоже были достоверны (p=0,04), хотя показатель в 1-й группе был выше, его динамика была более выраженной, чем во 2-й группе. Разность в снижении (улучшении) показателя в 1-й группе составила 1200±60 нг/мл против 410±58 нг/мл.
Исходные значения SP-D в 1-й и 2-й группах не достигали статистически значимых различий. При анализе на 10-й день лечения наиболее высокие значения показателя в сыворотке крови зарегистрированы у пациентов, имевших в последующем тяжелый ОРДС и неблагоприятный исход заболевания (рис. 1).
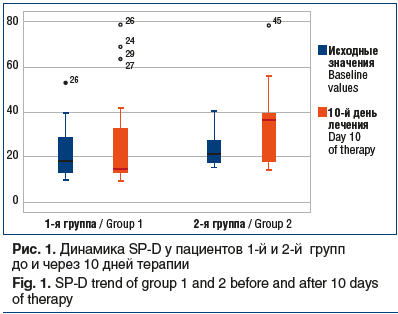
У выживших пациентов 1-й группы в процессе лечения показатель снижался, достигая уровня достоверных различий, во 2-й группе он практически не изменялся (табл. 5).
Статистически значимо более выраженное снижение SP-D на 10-й день демонстрировали пациенты 1-й группы по сравнению с показателем у пациентов 2-й группы (3,5±1,8 нг/мл против 1,2±1,3 нг/мл, p=0,04). Однофакторный дисперсионный анализ межгрупповых различий по уровню SP-D подтвердил на 10-й день лечения статистически более низкие значения показателя в группе сурфактант-терапии, р<0,05 (рис. 2).
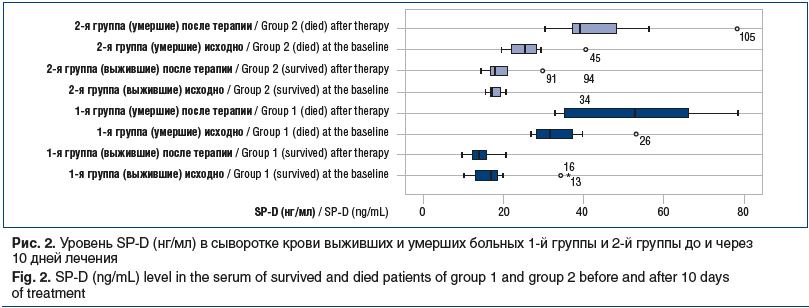
Таким образом, уровень и динамика SP-D в сыворотке крови больных тяжелой COVID-19-ассоциированной пневмонией отражали тяжесть течения заболевания. Показатель повышался при прогрессировании заболевания, развитии ОРДС и неэффективности лечения. Более благоприятный профиль SP-D регистрировали у больных, получавших дополнительную сурфактант-терапию, что подтверждает выполненный корреляционный анализ, где выявлена значимая отрицательная корреляция между уровнем SP-D и количеством лимфоцитов (r=-290, р=0,04), положительная корреляция с СРБ (r=370, р=0,01), РаО2 (r=420, р=0,001), РаО2/FiO2 (r=460, р=0,001). Положительные изменения на КТ грудной клетки в течение рассматриваемого периода отмечали в 65% случаев выживших пациентов 1-й группы, у пациентов 2-й группы — в 48% случаев.
Обсуждение
Результаты, полученные в исследовании, демонстрируют возможность использования сурфактант-терапии в качестве компонента комплексного лечения тяжелой пневмонии, вызванной вирусом SARS-CoV-2. Ингаляционное введение Сурфактанта-БЛ способствовало более быстрому восстановлению параметров оксигенации, улучшению газообмена, снижению числа больных, которым потребовалась ИВЛ, длительности пребывания в стационаре и показателя летальности, что согласуется с выводами ряда отечественных и зарубежных авторов [27–31].
Успехи применения экзогенного сурфактанта в условиях дефицита, связанного с гибелью альвеолоцитов 2-го типа, обусловлены предотвращением микроателектазирования, шунтирования крови и снижения растяжимости легочной ткани [30, 32, 33]. С другой стороны, хорошо известно участие сурфактанта в процессах формирования защитной функции легких в связи с его влиянием на врожденный и адаптивный местный иммунитет [34]. В ряде работ отмечены противовоспалительные и противовирусные свойства сурфактанта при пневмониях, вызванных как SARS-CoV-2, так и другими вирусами [12, 32, 35].
Однако эффективность применения сурфактанта при тяжелых внебольничных пневмониях и ОРДС не всегда оценивается однозначно [5, 13]. В связи с этим актуальными становятся вопросы о маркерах эффективности лечения, начале и длительности применения препарата. В настоящее время обсуждается возможность применения в качестве объективного показателя оценки повреждения структур аэрогематического барьера SP-D в сыворотке крови. В исследовании M. Tong et al. [24] отмечалось значительное повышение уровня SP-D у больных COVID-19 в острой фазе при тяжелом течении заболевания по сравнению с легким. Был сделан вывод о возможности использования этого показателя в качестве потенциального биомаркера тяжести COVID-19 и определения когорты пациентов, состояние которых может ухудшаться на ранней стадии. В выполненном исследовании достоверно более высокий уровень SP-D отмечался у пациентов c тяжелой пневмонией, ассоциированной с COVID-19, при прогрессировании и неблагоприятном исходе заболевания. Он коррелировал со значениями числа лимфоцитов, СРБ, РаО2 и РaO2/FiO2, что соответствует результатам, полученным ранее другими исследователями [15, 25]. Больные с благоприятным исходом заболевания, получавшие сурфактант-терапию, демонстрировали более низкие значения уровня SP-D при поступлении и его статистически достоверное снижение на 10-й день лечения, положительные изменения с тенденцией к нормализации числа лимфоцитов крови, СРБ, D-димера, данных КТ, показателей РаО2 и РaO2/FiO2 по сравнению с выжившими пациентами группы сравнения. Полученные данные позволили сделать вывод о возможности использования уровня SP-D сыворотки крови в качестве дополнительного маркера тяжелого течения пневмонии, вызванной вирусом SARS-CoV-2, полезного для диагностики ранней стадии ОРДС и эффективности лечения. Среди пациентов 1-й группы, имевших благоприятный исход заболевания, в 84% случаев сурфактант-терапия назначалась на более ранних сроках от начала заболевания по сравнению с больными, лечение которых было неэффективным (3±1,5 дня против 7±2,0 дня), что указывает на необходимость включения препарата на ранней стадии развития заболевания и дыхательной недостаточности и согласуется с мнением других исследователей [36].
Заключение
Сурфактант-терапия может быть рассмотрена в качестве дополнительного патогенетически обоснованного компонента в комплексном лечении тяжелой пневмонии, вызванной вирусом SARS-CoV-2. Основными эффектами сурфактант-терапии являются уменьшение риска прогрессирования дыхательной недостаточности, более быстрое восстановление газового состава крови, снижение частоты переводов на ИВЛ, сокращение продолжительности пребывания в стационаре, уменьшение летальности. Успех сурфактант-терапии сопряжен с ранним ее назначением. Определение содержания SP-D может быть использовано в качестве дополнительного маркера диагностики ранней стадии ОРДС у больных с тяжелым течением пневмонии, вызванной вирусом SARS-CoV-2, и эффективности сурфактант-терапии. С целью индивидуализации подхода и повышения эффективности включения сурфактант-терапии в комплексное лечение пациентов с тяжелым течением вирусной пневмонии необходим дальнейший поиск и оценка определяющих факторов, таких как соотношение комплаенса легких и уровня гипоксемии, длительности, дозы и срока начала введения препарата, применение усовершенствованной модели прогнозирования успеха лечения. Особый интерес вызывает влияние сурфактант-терапии, проведенной в острой фазе заболевания, на восстановление респираторной зоны в постковидном периоде.
Сведения об авторах:
Волчкова Елизавета Владимировна — аспирант кафедры анестезиологии, реаниматологии и неотложной педиатрии ФП и ДПО ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0000-0001-6712-5121.
Александрович Юрий Станиславович — д.м.н., профессор, заведующий кафедрой анестезиологии, реаниматологии и неотложной педиатрии ФП и ДПО ФГБОУ ВО СПбГПМУ Минздрава России; 194100, Россия, г. Санкт-Петербург, ул. Литовская, д. 2; ORCID iD 0000-0002-2131-4813.
Титова Ольга Николаевна — д.м.н., профессор, директор НИИ пульмонологии ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; ORCID iD 0000-0003-4678-3904.
Кузубова Наталия Анатольевна — д.м.н., заместитель директора НИИ пульмонологии ФГБОУ ВО ПСПбГМУ им. И.П. Павлова Минздрава России; 197022, Россия, г. Санкт-Петербург, ул. Льва Толстого, д. 6–8; ORCID iD 0000-0002-1166-9717.
Волчков Владимир Анатольевич — д.м.н., профессор, заслуженный врач РФ, заведующий кафедрой анестезиологии и реаниматологии СПбГУ; 199106, Россия, г. Санкт-Петербург, 21-я лин. В.О., д. 8a; ORCID iD 0000-0002-5664-7386.
Пискунов Дмитрий Павлович — врач СПБ ГБУЗ «ГМПБ № 2»; 194354, Россия, г. Санкт-Петербург, Учебный пер., д. 5; ORCID iD 0000-0002-9752-2539.
Бахолдина Марина Николаевна — главный врач СПб ГБУЗ «Городская Покровская больница»; 199106, Россия, г. Санкт-Петербург, Большой пр-т В.О., д. 85; ORCID iD 0000-0002-6224-6749.
Битакова Фатима Измаиловна — к.м.н., доцент кафедры госпитальной терапии и кардиологии им. М.С. Кушаковского ФГБОУ ВО СЗГМУ им. И.И. Мечникова Минздрава России; 191015, Россия, г. Санкт-Петербург, ул. Кирочная, д. 41; ORCID iD 0000-0001-6637-8266.
Контактная информация: Волчкова Елизавета Владимировна, e-mail: elizavetavolch@mail.ru.
Прозрачность финансовой деятельности: никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Статья поступила 09.07.2022.
Поступила после рецензирования 02.08.2022.
Принята в печать 25.08.2022.
About the authors:
Elizaveta V. Volchkova — post-graduate student of the Department of Anesthesiology, Resuscitation and Emergency Pediatrics, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194100, Russian Federation; ORCID iD 0000-0001-6712-5121.
Yuri S. Alexandrovich — Dr. Sc. (Med.), Professor, Head of the Department of Anesthesiology, Resuscitation and Emergency Pediatrics, St. Petersburg State Pediatric Medical University; 2, Litovskaya str., St. Petersburg, 194100, Russian Federation; ORCID iD 0000-0002-2131-4813.
Olga N. Titova — Dr. Sc. (Med.), Professor, Director of the Research Institute of Pulmonology, I.P. Pavlov First Saint Petersburg State Medical University; 6–8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0003-4678-3904.
Natalia A. Kuzubova — Dr. Sc. (Med.), Deputy Director of the Research Institute of Pulmonology, I.P. Pavlov First St. Petersburg State Medical University; 6–8, Lev Tolstoy str., St. Petersburg, 197022, Russian Federation; ORCID iD 0000-0002-1166-9717.
Vladimir A. Volchkov — Dr. Sc. (Med.), Professor, Honored Doctor of the Russian Federation, Head of the Department of Anesthesiology and Resuscitation, St. Petersburg State University; 8a, 21st Line, St. Petersburg, 199106, Russian Federation, ORCID iD 0000-0002-5664-7386.
Dmitry P. Piskunov — doctor, City Multidisciplinary Hospital No. 2; 5, Uchebnii Lane, St. Petersburg, 194354, Russian Federation; ORCID iD 0000-0002-9752-2539.
Marina N. Bakholdina — Chief Medical Officer, City Pokrovskaya Hospital; 85, Bol’shoi Ave, St. Petersburg, 199106, Russian Federation; ORCID iD 0000-0002-6224-6749.
Fatima I. Bitakova — C. Sc. (Med.), Associate Professor of the Department of Hospital Therapy and Cardiology named after M.S. Kushakovsky, I.I. Mechnikov North-Western State Medical University; 41, Kirochnaya str., St. Petersburg, 191015, Russian Federation; ORCID iD 0000-0001-6637-8266.
Contact information: Elizaveta V. Volchkova, e-mail: elizavetavolch@mail.ru.
Financial Disclosure: no authors have a financial or property interest in any material or method mentioned.
There is no conflict of interests.
Received 09.07.2022.
Revised 02.08.2022.
Accepted 25.08.2022.
Информация с rmj.ru


